芳姜黄酮衍生物对A375人黑素瘤细胞增殖及凋亡作用的机制研究
涂云华 康颖倩 李明娥 周英 薛月萃 叶振源 荣冬芸 昝雪娟 潘军玲 陆洪光 曹煜
550004贵阳,贵州医科大学附属医院皮肤性病科(涂云华、李明娥、薛月萃、叶振源、荣冬芸、昝雪娟、潘军玲、陆洪光、曹煜);贵州医科大学微生物学教研室(康颖倩);贵州大学生命科学学院贵州省中药(民族药)创制工程中心(周英)
芳姜黄酮衍生物对A375人黑素瘤细胞增殖及凋亡作用的机制研究
涂云华 康颖倩 李明娥 周英 薛月萃 叶振源 荣冬芸 昝雪娟 潘军玲 陆洪光 曹煜
550004贵阳,贵州医科大学附属医院皮肤性病科(涂云华、李明娥、薛月萃、叶振源、荣冬芸、昝雪娟、潘军玲、陆洪光、曹煜);贵州医科大学微生物学教研室(康颖倩);贵州大学生命科学学院贵州省中药(民族药)创制工程中心(周英)
目的研究一种芳姜黄酮衍生物(ATD)对人皮肤黑色素瘤A375细胞增殖及凋亡的影响。方法不同浓度(5、10、20、40、80 μmol/L)ATD、长春新碱及芳姜黄酮体外作用A375及人皮肤成纤维细胞(HSF)48 h。CCK⁃8法检测细胞增殖抑制率;吖啶橙/溴化乙锭(AO/EB)染色,倒置显微镜观察细胞凋亡形态;DNA片段化检测细胞凋亡;比色法检测半胱氨酸天冬氨酸蛋白酶3(caspase⁃3)活性;流式细胞仪检测细胞凋亡及周期。结果ATD、长春新碱及芳姜黄酮对A375细胞有抑制增殖作用,且呈剂量依赖性(ATD:R2=0.99,F=340.96;长春新碱:R2=0.99,F=349.19;芳姜黄酮:R2=0.89,F=25.41,均P< 0.05),三者IC50分别为(15.96± 0.02)、(77.00±0.04)及(356.95±0.01)μmol/L。当药物浓度为5 μmol/L及10 μmol/L时,ATD对HSF增殖抑制率分别为(8±0.06)%和(25±0.02)%,长春新碱为(33±0.04)%和(29±0.08)%,芳姜黄酮为(49±0.09)%和(34±0.07)%;ATD对A375细胞抑制率分别为(26±0.06)%和(39±0.02)%,长春新碱为(8±0.04)%和(17±0.08)%,芳姜黄酮为(6±0.09)%和(10±0.07)%,与二甲基亚砜相比,差异均有统计学意义(P<0.05),且ATD对A375细胞增殖抑制活性强于长春新碱及芳姜黄酮(P<0.05),但对HSF细胞毒性却明显低于长春新碱及芳姜黄酮(P<0.05)。ATD、长春新碱及芳姜黄酮均可诱导A375细胞凋亡,caspase⁃3活性随3种药物浓度增加而增强,且药效为ATD>长春新碱>芳姜黄酮。流式细胞仪检测证实,3种药物都能诱导细胞发生不同程度凋亡,同芳姜黄酮及长春新碱相比,ATD能显著诱导细胞凋亡,且以晚期凋亡为主。随药物浓度增加,ATD组G1期A375细胞逐渐增多,G2期及S期细胞数明显减少。结论ATD对A375细胞有抑制增殖及促凋亡作用,该作用明显强于芳姜黄酮及长春新碱,其机制可能是激活caspase⁃3,使细胞周期阻滞在G1期,进而抑制肿瘤细胞分化与增殖。
黑色素瘤,实验性;细胞系,肿瘤;姜黄酮;长春新碱;细胞增殖;细胞凋亡;芳姜黄酮衍生物
芳姜黄酮是中药姜黄的主要成分之一[1],具有抗肿瘤、抗血小板、抗细菌、抗真菌、抗氧化、抗老年痴呆及抗代谢综合征等药理作用[2-3]。近年来,芳姜黄酮在抗肿瘤方面已被广泛研究,但其溶解性较低,且对正常细胞有影响[4]。为寻求抗肿瘤活性更高的药物,我们运用芳姜黄酮衍生物作用A375及人皮肤成纤维细胞(HSF),观察其对细胞增殖及凋亡的影响,探讨其作用机制。
材料与方法
一、材料与试剂
芳姜黄酮衍生物,由潘博文等合成[5],化学名1⁃(4⁃氟苯基)⁃1⁃(1H⁃吲哚⁃3⁃烷基)⁃5⁃甲基⁃4⁃己烯⁃3⁃酮,由贵州大学生命科学院中药创制工程中心提供,含药溶液的总体积与二甲基亚砜(DMSO)的体积以10∶0.1的比例混合,用完全培养基稀释成10 mol/L作为母液,滤过除菌,4℃冰箱保存备用,芳姜黄酮(美国Cayman Chemical公司),长春新碱(浙江海正药业股份有限公司),A375细胞(广州吉妮欧生物科技有限公司),HSF细胞(CCC⁃HSF⁃1细胞,上海信则生物科技有限公司),Gibco胎牛血清(美国Life Technologies公司),DMEM、青霉素、链霉素及磁珠法基因组DNA抽提试剂盒[上海生工生物工程(上海)股份有限公司],CCK⁃8试剂盒(日本同仁化学公司),细胞周期试剂盒(江苏碧云天生物技术研究所),AnnexinⅤ⁃FITC细胞凋亡检测试剂盒及吖啶橙/溴化乙锭(AO/EB)凋亡染色试剂盒(上海贝博生物公司),半胱氨酸天冬氨酸蛋白酶3(caspase⁃3)活性检测试剂盒(南京建成生物工程研究所),ELX800酶联免疫检测仪(美国宝特公司),E⁃Gel®Imager(美国 Life Technologies公司),BD FACS Verse流式细胞仪(美国BD Biosciences公司)。
二、方法
1.细胞培养:A375贴壁细胞及CCC⁃HSF⁃1用完全培养基(含DMEM、10%胎牛血清及1%青霉素和1%链霉素)置37℃、5%CO2培养箱中培养,0.25%胰酶消化传代,每2~3 d传代1次,取对数生长期细胞进行实验。
2.细胞增殖抑制率测定:CCK⁃8法检测增殖抑制率[6]。芳姜黄酮的36个衍生物,经过CCK⁃8增殖抑制作用初筛,选择一种抗肿瘤活性较强的芳姜黄酮衍生物。取对数生长期A375及HSF细胞,调整密度为1.2 × 105个/ml,按50 μl/孔接种于96孔板,培养12 h,实验组加入不同体积ATD、芳姜黄酮及长春新碱母液,用完全培养基补足至总体积为100 μl/孔,使其终浓度分别为 5、10、20、40、80 μmol/L;设细胞对照组[不加药物,仅加入DMSO(体积分数10∶1 000)和培养液,其他处理同实验组]、空白组(不加DMSO、药物及细胞,余处理同前),每一浓度设6孔,培养48 h。培养结束前1.5 h,每孔加入10 μl CCK⁃8溶液孵育,酶标仪测定波长450 nm处吸光度(A)值。细胞增殖抑制率=(细胞对照A450⁃实验孔A450)/(细胞对照A450-空白孔A450)×100%。
3.细胞形态学观察:调整A375细胞密度为1.5×104个/ml,接种到 6孔板,培养 12 h,实验组加入ATD、芳姜黄酮及长春新碱,使终浓度分别为5、10、20、40、80 μmol/L,设不加药物细胞对照组,培养48 h,AO/EB染色,倒置显微镜观察细胞形态。
4.DNA片段化检测:调整A375细胞密度为1.4×105个/ml,按1 ml/孔接种于6孔板,培养12 h,实验组加入不同体积ATD、芳姜黄酮及长春新碱母液,补充完全培养基至总体积为2 ml/孔,使其终浓度为5、10、20、40、80 μmol/L,设不加药物细胞对照组,继续培养48 h,离心收集细胞。提取全基因组DNA,参考Hassan等[7]的方法,行琼脂糖凝胶电泳,凝胶成像仪下观察并拍照。
5.Caspase⁃3活性检测:A375细胞培养方法同“DNA片段化检测”,按照caspase⁃3活性检测试剂盒步骤操作,酶标仪检测波长405 nm处吸光度(A值)。Caspase⁃3活化程度=实验组A405/细胞对照组A405。
6.细胞凋亡检测:A375细胞培养方法同“DNA片段化检测”,用不含乙二胺四乙酸(EDTA)的胰酶消化,参考Jiang等[8]实验方法,按Annexin V⁃FITC凋亡检测试剂盒染色,然后上机检测。
7.细胞周期检测:取对数生长期A375细胞,参照Wu等[9]的实验方法,调整细胞密度为1.5 × 105个/ml,按1 ml/孔接种于6孔板,培养12 h,实验组加入不同体积ATD母液,使其终浓度分别为5、10、20、40、80 μmol/L,设不加药物细胞对照组,继续培养48 h,用不含EDTA的胰酶消化,1 000×g离心5 min,收集细胞,乙醇固定细胞1 h,按照周期试剂盒操作步骤加入PI染色液后上机检测。
三、统计学处理
采用SPSS13.0,结果以x±s表示,同一时间段不同浓度组间采用单因素方差分析,两两比较用LSD检验;药效-剂量关系运用曲线估计,用R2及F值来表示。P<0.05为差异有统计学意义。
结 果
一、ATD、长春新碱及芳姜黄酮对A375细胞增殖的影响
见图1。3种药物对A375细胞有抑制增殖作用,且呈剂量依赖性(ATD:R2=0.99,F=340.96,P<0.05;长春新碱:R2=0.99,F=349.19,P<0.05;芳姜黄酮:R2=0.89,F=25.41,P<0.05),各浓度下3种药物组细胞的增殖抑制程度与细胞对照组相比差异均有统计学意义(均P<0.05)。ATD、长春新碱及芳姜黄酮IC50分别为(15.96±0.02)、(77.00± 0.04)及(356.95 ± 0.01)μmol/L。当药物浓度为5、10 μmol/L时,ATD对A375细胞增殖抑制率分别为(26±0.06)%及(39±0.02)%,长春新碱为(8±0.04)%及(17±0.08)%,芳姜黄酮为(6±0.09)%及(10±0.07)%;ATD对A375细胞增殖抑制率与芳姜黄酮及长春新碱相比,差异均有统计学意义(P<0.05)。
二、ATD、长春新碱及芳姜黄酮对HSF增殖的影响
见图2。当药物浓度为5、10 μmol/L时,ATD对HSF增殖抑制率分别为(8±0.06)%及(25±0.02)%,长春新碱为(33±0.04)%及(29±0.08)%,芳姜黄酮为(49±0.09)%及(34±0.07)%;与细胞对照组相比,3种药物对细胞增殖的抑制作用差异均有统计学意义(P<0.05)。当药物浓度增高至20、40、80 μmol/L时,ATD对HSF的抑制作用明显强于长春新碱及芳姜黄酮(均P<0.05)。
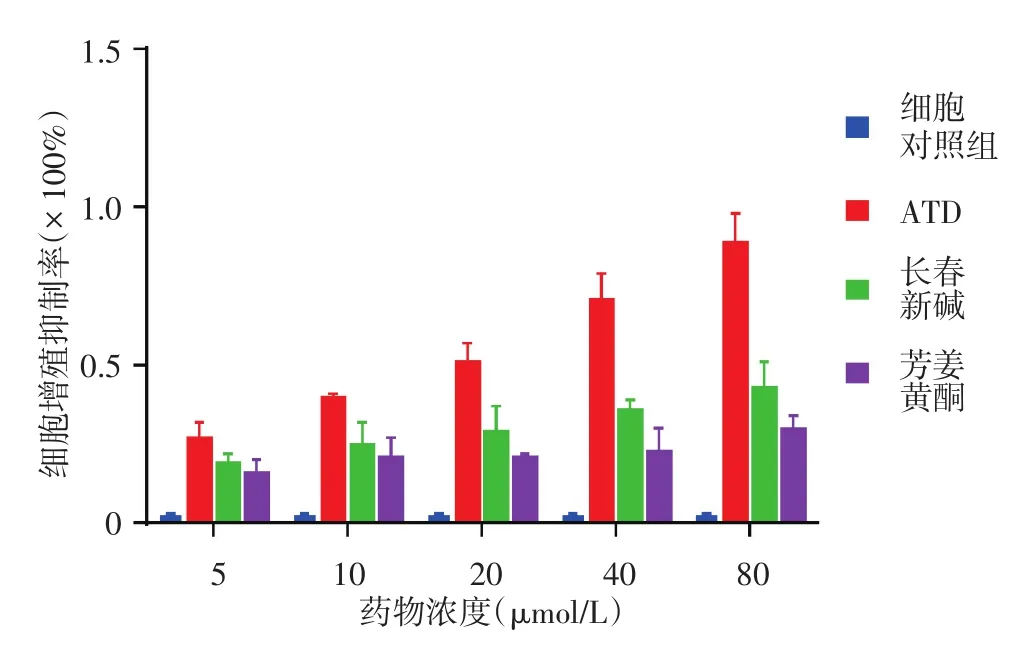
图1 芳姜黄酮衍生物(ATD)、长春新碱及芳姜黄酮作用48 h对A375细胞增殖的抑制率(n=6)

图2 芳姜黄酮衍生物(ATD)、长春新碱及芳姜黄酮作用48 h对人皮肤成纤维细胞增殖的抑制率(n=6)
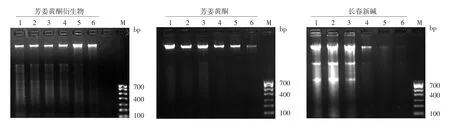
图3 不同浓度芳姜黄酮衍生物、芳姜黄酮、长春新碱作用A375细胞48 h后DNA片段化电泳图 M:标准参照物;1~5:分别为80、40、20、10、5 μmol/L 药物组;6:细胞对照组
三、ATD、长春新碱及芳姜黄酮对A375细胞形态的影响
对照组细胞呈多角形或梭形,紧密排列,生长活跃,呈现致密的绿色荧光;不同浓度ATD、长春新碱及芳姜黄酮组可见数量不等的黄绿色荧光,由低浓度至高浓度,黄绿色荧光逐渐减少,而桔黄色荧光逐渐增多,细胞逐渐变圆,贴壁性降低,细胞间隙增大,并有大量漂浮坏死细胞及细胞碎片,以ATD诱导细胞凋亡最为显著。
四、ATD、长春新碱及芳姜黄酮对A375细胞DNA片段化影响
作用A375细胞48 h后,5~ 80 μmol/L ATD组、20~ 80 μmol/L芳姜黄酮组、10~ 80 μmol/L长春新碱组均见明显DNA片段化,且随浓度升高片段化程度增强。5~80 μmol/L浓度范围内,对DNA片段化的诱导作用为ATD>长春新碱>芳姜黄酮。见图3。
五、ATD、长春新碱及芳姜黄酮对A375细胞caspase⁃3活性的影响

图4 芳姜黄酮衍生物(ATD)、长春新碱及芳姜黄酮作用48 h后A375细胞caspase⁃3活性
见图4。ATD、长春新碱及芳姜黄酮均不同程度活化A375细胞caspase⁃3,其中以ATD组最为明显。随药物浓度增加,caspase⁃3活性逐渐增加,且呈剂量依赖性(ATD:R2=0.98,F=162.30,P<0.05;长春新碱:R2=0.96,F=94.39,P<0.05;芳姜黄酮:R2=0.95,F=57.35,P<0.05)。在浓度为10、20、40及80 μmol/L时,各药物组与细胞对照组相比,差异均有统计学意义(P<0.05),ATD组与长春新碱及芳姜黄酮组比较,差异亦有统计学意义(均P<0.05)。
六、ATD、长春新碱及芳姜黄酮对A375细胞凋亡的影响
见表1。3种药物作用A375细胞48 h后,细胞出现不同程度凋亡。随药物浓度递增,ATD组晚期凋亡细胞逐渐增多,早期凋亡细胞呈现先增多后减少趋势;芳姜黄酮组早期凋亡及晚期凋亡不明显;长春新碱组晚期凋亡细胞逐渐增多,早期凋亡细胞亦呈现先增多后减少趋势。药物浓度为5~80 μmol/L时,3种药物组早期凋亡率及晚期凋亡率同对照组相比,差异均有统计学意义(均P<0.05)。而且,随药物浓度增加,ATD组发生坏死逐渐增多,与长春新碱组及芳姜黄酮组坏死率相比,差异均有统计学意义(P<0.05),见表2。
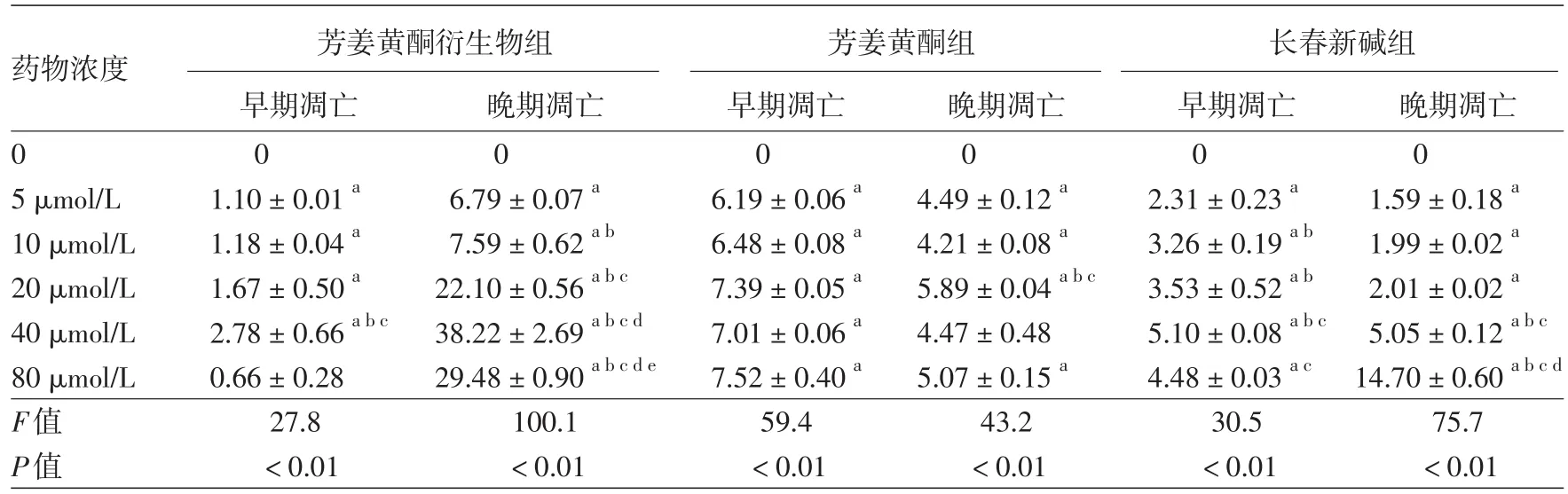
表1 不同浓度芳姜黄酮衍生物、芳姜黄酮及长春新碱作用48 h后A375细胞凋亡率比较(%,x±s)
七、ATD对A375细胞周期的影响
随ATD浓度增加,G1期细胞比例逐渐增高多,与对照组相比,差异均有统计学意义(P<0.05);但G2期及S期细胞逐渐减少,浓度为80 μmol/L时,G2期及S期细胞比例均降至0。见表3。
讨 论
我们曾对以芳姜黄酮为主要成分的姜黄挥发油进行抗肿瘤活性研究,发现其对人急性单核细胞白血病THP⁃1细胞株具有较好的抗肿瘤活性[10],芳姜黄酮通过诱导细胞凋亡及免疫激活等不同作用方式发挥抗癌活性,但其作用与化疗药物相比较弱。为寻求抗肿瘤活性更高而毒性更低的药物,我们选择ATD行抗黑素瘤活性研究,发现ATD通过影响凋亡相关分子而对黑素瘤细胞发挥抑制增殖及促凋亡作用。

表2 不同浓度芳姜黄酮衍生物、芳姜黄酮及长春新碱作用48 h后A375细胞死亡率比较(%,x±s)
本研究结果显示,ATD、芳姜黄酮及长春新碱都不同程度抑制A375细胞增殖,随药物剂量增加,增殖抑制作用增强,且为剂量依赖性,抗肿瘤活性ATD>长春新碱>芳姜黄酮。但3种药物对HSF有不同程度的影响,随药物浓度增加,ATD对HSF的作用明显增加,芳姜黄酮组及长春新碱组增加不明显。但当药物浓度为5及10 μmol/L时,ATD毒性明显小于芳姜黄酮及长春新碱,且在此浓度范围内,ATD抗肿瘤活性明显强于芳姜黄酮及长春新碱。
凋亡是由特定基因调控的细胞自杀过程,本实验中,随ATD、芳姜黄酮及长春新碱浓度增加,A375贴壁性能下降,并见数量不等的漂浮细胞及细胞碎片,说明3种药物都不同程度诱导细胞凋亡,当药物浓度为20、40及80 μmol/L时,可见ATD组细胞明显减少,细胞变圆,细胞间隙明显增宽,且见大量坏死细胞,而芳姜黄酮组及长春新碱组仍然可见到数目较多的贴壁细胞,且细胞形态较正常,说明ATD具有显著诱导A375细胞凋亡的作用,其作用强于芳姜黄酮及长春新碱。
聚腺苷二磷酸⁃核糖聚合酶(poly ADP⁃ribose polymerase,PARP)是caspase⁃3的主要底物之一,参与DNA修复及维持基因完整性[11]。凋亡启动时,PARP被caspase⁃3剪切成85 000和31 000两个片段,使PARP中与DNA结合的2个锌指结构与羧基端的催化区域分离,最终使受PARP负调控的Ca2+/Mg2+依赖性核酸内切酶活性增高,裂解核小体间DNA,引起细胞凋亡[12]。本研究结果显示,随ATD、芳姜黄酮及长春新碱浓度增加,caspase⁃3活性逐渐增高,且为剂量依赖性,以ATD组caspase⁃3活化程度最为明显。DNA片段化亦证实,ATD、芳姜黄酮及长春新碱诱导A375细胞凋亡,电泳见典型DNA梯状条带,为凋亡时激活Ca2+或Mg2+依赖性核酸内切酶,致DNA链断裂形成50 000~300 000 bp DNA片段所致[13],且以ATD作用较为明显。
流式细胞仪检测显示,ATD、芳姜黄酮及长春新碱均可不同程度诱导细胞凋亡,随药物浓度增加,凋亡作用增强,但三者致使细胞发生凋亡的时期不一致。ATD主要使细胞发生晚期凋亡,早期凋亡变化不明显,随剂量增加,细胞凋亡率明显上升,坏死细胞亦显著增多。芳姜黄酮组以早期凋亡较为明显,长春新碱组以晚期凋亡较为明显,但长春新碱诱导细胞凋亡作用明显弱于ATD。

表3 不同浓度芳姜黄酮衍生物作用48 h后A375细胞周期分布(%,x±s)
本实验中,ATD由低浓度至高浓度,A375细胞G1期逐渐增多,G2期及S期细胞数明显减少,细胞周期被阻滞在G1期,细胞DNA合成受阻,阻断了细胞的有丝分裂,从而对A375细胞起到增殖抑制作用。
综上所述,ATD对A375细胞具有抑制增殖及促凋亡作用,且其作用强度明显强于芳姜黄酮及长春新碱。当药物浓度为10 μmol/L时,ATD毒性明显小于芳姜黄酮及长春新碱,但抗肿瘤活性明显强于芳姜黄酮及长春新碱。
[1]Malasoni R,Naqvi A,Srivastava A,et al.An improved HPLC method for simultaneous estimation of isocurcumenol,ar⁃turmerone and alpha,beta⁃turmerone in hexane soluble fraction of curcuma longa and its formulations[J].J Biomater Tiss Eng,2014,4(5):405⁃410.DOI:10.1166/jbt.2014.1175
[2]Prakash P,Misra A,Surin WR,et al.Anti⁃platelet effects of Curcuma oil in experimental models of myocardial ischemia⁃reperfusion and thrombosis[J].Thromb Res,2011,127(2):111⁃118.DOI:10.1016/j.thromres.2010.11.007.
[3]Kim D,Suh Y,Lee H,et al.Immune activation and antitumor response of ar⁃turmerone on P388D1 lymphoblast cell implanted tumors[J].Int J Mol Med,2013,31(2):386⁃392.DOI:10.3892/ijmm.2012.1196.
[4]Mehrotra N,Sabarinath S,Suryawanshi S,et al.LC⁃UV assay for simultaneous estimation of aromatic turmerone, α/β ⁃turmerone and curlone:major bisabolane sesquiterpenes of turmeric oil in rabbit plasma for application to pharmacokinetic studies[J].Chromatographia,2009,69(9):1077⁃1082.DOI:10.1365/s10337⁃009⁃1007⁃1.
[5]潘博文,石洋,刘雄伟,等.姜烯衍生物的合成及其与吲哚类化合物的 Friedel⁃Crafts反应[J].合成化学,2013,21(4):400⁃405.DOI:10.3969/j.issn.1005⁃1511.2013.04.004.Pan BW,Shi Y,Liu XW,et al.Synthesis and friedel⁃crafts reaction with indole derivatives of zingiberene derivatives[J].Chin J Synthetic Chem,2013,21(4):400⁃405.DOI:10.3969/j.issn.1005⁃1511.2013.04.004.
[6]Song M,Park DK,Park HJ.Antrodia camphorata grown on germinated brown rice suppresses melanoma cell proliferation by inducing apoptosis and cell differentiation and tumor growth[J].Evid Based Complement Alternat Med,2013,2013:321096.DOI:10.1155/2013/321096.
[7] Hassan AM,Abdel⁃Aziem SH,El⁃Nekeety AA,et al.Panax ginseng extract modulates oxidative stress,DNA fragmentation and up⁃regulate gene expression in rats sub chronically treated with aflatoxin B1 and fumonisin B 1[J].Cytotechnology,2015,67(5):861⁃871.DOI:10.1007/s10616⁃014⁃9726⁃z.
[8] Jiang AJ,Jiang G,Li LT,et al.Curcumin induces apoptosis through mitochondrial pathway and caspases activation in human melanoma cells[J].Mol Biol Rep,2015,42(1):267⁃275.DOI:10.1007/s11033⁃014⁃3769⁃2.
[9] Wu Z,Liu B,E C,et al.Resveratrol inhibits the proliferation of human melanoma cells by inducing G1/S cell cycle arrest and apoptosis[J].Mol Med Rep,2015,11(1):400 ⁃404.DOI:10.3892/mmr.2014.2716.
[10]涂云华,康颖倩,周英,等.姜黄挥发油对THP⁃1细胞增殖及凋亡的影响[J].山东大学学报(医学版),2015,5:46⁃51.DOI:10.6040/j.issn.1671⁃7554.0.2014.731.Tu YH,Kang YQ,Zhou Y,et al.Effect of turmeric volatile oil on the proliferation and apoptosis of human leukemia cell line THP⁃1[J].J Shandong Univ(Health Sci),2015,5:46⁃51.DOI:10.6040/j.issn.1671⁃7554.0.2014.731.
[11]Rouleau M,Patel A,Hendzel MJ,et al.PARP inhibition:PARP1 and beyond[J].Nat Rev Cancer,2010,10(4):293 ⁃301.DOI:10.1038/nrc2812.
[12]龙建飞,张弛,张秋霞,等.黄连解毒汤有效部位对脑缺血大鼠半暗带神经元NeuN、Caspase⁃3、PARP表达的影响[J].北京中医药大学学报,2014,37(2):90⁃93,98,后插1.DOI:10.3969/j.issn.1006⁃2157.2014.02.005.Long JF,Zhang C,Zhang QX,et al.Active fraction of Huanglian Jiedu Tang affecting expression of penumbra neurons NeuN,Caspase⁃3 and PARP in rats after cerebral ischemia[J].Journal of Beijing University of Traditional Chinese Medicine,2014,37(2):90⁃93,98,back insert page 1.DOI:10.3969/j.issn.1006⁃2157.2014.02.005.
[13] Joshi N,Grant SG.Pulsed⁃field gel electrophoresis analysis of multicellular DNA double⁃strand break damage and repair[J].Methods Mol Biol,2014,1105:193⁃202.DOI:10.1007/978⁃1⁃62703⁃739⁃6_16.
Effects of an ar⁃turmerone derivative on the proliferation and apoptosis of A375 human melanoma cells and their mechanisms
Tu Yunhua,Kang Yingqian,Li Ming′e,Zhou Ying,Xue Yuecui,Ye Zhenyuan,Rong Dongyun,Zan Xuejuan,Pan Junling,Lu Hongguang,Cao Yu
Department of Dermatology and Venereology,Affiliated Hospital of Guizhou Medical University,Guiyang 550004,China(Tu YH,Li ME,Xue YC,Ye ZY,Rong DY,Zan XJ,Pan JL,Lu HG,Cao Y);Department of Microbiology,Guizhou Medical University,Guiyang 550004,China(Kang YQ);Guizhou Provincial Chinese Medicine(Ethnic Medicine)Creation Engineering Center,College of Life Sciences,Guizhou University,Guiyang 550025,China(Zhou Y)
ObjectiveTo investigate the effects of an ar⁃turmerone derivative(ATD)on the proliferation and apoptosis of A375 human melanoma cells.MethodsBoth A375 cells and human skin fibroblasts(HSFs)were cultured with different concentrations(5,10,20,40 and 80 μmol/L)of ATD,vincristine and ar⁃turmerone,separately,for 48 hoursin vitro.Subsequently,cell counting kit⁃8(CCK ⁃8)was used to evaluate cell proliferation,inverted microscopy to observe cell morphology after acridine orange/ethidium bromide(AO/EB)staining,and a colorimetric method to estimate caspase⁃3 activity.DNA fragmentation assay and flow cytometry were performed to assess cell apoptosis,and flow cytometry was conducted to analyze cell cycle.ResultsATD,vincristine and Ar⁃turmerone all inhibited the proliferation of A375 cells in a dose⁃dependent manner(ATD:R2=0.99,F=340.96,P< 0.05;vincristine:R2=0.99,F=349.19,P< 0.05;ar⁃turmerone:R2=0.89,F=25.41,P< 0.05).The fifty percent inhibitory concentra⁃tions(IC50s)of ATD,vincristine and ar⁃turmerone against A375 cells were 15.96 ± 0.02 μmol/L,77.00 ± 0.04 μmol/L and 356.95 ± 0.01 μmol/L respectively.When the drug concentrations were 5 and 10 μmol/L,the proliferation of HSFs was inhibited by 8%±0.06%and 25%±0.02%respectively by ATD,by 49%±0.09%and 34%±0.07%respectively by ar⁃turmerone,and by 33% ± 0.04%and 29% ± 0.08%respectively by vincristine,and the proliferation of A375 cells was inhibited by 26%±0.06%and 39%±0.02%respectively by ATD,by 6%±0.09%and 10%±0.07%respectively by ar⁃turmerone,and by 8% ± 0.04%and 17% ± 0.08%respectively by vincristine,with the inhibitory effects of the three drugs being significantly different from that of dimethyl sulfoxide(allP< 0.05).ATD showed stronger inhibitory effects on the proliferation of A375 cells,but weaker cytotoxic effects on HSFs compared with ar⁃turmerone and vincristine(allP< 0.05).Meanwhile,ATD,vincristine and ar⁃turmerone all induced the apoptosis of A375 cells(P<0.05),and caspase⁃3 activity increased with the increase in drug concentrations(ATD:R2=0.98,F=162.30,P< 0.05;vincristine:R2=0.96,F=94.39,P< 0.05;ar⁃turmerone:R2=0.95,F=57.35,P< 0.05).The effect of ATD on caspase⁃3 activity was strongest,followed by that of vincristine and ar⁃turmerone.As flow cytometry showed,all the three drugs induced cell apoptosis to different degrees,and ATD showed a relatively strong effect on cell apoptosis,especially late apoptosis,compared with the other two drugs.In the ATD group,the number of A375 cells in G1 phase gradually increased,while that in G2 phase and S phase significantly decreased with the increase in drug concentrations.Conclusions ATD exhibited proliferation⁃inhibiting and apoptosis⁃inducing effects on A375 cells,and the effects were stronger than those of vincristine and ar⁃turmerone.It is quite possible that ATD affects cell proliferation and differentiation by activating caspase⁃3 and arresting cell cycle in the G1 phase.
Melanoma,experimental;Cell line,tumor;Turmerone;Vincristine;Cell proliferation;Apoptosis;Ar⁃turmerone derivatives
Cao Yu,Email:382541077@qq.com
曹煜,Email:382541077@qq.com
10.3760/cma.j.issn.0412⁃4030.2016.07.012
贵州省中药现代化专项项目[黔科合中药字(2012)5018号];贵阳市科技局科技创新平台项目[筑科合同(2012303)号];贵州省中药民族药创制工程中心[黔教合字(2012)018号]
Fund programs:Modernization of Traditional Chinese Medicine Program of Guizhou Province(Grant No.[2012]5018);Science and Technology Innovation Platform Project of Guiyang Municipal Science and Technology Bureau(Grant No.2012303);Pharmaceutical Engineering Center for Traditional Chinese Medicine and National Medicine of Guizhou Province(Guizhou Education Grant No.[2012]018)
2015⁃07⁃31)
(本文编辑:尚淑贤)

