基本培养基及激素对野生一粒小麦幼胚培养的影响
李 扬,徐 凤,柴乖强,李春莲,王中华
(旱区作物逆境生物学国家重点实验室/农业部西北地区小麦生物学与遗传育种重点实验室/西北农林科技大学农学院,陕西杨凌 712100)
基本培养基及激素对野生一粒小麦幼胚培养的影响
李 扬,徐 凤,柴乖强,李春莲,王中华
(旱区作物逆境生物学国家重点实验室/农业部西北地区小麦生物学与遗传育种重点实验室/西北农林科技大学农学院,陕西杨凌 712100)
为建立适于野生一粒小麦遗传转化的高效组培再生体系,以野生型一粒小麦幼胚为外植体,研究了MS、MSE3和N6三种基本培养基和激素对愈伤组织诱导、分化和成苗的影响。结果表明,愈伤诱导培养基以MES3为基本培养基并添加2.0 mg·L-12, 4-D效果最佳,愈伤组织出愈率最高可达90.5%,胚性愈伤率为80.0%。愈伤组织分化过程在添加0.25 mg·L-1IAA的MS培养基中加入0.5 mg·L-16-BA分化效果最佳,分化率能达到50.7%,成苗率为26.5%。
野生一粒小麦;幼胚;愈伤组织;再生
随着测序技术的快速发展,普通小麦的基因组测序工作进展很快,其A、D基因组的二倍体供体种以及普通小麦中国春的基因组测序工作已完成[1-3]。由此,小麦的研究工作即将进入基因功能研究快速发展的新时期。但由于普通小麦是由3个二倍体供体材料经过两次天然杂交形成的异源六倍体,基因组大小为17 Gb,十分庞大,并且普通小麦的基因通常以多拷贝的形式存在,功能上有很大的冗余,这为研究小麦重要基因的功能造成巨大困难。野生一粒小麦(Triticumboeoticum, AA)是普通小麦A基因组的二倍体供体种,其基因组以及功能基因的冗余度比普通小麦小,可以作为研究小麦基因功能的一个较为理想的受体。同时,A基因组中含有包括抗病基因在内的大量重要的具有经济价值的基因。以抗白粉病基因为例,在已确定的50个小麦抗白粉病基因位点中11个都被定位在A染色体上[4]。所以建立野生一粒小麦的高效遗传转化体系可以为小麦功能基因的研究提供技术上的保证。
但二倍体小麦相比于四倍体和六倍体小麦来说,组培过程中愈伤组织形成和分化能力较差。目前对野生一粒小麦再生体系领域的研究仍较少,且再生率极低。陆维忠等[5]利用一粒小麦幼胚进行试验发现,一粒小麦幼胚出愈率仅为30%~40%,且并未得到再生植株。毕瑞明等[6]以野生一粒小麦成熟胚作为外植体,发现成熟胚诱导率为68.8%,再生效率仅为0.6%,不能适应批量化基因转化的要求。因此,亟须建立高效的野生一粒小麦组培再生体系和遗传转化体系。
目前,小麦组培体系的研究已比较成熟。小麦的再生效率主要取决于基因型、外植体类型和培养基成分等。在小麦研究中常用的外植体有幼胚、幼穗、花药和成熟胚,其中小麦幼胚出愈率和再生率高,被普遍认为是最佳的小麦组织培养外植体[7-8]。基于小麦幼胚研究进展,本研究以野生一粒小麦幼胚为外植体,使用不同基本培养基和不同浓度2, 4-D、6-BA进行诱导和分化,以期寻找适合野生一粒小麦幼胚的组织培养条件,提高一粒小麦再生效率,为研究小麦基因功能奠定基础。
1 材料与方法
1.1材 料
二倍体野生型一粒小麦YL1(Triticumboeoticum, AA)由西北农林科技大学小麦遗传育种新技术创新团队提供。2014年秋播种于西北农林科技大学试验田,2015年春取幼穗进行试验。
1.2培养基
本研究中所用培养基见表1,其中,MSE3培养基为:MS大量+MS微量+MS有机+盐酸硫胺素(0.04 mg·L-1)+L-天冬酰胺(150 mg·L-1)。所有培养基pH值均调节为5.8,然后120 ℃高温灭菌20 min。
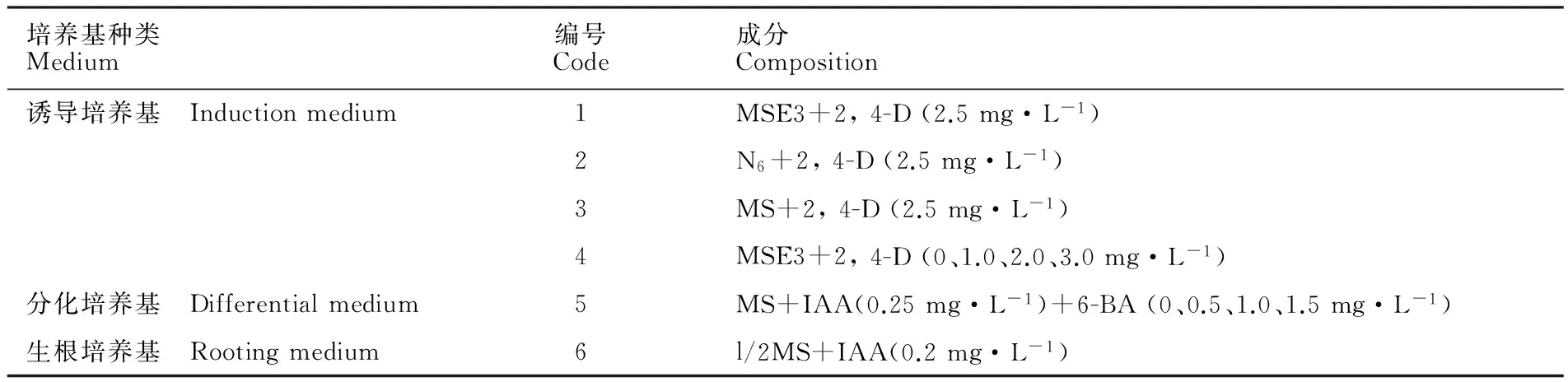
表1 诱导、分化培养基成分Table 1 Media of callus induction and differentiation
1.3组织培养
1.3.1种子消毒
取扬花后10~12 d的野生一粒小麦幼穗,插入水中置于4 ℃冰箱低温处理1~2 d后用镊子拨出籽粒。用75%(v/v)酒精表面消毒1 min,无菌水冲洗2~3次,15%(v/v)次氯酸钠消毒20 min,无菌水冲洗3~5次。
1.3.2接种及愈伤组织诱导
用镊子挑取野生一粒小麦种子的幼胚,盾片朝上接种在愈伤组织诱导培养基上。每皿接种约100个幼胚,每个处理3次重复。25 ℃黑暗条件下培养,每14天继代1次。诱导培养7 d后统计诱导出的愈伤组织数,愈伤诱导30 d左右统计胚性愈伤组织数。
1.3.3愈伤组织分化
待愈伤诱导30 d左右并统计胚性愈伤组织数后,挑取胚性愈伤组织接种到分化培养基上,将培养皿密封后置于人工气候培养箱,25 ℃光培养,每14天继代1次。分化培养30 d后统计长出绿点的愈伤组织数,分化40 d统计成苗数。
1.3.4再生植株生根及移栽
待绿苗长至3~5 cm时移至生根培养基。待植株生根且再生植株长至6~8 cm时移栽,炼苗1周,生长至成熟。
1.4数据统计与分析
实验数据用DPS软件进行处理,方差分析用LSD法检验。出愈率、胚性愈伤率、分化率和成苗率分别用以下公式进行计算。
愈伤组织诱导率=形成愈伤组织的幼胚数/接种幼胚数×100%;胚性愈伤组织诱导率=形成胚性愈伤组织的幼胚数/接种幼胚数×100%;分化率=分化出绿点的愈伤组织块数/接种在分化培养基上的愈伤组织块数×100%;成苗率=分化出绿苗的愈伤组织块数/接种在分化培养基上的愈伤组织块数×100%。
2 结果与分析
2.1基本培养基对野生一粒小麦幼胚愈伤组织诱导的影响
挑取一粒小麦幼胚分别接种到MSE3、N6和MS(每种诱导培养基中分别添加2.5 mg·L-1的2,4-D)三种不同愈伤诱导培养基上培养,结果(表2)表明,一粒小麦幼胚在3种基本培养基上的出愈率均达到85%以上,胚性愈伤率均达到68%以上,但不同培养基的诱导率存在显著差异(P<0.05)。MSE3基本培养基的诱导率和胚性愈伤率均最高,N6次之,MS最差。MSE3培养基愈伤诱导率与MS培养基之间存在极显著差异(P<0.01),胚性愈伤率与MS培养基之间存在显著差异(P<0.05)。
从愈伤质量来看,MSE3培养基上绝大多数愈伤组织呈淡黄色致密颗粒状,而N6和MS培养基上的愈伤组织则为乳白色、水质状。从总体上来看,MSE3更适合一粒小麦幼胚愈伤组织的诱导,诱导率可达93.3%,胚性愈伤率为83.0%,且诱导出的愈伤组织质量较好。
2.2不同浓度2, 4-D对野生一粒小麦幼胚愈伤组织诱导的影响
在MSE3基本培养基中分别添加0、1.0、2.0和3.0 mg·L-1的2,4-D,研究2,4-D浓度对一粒小麦幼胚愈伤组织诱导率及胚性愈伤率的影响,结果(表3)表明,在MSE3培养基中不同浓度的2, 4-D对一粒小麦幼胚愈伤诱导和胚性愈伤组织的形成存在着明显的影响。
在不添加2, 4-D的对照处理中,接种幼胚直接形成实生芽,导致愈伤组织较小,几乎无法形成胚性愈伤。而随着2, 4-D浓度的升高,幼胚的出愈率和胚性愈伤率都有显著提高。当2, 4-D浓度达到2.0 mg·L-1时,出愈率和胚性愈伤率都达到最大值,分别为90.5%和80.0%,且与对照存在极显著差异(P<0.01)。当2, 4-D浓度继续升高,出愈率和胚性愈伤率极显著地下降。

表2 基本培养基对野生一粒小麦幼胚愈伤组织诱导的影响Table 2 Effects of basal medium on callus induction of immature embryo in Triticum boeoticum
同列数字后的不同小写字母表示差异在0.05水平上显著;同列数字后的不同大写字母表示差异在0.01水平上显著。下同
Values labeled with different lower-case letters in the same column are significantly different among the treatments at 0.05 level and values labeled with different capital letters are significantly different among the treatments at 0.01 level.The same as below
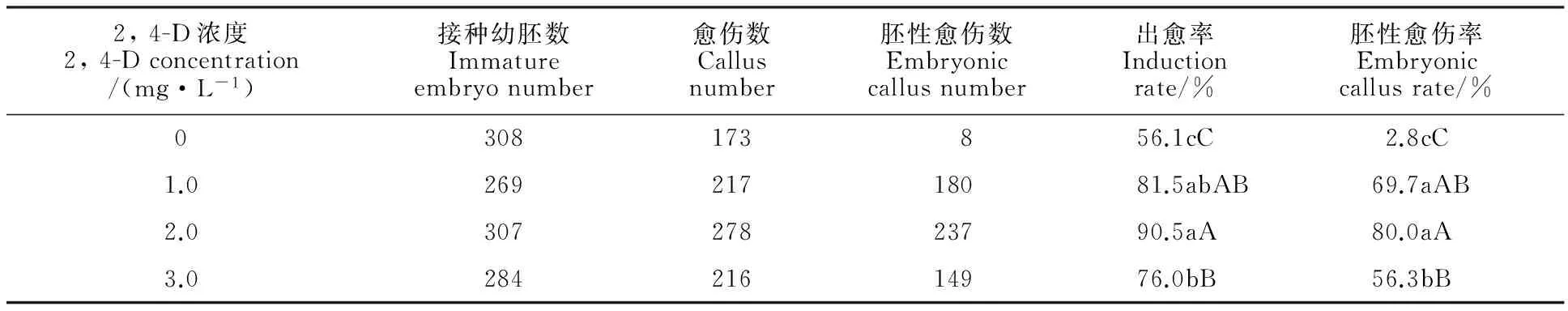
表3 不同浓度2, 4-D对野生一粒小麦幼胚愈伤组织诱导的影响Table 3 Effects of 2, 4-D concentration on immature embryo callus induction in Triticum boeoticum
2.3不同浓度6-BA对野生一粒小麦幼胚愈伤组织分化的影响
在MS+IAA(0.25 mg·L-1) 的愈伤组织分化培养基中分别添加不同浓度的6-BA,研究6-BA浓度对一粒小麦幼胚愈伤组织分化的影响。结果(表4)表明,6-BA的浓度对一粒小麦愈伤组织的分化具有重要影响。最适宜野生一粒小麦幼胚分化的6-BA浓度为0.5 mg·L-1,此时分化率和成苗率均最高,且与其他处理差异极显著(P<0.01)。在添加不同浓度6-BA的分化培养基中,分化率范围为22.4%~50.7%,最高分化率比最低高28.3%,成苗率范围为7.2%~26.5%,成苗率最高比最低高19.3%。观察发现(图1),当6-BA浓度为0和0.5 mg·L-1时愈伤组织呈淡黄色、较致密,而当6-BA浓度继续升高,愈伤组织褐化严重,分化率显著下降。因此,适宜一粒小麦分化的6-BA浓度为0.5 mg·L-1,分化率最高可达50.7%,成苗率为26.5%。
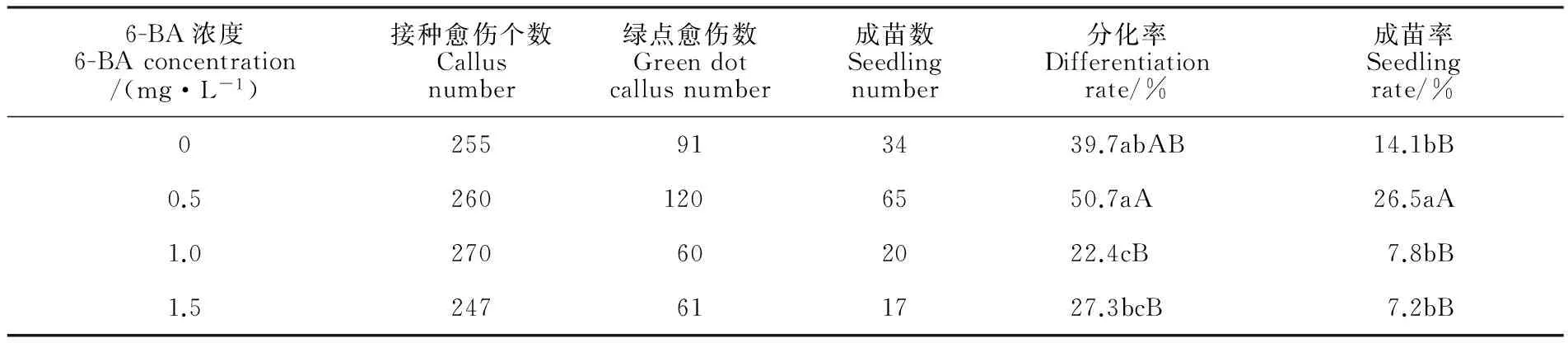
表4 不同浓度6-BA对野生一粒小麦幼胚愈伤分化的影响Table 4 Effects of 6-BA concentration on immature embryo callus differentiation in Triticum boeoticum
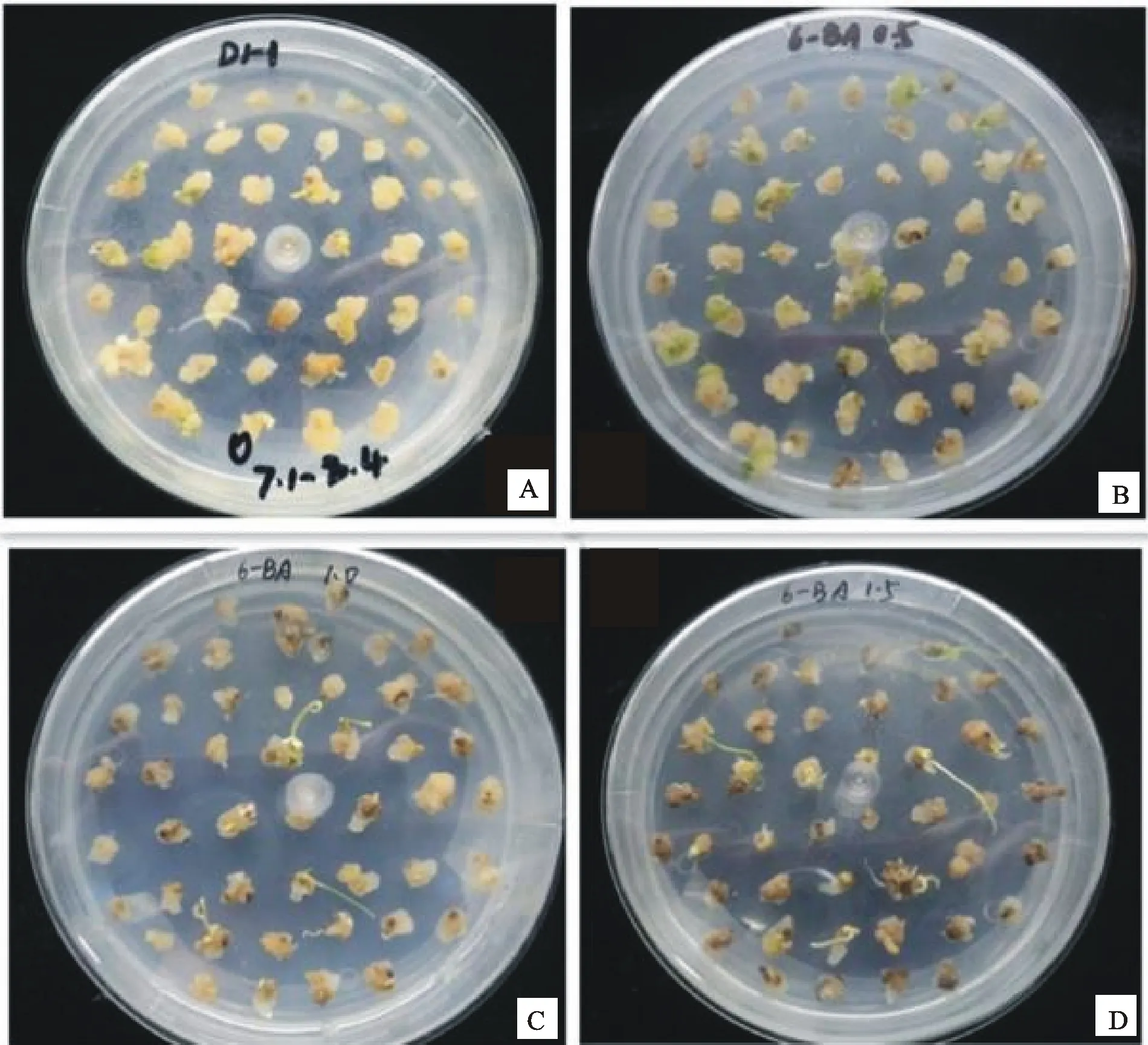
A~D分别代表0、0.5、1.0和1.5 mg·L-14个6-BA浓度
A-D indicated the four 6-BA concentrations of 0, 0.5, 1.0 and 1.5 mg·L-1,respectively
图1不同浓度6-BA诱导野生一粒小麦的分化情况
Fig.1Differentiation of immature embryo callus in different 6-BA concentrations
3 讨 论
已有的研究大多以MS培养基为诱导小麦愈伤组织最常用的基本培养基。伍 玲等[9]利用四川小麦背景的小麦幼胚进行研究,发现MSE3培养基的愈伤组织诱导率比MS培养基平均高18.2%,显著提高了诱导效率。本研究显示在所用的3种基本培养基中,MSE3效果最佳,MSE3培养基上愈伤组织诱导率和胚性愈伤率都显著高于MS和N6两种培养基,说明MSE3培养基同样适宜于野生一粒小麦幼胚愈伤诱导。
2, 4-D是麦类作物组织培养中最常用的外源激素,它相比于其他生长素更适合小麦愈伤组织的诱导[10],且在MS培养基上添加2.0~3.0 mg·L-1的2, 4-D诱导小麦幼胚产生愈伤组织均取得良好效果[11]。本研究以MSE3为基本培养基,在2, 4-D设置的4个浓度梯度中,诱导率和胚性愈伤率随2, 4-D浓度的增加呈单峰曲线变化,当浓度为2.0 mg·L-1时效果最好,与Wu等[12]和陈学虎等[13]在小麦中的研究结果一致。说明一粒小麦最佳的2, 4-D使用量与小麦相同。在2, 4-D浓度为0 时诱导效果最差,实验证明生长素是一粒小麦愈伤诱导过程必需的激素,但过高浓度的2, 4-D也不利于愈伤组织的形成。
本研究在低浓度的生长素环境中添加不同浓度的细胞分裂素6-BA,研究了适合野生一粒小麦幼胚分化的6-BA浓度,结果发现,0.5 mg·L-16-BA最适宜野生一粒小麦分化,当浓度继续增加,愈伤组织褐化严重,该结果与赵占军等[14]研究结论一致。曾有人以薄皮核桃、辣椒和沙棘等为材料,发现低浓度的6-BA适宜愈伤组织的分化,随着培养基中6-BA浓度的升高,褐化率显著升高,分化率下降[15-18],与本研究结果相同。在组培过程中植物组织褐变会造成分化率下降、组培材料死亡等结果,严重影响了组织培养效率。张卫芳等[15]认为在分化培养基中添加生长素2, 4-D及IAA可以减弱高浓度细胞分裂素的伤害。在未来试验中可深入研究,考虑二者复配对愈伤分化的影响,从而选择最佳的生长素与细胞分裂素的浓度配比,进一步提高一粒小麦的分化效率。
本研究对野生一粒小麦再生体系的研究较前人有了显著提升,出愈率、胚性愈伤率、分化率和成苗率都显著提高,分别可达到90.5%、80.0%、50.7%和26.5%,证明了野生一粒小麦具有极高的再生潜力,经过不断深入的研究,一粒小麦可以作为研究小麦功能基因的重要受体材料,为今后的研究奠定基础。
[1]Ling H,Zhao S,Liu D,etal.Draft genome of the wheat A-genome progenitorTriticumurartu[J].Nature,2013,496(7443):87-90.
[2]Jia J,Zhao S,Kong X,etal.Aegilopstauschiidraft genome sequence reveals a gene repertoire for wheat adaptation [J].Nature,2013,496(7443):91-95.
[3]The International Wheat Genome Sequencing Consortium (IWGSC).A chromosome-based draft sequence of the hexaploid bread wheat (Triticumaestivum) genome [J].Science,2014,345(6194):1251788.
[4]Chhuneja P,Yadav B,Stirnweis D,etal.Fine mapping of powdery mildew resistance genes PmTb7A.1 and PmTb7A.2 inTriticumboeoticum(Boiss.) using the shotgun sequence assembly of chromosome 7AL [J].TheoreticalandAppliedGenetics,2015,128(10):2099-2111.
[5]陆维忠,佘建明,吴鹤鸣,等.小麦属不同种间胚组织培养的诱导与分化 [J].江苏农业学报,1989,5(4):9-13.
Lu W Z,She J M,Wu H M,etal.Callus induction and differentiation in embryo culture ofTriticumspecies [J].JiangsuJournalofAgriculturalSciences,1989,5(4):9-13.
[6]Bi R M,Kou M,Chen L G,etal.Plant regeneration through callus initiation from mature embryo ofTriticum[J].PlantBreeding,2007,126:9-12.
[7]于相丽,孟 军.小麦幼胚培养研究进展 [J].贵州农业科学,2009,37(7):13-16.
Yu X L,Meng J.Research advance in tissue culture of wheat immature embryo [J].GuizhouAgriculturalSciences,2009,37(7):13-16.
[8]Yang S Q,Xu K J,Wang Y F,etal.Analysis of biochemical and physiological changes in wheat tissue culture using different germplasms and explant types [J].ActaPhysiologiaePlantarum,2015,37(6):13-16.
[9]伍 玲,朱华忠.一种高效建立小麦再生系统的方法 [J].西南农业学报,2007,20(2):262-265.
Wu L,Zhu H Z.One effective method to built regeneration system of wheat [J].SouthwestChinaJournalofAgriculturalSciences,2007,20(2):262-265.
[10]Fennell S,Bohorova N,Ginkel M,etal.Plant regeneration from immature embryos of 48 elite CIMMYT bread wheats [J].TheoreticalandAppliedGenetics,1996,92(2):163-169.
[11]何盛莲,崔党群,陈军营,等.小麦幼胚培养特性对外源物质响应的研究 [J].西北农业学报,2006,15(2):49-53.
He S L,Cui D Q,Chen J Y,etal.Studies on the effects of exogenic substances on someclone culture of wheat immature embryos [J].ActaAgriculturaeBoreali-occidentalisSinica,2006,15(2):49-53.
[12]Wu L M,Wei Y M,Zheng Y L.Effects of auxins and media on callus induction of Chinese Spring wheat (TriticumaestivumL.) [J].AgriculturalSciencesinChina,2005,4(8):567-573.
[13]陈学虎,陈耀锋,王 丽,等.基因型和2,4-D浓度对小麦不同外植体离体培养特性的影响 [J].麦类作物学报,2013,33(3):450-454.
Chen X H,Chen Y F,Wang L,etal.Study on the effects of genotypes and 2,4-D concentrationinvitroculture traits of explant [J].JournalofTriticeaeCrops,2013,33(3):450-454.
[14]赵占军,陈茂盛,王贵娟.胚龄和激素对小麦幼胚组织培养的影响 [J].生物技术,2003,13(5):7-8.
Zhao Z J,Chen M S,Wang G J.Effect of age of immature embryos and exogenous hormones on the tissue culture from immature embryos of wheat [J].Biotechnology,2003,13(5):7-8.
[15]张卫芳,高疆生,欧勇慧,等.核桃组培中抑制褐化现象初探 [J].中国农学通报,2003,19(5):43-46.
Zhang W F,Gao J S,Ou Y H,etal.Primary study on browning control in tissue culture of pellicular walnut [J].ChineseAgriculturalScienceBulletin,2003,19(5):43-46.
[16]蒋 燕,王进涛,袁 红.激素配比对辣椒叶片愈伤组织诱导和不定芽分化的影响 [J].北方园艺,2013,37(14):118-120.
Jiang Y,Wang J T,Yuan H.Effect of hormone combinations on callus induction and adventitious bud differentiation of pepper leaves [J].NorthernHorticulture,2013,37(14):118-120.
[17]杜 研,李 毅,马彦军,等.几种影响沙棘组织培养外植体褐化因子分析 [J].河北农业大学学报,2007,30(5):40-43.
Du Y,Li Y,Ma Y J,etal.Factors affecting explant browning in tissue culture ofHippophaerhamnoidesL.[J].JournalofAgriculturalUniversityofHebei,2007,30(5):40-43.
[18]邱 璐,陈善娜,夏跃明,等.桑树组织培养中褐化问题的研究 [J].云南大学学报:自然科学版,2000,22(1):76-78.
Qiu L,Chen S N,Xia Y M,etal.Study on the browning during tissue culture ofMorusalbaL.[J].JournalofYunnanUniversity:NaturalEdition,2000,22(1):76-78.
The Effects of Basal Medium and Hormone on Immature Embryo Culture inTriticumboeoticum
LI Yang, XU Feng, CHAI Guaiqiang, LI Chunlian, WANG Zhonghua
(State Key Laboratory of Crop Stress Biology for Arid Areas/Key Laboratory of Wheat Biology and Gennetics-breeding in Northwest Area, Ministry of Agriculture/College of Agronomy,Northwest A&F University, Yangling, Shaanxi 712100, China)
In order to optimize regeneration system of immature embryo culture inTriticumboeoticum, the effects of the basal medium and hormone on callus induction, differentiation, and regeneration of immature embryo were studied. The results showed that the callus induction rates were obviously different in various basic media and 2, 4-D concentration. MSE3 with 2.0 mg·L-12, 4-D was suitable for producing immature embryos callus, in which the induction rate can reach to 90.5% and the frequency of embryonic callus induction was 80.0%. The differentiation and seedling rates shown as 50.7% and 26.5%, respectively, were significantly higher under 0.5 mg·L-16-BA than the other three treatments.
Triticumboeoticum; Immature embryo; Callus; Regeneration
时间:2016-05-10
2016-01-06
2016-03-02
国家自然科学基金项目(31271794)
E-mail:liyang910806@163.com
王中华(E-mail:zhonghuawang@nwsuaf.edu.cn)
S512.1;S330
A
1009-1041(2016)05-0583-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160510.1623.014.html

