Bohai sea-9145重组脂肪酶基因工程菌的发酵表达条件优化
冉凡娇,孙 谧,包 静,郝建华
(1.农业部海洋渔业可持续发展重点实验室,青岛市海洋酶工程重点实验室,中国水产科学研究院黄海水产研究所,山东青岛 266071;2. 上海海洋大学食品学院,上海 201306)
Bohai sea-9145重组脂肪酶基因工程菌的发酵表达条件优化
冉凡娇1,2,孙谧1,*,包静1,郝建华1
(1.农业部海洋渔业可持续发展重点实验室,青岛市海洋酶工程重点实验室,中国水产科学研究院黄海水产研究所,山东青岛 266071;2. 上海海洋大学食品学院,上海 201306)
为提高大肠杆菌(E.coli)基因工程菌产Bohai sea-9145重组脂肪酶(Lipase,EC3.1.1.3)的能力,有效制备Bohai sea-9145脂肪酶。采用单因素实验、Plackett-Burman实验和Box-Behnken响应面设计实验,对该重组酶基因工程菌的发酵表达条件进行了优化。最终确定的最佳条件是:接种量为1.5%,培养基的初始pH为8.0,诱导剂IPTG的添加时间为3.5 h,终浓度为0.5 mmol/L,诱导时间为15 h,诱导温度为16 ℃,摇床转速为200 r/min,经优化后该菌的产酶量是优化前的9.72倍。
Bohai sea-9145重组脂肪酶,基因工程菌,产酶条件优化,响应面分析
脂肪酶(Lipase,EC3.1.1.3)是一类主要水解甘油三酯的酰基水解酶,可以将甘油三酯降解生成甘油二酯、单甘油酯和脂肪酸,是一种重要的工业酶制剂[1]。在食品[2-3]、制药[4]、有机合成[5]、皮革[6]、日用化工[7]等方面具有非常广阔的应用前景。
海洋微生物的生活环境较陆地微生物复杂多样,来自海洋的微生物酶类比陆地微生物酶作用范围更广,应用前景更广阔,已经成为各国科学家广泛关注的热点。Bohai sea-9145脂肪酶是一种来自海洋的新型低温碱性脂肪酶,具有极大的发展潜力,其脂肪酶基因lipYp(1116 bp)来源于海洋酵母YarrowialipolyticaBohai sea-9145,该酵母于2004年由邵铁娟等[8]从2000多份渤海海区海水海泥样品中分离出来;随后,董宏伟等[9]对该酶的分离纯化条件及理化性质进行了研究,得到达到电泳纯的脂肪酶,分子量为(40.0±1) ku;李忠磊等[10]采用基因重组和分子生物学相关技术,将该酶基因进行了异源表达。
本文的研究是在该酶大肠杆菌基因工程菌BL21的基础上进行的,基因工程菌易繁殖、易培养、代谢快的特点使该酶的制备得以简化,但产酶效率仍然不高,其酶液活力仅为121.38 U/mL。本文主要通过单因素实验、Plackett-Burman实验和Box-Behnken响应面分析设计实验相结合的方法,对Bohai sea-9145大肠杆菌基因工程菌的发酵表达条件进行优化,提高该脂肪酶的制备效率。
1 材料与方法
1.1材料与仪器
海洋解脂耶氏酵母(Y.lipolyticaBohaisea-9145)由本研究团队自渤海海泥中分离并鉴定保存;埃希氏大肠杆菌(EscherichiacoliBL21 PET22-LiYp,E.coli)基因工程菌由本研究团队构建并提供;对硝基苯基月桂酸酯(p-nitropHenyl laurate,pNP-laurate)、对硝基苯酚(p-nitrophenol,pNP)、卡那霉素(kanamycin,Kana)、氨苄青霉素(ampicillin,Amp)和异丙基-β-D-硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG)购自Sigma公司;蛋白胨和酵母粉购自英国Oxoid公司;Prestained Protein Marker购自New England Bio Labs公司;其它试剂均购自国药集团;LB液体培养基胰蛋白胨1%,酵母粉0.5%,氯化钠1%;LB固体培养基LB液体培养基加2%的琼脂。
SHIMADZU UV-2550岛津分光光度计购自日本岛津公司;SHAKER型恒温培养摇床购自上海市离心机械研究所;SW-CJ型超净工作台购自中外合资苏州安泰空气技术有限公司;20PR-52D高速冷冻离心机购自日立公司;LKB2219恒温水浴购自瑞典BROMMA公司;ORION Model 818 pH计购自美国奥立龙;JY96-ⅡN型超声波细胞粉碎机购自宁波新芝科技生物股份有限公司;Bio-Rad Mini III蛋白电泳仪购自美国伯乐公司。
1.2实验方法
1.2.1溶液的配制100 mg/mL Kana贮存液配制:1 g Kana溶于10 mL双蒸水中,0.22 μm的滤膜过滤除菌,分装后-20 ℃保存;2.38 g IPTG溶于10 mL双蒸水或去离子水中,0.22 μm的滤膜过滤除菌,分装后-20 ℃保存;脂肪酶测活A液,83.33 mg pNP-laurate溶于异丙醇定容至25 mL,4 ℃保存;脂肪酶测活B液,4.0 g Triton X-100溶于100 mmol/L pH8.0磷酸盐缓冲液中,定容至1 L,4 ℃保存。
1.2.2脂肪酶活性的测定参照李忠磊[10]和Hatzinikolaou[11]等的方法并加以改进。适宜条件下pNP-laurate作为底物,可被脂肪酶等摩尔的分解为pNP,其最大吸收峰在410 nm,因而检测产物中的pNP在410 nm处的吸光度即可确定脂肪酶的酶活力。
将100 μL A液和1.5 mL B液混合置于35 ℃水浴中预热3 min,随后加入100 μL酶液(对照组选择100 ℃灭活的酶液),继续水浴6 min,反应结束后加入2.0 mL乙醇并冰浴终止反应,410 nm下测定其吸光值。
脂肪酶活力单位(U)定义为,在35 ℃,pH8.0的条件下,每分钟催化底物水解产生1.0 μmol pNP所需的酶量。
1.2.3大肠杆菌工程菌发酵产酶的单因素实验
1.2.3.1培养基初始pH对产酶的影响调整LB培养基的初始pH分别为6、7、7.5、8、8.5、9,保持其他条件相同对重组酶基因工程菌进行培养。培养结束后收集菌体并破碎细胞,检测酶活性,以酶活力最高的数据为100%,计算相对酶活(以下同上)。
1.2.3.2接种量对产酶的影响调整培养基的初始pH为“1.2.3.1”项的最优值,将种子液分别按0.5%、1%、1.5%、2%、2.5%、3%的接种量接种,其它条件同“1.2.3.1”。培养结束后收集菌体并破碎细胞,检测酶活性。
1.2.3.3诱导剂添加时间对产酶的影响调整培养基的初始pH为“1.2.3.1”项的最优值,按“1.2.3.2”项的最适接种量接种,在37 ℃、200 r/min的条件下分别培养2、2.5、3、3.5、4、4.5、5、6 h,加入诱导剂IPTG进行诱导,并在每个时间段取样测大肠杆菌的菌体浓度OD600,寻找最佳诱导时机。培养结束后收集菌体并破碎细胞,检测酶活性。
1.2.3.4诱导剂终浓度对产酶的影响调整培养基的初始pH为“1.2.3.1”项的最优值,按“1.2.3.2”项的最适接种量接种,在“1.2.3.3”项优化的最佳时间加入诱导剂IPTG,调整其终浓度分别为0.1、0.3、0.5、0.7、1.0、1.2、1.4 mmol/L。培养结束后收集菌体并破碎细胞,检测酶活性。
1.2.3.5诱导温度对产酶的影响根据以上实验结果调整培养基的初始pH、接种量、诱导剂添加时间分别为最优值,让加入诱导剂后的菌液分别在8、16、22、30、37 ℃下诱导培养过夜。培养结束后收集菌体并破碎细胞,并检测酶活性。
1.2.3.6诱导时间对产酶的影响根据以上实验结果分别调整培养基的初始pH、接种量、诱导剂添加时间、诱导温度为最优值,将菌液分别诱导6、8、10、12、14、16、18、20、22 h。收集菌体并破碎细胞,检测酶活性。
1.2.3.7摇床转速对菌体产酶的影响根据以上实验结果分别调整培养基的初始pH、接种量、诱导剂添加时间、诱导温度、诱导时间为最优值,在摇床转速分别为80、100、140、180、200、220、240 r/min的条件下进行培养。培养结束后收集菌体并破碎细胞,检测酶活性。
1.2.4响应面法优化发酵条件
1.2.4.1用Plackett-Burman实验筛选主要影响因子根据单因素实验选取培养基初始pH、接种量、诱导剂添加时间、诱导剂终浓度、诱导时间、诱导温度和摇床转速共7个因素进行PB实验,实验设计见表1,为响应面法优化产酶条件筛选主要影响因子[12]。
1.2.4.2利用Box-Behnken响应面设计确定最佳配方根据PB实验结果,本设计选取诱导剂添加时间、诱导温度、诱导时间作为响应面实验的主要影响因子(其他条件按单因素实验最优结果),各因素及水平如表2所示。

表1 Plackett-Burman设计因子水平

表2 响应面因子及水平
1.3数据处理
单因素实验每个因素重复三次,采用Microsoft Office Excel 2003处理数据并作图;Plackett-Burman和Box-Behnken实验采用Design Expert 8.0.5.0软件进行数据处理并作图。
2 结果与分析
2.1单因素实验结果
2.1.1培养基初始pH对产酶的影响外部环境的pH会影响基因工程菌的生长和代谢,一般来说大肠杆菌的最适生长pH在6.0~8.0范围内,不同类型的重组工程菌,适合其外源蛋白表达的pH是不同的。如图1所示,当培养基初始pH在7.5~8.5范围内时较适合外源蛋白的表达,因而相对酶活较高,当pH为8.0时,相对酶活达到最大值。因此,本实验确定培养基的初始pH为8.0。
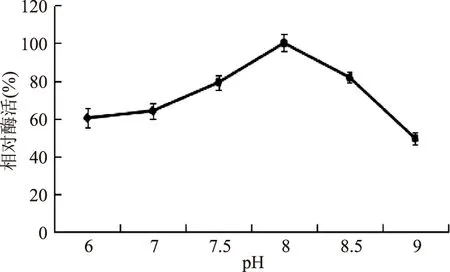
图1 培养基初始pH对菌株产酶的影响Fig.1 The effect of different initial pH of the medium on the production of enzyme
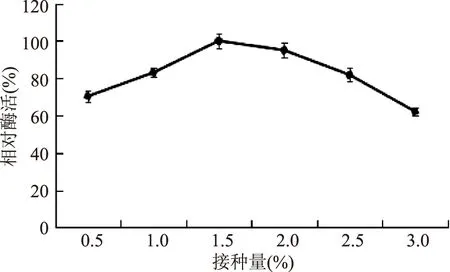
图2 不同接种量对菌株产酶的影响Fig.2 The effect of different amount of inoculation on the production of enzyme
2.1.2接种量对产酶的影响如图2所示,当接种量从0.5%增加到1.5%时,随着接种量的增大,相对酶活呈上升趋势,这是因为在此过程中细菌生长速度的加快使菌浓度增加,蛋白表达量升高,酶活随之增大,当接种量为1.5%时,相对酶活达到最大值,当接种量继续增大时,由于细菌生长过快,代谢产物积累过多,影响了后期蛋白的表达,产酶量开始降低。因此,本实验确定的最佳接种量为1.5%。
2.1.3诱导剂添加时间对产酶的影响诱导剂添加的越晚,菌体密度越高,但菌体相对较老,蛋白表达效率会降低。诱导剂添加的越早,细菌越快从生长阶段进入表达阶段,但由于菌体总密度较低,因而蛋白表达量不高[13]。因此需要对该菌的菌体浓度进行分析,并选择合理的时间添加诱导剂。如图3所示,当OD600在0.6~0.8的范围内,即种子液培养后的2.5~4 h内添加诱导剂IPTG时,相对酶活处于较高状态,当培养至3.5 h(OD600=0.75)添加诱导剂IPTG时,相对酶活达到最高值。因此,本实验确定诱导剂IPTG的添加时间为3.5 h(即OD600=0.75时)。
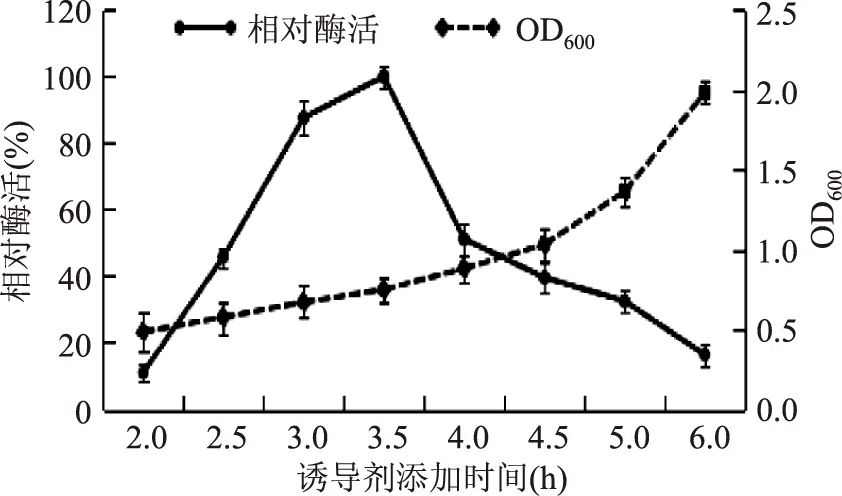
图3 诱导剂添加时间对菌株产酶的影响Fig.3 The effect of different timeto add inducing agent on the production of enzyme
2.1.4诱导剂终浓度对产酶的影响诱导剂IPTG的浓度与蛋白表达的速度相关,高浓度的IPTG会加快外源蛋白的表达,但是IPTG具有一定的细胞毒性,浓度过高时会降低细胞的活性。从图4中可以看出当诱导剂浓度在0.3~0.7 mmol/L时,菌体表达外源蛋白的速率较高,酶活维持在相对较高的状态,当诱导剂终浓度为0.5 mmol/L时的相对酶活最大。因此,本实验确定诱导剂的终浓度为0.5 mmol/L。

图4 诱导剂终浓度对菌株产酶的影响Fig.4 The effect of different inducerconcentration on ezyme production
2.1.5诱导温度对产酶的影响降低温度可以减缓菌体生长的速度,降低蛋白表达的速率,延长蛋白表达的时间。如图5所示,当诱导温度为8 ℃时,由于温度过低,外源蛋白表达的速率较低,因而酶活较低;当诱导温度为16 ℃时,相对酶活最高;当诱导温度继续升高时,外源蛋白表达速率加快,形成的不溶性包含体增多,因而酶活逐渐降低。从图6 SDS-PAGE电泳图中可以看出,当诱导温度为16 ℃时的蛋白表达量最高,这一结果与图5结果相符合,说明16 ℃是该酶表达蛋白的最佳诱导温度。因此,本实验确定诱导温度为16 ℃。

图5 不同诱导温度对菌株产酶的影响Fig.5 The effect of different induced temperature on the production of enzyme

图6 不同诱导温度样品蛋白的SDS-PAGE条带Fig.6 SDS-PAGE analysis of the protein by different induce temperature注:M:标准蛋白;1~5:8、16、22、30、37 ℃诱导的样品。
2.1.6诱导时间对产酶的影响如图7所示,当诱导时间为6~14 h时,菌体密度逐渐升高,蛋白合成旺盛,酶活随诱导时间的延长而提高,在14 h时达到最高值,当诱导时间超过14 h时,菌体由于生长时间过长而衰退,酶活逐渐降低。SDS-PAGE分析结果如图8所示,当诱导时间为14 h时的蛋白含量最高,说明诱导总时间为14 h时可以较好的表达重组酶蛋白。因此,本实验确定诱导时间为14 h。

图7 不同诱导时间对菌株产酶的影响Fig.7 The effect of different induced time on the production of enzymy

图8 不同诱导时间下样品蛋白的SDS-PAGE条带Fig.8 SDS-PAGE analysis of the protein by different induce time注:M:标准蛋白;1~9:诱导6、8、10、12、14、16、18、20、22 h的目的条带。
2.1.7不同摇床转速对产酶的影响如图9所示,当摇床转速从80 r/min增加到200 r/min时,发酵液中的溶氧随转速增加而升高,菌体生长速度加快,酶活逐渐增加,当摇床转速为200 r/min时酶活最高,转速继续增加后,发酵液中泡沫增多,影响溶氧,菌体生长减缓,酶活降低。因此,本实验确定摇床转速为200 r/min。

图9 不同摇床转速对菌株产酶的影响Fig.9 The effect of different rotation speed on enzyme production
2.2响应面法优化产酶条件
2.2.1Plackett-Burman实验筛选主要影响因素PB实验结果见表3,方差分析见表4。从表4可以看出,诱导剂添加时间、诱导温度、诱导时间的p值均小于0.05,是显著影响因子,三者贡献值之和达89.31%,其中诱导剂添加时间的贡献值为58.24,是最显著的影响因子。

表4 PB实验分析

表3 PB实验设计及结果
2.2.2Box-Behnken响应面设计法确定最佳配方本实验在单因素实验及PB实验结果的基础上,以Bohai sea-9145脂肪酶酶活作为响应值Y,采用多元二次回归方程拟合各因素与响应值之间的函数关系,设计三因素三水平的响应面分析实验,通过回归方程,优化工艺参数,预测响应值,并对影响实验结果的因子及其交互作用进行评价,确定最佳发酵表达条件。每组实验做三组平行,取其平均值,实验设计及结果如表5所示。

表6 响应面模型的方差分析表
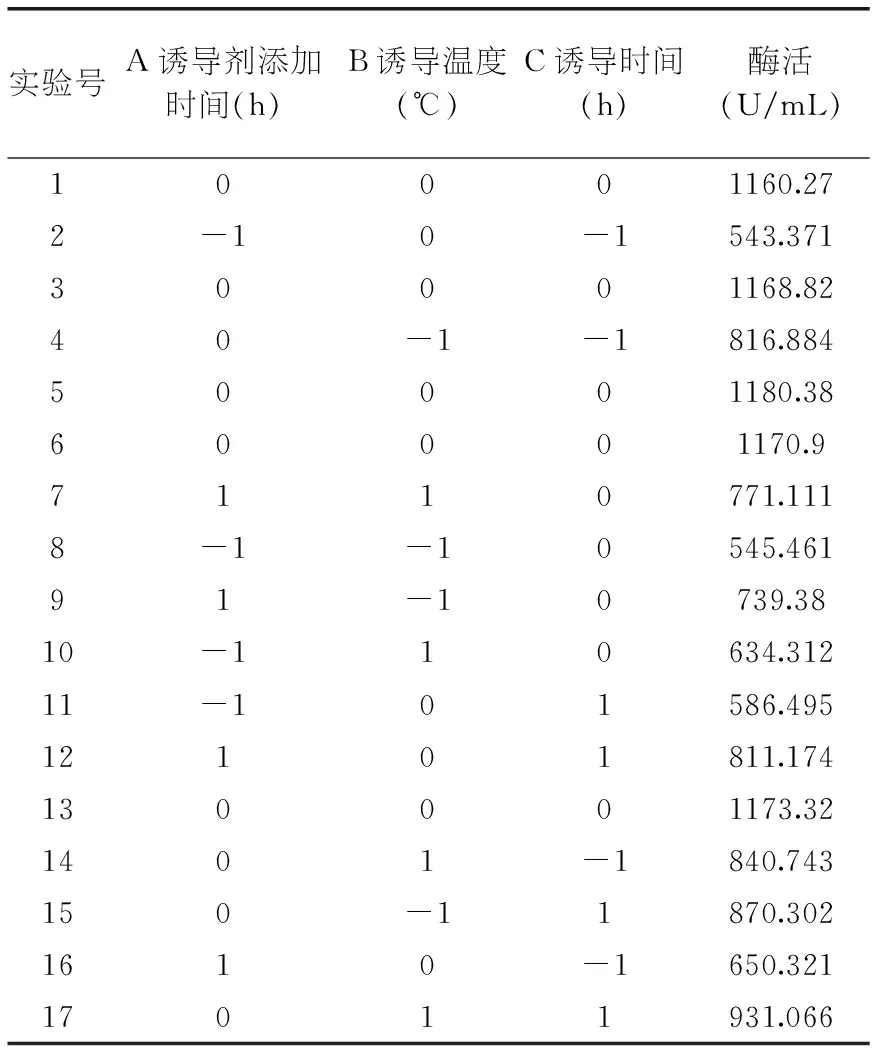
表5 Box-Behnken设计方案及结果
从表6可以看出该响应面模型是显著的,F值为829.46表示仅有0.01%的可能是由噪音引起的,其中,A、B、C、AB、AC、A2、B2、C2的p值均小于0.05,是显著模型项,同时失拟F值为3.85(p=0.1127)表示该模型的失拟项不显著,方程的R2等于0.9979,说明酶活实测值与预测值拟合度较好,该模型能较好的解释菌株产酶量的变化。二次多项式回归方程为:
Y=1170.74+82.79A+25.65B+43.46C-14.28AB+29.43AC+9.23BC-357.54A2-140.63B2-165.36C2
根据上面的方程绘制的响应面分析如图10所示,从图10中可以看出AB、AC的曲面较明显,交互作用较大,A-诱导剂添加时间和B-诱导温度与酶活的关系呈标准的抛物线型,且有一极大值点,说明酶活随诱导温度升高和诱导剂添加时间的增加而提高,当诱导剂添加时间为3.5 h,诱导温度为16 ℃时的酶活达到其极大值点,当诱导剂添加时间继续延长,诱导温度继续升高时酶活降低,说明此时的诱导剂添加时间及温度不适宜外源蛋白的表达,对AC的交互作用同理可分析。

图10 两因子之间相互作用的3D图Fig. 10 Contour plot of effects of the interaction of two factors on the production of lipase
2.2.3验证实验对回归方程求导可以得到模型的极值点,理论上当诱导剂添加时间为3.68 h,诱导温度为16.54 ℃,诱导时间为15.16 h时,单位酶活达到其最大响应值,理论最大酶活为1180.38 U/mL。
为方便实验操作,将实验条件定为:诱导剂添加时间为3.5 h,诱导温度16 ℃,诱导时间15 h,在该条件下进行摇瓶发酵,实际测定的平均单位酶活为1170.56 U/mL,该值与理论值相接近,证明此响应面模型是可靠的,可以有效优化该基因工程菌的发酵表达条件。
3 结论
本文以单因素实验、Plackett-Burman和Box-Behnken响应面设计实验相结合的方法,对影响Bohai sea-9145重组脂肪酶工程菌产酶的各因素进行分析,得出的结论如下:
Bohai sea-9145重组脂肪酶工程菌的最佳发酵表达条件为:调整培养基的初始pH为8.0,按1.5%的接种量接种,在种子液培养3.5 h后加入终浓度为0.5 mmol/L的诱导剂IPTG,在16 ℃、200 r/min的条件下诱导15 h。经过上述优化后,该基因工程菌所产重组脂肪酶的酶活最高为1170.56 U/mL,是优化前的9.72倍,该结果极大提高了Bohai sea-9145海洋重组脂肪酶的制备效率,为该酶的进一步研究奠定基础。
[1]宋欣.微生物酶转化技术[M].北京:化学工业出版社,2004:143.
[2]王庭,秦刚.脂肪酶及其在食品工业中的应用[J].肉类研究,2010(1):1001-8124.
[3]刘海洲,吴小飞,牛佰慧,等.脂肪酶在食品工业中的应用与研究进展[J].粮食加工,2008,33(5):55-57.
[4]陈代杰.微生物药物学[M].北京:化学工业出版社,2008,5:587-594.
[5]宋欣,曲音波.有机相中脂肪酶催化作用的应用[J].微生物学通报,1999,26(4):296-299.
[6]姚庆龙,高传福.碱性脂肪酶在驴马制革中的应用研究[J].中国皮革,2006,35(9):4-5.
[7]王智,苟小军,曹淑桂.脂肪酶在生物化工中的应用[J].成都大学学报(自然科学版),2003,22(1):1-7.
[8]邵铁娟,孙谧,郑家声,等.Bohaisea-9145海洋低温碱性脂肪酶研究[J].微生物学报,2004,44(6):789-793.
[9]董宏伟,孙谧,王跃军,等.海洋微生物低温碱性脂肪酶的纯化与性质研究[J].海洋与湖沼,2004(4):376-383.
[10]李忠磊,王跃军,盛军,等.Bohaisea-9145海洋耶氏酵母碱性脂肪酶基因的克隆、异源表达和重组酶酶学性质[J].海洋与湖沼,2012(2):230-236.
[11]Hatzinikolaou D G,Kourentzi E,Stamatis H,et al. A novel lipolytic activity of Rhodotorula glutinis cells:production,partial characterization and application in the synthesis of esters[J]. Journal of Bioscience and Bioengineering,1999,88(1):53-56.
[12]Gupta N,Mehra G,Gupta R. A glycerol-inducible thermostable lipase fromBacillussp.:medium optimization by a Plackett-Burman design and by response surface methodology[J].Canadian Journal of Microbiology,2004,50(5):361-368.
[13]Ariane Leites Larentis,Júlia Fabiana Monteiro Quintal Nicolau,Gabriela dos Santos Esteves,et al. Evaluation of pre-induction temperature,cell growth at induction and IPTG concentration on the expression of a leptospiral protein in E. coli using shaking flasks and microbioreactor[J]. BMC Research Notes,2014,7:671.
Optimization of fermentation and expression conditions for production of marine lipase by Bohai sea-9145
RAN Fan-jiao1,2,SUN Mi1,*,BAO Jing1,HAO Jian-hua1
(1.Key Laboratory of Sustainable Development of Marine Fisheries,Ministry of Agriculture,Qingdao Key Laboratory of Marine Enzyme Engineering,Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Qingdao 266071,China;2.College of Food Science & Technology,Shanghai Ocean University,Shanghai 201306,China)
To effectively improve the production of the Bohai sea-9145 lipase,single factor experiment,PB experiment and BB surface response experiment were used to optimize the fermentation conditions of the recombinant strain Bohai sea-9145. The optimal conditions were as follows:the initial pH value of the medium was 8.0,the inoculation amount was 1.5%,and after 3.5 hours of incubation,the expression of the lipase was induced by adding IPTG to a final concentration of 0.5 mmol/L at 16 ℃ for 15 hours with the shaking speed of 200 r/min. After optimization,the final activity of the recombinant lipase was increased by 9.72 times.
Bohai sea-9145 recombined lipase;genetic engineering bacteria;fermentation conditions;analysis of response surface
2016-03-11
冉凡娇(1991-),女,硕士研究生,研究方向:食品工程, E-mail:ranfanjiao@sina.com。
孙谧(1962-),女,研究员,研究方向:海洋产物资源与酶工程,E-mail:sunmi@ysfri.ac.cn。
国家自然科学基金-联合基金项目(U1406402-5);国际科技合作与交流专项(2014DFG30890)资助。
TS201.3
A
1002-0306(2016)16-0178-07
10.13386/j.issn1002-0306.2016.16.027

