副溶血弧菌噬菌体qdvp001重组内溶素诱导表达以及理化性质初步研究
王伟宇,林 洪,王静雪
(中国海洋大学食品科学与工程学院,山东青岛 266003)
副溶血弧菌噬菌体qdvp001重组内溶素诱导表达以及理化性质初步研究
王伟宇,林洪,王静雪*
(中国海洋大学食品科学与工程学院,山东青岛 266003)
对重组内溶素Lysqdvp001诱导表达条件进行探讨,发现适当降低诱导温度,可以避免包涵体的形成。最终确定诱导表达条件为25 ℃、IPTG浓度为1 mmol/L、诱导4 h,此时不仅蛋白表达量大并且不形成包涵体。为研究Lyqdvp001抑菌以及理化性能,采用浊度法对pH、温度、离子强度对裂解活性的影响进行探讨。结果表明,Lysqdvp001具有宽pH适应性,pH3~10均能很好发挥作用;耐高温,在75 ℃处理30 min仍能维持70%活性;低浓度(0.1 mmol/L)的Zn2+、Fe2+以及各浓度(10、1、0.1 mmol/L)的Ca2+可以明显提高重组内溶素Lysqdvp001活性。结果显示重组内溶素有作为抑菌剂的潜力。
副溶血弧菌,副溶血弧菌噬菌体,内溶素
副溶血弧菌是一种革兰氏阴性致病菌,广泛存在于近海岸及各种水产品中[1]。若食用被副溶血弧菌污染的食品易引起食物中毒,出现头疼、腹泻、呕吐等一系列症状。近年来,副溶血弧菌引起的食物中毒事件呈现上升趋势,已经成为感染食源性疾病的主要原因之一[2],而且,对食物中毒分离得到的副溶血弧菌进行检测发现细菌已对一些常用的抗生素产生了耐药性。有文献报道,从青岛地区水产品分离得到的副溶血弧菌90%以上对氨苄西林和阿莫西林具有耐药性[3]。因此,找到能够替代抗生素并能有效防控副溶血弧菌的抑菌剂迫在眉睫。
内溶素是噬菌体编码的一种裂解酶,它通过裂解细菌细胞壁的肽聚糖来帮助子代噬菌体从细菌细胞中释放出去[4]。与噬菌体以及小分子抗生素相比,内溶素具有不易产生抗性的优点[5-6]。1957年报道了第一个关于内溶素裂解细菌的研究[7],但直到2001年才报道了链球菌噬菌体重组内溶素在体内和体外都能有效抑制A族链球菌的感染[8]。近年来随着克隆表达技术的不断成熟,越来越多的重组内溶素被研究,并且研究表明重组内溶素均具有良好的裂解活性[9-12]。因此,内溶素作为新型抑菌剂具有很大的潜力。
在前期工作中,本实验室分离得到一株新型副溶血弧菌噬菌体qdvp001[13],对其进行全基因组测序,通过分析后发现ORF60为编码内溶素的开放式阅读框,对其进行克隆表达。本实验对诱导表达的最佳条件做了探究,然后分析该内溶素的裂解性能,为将内溶素应用于防控副溶血弧菌方面提供基础。
1 材料与方法
1.1材料与仪器
宿主菌副溶血弧菌ATCC 17802(以下简称VP17802)购买于美国典型微生物菌种保藏中心;烈性副溶血弧菌噬菌体qdvp001(保存号为CCTCC M 2011143)本实验室分离纯化得到[13];含有内溶素基因的重组大肠杆菌BL21-qdvp001本实验构建并且其制备的重组内溶素命名为Lysqdvp001;LB肉汤购买于北京陆桥技术有限责任公司;2216E肉汤、2216E琼脂购买于青岛海博生物技术有限公司;液体、固体培养基按照所购培养基的说明配制;异丙基-β-D-硫代半乳糖苷(简称IPTG)购于索莱宝生物技术有限公司;溶菌酶购于索莱宝生物技术有限公司。
HZQ-F100型振荡培养箱哈尔滨市东联电子技术开发有限公司;SW-CJ-2FD超净工作台苏净安泰空气技术有限公司;Sigma 3K15型高速冷冻离心机曦玛离心机(上海)有限公司;MLS-3750型高压蒸汽灭菌锅日本Sanyo公司;Power Wave XS型酶标仪美国Biotek。
1.2实验方法
1.2.1重组内溶素Lysqdvp001表达条件的确定
1.2.1.1诱导时间将重组菌BL21-qdvp001单菌落加入到10 mL含有100 μg/mL卡那霉素的LB液体培养基中,37 ℃ 150 r/min振荡过夜培养。次日,按照1∶50的比例将过夜培养的菌液加入到新鲜的LB液体培养基中(含有100 μg/mL卡那霉素),37 ℃ 150 r/min培养至OD600 nm大约0.6,加入IPTG至终浓度为1 mmol/L,37 ℃ 150 r/min诱导8 h,每隔1 h取1 mL菌液,离心去上清,用100 μL SDS-PAGE电泳上样缓冲液复融沉淀,煮沸5 min,利用SDS-PAGE电泳检测诱导时间。
1.2.1.2IPTG诱导浓度将重组菌BL21-qdvp001单菌落加入到10 mL含有100 μg/mL卡那霉素的LB液体培养基中,37 ℃ 150 r/min振荡过夜培养。次日,按照1∶50的比例将过夜培养的菌液加入到新鲜的LB液体培养基中(含有100 μg/mL卡那霉素),37 ℃ 150 r/min培养至OD600 nm大约0.6,加入IPTG使不同样品终浓度分别为0、0.1、0.5、1、2、3、4、5 mmol/L,振荡诱导4 h,取不同诱导浓度样品各1 mL按照上述步骤处理进行SDS-PAGE检测。
1.2.1.3诱导温度的确定将重组菌BL21-qdvp001单菌落加入到10 mL含有100 μg/mL卡那霉素的LB液体培养基中,37 ℃ 150 r/min振荡过夜培养。次日,按照1∶50的比例将过夜培养的菌液加入到新鲜的LB液体培养基中(含有100 μg/mL卡那霉素),37 ℃ 150 r/min培养至OD600 nm大约0.6,加入IPTG浓度使其终浓度为1 mmol/L,分别将样品置于20、25、30、37 ℃下进行4 h振荡诱导,不同温度样品按照上述步骤分别取样1 mL进行SDS-PAGE检测。
1.2.1.4重组内溶素Lysqdvp001表达形式的确定将重组菌BL21-qdvp001单菌落加入到10 mL含有100 μg/mL卡那霉素的LB液体培养基中,37 ℃ 150 r/min振荡过夜培养。次日,按照1∶50的比例将过夜培养的菌液加入到新鲜的LB液体培养基中(含有100 μg/mL卡那霉素),37 ℃ 150 r/min培养至OD600 nm大约0.6,加入IPTG至终浓度1 mmol/L,分别在25和37 ℃条件下诱导4 h,4000 r/min,离心20 min,去上清,用PBS缓冲液复融细菌沉淀,在300 W、工作5 s、休息15 s、工作99次条件下进行超声破碎,然后8000 r/min离心30 min,对上清和复融沉淀分别进行SDS-PAGE检测。
1.2.2重组内溶素Lysqdvp001的纯化将重组菌BL21-qdvp001单菌落加入到10 mL含有100 μg/mL卡那霉素的LB液体培养基中,37 ℃ 150 r/min振荡过夜培养。次日,按照1∶50的比例将过夜培养的菌液加入到300 mL新鲜的LB液体培养基中(含有100 μg/mL卡那霉素),在最适条件下进行诱导,然后参考林洪[14]的方法将样品进行离心、复融、超声破碎、过滤膜。将4 mL Ni SepharoseTM6 Fast Flow填料加入柱子中,以1 mL/min的流速用超纯水和结合缓冲液冲(20 mmol/L Tris-HCl,300 mmol/L NaCl,pH8.0)洗柱子直至基线平稳,加入25 mL酶液,用含有30 mmol/L咪唑浓度的结合缓冲液冲洗柱子以洗脱杂蛋白,用含有150 mmol/L咪唑的缓冲液洗脱目的蛋白,收集OD280 nm峰值的几管洗脱液,利用10 ku超滤离心管进行后续脱盐处理。将纯化后的重组内溶素Lysqdvp001置于-80 ℃保存。
1.2.3浊度法测定重组内溶素Lysqdvp001抑菌活性参考Nelson[8]方法,做适当修改。挑取副溶血弧菌VP17802至300 mL 2216E液体培养基中,过夜培养,菌体离心,用100 mmol/L EDTA复融5 min,4 ℃、8000 r/min条件下离心10 min,然后用纯水复融、离心两次获得细菌沉淀,-80 ℃保存。
OD450 nm吸光值下降幅度间接表示裂解活性[15]。测定活性之前,将副溶血弧菌细菌沉淀用50 mmol/L Tris,pH8.2,含0.1% Triton X-100复融。在96孔板中加入100 μL细菌复融液,然后加入100 μL重组内溶素Lysqdvp001,室温下(20 ℃)测定15 min内OD450 nm值。以Tris缓冲液作为阴性对照,溶菌酶作为阳性对照,每组3组平行。
1.2.4重组内溶素Lysqdvp001的pH稳定性将细菌沉淀用pH3.0~10.0复融缓冲液复融。将100 μL重组内溶素Lysqdvp001加入到100 μL不同pH的细菌复融液中,利用上述浊度法测定酶活并按照公式(1)计算各个组的相对酶活力。
各个实验组的相对酶活力(%)=各个组的OD450 nm下降值/实验组中OD450 nm下降最多值×100
式(1)
1.2.5重组内溶素Lysqdvp001温度稳定性将保存的Lysqdvp001分装后分别放于30、37、45、50、55、65、75 ℃水浴,采用浊度法分别测定0、15、30 min时酶活并按照公式(2)计算各组相对酶活。
各个实验组的相对酶活力(%)=各个组的OD450 nm下降值/未处理组中OD450 nm下降值×100
式(2)
1.2.6重组内溶素Lysqdvp001离子强度稳定性将100 mmol/L ZnCl2、CaCl2、MgCl2和FeSO4溶液分别加入到已分装好的细菌复融液中,使其终浓度分别为0.1、1、10 mmol/L。100 μL重组内溶素Lysqdvp001溶液加入到100 μL 含有不同离子浓度的细菌复融液中,浊度法测定酶活,并按照公式(3)计算相对酶活。
各个实验组的相对酶活力(%)=各个组的OD450 nm下降值/离子浓度为0 mmol/L组OD450 nm下降值×100
式(3)
2 结果与分析
2.1重组内溶素Lysqdvp001表达条件的确定
2.1.1诱导时间的确定通过测定不同诱导时间下蛋白表达情况,确定诱导时间为4 h(图1),既能保证蛋白表达量,又避免过长时间的诱导表达导致蛋白失活等情况。
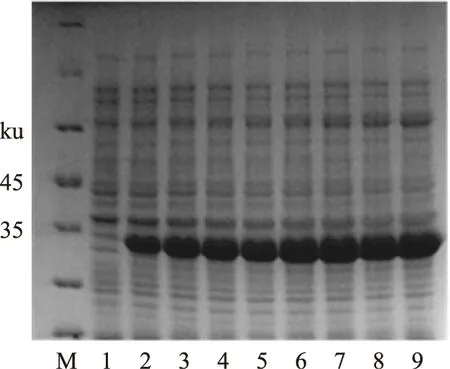
图1 诱导时间对重组内溶素Lysqdvp001表达影响的SDS-PAGE电泳图Fig.1 The effects of different time on recombinantendolysin Lysqdvp001 by SDS-PAGE注:M表示蛋白标准分子量,1为未经IPTG诱导的细菌总蛋白,2~9分别为诱导1~8 h的细菌总蛋白。
2.1.2IPTG浓度的确定IPTG的浓度对诱导表达的影响较大,IPTG浓度过高可能会抑制大肠杆菌的生长从而造成蛋白表达量降低。在0.1~5 mmol/L范围内改变IPTG浓度,最终确定IPTG浓度为1 mmol/L(图2)。

图2 IPTG浓度对重组内溶素Lysqdvp001表达影响的SDS-PAGE电泳图Fig.2 The effects of different IPTG concentration on recombinant endolysin Lysqdvp001 by SDS-PAGE注:M表示蛋白标准分子量,1为未经IPTG诱导的细菌总蛋白,2~8分别为IPTG浓度为0.1、0.5、1、2、3、4、5 mmol/L时诱导的细菌总蛋白。
2.1.3诱导温度及表达方式的确定通过SDS-PAGE电泳对重组内溶素Lysqdvp001的诱导温度进行研究,最终确定最佳表达条件为37 ℃(图3)。因此在诱导温度37 ℃、IPTG浓度1 mmol/L的条件诱导4 h,但是此时重组内溶素Lysqdvp001的表达形式为包涵体(结果未展示),原因可能是细菌生长速率过快,导致细菌体内蛋白合成系统负担过重,形成包涵体。因此,降低诱导温度至25 ℃,其余条件不变,结果发现重组内溶素主要存在于超声后的上清液中(图4),重组内溶素Lysqdvp001表达方式为可溶性表达。综上,在25 ℃、IPTG浓度为1 mmol/L、诱导时间为4 h时,重组内溶素Lysqdvp001既能保证表达量又能避免形成包涵体。

图3 不同温度对重组内溶素Lysqdvp001表达影响的SDS-PAGE电泳图Fig.3 The effects of different temperature on recombinant endolysin Lysqdvp001 by SDS-PAGE注:M表示蛋白标准分子量,1为未经IPTG诱导的细菌总蛋白,2~5分别为温度20、25、30、37 ℃诱导时的细菌总蛋白。
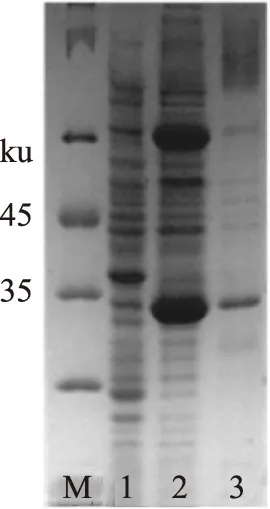
图4 25 ℃诱导条件下重组内溶素Lysqdvp001表达形式Fig.4 The expression form of recombinant endolysin Lysqdvp001 at 25 ℃注:M为蛋白标准分子量,1为未经IPTG诱导的细菌总蛋白,2为超声破碎后上清液中的细菌总蛋白,3为超声破碎后沉淀中的细菌总蛋白。
2.2浊度法测定重组内溶素Lysqdvp001
当细菌菌体被裂解后,光密度随着下降,OD450 nm吸光值也下降,因此OD450 nm吸光值可以间接表示细菌数量的变化。由图5可以看出,在5 min时间内,重组内溶素Lysqdvp001使得OD450 nm吸光值下降0.6,和同浓度的400 μg/mL溶菌酶OD450 nm吸光值下降一样,而Tris缓冲液仅使得OD450 nm吸光值下降0.01,说明重组内溶素Lysqdvp001具有很好的抑菌活性。

图5 浊度法测定重组内溶素Lysqdvp001抑菌活性Fig.5 Lytic activity of Lysqdvp001 by turbidity reduction assay
由于革兰氏阴性细菌细胞壁外存在一层外膜,阻碍内溶素直接作用于细胞壁,因此当内溶素从外部裂解革兰氏阴性细菌时作用效果不明显[16]。目前,大多数研究都是使用外膜通透剂来对外膜进行处理。外膜通透剂主要有两大类,一类是多肽类抗生素,一类是螯合剂[17]。本实验采用的是常用的EDTA螯合剂,它能螯合吸附二价离子,破坏外膜稳定性,从而使内溶素高效的发挥作用[18]。林洪[14]的研究表明,在EDTA的协同作用下,内溶素LysSTP4能有效的杀灭沙门氏菌。内溶素EL188和SPN1S在EDTA的共同作用下也有效的杀灭了Pseudomonasaeruginosa和SalmonellaTyphimurium[19-20]。在今后的研究中,可以考虑改变外膜通透剂的种类、用量或者与内溶素共同加入来改善内溶素的抑菌效果。
2.3重组内溶素Lysqdvp001的pH稳定性
当pH为4时,重组内溶素Lysqdvp001酶活力最大,并且酸性条件下,重组内溶素Lysqdvp001裂解活性都很好。虽然pH为10时,重组内溶素Lysqdvp001裂解活性仅为最高酶活力的40%,但是其仍能将OD450 nm降低0.6左右(结果未展示),活性仍旧很高。说明重组内溶素Lysqdvp001在任何pH条件下均能很好的发挥裂解作用,与一些嗜碱性裂解酶沙门氏噬菌体STP4-a重组内溶素LysSTP4[14]、蜡样芽孢杆菌噬菌体B4的重组内溶素LysB4[21]等相比具有一定的优势。
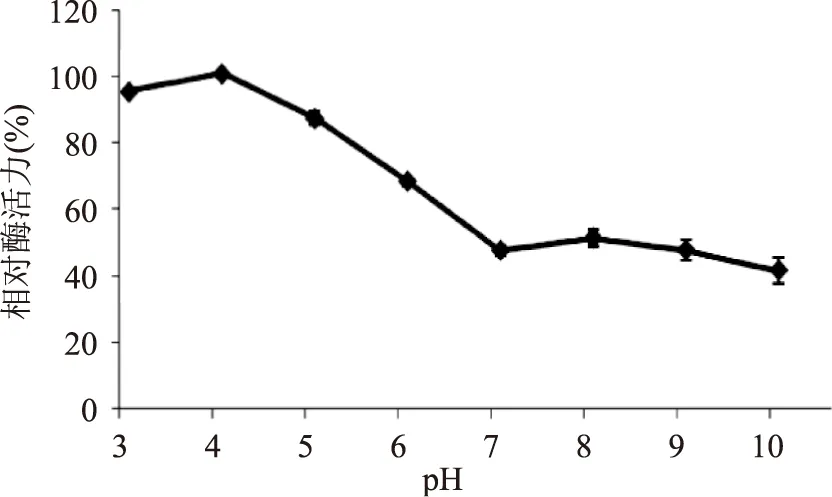
图6 pH对重组内溶素Lysqdvp001裂解活性影响Fig.6 The effects of pH on the lytic activity of Lysqdvp001
2.4重组内溶素Lysqdvp001的温度稳定性
由图7可以看出,重组内溶素在室温下复融时酶活力最大。65 ℃以下水浴15 min,酶活力基本不变,维持在最大酶活力的90%左右;当温度升高到75 ℃时,水浴处理15 min,酶活力下降到70%左右,并且水浴30 min后酶活力仍维持在70%左右,说明重组内溶素Lysqdvp001具有很好的温度耐受性。而林洪[14]报道的重组内溶素LysSTP4在65 ℃处理30 min后几乎无裂解活性。

图7 温度对重组内溶素Lysqdvp001裂解活性的影响Fig.7 The effects of temperature on the lytic activity of Lysqdvp001
2.5重组内溶素Lysqdvp001离子稳定性
由图8可以看出,离子浓度对重组内溶素Lysqdvp001影响比较大。高浓度的Zn2+和Fe2+(10、1 mmol/L)都显著地抑制了酶活,低浓度的Zn2+和Fe2+(0.1 mmol/L)能显著激活酶活。Ca2+能显著提高酶活,特别是1 mmol/L Ca2+可以提高酶活1.7倍。高浓度(10 mmol/L)和低浓度(0.1 mmol/L)Mg2+均显著地抑制了酶活,1 mmol/L Mg2+提高了酶活,但并不显著。

图8 离子强度对重组内溶素Lysqdvp001裂解活性影响Fig.8 The effects of iron concentration on the lytic activity of Lysqdvp001
3 结论
重组内溶素最佳表达条件为:IPTG浓度为1 mmol/L、25 ℃、诱导4 h,此时蛋白表达量大且不形成包涵体。通过浊度法测定Lysqdvp001对副溶血弧菌VP170802的裂解效果,得知该重组内溶素Lysqdvp001具有生物活性,并且具有宽pH适应性,能耐高温,在75 ℃作用30 min仍能维持70%的酶活力,低浓度(0.1 mmol/L)的Zn2+、Fe2+以及各浓度(10、1、0.1 mmol/L)的Ca2+可以明显提高重组内溶素Lysqdvp001活性。这些性质表明重组内溶素Lysqdvp001具有成为新型抑菌剂的潜力,为利用内溶素防控副溶血弧菌以及其他革兰氏阴性细菌提供了理论基础。
[1]Su YC,Liu CC.Vibrioparahaemolyticus:a concern of seafood safety[J]. Food Microbiol,2007,24(6):549-558.
[2]宁芊,李寿崧,陈守平. 文蛤中副溶血性弧菌的风险评估[J]. 现代食品科技,2010(11):1259-1263.
[3]江艳华,姚琳,李风铃,等. 青岛市售养殖海水虾中副溶血性弧菌的分离及耐药性分析[J]. 中国人兽共患病学报,2013(5):516-519.
[4]Schmelcher M,Donovan DM,Loessner MJ. Bacteriophage endolysins as novel antimicrobials[J]. Future Microbiol,2012,7(10):1147-1171.
[5]姜焕焕,安小平,米志强,等. 噬菌体治疗细菌性感染的进展[J]. 中国生物工程杂志,2010(12):116-122.
[6]Gupta R,Prasad Y. P-27/HP endolysin as antibacterial agent for antibiotic resistantStaphylococcusaureusof human infections[J]. Curr Microbiol,2011,63(1):39-45.
[7]Ralston DJ,Baer BS,Lieberman M,et al. Lysis from without ofS.aureusK1 by the combined action of phage and virolysin[J]. J Gen Physiol,1957,41(2):343-358.
[8]Nelson D,Loomis L,Fischetti VA. Prevention and elimination of upper respiratory colonization of mice by group A streptococci by using a bacteriophage lytic enzyme[J]. Proc Natl Acad Sci U S A,2001,98(7):4107-4112.
[9]Schuch R,Nelson D,Fischetti VA. A bacteriolytic agent that detects and killsBacillusanthracis[J]. Nature,2002,418(6900):884-889.
[10]Sass P,Bierbaum G. Lytic activity of recombinant bacteriophage phi11 and phi12 endolysins on whole cells and biofilms ofStaphylococcusaureus[J]. Appl Environ Microbiol,2007,73(1):347-352.
[11]Lai MJ,Lin NT,Hu A,et al. Antibacterial activity of
Acinetobacterbaumanniiphage varphiAB2 endolysin(LysAB2)against both gram-positive and gram-negative bacteria[J]. Appl Microbiol Biotechnol,2011,90(2):529-539.
[12]Paradis-Bleau C,Cloutier I,Lemieux L,et al. Peptidoglycan lytic activity of the Pseudomonas aeruginosa phage phiKZ gp144 lytic transglycosylase[J]. FEMS Microbiol Lett,2007,266(2):201-209.
[13]丁云娟,彭勇,林洪,等. 一株副溶血弧菌噬菌体的分离鉴定及生理特性[J]. 微生物学通报,2011(11):1639-1646.
[14]林洪,李萌,王静雪. 沙门氏菌噬菌体STP4-a重组内溶素抑菌特性分析[J]. 食品科学,2015(5):104-108.
[15]Briers Y,Lavigne R. A standardized approach for accurate quantification of murein hydrolase activity in high-throughput assays[J]. J Biochem Biophys Methods,2007,70(3):531-533.
[16]Fischetti VA. Bacteriophage endolysins:a novel anti-infective to control Gram-positive pathogens[J]. Int J Med Microbiol,2010,300(6):357-362.
[17]Vaara M. Agents that increase the permeability of the outer membrane[J]. Microbiol Rev,1992,56(3):395-411.
[18]Helander IM,Mattila-Sandholm T. Fluorometric assessment of gram-negative bacterial permeabilization[J]. J Appl Microbiol,2000,88(2):213-219.
[19]Lim JA,Shin H,Kang DH,et al. Characterization of endolysin from aSalmonellaTyphimurium-infecting bacteriophage SPN1S[J]. Res Microbiol,2012,163(3):233-241.
[20]Briers Y,Walmagh M,Lavigne R. Use of bacteriophage endolysin EL188 and outer membrane permeabilizers againstPseudomonasaeruginosa[J]. J Appl Microbiol,2011,110(3):778-785.
[21]Son B,Yun J,Lim JA,et al. Characterization of LysB4,an endolysin from the Bacillus cereus-infecting bacteriophage B4[J]. BMC Microbiol,2012(12):33.
Characterization of recombinant endolysin fromVibrioparahaemolytics-infecting bacteriophage qdvp001
WANG Wei-yu,LIN Hong,WANG Jing-xue*
(Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
The inducible expression conditions of the recombinant endolysin Lysqdvp001 were discussed,founding that lowering temperature properly could avoid forming inclusion bodies. It was concluded that the recombinant endolysin Lysqdvp001 was induced by the addition of 1 mmol/L IPTG at 25 ℃ for 4 h. Under this condition,the Lysqdvp001 was soluble and was expressed in a high level. Then the Lysqdvp001 was characterized its lytic activity and biochemical properties such as pH,temperature and iron concentration by turbidity assay. The results showed that the Lysqdvp001 was stable over broad pH,maintaining good activities in pH3~10,and temperature ranges,maintaining 70% activity after 30 min at 75 ℃. Low iron concentration(0.1 mmol/L)of Zn2+and Fe2+and different iron concentration(10,1,0.1 mmol/L)of Ca2+could increase lytic activity of Lysqdvp001. In conclusion,the Lysqdvp001 had the potential to be antibacterial agents.
Vibrioparahaemolyticus;Vibrioparahaemolyticus-infecting bacteriophage;endolysin
2016-01-18
王伟宇(1990-),女,硕士研究生,研究方向:食品安全,E-mail:weiyu0828@163.com。
王静雪(1976-),女,博士,教授,研究方向:食品安全,E-mail:snow@ouc.edu.cn。
山东省科技重大专项(2014ZZCX02703);“十二五”农村领域国家科技支撑计划(2015BAD16B0902)。
TS201.3
A
1002-0306(2016)16-0205-05
10.13386/j.issn1002-0306.2016.16.032

