快速酶法制备低聚异麦芽糖工艺建立与优化
田康明,乔 舰,李普均,牛丹丹,3,*,路福平
(1.天津科技大学化工与材料学院,天津 300457;2.天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津 300457;3.福州大学生物科学与工程学院,福建省海洋酶工程重点实验室,福建福州 350116)
快速酶法制备低聚异麦芽糖工艺建立与优化
田康明1,2,乔舰2,李普均2,牛丹丹2,3,*,路福平2
(1.天津科技大学化工与材料学院,天津 300457;2.天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津 300457;3.福州大学生物科学与工程学院,福建省海洋酶工程重点实验室,福建福州 350116)
对多酶协同制备低聚异麦芽糖(IMOs)生产工艺进行研究,建立了以玉米淀粉为底物,使用耐高温α-淀粉酶进行液化,以α-葡萄糖苷酶、普鲁兰酶和β-淀粉酶同时糖化转苷制备IMOs的基本工艺。通过优化液化程度、糖化转苷过程作用温度和pH、糖化阶段α-葡萄糖转苷酶、普鲁兰酶和β-淀粉酶的添加量,形成了快速酶法制备低聚异麦芽糖的工艺。最优工艺如下:以25%(w/v)玉米淀粉为底物,液化还原糖含量(DE值)为20~30,糖化转苷温度为55 ℃,pH6.0,α-葡萄糖苷酶添加量为500~1000 U/g、普鲁兰酶添加量为0.9 U/g、β-淀粉酶添加量为500 U/g。结果表明:反应15 h可得到异麦芽二糖、异麦芽三糖和潘糖之和为49.09%的低聚异麦芽糖浆。本研究所建新工艺可以淀粉为原料快速高效制备IMOs,其有效组分明显高于现有生产工艺,制备周期也较现有生产工艺缩短70%以上,研究结果对现有IMOs生产技术的提升具有指导意义。
低聚异麦芽糖,快速酶法,工艺优化
低聚异麦芽糖(Isomaltooligosaccharides,IMOs)又称异麦芽寡糖、异麦芽低聚糖、分支低聚糖,是指葡萄糖之间至少有一个以α-1,6-糖苷键结合而成的、单糖数在2~5不等的一类低聚糖[1-2]。低聚异麦芽糖的核心有效成分为异麦芽糖又称异麦芽二糖(IG2)、异麦芽三糖(IG3)和潘糖(P),常被简称为“二三潘”,三组分含量之和是IMOs产品质量评价的重要指标。成品中还含有一定量的四糖以上的低聚寡糖、葡萄糖和麦芽糖,可以通过物理方法或生物方法去除而得到高纯度产品[3-4]。低聚异麦芽糖口味适宜,生产成本低,具有很多生理功能,其中最直接的生理功能有:不被生物体内淀粉消化酶消化,热量低,甜度低,基本上不增加血糖血脂水平,故被广泛用于生产低糖产品[1-2];能促进人体肠道内的双歧杆菌等益生菌的增殖,进而抑制肠道内各类有害菌及腐败物质的形成,增加各种维生素的含量,提高机体免疫力[5-6];作为饲料添加剂,不但可以提高饲料产品的品质,促进禽畜生长,还可以减少饲养过程中抗生素及其他药物的使用[1]。利用低聚异麦芽糖所具有的多种优良理化性质和生理保健功能,其在诸如保健品、食品、医药、化妆品等领域具有广泛应用价值[1]。
目前,国内外生产IMOs的典型方法,是以淀粉为原料采用淀粉酶系多酶协同与分步作用,转化淀粉得到。工业上首先由淀粉在高温α-淀粉酶的作用下液化,液化淀粉在β-淀粉酶作用下生成麦芽糖浆,再利用α-葡萄糖转苷酶进行糖基转换生成IMOs,其糖类组分中约含有50%~60%的各种低聚异麦芽糖和40%~50%的葡萄糖、麦芽糖、麦芽三糖、麦芽寡糖,最后经过过滤、脱色、脱盐、浓缩等得到成品,并可以通过酵母发酵或物理分离纯化获得高纯度产品,目前以酵母发酵法去除可发酵糖为主流生产技术[1,3-4,7]。现有低聚异麦芽糖工业生产工艺存在工序多、周期长、底物转化率低、工艺参数控制困难等缺点,且酶法转化产品中重要功能性糖分的含量不高(约为35%,w/w),这些都制约着我国IMOs产业的进一步发展。其核心技术问题之一是酶的合理组合与优化利用。
本文通过研究IMOs制备过程影响酶的功能发挥相关因素及其酶的组合作用与优化,试图建立起全新的高效IMOs酶法制备工艺技术,为现有IMOs工业制造技术的革新奠定基础。
1 材料和方法
1.1材料与仪器
玉米淀粉食品级,购自山东百盛生物科技有限公司;耐高温α-淀粉酶(40000 U/mL)、普鲁兰酶(2,000 U/mL)购自福大百特生物科技有限公司;β-淀粉酶(700000 U/mL)、α-葡萄糖转苷酶(360000 U/g)由江苏锐阳生物科技有限公司提供;葡萄糖分析纯,国药控股有限公司;麦芽糖分析纯,生工生物工程(上海)股份有限公司;异麦芽糖、麦芽三糖、异麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖、潘糖均为色谱纯,购自江苏锐阳生物科技有限公司。
1260液相色谱仪安捷伦科技有限公司;ELSD 2000 ES蒸发光检测器埃文森科技有限公司;TSK-GEL Amide-80亲水相互作用色谱柱北京绿百草科技发展有限公司。
1.2实验方法
1.2.1低聚异麦芽糖制备工艺流程参照现有工业生产技术体系进行并参考文献[7]方法。实验室操作时的反应体积为100 mL,一般步骤是:称取淀粉溶于水中制成25%(w/v)淀粉乳,调节pH至6.0,加入一定量的耐高温α-淀粉酶,加热煮沸液化;将温度降低到55 ℃左右,加入一定量的β-淀粉酶和普鲁兰酶,再加入α-葡萄糖转苷酶,55 ℃保温一段时间。定时取样,用HPLC分析糖分组成及其变化。
1.2.2淀粉液化程度的优化在25%淀粉乳中按照100、200、400 U/g的加入量加入耐高温α-淀粉酶,混匀后加热到100 ℃,进行液化,在淀粉液化液的DE分别达到12、20和30后,将淀粉液化液降温到55 ℃,依次加入β-淀粉酶、普鲁兰酶和α-葡萄糖苷酶,55 ℃保温10 h。取样,HPLC法分析其糖分组成。
1.2.3转苷过程中最佳pH的确定在液化完成后,将其pH调整到3.0、4.0、5.0、6.0、7.0,再加入β-淀粉酶、普鲁兰酶和α-葡萄糖转苷酶,55 ℃保温6 h糖化后,取样HPLC分析糖分组成。
1.2.4转苷过程中最适温度的确定在转苷过程中将样本分别在37、45、50、55、65和75 ℃下反应6 h,取样HPLC分析糖分组成。
1.2.5α-葡萄糖转苷酶的不同添加量对IMOs形成的影响在其它条件不变的情况下,在反应体系中按照500、1000、2000 U/g的添加量加入α-葡萄糖转苷酶,在55 ℃下反应不同时间,定时取样分析。
1.2.6普鲁兰酶的不同添加量对IMOs形成的影响在其它条件不变的情况下,在反应体系中按照0.3、0.6、0.9、1.8 U/g的添加量加入普鲁兰酶,一组不添加普鲁兰酶,在55 ℃下反应15 h后,取样分析。
1.2.7β-淀粉酶的不同添加量对IMOs形成的影响在固定其它反应条件不变的情况下,分别按照300、400、500、600、700 U/g的添加量添加β-淀粉酶,一组不添加β-淀粉酶,在55 ℃下反应15 h,取样分析。
1.2.8最优条件下IMOs的酶法制备在上述确认的最优条件下,进行完整的液化和糖化转苷实验,并经HPLC分析最终产物的组成情况。
1.3分析测定方法
1.3.1淀粉液化液DE值按GB/T 22428.1-2008进行,采用直接滴定法(以葡萄糖计算)[8]。
1.3.2低聚异麦芽糖含量与组成分析按GB/T 20881-2007测定,采用HPLC法进行[9]。色谱柱为TSK-GEL Amide-80亲水相互作用色谱柱,流动相为67%的乙腈,流速为1 mL/min,色谱柱检测温度为30 ℃,检测器使用ELSD 2000ES蒸发光检测器,检测器气体流速为2.2 L/min,检测器温度为90 ℃。干物质(固形物)总量按GB/T 20885-2007中6.2测定[10]。
结果计算:依据国标GB/T 20881-2007要求,计算低聚异麦芽糖质量中的核心指标,异麦芽糖(IG2)、异麦芽三糖(IG3)和潘糖(P)的含量[9]。本研究采用更贴合生产实践的低聚异麦芽糖产率描述各实验结果,即二三潘(%)为样本中IG2、IG3和P之和除以样本总干物质量。
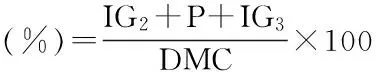
式中:二三潘(%)-异麦芽糖、异麦芽三糖、潘糖之和占总干物质的质量比例,%(w/w);IG2-异麦芽糖含量,mg/mL;P-潘糖含量,mg/mL;IG3-异麦芽三糖含量,mg/mL;DMC-样品的干物质含量,mg/mL;潘糖占比(%)为样品中潘糖(P)的含量除以总干物质量。
1.4数据处理
相关实验均设置三个平行实验,数据分析借助Origin 8.0软件处理完成,统计分析采用F检验法进行。
2 结果与讨论
2.1淀粉液化程度与IMOs形成间的关系
淀粉液化程度优化结果如表1所示。淀粉液化达到DE值为20时,转苷10 h,二三潘占比为45.91%,潘糖占比为16.41%;液化淀粉达到DE值为30时,转苷8 h后,二三潘占比为46.83%,潘糖占比为17.36%。可见,在上述实验条件下,控制淀粉液化度在20~30之间,对后续IMOs形成及其质量有一定影响。考虑到用酶成本与操作方便性,后续实验淀粉液化度可以控制在DE值20~30之间。

表1 不同淀粉液化程度与IMOs形成间的关系
注:*p<0.05表示具有显著性,**p<0.01表示具有极显著性。
在淀粉制糖实践中,无论是淀粉制葡萄糖还是淀粉制麦芽糖,淀粉液化及其液化程度直接影响终产品的形成与质量。就低聚异麦芽糖生产而言,IMOs的生成依赖具有转苷活性的α-葡萄糖苷酶,其作用底物是淀粉液化与糖化后形成的麦芽糖或麦芽寡糖[7]。本研究结果显示,淀粉液化程度对IMOs制备具有明显影响,但相较淀粉制备葡萄糖或麦芽糖的制造过程而言,IMOs制备过程中淀粉液化程度较高,更有利于目标产品的形成。
2.2转苷过程中最佳pH的确定
不同pH下进行IMOs制备的结果如图1所示。随着pH从4.0增加至6.0时,反应得到的二三潘占比也在逐渐增加,反应pH继续升高,则反应得到的二三潘占比会明显下降。可见,控制反应pH在5.0~6.0之间皆能较好完成IMOs的制备,pH6.0为IMOs酶法合成的最佳pH,用于后续研究。

图1 转苷过程不同pH与二三潘含量的关系Fig.1 Relationship between various reaction pHand IMOs yield during transglycosylation process
2.3转苷过程中最适温度的确定
不同温度下进行IMOs制备的结果如图2所示。当制糖反应温度从37 ℃升高到55 ℃时,二三潘占比也在升高;当反应温度继续升高,二三潘占比在逐步下降,从65 ℃升高到75 ℃时,二三潘占比下降的尤为明显。故确定淀粉制备IMOs的最佳反应温度可以控制在50~65 ℃之间,考虑到工业过程与安全控制,可选定55 ℃最适反应温度。

图2 转苷过程不同温度与IMOs形成间的关系Fig.2 Relationship between various reaction temperature and IMOs yield during transglycosylation process
2.4α-葡萄糖转苷酶的不同添加量对IMOs形成的影响
研究了α-葡萄糖转苷酶的添加量对IMOs形成的影响,见图3。α-葡萄糖转苷酶的添加量极大的影响IMOs生成速率并轻度影响其转化率。酶量添加500 U/g,反应15 h,二三潘占比达到最高的46.41%;酶量添加1000 U/g,反应10 h,二三潘占比达到最高的45.53%;酶量添加2000 U/g,反应6 h,二三潘占比达到最高的45.73%。α-葡萄糖转苷酶能催化双糖、低聚糖和其他类似物的非还原端α-1,4糖苷键断裂,释放出D-葡萄糖;也能专一地进行糖苷键转移反应,将葡萄糖苷转移到糖类受体底物上形成α-1,6糖苷键[7,11]。本研究结果显示,α-葡萄糖转苷酶的添加量主要影响转苷的速度,对IMOs核心组成的影响较小,在选择其使用量时可主要依据制造成本与制造效率之间的最适平衡。推荐工业生成体系下选取500~1000 U/g作为此酶的添加量。

图3 α-葡萄糖苷酶的不同添加量对IMOs形成的影响Fig.3 Effect of various amounts of α-glucosyltransferase added on IMOs formation
2.5普鲁兰酶的不同添加量对IMOs形成的影响
进一步实验研究了普鲁兰酶在IMOs制备中的作用,结果见图4。不添加普鲁兰酶时,二三潘仅为35%左右;添加一定量的普鲁兰酶后,IMOs的形成随着普鲁兰酶添加量的增加逐步提高,普鲁兰酶添加量为0.9 U/g时二三潘占比提高到45.38%,继续增加普鲁兰酶的添加量未明显提高二三潘占比。后续研究使用0.9 U/g作为普鲁兰酶的最适添加量。普鲁兰酶能专一性水解支链淀粉分支点中的α-1,6糖苷键,形成直链淀粉,对小分子淀粉分支点或小分子异麦芽(寡)糖中α-1,6糖苷键没有水解作用[12],本研究结果进一步验证这一结果。研究结果还显示,在淀粉形成麦芽糖或麦芽寡糖过程中,普鲁兰酶通过改善淀粉脱支,显著提高IMOs制造过程中的总糖转化率或转化效率。

图4 普鲁兰酶的不同添加量对IMOs形成的影响Fig.4 Relationship between various amounts of pullulanase added and IMOs formation
2.6β-淀粉酶的不同添加量对IMOs形成的影响
β-淀粉酶是一种外切型糖化酶,从淀粉的非还原性末端依次切下一个麦芽糖单位,将液化后的麦芽糊精进一步水解为麦芽糖和麦芽三糖,后者又是α-葡萄糖转苷酶的主要底物,可见其作用在IMOs制造中是比较重要的酶种。为此,对β-淀粉酶在IMOs制备中的作用进行了分析,结果见图5。不添加β-淀粉酶时,二三潘占比仅为33.18%,在一定量β-淀粉酶的协助下,随着β-淀粉酶添加量的增加二三潘占比呈现升高趋势,当β-淀粉酶添加量多于500 U/g时,二三潘占比达到46.29%,继续增加β-淀粉酶添加量二三潘占比不再升高甚至出现轻度下降。后续研究选择500 U/g作为β-淀粉酶的最优添加量。

图5 β-淀粉酶的不同添加量对IMOs形成的影响Fig.5 Relationship between various amounts of β-amylase added and IMOs formation
2.7优化条件下IMOs的酶法制备
依据以上实验结果,使用25%(w/v)淀粉乳,按400 U/g添加耐高温α-淀粉酶在pH6.0下进行淀粉液化,使液化淀粉的DE值为达到20~30,降温至55 ℃,加入β-淀粉酶、普鲁兰酶及α-葡萄糖苷酶添加量分别为500、0.9、500 U/g,55 ℃保温15 h,其IMOs各组成形成与图6所示(图中方框为局部HPLC图谱的放大,目的是进一步观察较大低聚糖的形成情形)。此外,按照本研究的检测条件,麦芽五糖(DP5)的出峰时间应为24.838 min,麦芽六糖的出峰应为时间34.74 min,但在对应出峰位置未形成可积分峰。因此,本研究制备的IMOs较少出现大约四糖的低聚物。
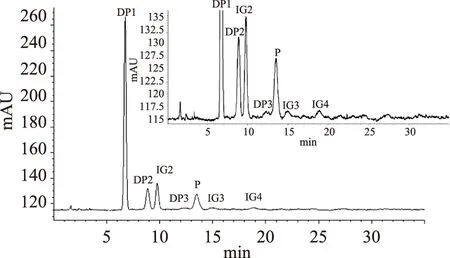
图6 本研究制备的IMOs HPLC图谱Fig.6 HPLC profile of IMOs components prepared in this study
与同类产品的核心组分含量相比如表2所示。本研究所制备的样本中IMOs含量和各主要组分占总糖的比例均明显高于同类产品中的相应组分含量。
国内低聚异麦芽糖产品剂型主要为IMO-50型和IMO-90型。其中,IMO-90型由低聚异麦芽糖浆经酵母发酵或模拟流动床分离去除葡萄糖和麦芽糖获得[3-4]。依据国家标准,IMOs产品中异麦芽糖、潘糖和异麦芽三糖三者总和占干物质的比例约35%(IMO-50型产品)或45%(IMO-90型产品)。本研究制备获得的低聚异麦芽糖中异麦芽糖、潘糖和异麦芽三糖三者总和占干物质的比例约49.09%,高于低聚异麦芽糖产品质量要求,也明显高于同类产品(表2)。更为重要的是,本研究将糖化与转苷工序统一为一步,糖化转苷周期仅需15 h,较传统IMOs制
表2IMOs组成成分比较
Table 2Comparison of IMOs prepared in this study with commercial products
IMOs类别IMOs组成成分(%,w/v)异麦芽糖潘糖异麦芽三糖二三潘来源IMOs19.22±1.05**18.51±1.22**11.35±1.34**49.09±1.56**本研究Isomalto50016.912.58.437.8[13]Iso-G13.116.03.933.0[13]Biotose5017.110.78.436.2[13]
注:**p<0.01表示极显著。
备工艺的48 h以上的转苷周期缩短70%以上,工艺过程也实现了进一步简化。
3 结论
糖化过程和转苷过程同步实施与酶的优化应用,可以有效提高所制备的低聚异麦芽糖浆中二三潘占比并大幅缩短低聚异麦芽糖浆的制备周期,可显著提高生产效率。研究结果对现有工业生产技术的提升或改良具有一定指导意义。
[1]Goffin D,Delzenne N,Blecker C,et al. Will isomalto-oligosaccharides,a well-established functional food in Asia,break through the European and American market? The status of knowledge on these prebiotics[J]. Critical Reviews in Food Science and Nutrition,2011,51(5):394-409.
[2]Singh DP,Khare P,Zhu JH,et al. A novel cobiotic-based preventive approach against high-fat diet-induced adiposity,nonalcoholic fatty liver and gut derangement in mice[J]. International Journal of Obesity,2016,40(3):487-496.
[3]鲍元兴,孙蔚榕,杨维亚. 低聚异麦芽糖的纳滤分离技术和色谱分离技术[J]. 无锡轻工大学学报,2001,20(4):351-355.
[4]Pan YC,Lee WC. Production of high-purity isomalto-oligosaccharides syrup by the enzymatic conversion of transglucosidase and fermentation of yeast cells[J]. Biotechnology and Bioengineering,2005,89(7):797-804.
[5]Kondepudi KK,Ambalam P,Karagin PH,et al. A novel multi-strain probiotic and synbiotic supplement for prevention of Clostridium difficile infection in a murine model[J]. Microbiology and Immunology,2014,58(10):552-558.
[6]Ketabi A,Dieleman LA,Gänzle MG. Influence of isomalto-oligosaccharides on intestinal microbiota in rats[J]. Journal of Applied Microbiology,2011,110(5):1297-1306.
[7]Lee HS,Auh JH,Yoon HG,et al. Cooperative action ofα-glucanotransferase and maltogenic amylase for an improved process of isomaltooligosaccharide(IMO)production[J]. Journal of Agricultural and Food Chemistry,2002,50(10):2812-2817.
[8]GB/T 22428.1-2008. 淀粉水解产品还原力和葡萄糖当量测定[S]. 北京:中国标准出版社,2008.
[9]GB/T 20881-2007. 低聚异麦芽糖[S]. 北京:中国标准出版社,2007.
[10]GB/T 20885-2007. 葡萄糖浆[S]. 北京:中国标准出版社,2007.
[11]Yan TR,Chiou RD. Catalytic properties of a transglucosidase fromAspergillusnigerCCRC 31494[J]. Biotechnology Letters,1996,18(5):553-558.
[12]Tetlow IJ,Emes MJ. A review of starch-branching enzymes and their role in amylopectin biosynthesis[J]. International Union of Biochemistry and Molecular Biology Life,2014,66(8):546-558.
[13]中国发酵工业协会. 糖化用酶和低聚糖技术论文集[M]. 中国食品出版社,1998,187:203-205.
Development and optimization of rapid enzymatic process for isomaltooligosaccharides preparation
TIAN Kang-ming1,2,QIAO Jian2,LI Pu-jun2,NIU Dan-dan2,3,*,LU Fu-ping2
(1.College of Chemical Engineering and Materials Science,Tianjin University of Science and Technology,Tianjin 300457,China;2.Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China;3.Fujian Provincial Key Laboratory of Marine Enzyme Engineering,College of Biological Science and Technology,Fuzhou University,Fuzhou 350116,China)
Combined action with multiple enzymes was investigated for isomaltooligosaccharides(IMOs)production in this study. The corn starch was liquefied using thermostableα-amylase,followed by simultaneous saccharification and transglycosylation usingα-glucosyltransferase,pullulanase andβ-amylase. The reaction condition was optimized through single factor experiments,including liquefaction degree,reaction temperature and pH in saccharification and transglycosylation phase,α-glucosyltransferase dosage,pullulanase andβ-amylase dosage in saccharification phase. The optimum reaction condition was obtained when the dextrose equivalent value(DE)was control at 20~30 and 500~1000 U/g ofα-glucosyltransferase,0.9 U/g of pullulanase and 500 U/g ofβ-amylase were employed for simultaneous saccharification and transglycosylation at pH6.0 and 55 ℃ with the 25% starch slurry. Under this optimal condition,IMOs with 49.09% of isomaltose,isomaltotriose and panol was obtained within 15 h incubation. In conclusion,the new developed procedure processed rapid preparation of IMOs with high efficiency,in which the IMOs index was significantly improved and the manufacturing duration was 70% reduced. The results are able to improve or reform the current industrial scale process for IMOs manufacturing.
isomaltooligosacchrides;rapid enzymatic preparation;process optimization
2016-01-18
田康明(1985-),男,博士,研究方向:酶制剂的开发与应用,E-mail:kangmingtian@tust.edu.cn。
牛丹丹(1980-),女,博士,研究方向:工业微生物育种与酶工程,E-mail:ddniu0529@fzu.edu.cn。
天津市应用基础与前沿技术研究计划(青年基金项目)(14JCQNJC09200);福建省教育厅产学研(JA15049);天津市高等学校科技发展基金计划项目(20130628)。
TS201.3
A
1002-0306(2016)16-0238-05
10.13386/j.issn1002-0306.2016.16.039

