基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究
温慧芳,陈丽丽,白春清,赵 利,*,袁美兰,杜雨芊
基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究
温慧芳1,陈丽丽1,白春清1,赵 利1,*,袁美兰1,杜雨芊2
(1.江西科技师范大学生命科学学院,国家淡水鱼加工技术研发分中心,江西 南昌 330013;2.南昌市食品化妆品监督所,江西 南昌 330038)
本实验以鮰鱼皮为原料,将碱法、盐法、热水法、酸法与酶法提取的胶原蛋白进行理化性质的比较,通过对不同胶原蛋白的氨基酸组成、紫外光谱、傅里叶红外光谱、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)、热变性温度、扫描电子显微镜图像以及流变学特性的研究,从分子结构到微观结构对胶原蛋白进行全面解析和比较。结果表明:5 种方法提取的胶原蛋白的紫外光谱与红外光谱都较为相似,为典型的胶原蛋白;碱法、热水法、盐法、酸法和酶法提取的胶原蛋白热变性温度分别为63.21、71.70、49.49、29.8、22 ℃;SDS-PAGE结果显示酸法、酶法、热水法提取的胶原蛋白均属于Ⅰ型胶原蛋白,且较好地保留了蛋白的结构;高效液相色谱显示碱法与盐法提取的胶原蛋白为多肽的形式;通过流变学特性研究发现,热水法提取的胶原蛋白凝胶稳定性最高。由此可见,不同的提取方法对胶原蛋白的氨基酸组成、流变性质、热变性温度以及微观结构均有不同的影响。
鮰鱼;胶原蛋白;碱法;盐法;热水法;理化性质
http://www.spkx.net.cn
胶原蛋白作为生物体中最重要的结构蛋白之一,占总蛋白含量的25%~30%[1],主要存在于皮肤、骨骼和韧带中,起到支撑和保护机体的功能。动物皮肤中的胶原主要以白色透明、具有四级结构的Ⅰ型纤维状胶原为主。Ⅰ型胶原分子中含有3 条α多肽链,其中2 条相同的多肽链称α1链,另外一条与α1链的氨基酸组成不同,称为α2链,在一些鱼类和低等脊椎动物中的胶原蛋白还可能含有α3链。胶原蛋白的结构特征是由3 条左手螺旋构型的α链构成三螺旋结构,然后又相互缠绕成右手超螺旋结构[2]。
我国淡水资源丰富,水产加工过程中出现大量的下脚料如鱼头、鱼皮和鱼骨等,约占鱼体质量的70%,而这些下脚料中含有丰富的胶原蛋白,大多都被丢弃或制成动物饲料,造成环境的污染和资源的极大浪费。冷冻鮰鱼片是江西水产行业的主要创汇产品,鮰鱼皮中胶原蛋白的含量高达28%,远高于鳙鱼皮和草鱼皮,最高可占鱼皮粗蛋白总量的80%之多[3]。
现阶段对鮰鱼皮胶原蛋白的提取多用酸法与酶法提取,限制了鮰鱼皮的高效利用。本实验创新地利用盐法、碱法以及热水法从鮰鱼皮中提取胶原蛋白,从分子结构到微观组织全面分析胶原的理化特性,并与酸法、酶法提取的胶原蛋白进行分析比较,以期为全面开发鮰鱼皮胶原蛋白提供理论依据。
1 材料与方法
1.1 材料与试剂
鮰鱼皮,江西海浩鄱阳湖水产有限公司提供,平板冻结保藏。
胃蛋白酶(EC3.4.23.1,3 000 U/mg)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 美国Sigma公司;Tris、考马斯亮蓝R-250、250 kD标准蛋白 北京索莱宝科技有限公司;β-巯基乙醇 美国Amresco公司;甘氨酸 厦门星隆达化学试剂有限公司;30%甲叉双丙烯酰胺、四甲基乙二胺(tetramethylethylenediamine,TEMED) 碧云天生物技术研究所;其余化学试剂均为分析纯。
1.2 仪器与设备
JJ1000型精密电子天平 常熟双杰仪器厂;HZF-A1000型电子天平 美国康州电子科技有限公司;RW20型悬臂搅拌器 德国IKA公司;TDL-5A台式低速离心机 上海菲恰尔分析仪器有限公司;Centrifuge 5804R型高速离心机 德国Eppendorf公司;HH-4型数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司;UV2600紫外分光光度计 尤尼柯(上海)仪器有限公司;Vertex 70傅里叶变换红外光谱仪 德国Bruker公司;L-8900氨基酸自动分析仪 日本日立公司;DSC 200F3型差示扫描量热仪 德国耐驰仪器制造有限公司;MCR302型流变仪 奥地利安东帕公司;Waters 600高效液相色谱仪(配2487紫外检测器和M32工作站) 美国Waters公司;JSM-6490LV扫描电子显微镜 JEOL日本株式会社;SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gelelectrophoresis,PAGE)垂直电泳装置 美国Bio-Rad公司。
1.3 方法
1.3.1 鮰鱼皮的预处理
将鮰鱼皮解冻后用刀刮去大部分脂肪,并剪成10 mm×20 mm的形状,用10%异丙醇在4 ℃条件下浸泡24 h,清洗干净后用质量分数5%的NaCl溶液在4 ℃条件下浸泡24 h,洗净后-20 ℃保藏。
1.3.2 鮰鱼皮胶原蛋白的提取
1.3.2.1 碱法提取胶原蛋白
将处理后的鱼皮10 g用质量分数1.5%的Ca(OH)2溶液以1∶10(m/V)的料液比于70 ℃提取9 h,5 000 r/min离心后过滤,-45 ℃冷冻干燥,得到碱溶性胶原蛋白。
1.3.2.2 盐法提取胶原蛋白
将处理好的鮰鱼皮与水1∶30(m/V)混合,加入Na2SO4(25 g/L)和NaOH(8 g/L),加热50 ℃提取2 h,5 000 r/min离心后过滤,-45 ℃冷冻干燥,得到盐溶性胶原蛋白。
1.3.2.3 热水法提取胶原蛋白
将处理好的鮰鱼皮与水1∶13(m/V)混合,在70 ℃条件下提取6 h,5 000 r/min离心后过滤,-45 ℃冷冻干燥,得到水溶性胶原蛋白。
1.3.2.4 酸法提取胶原蛋白
将预处理好的鮰鱼皮置于0.5 mol/L的乙酸中,以1∶50(m/V)的料液比在15 ℃条件下提取72 h,5 000 r/min离心后过滤,-45 ℃冷冻干燥,得到酸溶性胶原蛋白[4]。
1.3.2.5 酶法提取胶原蛋白
将预处理好的鮰鱼皮置于0.3 mol/L乙酸中,以1∶20(m/V)的料液比加入5 000 U/g胃蛋白酶在37 ℃提取6 h, 5 000 r/min离心后过滤,-45 ℃冷冻干燥,得到酶溶性胶原蛋白[4]。
1.3.3 鮰鱼皮胶原蛋白理化性质测定
1.3.3.1 胶原蛋白的氨基酸组成分析
采用高效液相色谱(high performance liquid chromatography,HPLC)AccQ-Tag柱前衍生法对氨基酸组成进行分析,称取20 mg冻干的鮰鱼皮胶原蛋白,加入6 mol/L HCl后真空封管,于110 ℃条件下水解24 h。水解完全后,在旋转蒸发器中将HCl蒸干,加入蒸馏水复溶。水解液加入AccQ-Tag衍生剂进行衍生反应,衍生好后的样品用HPLC法进行分析。
1.3.3.2 胶原蛋白的紫外光谱扫描
参考Caputo等[5]的方法略有改动:将冻干的胶原蛋白成品配制成2 mg/mL溶液,用紫外分光光度计在200~400 nm波长之间进行扫描。
1.3.3.3 胶原蛋白傅里叶红外光谱扫描
鮰鱼皮胶原蛋白的傅里叶变换红外光谱扫描参照Muyonga等[6]的方法略作改动:将干燥的KBr(约100 mg)与鮰鱼皮胶原蛋白的冻干制品(2 mg)置于玛瑙研钵中,彻底磨成粉末状后,放入压片机手动压片,放入样品室扫描。设置扫描波数范围为4 000~500 cm-1,分辨率为2 cm-1。
1.3.3.4 酸溶性、酶溶性与水溶性胶原蛋白的SDS-PAGE分析
配制质量浓度为4 mg/mL的胶原蛋白:取40 mg冻干的胶原蛋白样品溶解于蛋白质可溶性溶液(48%尿素、2% SDS、0.2% Tris-HCl、2.0% β-巯基乙醇,pH 8.8)中,与0.1%溴酚蓝染色剂等体积混合,沸水浴3 min,10 000 r/min离心20 min,除去不溶物。电泳采用浓缩胶质量分数为4%,分离胶质量分数为7.5%,在不连续的Tris-HCl/甘氨酸系统中进行,起始电压为80 V,进入分离胶后电压调至120 V。待溴酚蓝跑至胶底部1 cm处停止电泳。电泳结束后,将分离胶置于质量分数0.25%考马斯亮蓝R-250溶液中染色1 h,然后用乙酸-乙醇脱色液处理直至背景色透明为止,最后将胶片放置于凝胶成像系统中拍照。
1.3.3.5 盐溶性与碱溶性胶原蛋白的分子质量分布
根据HPLC检测乳铁蛋白抗菌肽的分子质量分布的条件进行设置,色谱条件:色谱柱:TSKgel 2000 SWXL(300 mm×7.8 mm,0.7 μm);流动相体积比:乙醇-水-氯乙酸(450∶550∶1,V/V);检测波长:220 nm;流量:0.5 mL/min;柱温:30 ℃;样品制备:吸取2 mL样品于10 mL容量瓶中,用流动相稀释至2 mg/mL,用微孔过滤膜0.22 μm过滤后进样。
1.3.3.6 胶原蛋白的热变性温度测定
准确称取约4 mg样品于差示扫描量热仪(differential scanning calorimeter,DSC)坩埚中,加盖密封后,以空坩埚作参比,从20 ℃加热至120 ℃,升温速率为5 ℃/min,样品室的氮气流量为20 mL/min。
1.3.3.7 胶原蛋白的流变学特性研究
取适量冻干的胶原蛋白溶于蒸馏水中,配制成质量分数为0.3%的胶原蛋白溶液。在20 ℃条件下,剪切频率为0.1~150 rad/s,胶原蛋白溶液的流变学曲线测定条件为:椎板40 mm、2 °;在振荡模式下,采用频率扫描的数据获取模式,频率扫描范围为0.1~150 rad/s;变量扫描为对数模式,采集33 个变量点,控制变量为形变率(30%)。研究胶原蛋白溶液的储能模量(弹性模量)G’、损耗模量(黏性模量)G”随着振荡频率的变化规律[7]。
1.3.3.8 胶原蛋白的扫描电镜分析
取适量冷冻干燥好的胶原蛋白样品置于液氮中冷冻定型,将定型后的样品切成薄片之后真空喷金,最后在20 kV电压下放大100 倍观察胶原蛋白的表面形态。
1.4 数据统计分析
实验数据采用SPSS 6.0进行统计学分析,使用Origin 7.5软件作图。
2 结果与分析
2.1 胶原蛋白的氨基酸组成
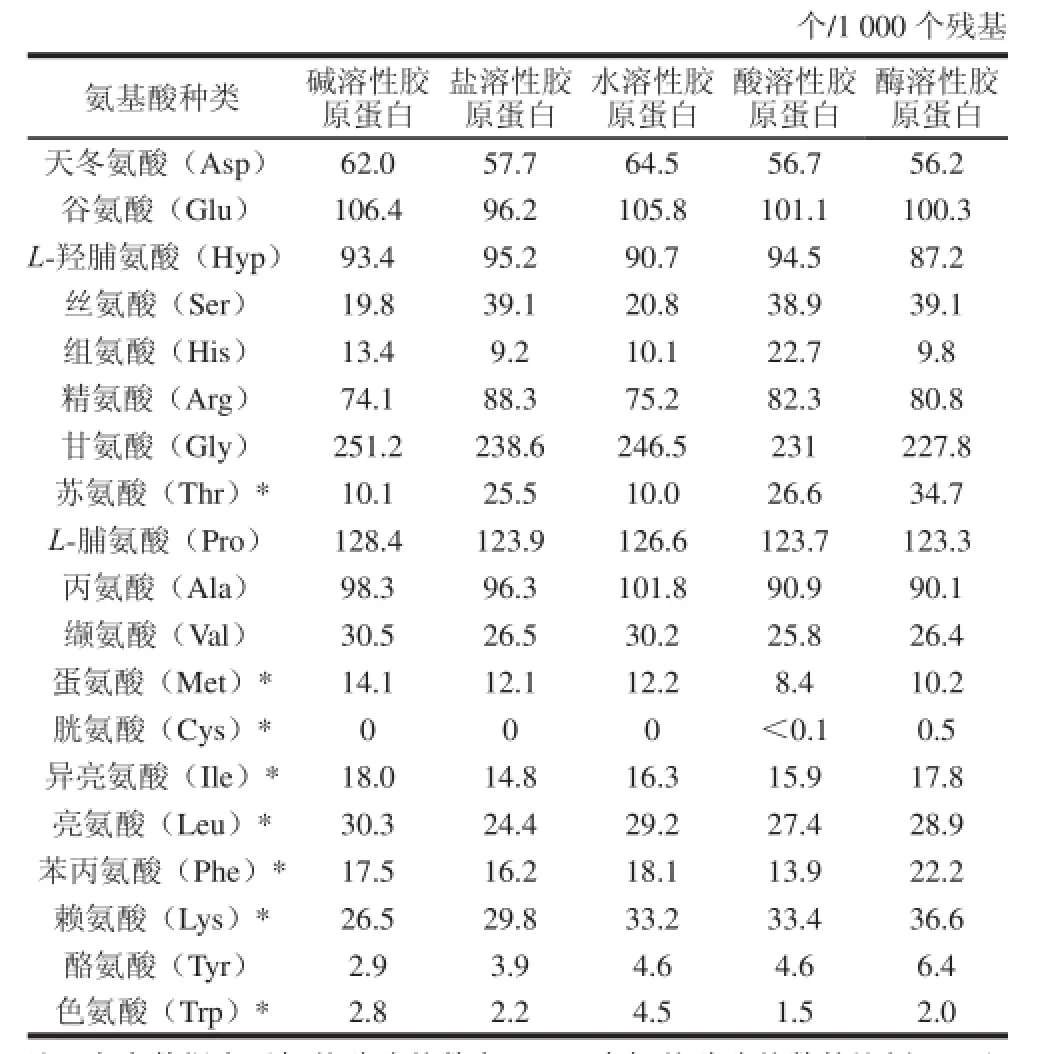
表1 鱼皮胶原蛋白的氨基酸组成Table 1 Amino acid composition of collagens extracted from Chinese longsnout catfish skin by different extraction methods
由表1可知,5 种样品均具有胶原蛋白的特征性氨基酸,即富含甘氨酸、脯氨酸和羟脯氨酸。其中甘氨酸、谷氨酸、脯氨酸和丙氨酸的含量均比较丰富;相反,胱氨酸、色氨酸、组氨酸、苏氨酸以及苯丙氨酸的含量很低甚至没有;5 种胶原蛋白中甘氨酸含量均最高,约占氨基酸残基总量的1/3,这是因为胶原蛋白多肽链很长的区段序列是由Gly-X-Y氨基酸序列重复而成的[8]。作为胶原蛋白中的特征氨基酸,羟脯氨酸能够促进肽链间氢键的形成,氢键能够维持胶原三螺旋结构的稳定性,与胶原蛋白的热稳定性质相关[9]。提取方法不同会直接影响羟脯氨酸的含量,这可能是因为不同的提取方法对胶原蛋白结构的影响程度不同。热水提取的方法会使得胶原蛋白分子中的部分氨基酸被水解,而酶解会使酶溶性胶原蛋白失去端肽,切断胶原肽链间的共价交联键,导致其羟脯氨酸的含量也低于其他胶原蛋白,该结果也与Knott等[10]的研究结论一致,而胶原蛋白α链间氢键的形成主要依赖于羟脯氨酸,它对胶原蛋白分子三级结构的稳定性起到非常重要旳作用[11]。
2.2 胶原蛋白的紫外光谱分析
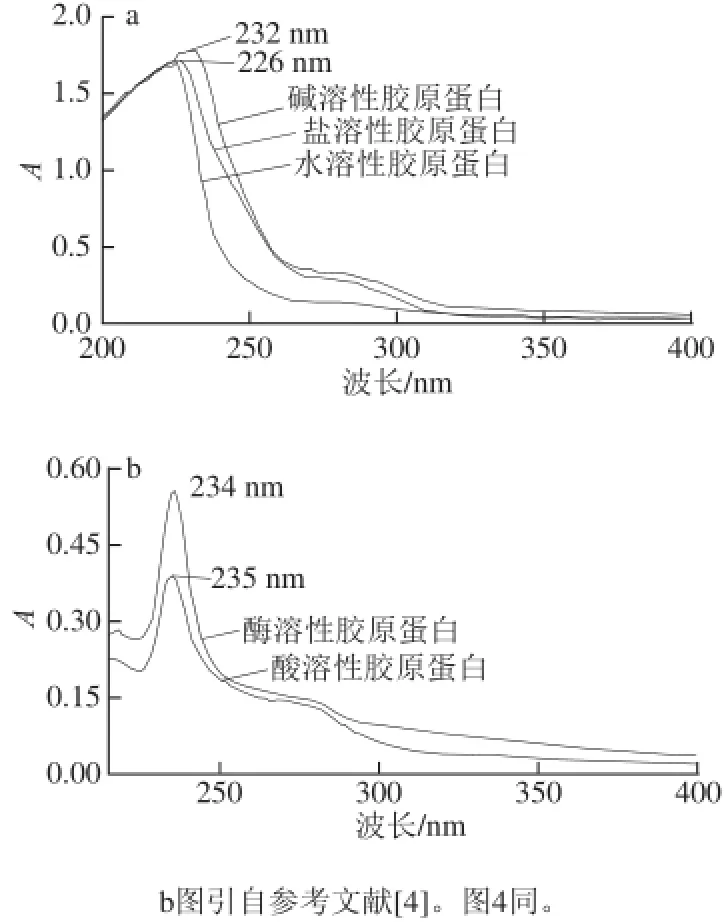
图1 1 鮰鱼皮胶原蛋白的紫外吸收光谱Fig.1 UV-visible absorption spectra of collagens from Chinese longsnout catfish skin
蛋白分子在溶液中能够吸收一定波长范围的紫外光,产生紫外吸收光谱。蛋白质分子之所以能够吸收紫外光,是因为蛋白质分子中含有一些能吸收某一波长的紫外生色基团,例如胶原肽链所含的—C=O、—COOH、—CONH2都是生色基团,蛋白质溶液的紫外吸收光谱实际上是蛋白质分子中各种紫外生色基团加和的结果[1]。蛋白质分子中的部分官能团具有特征性的紫外吸收区域,如芳香族氨基酸残基通常在250~280 nm波长范围内有一个吸收峰;氨基酸残基、氢键或与螺旋等构象有关的次级键通常在210~250 nm波长范围内有吸收峰;而蛋白质分子中的肽键以及许多蛋白质构象因素通常可产生210 nm波长以下的吸收峰[12]。鮰鱼皮胶原蛋白的紫外扫描光谱如图1所示,其特征吸收波长均位于230 nm左右,主要是由肽键—C=O的n→π*跃迁所贡献,这是胶原蛋白三螺旋结构的特征吸收峰,与其他鱼类胶原蛋白的研究结果一致[13-14]。Trp在280 nm波长处有较强的紫外吸收,但是胶原蛋白中几乎不含有Trp,故在280 nm波长处无吸收峰可作为鉴定胶原蛋白的方法,同时也表明通过该方法提取得到的胶原蛋白杂蛋白少,纯度较高[15]。由以上结果可初步推断本实验所提取的胶原蛋白为典型的胶原蛋白。
2.3 胶原蛋白的红外光谱分析

图2 2 鮰鱼皮胶原蛋白的红外光谱图Fig.2 FTIR spectra of collagens from Chinese longsnout catfish skin
图2 为不同方式提取的鮰鱼皮胶原蛋白的傅里叶红外光谱图,5 种样品都具有胶原蛋白红外光谱的特征吸收峰,即酰胺A、B、Ⅰ、Ⅱ和Ⅲ吸收峰,酰胺A归属于N—H伸缩振动,酰胺B归属于—CH2的不对称伸缩振动。由文献[16]可知,酰胺A的吸收峰在3 440~3 400 cm-1处,而当含N—H基团的肽段参与氢键形成时,N—H基团的伸缩振动产生的吸收峰会降低100 cm-1左右,从图中可以看出,5 种胶原蛋白均在3 300 cm-1左右有吸收峰出现,说明5 种胶原蛋白分子均有氢键的存在。而由于在蛋白分子内亚甲基基团会发生不对称的伸缩振动,使得酰胺B的吸收峰在3 080 cm-1处出现[6]。从图中可看出,碱法与盐法提取的胶原蛋白在3 080 cm-1处并无吸收峰,说明亚甲基被破坏,而亚甲基是三级结构的特征基团,说明其三级结构受到了破坏。酰胺键是蛋白质二级结构变化敏感特征的官能团,常常被用来鉴定和分析蛋白质的二级结构,酰胺Ⅰ、Ⅱ和Ⅲ带是反映蛋白质肽链骨架结构的最重要吸收峰。其中C=O伸缩振动峰为酰胺Ⅰ,N—H和C—N扭转振动峰为酰胺Ⅱ,而甘氨酸和脯氨酸残基的—CH2特征振动峰为酰胺Ⅲ。在蛋白质分子内,存在大量的肽键于氨基酸之间,而羰基键的伸缩振动会导致酰胺Ⅰ的特征吸收峰位于1 700~1 600 cm-1处[17]。酰胺Ⅰ与蛋白肽链骨架的有序程度密切相关,有序度越高,则酰胺Ⅰ吸收峰波数越大[15]。从图中可以看到,5 种胶原蛋白分子都具有酰胺Ⅰ带的吸收峰,而碱溶性胶原蛋白的吸收峰波数较小,故其有序度较低。在已知的胶原蛋白分子中,胶原蛋白酰胺Ⅱ的吸收峰通常位于1 600~1 500 cm-1范围内[18]。图中显示在1 550 cm-1处有吸收峰,说明5 种胶原蛋白分子均具有酰胺Ⅱ带,同酰胺Ⅰ带一样,酰胺Ⅱ带也是由α-螺旋、β-螺旋、β-转角和无规卷曲叠加共同作用产生的吸收带。酰胺Ⅲ的吸收峰通常位于1 300~1 200 cm-1,酰胺Ⅲ带的存在可以证明胶原蛋白的三螺旋结构是否保持完整[19]。对5 种胶原蛋白的红外光谱分析可以发现:碱法与盐法提取的胶原蛋白三级结构被破坏,其余蛋白均保留了完整的三螺旋结构。
2.4 酸溶性、酶溶性与水溶性胶原蛋白的SDS-PAGE结果

图3 3 鮰鱼皮胶原蛋的SDS-PAGE图谱AGEFig.3 SDS-PAGE patterns of collagens from Chinese longsnout catfish skin
胶原蛋白呈三股螺旋结构,分子由3 条多肽链组成,每条胶原链都是左手螺旋构型,3 条左手螺旋的α链又互相缠绕成右手螺旋结构,即超螺旋结构[20]。牛跟腱胶原蛋白是Ⅰ型胶原蛋白,在电泳分析中作为胶原蛋白的标准品,由图3可知,酸法、酶法、热水法提取的胶原蛋白均有1 条β链和至少2 条α链(α1和α2)组成,与标准品条带出现的位置一致,可鉴定为Ⅰ型胶原蛋白[21]。而条带α1中可能含有α3链,因为α1链和α3链在单相垂直电泳胶上无法辨别[22],其中酸法与酶法提取的胶原蛋白具有较多的β链与明显的γ链,而热水法提取的胶原蛋白中只存在较少的β链,这可能是因为热水法提取的温度较高,使得胶原蛋白中的高分子质量部分发生降解,即γ链和β链部分,特别是γ链的含量大大降低,而出现的低分子质量蛋白可能是在提取时水解高分子部分形成的。本实验中酸法、酶法、热水法提取的胶原蛋白的电泳条带较为清晰,无杂带出现,说明提取的胶原蛋白具有较高的纯度;而胶原蛋白特征条带的出现说明了利用本实验工艺提取的胶原蛋白样品基本保持了其原有的结构。高分子质量的γ链和β链的含量越高,胶原的凝胶强度会变差[23]。相比于酸法与酶法提取的胶原蛋白,热水法提取的胶原蛋白β链含量显然较少,这表明水溶性胶原蛋白具有较高的凝胶性能。
2.5 盐溶性与碱溶性胶原蛋白的分子质量
碱溶性与盐溶性胶原蛋白的平均分子质量分布如表2所示,盐溶性胶原蛋白的分子质量集中在700~1 400 D左右,碱溶性胶原蛋白的分子质量集中在280~700 D左右,且均无大分子物质存在,从分子质量分布看来,两者的α链被打断,呈现多肽的性质,说明碱溶性与盐溶性胶原蛋白在提取过程中发生降解,此类多肽极易被人体吸收。
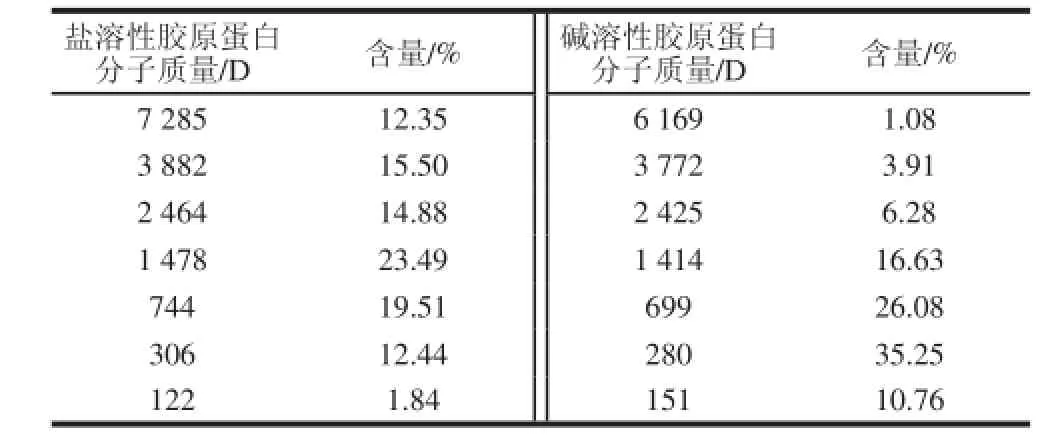
表2 盐溶性与碱溶性胶原蛋白的分子质量Table 2 Average relative molecular weight distribution of salt-soluble collagens and alkali-soluble collagens from Chinese longsnout catfish skin
2.6 胶原蛋白的热变性温度(Td)
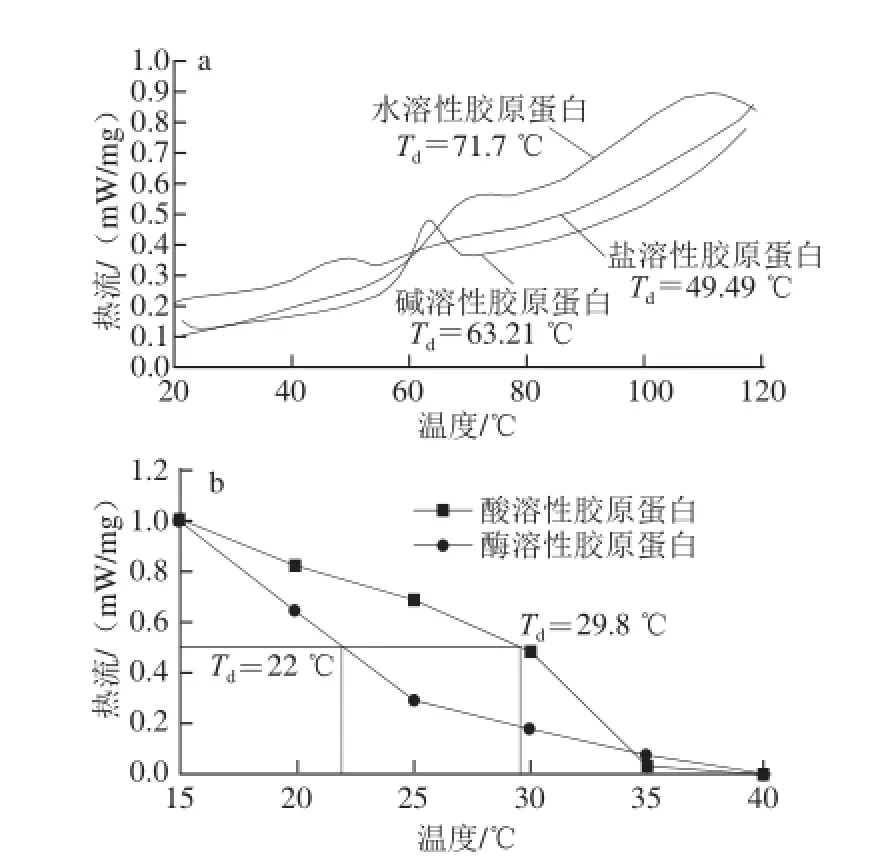
图4 4 鮰鱼皮胶原蛋白的热变性曲线Fig.4 Thermal denaturation curves of collagens from Chinese longsnout catfish skin
热变性温度(Td)通常可以用来反映胶原蛋白的热稳定性,即蛋白的热变性温度。胶原蛋白的变性是指其三螺旋结构的次级键断裂,螺旋打开后形成无规则的单链线团结构,从而导致胶原蛋白失去独特的性质,例如黏度下降、沉降速率增加、浮力上升、紫外吸收增强等[24]。胶原蛋白的热变性温度与其羟脯氨酸和脯氨酸的含量有关,羟脯氨酸和脯氨酸含量越高,胶原蛋白的热稳定性越高[25],2.1节的氨基酸组成分析也显示,盐溶性胶原蛋白的羟脯氨酸残基含量最高,故其热变性温度也在这5 种胶原蛋白中最高。由图4可知,酸溶性胶原蛋白的热变性温度为29.8 ℃,酶溶性胶原蛋白的热变性温度为22 ℃,水溶性胶原蛋白的热变性温度为71.7 ℃,盐溶性胶原蛋白的热变性温度为49.49 ℃,碱溶性胶原蛋白的热变性温度为63.21 ℃。可以看出,胶原蛋白的热变性温度与提取温度有很大关系,因为碱法、热水法、盐法的提取温度分别为70、70、50 ℃,与其热变性温度相近,由此可推断出胶原蛋白的热变性温度可能受到提取温度的影响较大。
2.7 胶原蛋白的流变学特性
胶原蛋白溶液的黏弹性可用振荡模型进行测定,即对胶原分子施加一个扭摆力矩,使胶原分子在此力矩下发生运动。当扭摆力矩的频率从低到高变化时,分子链的运动也会发生相应的改变,据此测定其黏弹性能。G’为储能模量或弹性模量,反映胶原分子随外力的改变而发生形变的能力;G’为损耗模量或黏性模量,反映胶原分子在外力作用发生改变时分子链内或分子间拉伸导致的能量耗损。
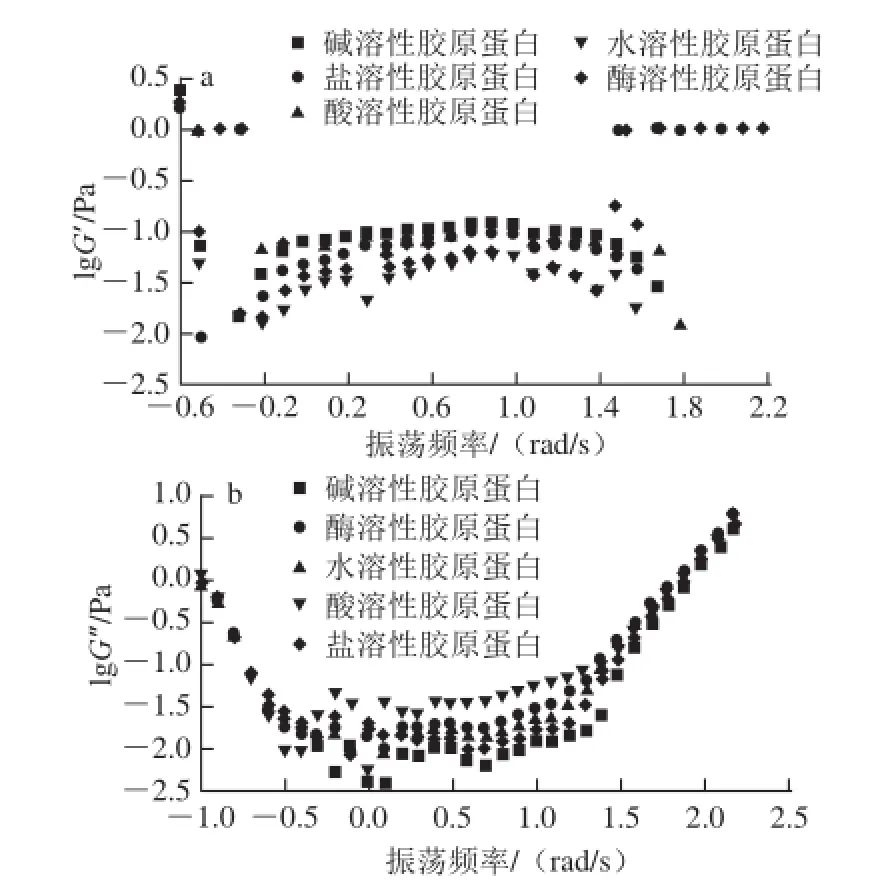
图5 5 鮰鱼皮胶原蛋白溶液的流变学特性Fig.5 Rheological characteristics of collagen solutions of Chinese longsnout catfish skin
由图5可知,水溶性胶原蛋白的G’的变化斜率较大,说明在0.4~1.8 rad/s区间内具有较高的凝胶稳定性[26]。当振荡频率较低时,胶原蛋白溶液主要表现出黏性为主的特征;随着振荡频率的增高,胶原蛋白溶液主要表现出弹性为主的特征。5 种胶原蛋白溶液随着振荡频率的变化出现相同的变化趋势,说明振荡频率的变化可以影响胶原溶液的流变性质,而不同胶原溶液的变化呈现不同的程度,说明不同胶原溶液的流变性质存在差异。
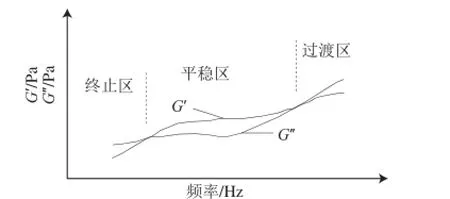
图6 黏弹性溶液的三区模型图[[2277]]Fig.6 Illustration of three-zone behavior for viscoelastic liquids[27]
胶原蛋白溶液在不同振荡频率下的流变行为可用黏弹性液体的三区模型[28]来描述。如图6所示,在不同的剪切频率下,胶原蛋白溶液的流变学行为可分为3 个区域,分别为终止区、平稳区和过渡区。当剪切频率较低时,G’大于G’,溶液以黏性为主;随着剪切频率的增大,G’大于G’,溶液以弹性为主;若剪切频率进一步增加,分子结构被破坏,G’又表现为大于G’。
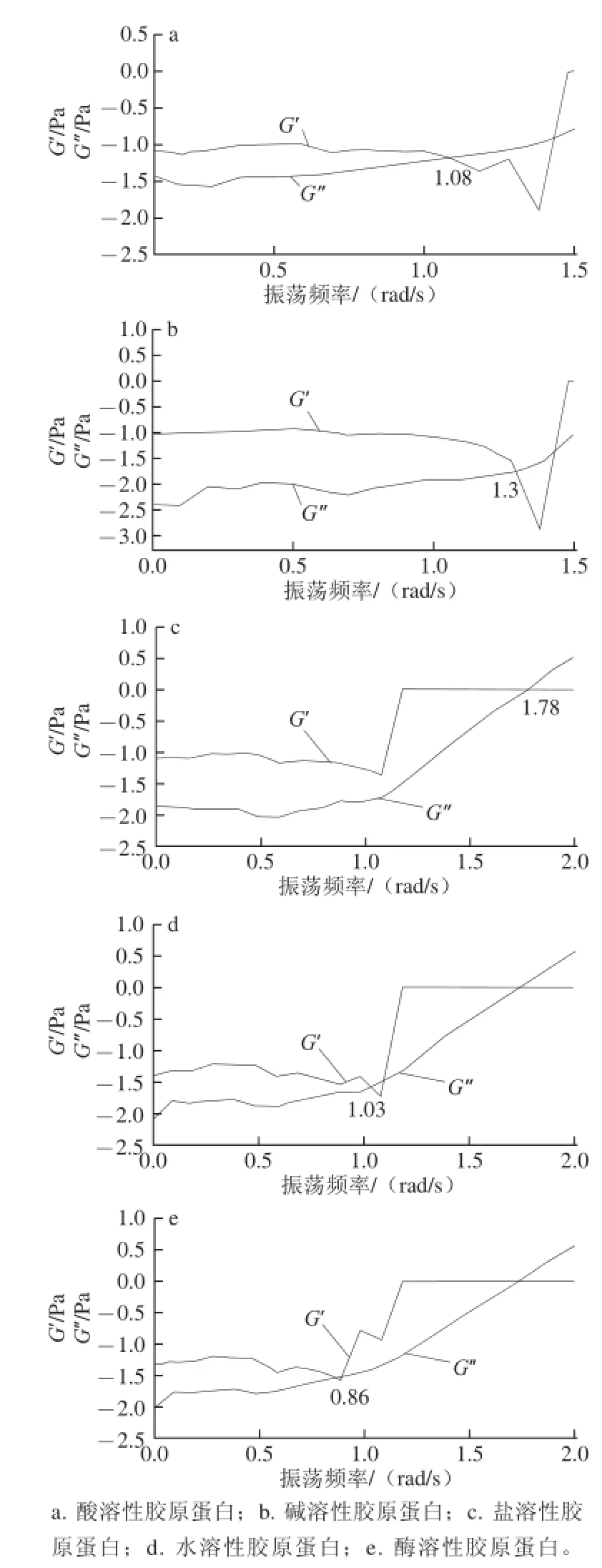
图7 不同方式提取的胶原蛋白溶液的动态模量Fig.7 Dynamic modulus of collagens obtained by different extraction methods
不同提取方式下鮰鱼皮胶原蛋白溶液的黏弹性模量与振荡频率的关系如图7所示。不同胶原蛋白溶液的黏弹性模量随着振荡频率的增加而增大,除盐溶性胶原蛋白溶液外,其余胶原蛋白溶液的黏性模量和弹性模量的交点均在终止区,交点分别为1.08、1.30、1.03、0.86 rad/s,而交点为1.78 rad/s的盐溶性胶原蛋白溶液出现在平稳区。在几种胶原蛋白溶液中,碱溶性与盐溶性胶原蛋白溶液交点的数值较高,表明其松弛时间较短。而松弛时间与原胶原分子运动以及分子内临近链中的—NH和—CO形成的氢键有关。因此,高交点值会导致胶原分子内三螺旋结构被破坏,使得分子内流动性增加[29]。这种情况可能与提取胶原的方法有关,碱提法与盐提法的提取环境较为刺激,使得原胶原分子的结构被破坏;而酶提法、酸提法、水提法的提取环境比较温和,故较好地保留了胶原蛋白三螺旋结构。
2.8 胶原蛋白的扫描电镜图像
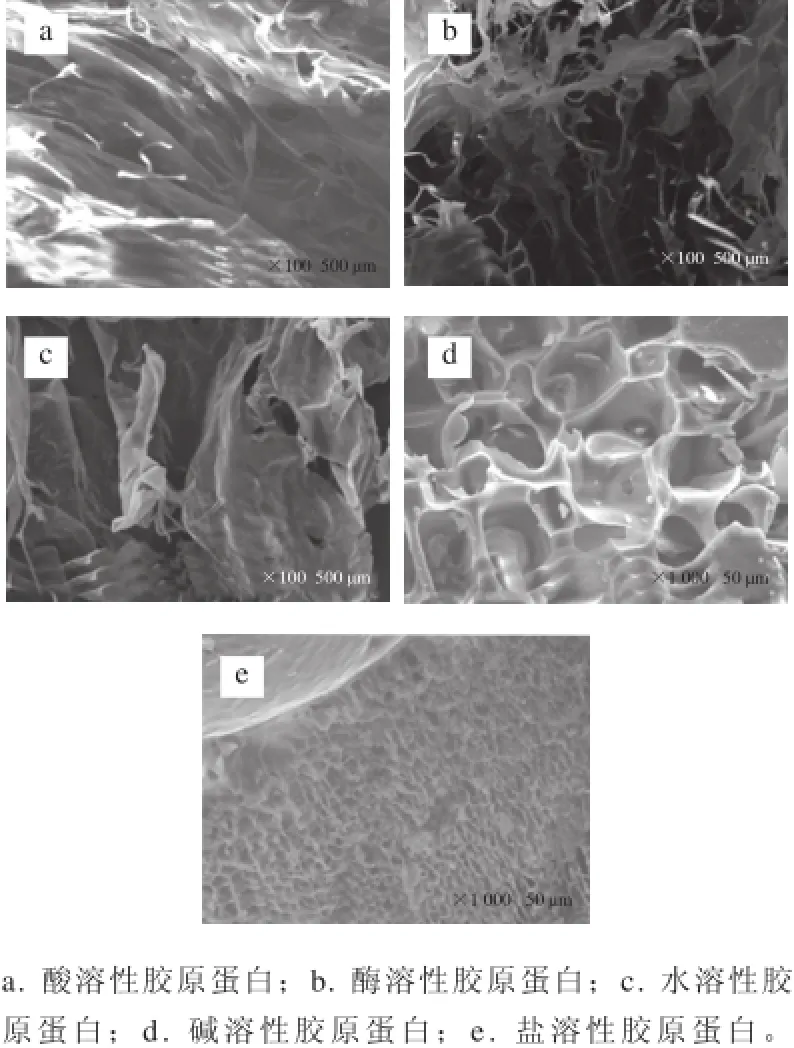
图8 8 鮰鱼皮胶原蛋白的扫描电镜图像Fig.8 SEM images of collagens from Chinese longsnout catfish skin
如图8a~8c所示,酸法、酶法、热水法提取的胶原蛋白在放大100 倍的情况下呈现出规则的、光滑的、纤维状的网络结构,且分布均匀,其中酸溶性胶原蛋白的薄片较薄且分布均匀,说明在提取过程中基本保持了胶原蛋白原有的纤维结构,这与Wang Lin等[30]研究的史氏鲟鱼皮胶原蛋白的结构类似;热水法提取的胶原蛋白的薄片分布不均匀且孔径也大小不一,说明已有部分胶原蛋白交联呈现出明胶的性质;而酶法提取的胶原蛋白孔径较多且分布不均匀,说明酶对胶原的结构有部分改变,但明显还保持了较好的网络结构。如图8d、8e所示,碱法与盐法提取的胶原蛋白的结构与前面几种相比有所不同,表现为多孔基体互相连接而成的网状结构,在孔与孔之间存在微米薄层,伴有散布的与内部贯通的裂纹,表明胶原蛋白有较好的溶解性和吸湿、透气、导湿的特点[31]。研究表明,胶原蛋白呈现出的不同结构特点,包括空隙率、孔径大小、网络结构以及表面积等,是其应用于不同生物医药材料的重要参数[32]。通过对几种不同提取方法而得的胶原蛋白的扫描电镜图分析可知,提取方式不同,所得的胶原的性质与结构也不尽相同,其中酸法、酶法、热水法提取的胶原蛋白保留了较完整的纤维网络结构,可较好地应用于生物医药材料;而碱法与盐法所得的胶原蛋白薄片部分被破坏,只留下多孔状的网络结构,其作为食品加工辅料(例如鱼糜改良剂、饮料增稠剂等)和化妆品、保健品等可起到较好的作用。
3 结 论
本实验分析对比了酸法、酶法、碱法、盐法以及热水法提取鮰鱼皮胶原蛋白的理化特性:氨基酸组成分析表明5 种胶原蛋白均存在特征氨基酸,羟脯氨酸占总蛋白的比例为70%左右,且在230 nm波长处出现最大紫外吸收峰,故5 种样品均为典型的胶原蛋白;碱法、热水法、盐法、酸法和酶法提取的胶原蛋白热变性温度分别为63.21、71.70、49.49、29.8、22 ℃;红外光谱以及SDS-PAGE图谱分析表明,酸法、酶法和热水法提取的胶原蛋白均为典型的Ⅰ型胶原蛋白,盐法与碱法提取的胶原蛋白为胶原蛋白多肽;流变学特性测定结果表明酸法、酶法和热水法提取的胶原蛋白保留了较好蛋白结构,其中水溶性胶原蛋白的凝胶稳定性最高;从扫描电镜图片可以看出,酸法、酶法和热水法提取的胶原蛋白保留了较完整的纤维网络结构,碱法与盐法所得的胶原蛋白部分结构被破坏,形成多孔状的网络结构。
[1] 蒋挺大. 胶原与胶原蛋白[M]. 北京: 化学工业出版社, 2006: 1-4.
[2] 顾其胜, 蒋丽霞. 胶原蛋白与临床医学[M]. 上海: 第二军医大学出版社, 2003: 1-58.
[3] 宫子慧. 鮰鱼皮胶原蛋白的提取、特性和生物活性的研究[D]. 合肥: 合肥工业大学, 2012: 5-17.
[4] 陈丽丽. 鮰鱼皮中胶原蛋白的提取、性质及应用研究[D]. 南昌: 江西科技师范大学, 2012: 10-21.
[5] CAPUTO I, LEPRETTI M, SCARABINO C, et al. An acetic acidbased extraction method to obtain high quality collagen from archeological bone remains[J]. Analytical Biochemistry, 2012, 421(1): 92-96. DOI:10.1016/j.ab.2011.10.024.
[6] MUYONGA J H, COLE C G B, DUODU K G. Characterisation of acid soluble collagen from skins of young and adult Nile perch (Lates niloticus)[J]. Food Chemistry, 2004, 85(1): 81-89. DOI:10.1016/ j.foodchem.2003.06.006.
[7] 张强, 王倩倩, 陆剑锋, 等. 不同方法提取鲢鱼皮胶原蛋白的理化特性比较[J]. 现代食品科技, 2014, 30(5): 104-110.
[8] BAE I, OSATOMI K, YOSHIDA A, et al. Biochemical properties of acid-soluble collagens extracted from the skins of underutilised fishes[J]. Food Chemistry, 2008, 108(1): 49-54. DOI:10.1016/ j.foodchem.2007.10.039.
[9] SHOULDERS M D, RAINES R T. Collagen structure and stability[J]. Annual Review of Biochemistry, 2009, 78: 929. DOI:10.1146/annurev. biochem.77.032207.120833.
[10] KNOTT L, BAILEY A J. Collagen cross-links in mineralizing tissues: a review of their chemistry, function, and clinical relevance[J]. Bone, 1998, 22(3): 181-187. DOI:10.1016/S8756-3282(97)00279-2.
[11] 刘书成. 水产食品加工学[M]. 郑州: 郑州大学出版社, 2011: 1-37.
[12] 刘龙天. 胶原蛋白三螺旋结构及热稳定性的研究[D]. 北京: 北京协和医学院, 2009: 7-28.
[13] DUAN R, ZHANG J, DU X, et al. Properties of collagen from skin, scale and bone of carp (Cyprinus carpio)[J]. Food Chemistry, 2009, 112(3): 702-706. DOI:10.1016/j.foodchem.2008.06.020.
[14] NALINANON S, BENJAKUL S, KISHIMURA H, et al. Type I collagen from the skin of ornate threadfin bream (Nemipterus hexodon): characteristics and effect of pepsin hydrolysis[J]. Food Chemistry, 2011, 125(2): 500-507. DOI:10.1016/j.foodchem.2010.09.040.
[15] 杨玲, 赵燕, 鲁亮, 等. 鲟鱼鱼皮胶原蛋白的提取及其理化性能分析[J]. 食品科学, 2013, 34(23): 41-46. DOI:10.7506/spkx1002-6630-201323010.
[16] LI H, LIU B L, GAO L Z, et al. Studies on bullfrog skin collagen[J]. Food Chemistry, 2004, 84(1): 65-69. DOI:10.1016/S0308-8146(03)00167-5.
[17] ZHU B, DONG X, ZHOU D, et al. Physicochemical properties and radical scavenging capacities of pepsin-solubilized collagen from sea cucumber Stichopus japonicus[J]. Food Hydrocolloids, 2012, 28(1): 182-188. DOI:10.1016/j.foodhyd.2011.12.010.
[18] AHMAD M, BENJAKUL S. Extraction and characterisation of pepsin-solubilised collagen from the skin of unicorn leatherjacket (Aluterus monocerous)[J]. Food Chemistry, 2010, 120(3): 817-824. DOI:10.1016/j.foodchem.2009.11.019.
[19] LIU D, LIANG L, REGENSTEIN J M, et al. Extraction and characterisation of pepsin-solubilised collagen from fins, scales, skins, bones and swim bladders of bighead carp (Hypophthalmichthys nobilis)[J]. Food Chemistry, 2012, 133(4): 1441-1448. DOI:10.1016/ j.foodchem.2012.02.032.
[20] 王镜岩. 生物化学[M]. 3版. 北京: 高等教育出版社, 2002: 22-87.
[21] MUYONGA J H, COLE C G B, DUODU K G. Characterisation of acid soluble collagen from skins of young and adult Nile perch (Lates niloticus)[J]. Food Chemistry, 2004, 85(1): 81-89. DOI:10.1016/ j.foodchem.2003.06.006.
[22] KIMURA S, TAKEMA Y, KUBOTA M. Octopus skin collagen. Isolation and characterization of collagen comprising two distinct alpha chains[J]. Journal of Biological Chemistry, 1981, 256(24): 13230-13234.
[23] 刘海英. 斑点叉尾鮰鱼皮胶原蛋白及胶原蛋白多肽的研究[D]. 无锡: 江南大学, 2007: 6-23.
[24] ZHANG Y, LIU W, LI G, et al. Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp (Ctenopharyngodon idella)[J]. Food Chemistry, 2007, 103(3): 906-912. DOI:10.1016/ j.foodchem.2006.09.053.
[25] ZHANG J, DUAN R, TIAN Y, et al. Characterisation of acidsoluble collagen from skin of silver carp (Hypophthalmichthys molitrix)[J]. Food Chemistry, 2009, 116(1): 318-322. DOI:10.1016/ j.foodchem.2009.02.053.
[26] BINSI P K, SHAMASUNDAR B A, DILEEP A O, et al. Rheological and functional properties of gelatin from the skin of bigeye snapper (Priacanthus hamrur) fish: Influence of gelatin on the gel-forming ability of fish mince[J]. Food Hydrocolloids, 2009, 23(1): 132-145. DOI:10.1016/j.foodhyd.2007.12.004.
[27] HSIEH T T, TIU C, SIMON G P, et al. Rheology and miscibility of thermotropic liquid crystalline polymer blends[J]. Journal of Non-Newtonian Fluid Mechanics, 1999, 86(1): 15-35. DOI:10.1016/S0377-0257(98)00200-6.
[28] REN G Y, ZHANG H Y, GUO J Y, et al. Effect of concentration and temperature on the rheological behavior of collagen from swimming bladder of grass carp[J]. Advanced Materials Research, 2012, 518: 584-588. DOI:10.4028/www.scientific.net/AMR.518-523.584.
[29] GUN’KO V M, ZARKO V I, GONCHARUK E V, et al. TSDC spectroscopy of relaxational and interfacial phenomena[J]. Advances in Colloid and Interface Science, 2007, 131(1): 1-89. DOI:10.1016/ j.cis.2006.11.001.
[30] WANG L, LIANG Q F, CHEN T T, et al. Characterization of collagen from the skin of Amur sturgeon (Acipenser schrenckii)[J]. Food Hydrocolloids, 2014, 38: 104-109. DOI:10.1016/j.foodhyd.2013.12.002.
[31] 苏玉恒, 孔繁荣. 胶原蛋白纤维结构与性能研究[J]. 河南工程学院学报(自然科学版), 2014, 26(3): 15-17.
[32] TAMILMOZHI S, VEERURAJ A, ARUMUGAM M. Isolation and characterization of acid and pepsin-solubilized collagen from the skin of sailfish (Istiophorus platypterus)[J]. Food Research International, 2013, 54(2): 1499-1505. DOI:10.1016/j.foodres.2013.10.002.
Comparative Study on Physical and Chemical Properties of Collagens Obtained by Different Extraction Methods from the Skin of the Chinese Longsnout Catfish Leiocassis longirostris
WEN Huifang1, CHEN Lili1, BAI Chunqing1, ZHAO Li1,*, YUAN Meilan1, DU Yuqian2
(1. National Research and Development Branch Center for Conventional Freshwater Fish Processing, College of Life Science, Jiangxi Science and Technology Normal University, Nanchang 330013, China; 2. Nanchang Food and Cosmetics Supervision Institution, Nanchang 330038, China)
Collagens extracted from the skin of the Chinese longsnout catfish Leiocassis longirostris by alkali, salt, hot water, acid and pepsin were comparatively evaluated for their chemical and structural properties (amino acid compositions, thermo-stability, molecular weight distribution and scanning electron microscope) and rheological characteristics. The results showed that all collagens presented similar UV spectrum with the absorption peak at 230 nm. SDS-PAGE indicated collagens extracted by acid, pepsin and water belonged to collagen I with well-preserved structure. The denaturation temperatures of collagens extracted by alkali, water, salt, acid and pepsin were 63.21, 71.70, 49.49, 29.8 and 22 ℃, respectively. The salt-extractable collagen was polypeptides as analyzed by high-performance liquid chromatography (HPLC). The water-soluble collagen from the fish skin presented the highest gel stability. Therefore, different extraction methods could result in differences in the chemical and structural properties of fish skin collagens.
Leiocassis longirostris; collagen; alkali extraction; salt extraction; hot-water extraction; physicochemical properties
10.7506/spkx1002-6630-201601014
S986.1
A
1002-6630(2016)01-0074-08
温慧芳, 陈丽丽, 白春清, 等. 基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究[J]. 食品科学, 2016, 37(1): 74-81.
DOI:10.7506/spkx1002-6630-201601014. http://www.spkx.net.cn
WEN Huifang, CHEN Lili, BAI Chunqing, et al. Comparative study on physical and chemical properties of collagens obtained by different extraction methods from the skin of the Chinese longsnout catfish Leiocassis longirostris[J]. Food Science, 2016, 37(1): 74-81. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201601014.
2015-04-20
江西省高等学校科技落地计划项目(KJLD12009);江西省现代农业产业技术体系建设专项
温慧芳(1989—),女,硕士研究生,研究方向为食品化学。E-mail:susie20102389@sina.cn
*通信作者:赵利(1967—),女,教授,博士,研究方向为食品化学。E-mail:lizhao618@hotmail.com

