“乌叶”与“兰竹”荔枝转色期果肉的差异蛋白分析
盖永红,钟灿钰,林伟彬,沈璐岑,邱智敏,宋晓敏,黄榕辉,*
“乌叶”与“兰竹”荔枝转色期果肉的差异蛋白分析
盖永红1,2,钟灿钰1,林伟彬1,沈璐岑1,邱智敏3,宋晓敏1,黄榕辉1,*
( 1.福建农林大学生命科学学院,福建 福州 350002;2.甘肃省景泰县农产品质量安全检验检测管理站,甘肃 景泰 730400;3.福建农林大学林学院,福建 福州 350002)
为探索转色期荔枝(Litchi chinensis Sonn.)品质形成过程中蛋白质的变化,应用蛋白质组学技术分析“乌叶”和“兰竹”荔枝品种转色期的差异蛋白质,共发现37 个2 倍以上的差异表达蛋白,32 个差异蛋白被成功鉴定。这些蛋白参与了糖类和能量代谢(21.9%)、抗性胁迫(9.4%)、蛋白质代谢(15.6%)、细胞结构形成(12.5%)、次级代谢(12.5%)、发育调控(12.5%)和未知功能途径(15.6%)等代谢活动。与“兰竹”荔枝相比,“乌叶”荔枝中与糖酵解途径和能量代谢相关蛋白均下调表达,说明在转色期,“乌叶”荔枝中糖类物质降解速率较慢,有利于糖分的积累,形成高糖的品质。同时,“乌叶”荔枝中与细胞结构形成和抗性相关蛋白的上调表达,这有利于“乌叶”荔枝形成果肉质地密集、耐贮藏的良好品质。>
荔枝;果肉;差异蛋白;品质
荔枝(Litchi chinensis Sonn.)属于常绿乔木,是南亚热带广泛栽培的珍贵果树之一,也是起源于我国的世界级水果,如今在印度、越南等世界各地均有栽培。荔枝果肉肉质细腻多汁,酸甜入口,其补心安神、开胃益脾、补脑益身等功效使之成为上等的滋身健体补品。荔枝果实各部分组织的累加鲜质量生长表现为典型的“S”型曲线[1-2],其中假种皮的快速膨大生长期发生在花后67~88 d(持续约21 d),即果实发育过程中的转色期[3]。此外,李开拓[4]对荔枝的相关蛋白质组学研究发现,无论是荔枝的果皮还是假种皮,在转色期检测和鉴定出的蛋白点数均最多。由以上可见,在荔枝果实发育过程中,转色期的生理代谢最为旺盛,酶活性较高,参与或调控细胞内各种代谢途径的酶的数量也居多。早期对果实转色期的研究主要集中在葡萄[5]、苹果[6]、草莓[7]等果实色泽变化规律方面,而目前对荔枝果实转色期研究,除王家保[8]、胡桂兵[9]和Thakur[10]等对荔枝果皮及坐果机制有相关报道外,还未见其他相关报道。“乌叶”和“兰竹”荔枝是福建省最主要种植的品种,果肉多汁鲜美,色泽鲜红诱人,品质优良。因此,本实验应用凝胶蛋白质组学技术,比较“乌叶”和“兰竹”两个荔枝品种转色期果肉的差异蛋白,分析其在细胞内代谢的作用功能,为揭示不同荔枝品种品质形成的分子生理机制研究提供科学依据,为生产上提高荔枝果实的商品价值提供理论参考。
1 材料与方法
1.1 材料与试剂
供试材料为高糖含量的“乌叶”荔枝和低糖含量的“兰竹”荔枝,于2014年7月采自福建省农业科学院果树研究所。选取盛花期后70 d,无病虫害,大小及外观形态一致的荔枝果实,采摘后剥去果皮,果肉置于液氮中冷冻后,保存于-80 ℃冰箱。每个实验3 次生物学重复。
pH 4~7(线性)IPG(Immobilazed pH gradient)干胶条 美国GE公司;尿素、硫脲、3-((3-胆酰胺丙基)二乙胺)-1-丙磺酸盐(3-((3-cholamidopropyl) dimethylammonio) propanesulfonate,C HAPS)、二硫苏糖醇(dithiothreitol,DTT)、碘乙酰胺(iodoacetamide,IAA)、三羟甲基氨基甲烷(Tris)、苯甲基磺酰氟(phenylmethylsulfonyl fluorid e,PMSF)、Tris-饱和酚、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、丙烯酰胺、N,N-甲叉双丙烯酰胺、考马斯亮蓝美国Amresco公司;载体两性电解质、IPG Buffer、β-巯基乙醇、四甲基乙二胺(tetramethylethylenediamine,TEMED)、聚乙二醇单辛基苯基醚(Triton X- 100)美国Sigma公司;乙腈、三氟乙酸(色谱纯) 国药集团化学试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;EttanTMIPGphorTM等电聚焦电泳仪、Ettan DALT-six双向SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gelelectrophoresis,SDS-PAGE)仪、凝胶扫描仪、图像分析系统 美国GE公司;基质辅助激光解吸电离-串联飞行时间质谱仪(matrix-assisted laser desorption ionization time-of-flight/time-of-flight mass spectrometry,MALDI-TOF/TOF-MS) 美国Applied Bio-systems公司。
1.3 方法
1.3.1 蛋白质提取及定量方法
蛋白质的提取参照Saravanan等[11]方法并稍作改进。从-80 ℃冰箱称取5 g荔枝果肉在液氮中充分研磨成粉末,加15 mL酚提取液(100 mmol/L Tris-HCl pH 8.0,50 mmol/L抗坏血酸,100 mmol/L KCl,50 mmol/L硼砂,10 mL/L Triton-100,20 mL/L β-巯基乙醇,1 mmol/L PMSF),加入等体积的pH 8.0 Tris-饱和酚,充分混匀,5 500×g、4 ℃离心10 min。取酚层,加入6 倍体积的 0.1 mol/L乙酸铵-甲醇溶液,-20 ℃过夜沉淀蛋白。15 000×g、4 ℃离心20 min,弃上清液。沉淀用预冷的甲醇溶液洗涤1 次,再用预冷的丙酮(含0.2 mL/L β-巯基乙醇)洗涤2 次。所得干粉置于-20 ℃保存。取10 mg干燥的样品粉末溶解于250 μL裂解液(7 mol/L尿素,2 mol/L硫脲,40 g/L CHAPS,20 mL/L载体两性电解质pH 4~7,40 mmol/L DTT)中,参考Bradford[12]的方法测定蛋白质浓度。将裂解好的蛋白液立即进行双向电泳。
1.3.2 双向电泳及图像扫描分析
第一向固相pH值梯度等电聚焦(isoelectric focusing,IEF)参考Wang等[13]的方法进行。胶条为24 cm、pH 4~7(线性)IPG干胶条。首先将蛋白裂解液与水化液(7 mol/L 尿素,2 mol/L 硫脲,20 g/L CHAPS,40 mmol/L DTT,5 mL/L IPG Buffer,0.1 g/L溴酚蓝)混合均匀,最终体积定为450 μL。IEF的参数设定为:20 ℃,50 μA/trip,30 V(12 h),200 V(1 h),500 V(1 h),1 000 V(1 h),1 000~8 000 V(梯度30 min),8 000 V(48 000 Vhs),1 000 V(3 h)。
IEF结束后,将胶条用新配制的平衡液Ⅰ(50 mmol/L Tris-HCl pH 8.8,6 mol/L 尿素,300 mL/L甘油,20 g/L SDS,10 g/L DTT,痕量溴酚蓝)和平衡液Ⅱ(50 mmol/L Tris-HCl pH 8.8,6 mol/L 尿素,300 mL/L甘油,20 g/L SDS,25 g/L IAA,痕量溴酚蓝)先后各平衡15 min。平衡结束后将IPG胶条转移至12%的聚丙烯酰胺凝胶上进行第二向SDS-PAGE垂直板电泳。开始电泳时先设置15 mA/gel电泳30 min,再加大电流至30 mA/gel。电泳结束后,考马斯亮蓝R-250染色。
脱色干净的凝胶用GE公司的凝胶扫描仪进行扫描,分辨率为300 dpi。再用ImageMasterTM软件(版本7.2.0,Bio-Rad)分析图像。
1.3.3 蛋白质酶解及质谱分析
蛋白质酶解参考Wang等[13]的方法。差异表达蛋白胶点分别用100 mmol/L NH4HCO3和100 μL乙腈(acetonitrile,ACN)脱色,56~60 ℃真空干燥,加入10 ng/μL Trypsin溶液和等体积的50 mmol/L NH4HCO3缓冲液,37 ℃反应12 h,加入50% ACN/0.5%三氟乙酸(trifluoroacetic acid,TFA),超声10 min后抽提酶解产物,真空干燥后用于质谱分析。
酶解产物采用4800 MALDI-TOF/TOF质谱仪进行质谱分析。采用氮/氩激光,波长为355 nm,激光强度为4 000 W/cm2,激发时间为3~7 ns,频率为200 Hz,加速电压为20 kV,正离子发射模式进行采集数据。肽指纹图谱(peptide mass fingerprinting,PMF)分子质量扫描范围为800~4 000 D,质谱图用胰蛋白酶酶解肽段进行外标校正。所得结果用GPS(Applied Biosystems, USA)-MASCOT(Matrix Science, London, UK)软件进行数据库检索。数据库检索的设置参数为:数据库为NCBInr,检索种属为绿色植物,检索的方式为combined,酶为胰蛋白酶,最大允许漏切位点为1,PMF质量误差为100 ppm,MS/MS质量误差为0.2 D。
1.4 数据分析
用ImageMasterTM软件对凝胶图像进行差异分析,以2 倍的差异表达为标准。蛋白相对量变化为两个荔枝品种的3 次生物学重复,所获得数据均以±s表示,并采用SPSS 13.0软件进行方差分析(P<0.05为显著性差异)。
2 结果与分析
2.1 “乌叶”和“兰竹”荔枝果肉蛋白的2-DE分析
采用长24 cm、pH 4~7的线性干胶条对“乌叶”和“兰竹”荔枝转色期的果肉蛋白质进行IEF-SDS-PAGE分离,应用ImageMasterTM软件对不同荔枝品种转色期果肉的电泳图谱进行分析,在“乌叶”荔枝图谱中检测到1 383 个蛋白点,在“兰竹”荔枝图谱中检测到1 485 个蛋白点,匹配率为76.8%,共发现了37 个2 倍以上的差异表达蛋白点(图1)。


图1 “乌叶”和“兰竹”荔枝转色期蛋白质双向电泳图谱Fig.1 Proteome maps of “Wuye” and “Lanzhu” litchi fruits during color-changing period
2.2 “乌叶”和“兰竹”荔枝转色期果肉差异蛋白的质谱鉴定
经MALDI-TOF/TOF-MS质谱鉴定,37 个差异表达蛋白点中有32 个蛋白点被成功鉴定(表1),鉴定成功率约为86.5%。在被成功鉴定的32 个蛋白中,有13 个蛋白在“乌叶”荔枝品种中上调表达,19 个蛋白在“兰竹”荔枝品种中上调表达(图2)。此外,在鉴定结果中,有多个蛋白点被鉴定为同一种蛋白,如spot 5和spot 9均为蛋白酶体β亚基,spot 20和spot 28均为蛋白质二硫键异构酶,表明它们可能是同一个蛋白的不同形式或者是同工酶,具有不同的翻译后修饰。鉴定出的蛋白点大部分理论分子质量与实际分子质量相近,但有少数几个蛋白点的理论分子质量与实际分子质量相差较大,如spot 11和spot 13,这可能是由于蛋白质转录后存在着蛋白质的翻译后修饰及蛋白翻译后的水解[14-15]。
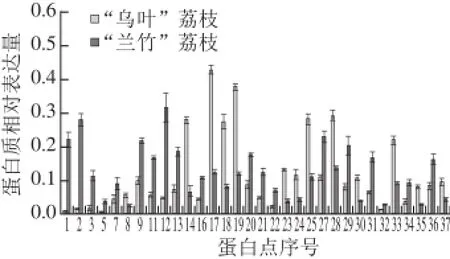
图2 “乌叶”和“兰竹”荔枝果实转色期果实差异蛋白相对表达量变化Fig.2 Relative expression of 37 differentially expressed proteins in“Wuye” and “Lanzhu” litchi fruits
2.3 “乌叶”和“兰竹”荔枝转色期果肉差异蛋白
对32 个差异蛋白的功能进行数据库检索分析后,可以将这32 个差异蛋白分成以下七大类(图3):糖类和能量代谢相关蛋白(7 个,占21.9%)、抗性与胁迫相关蛋白(3 个,占9.4%)、细胞结构形成相关蛋白(4 个,占12.5%)、蛋白质代谢相关蛋白(5 个,占15.6%)、次级代谢相关蛋白(4 个,占12.5%)、发育调控相关蛋白(4 个,占12.5%)、未知功能蛋白(5 个,占15.6%)。
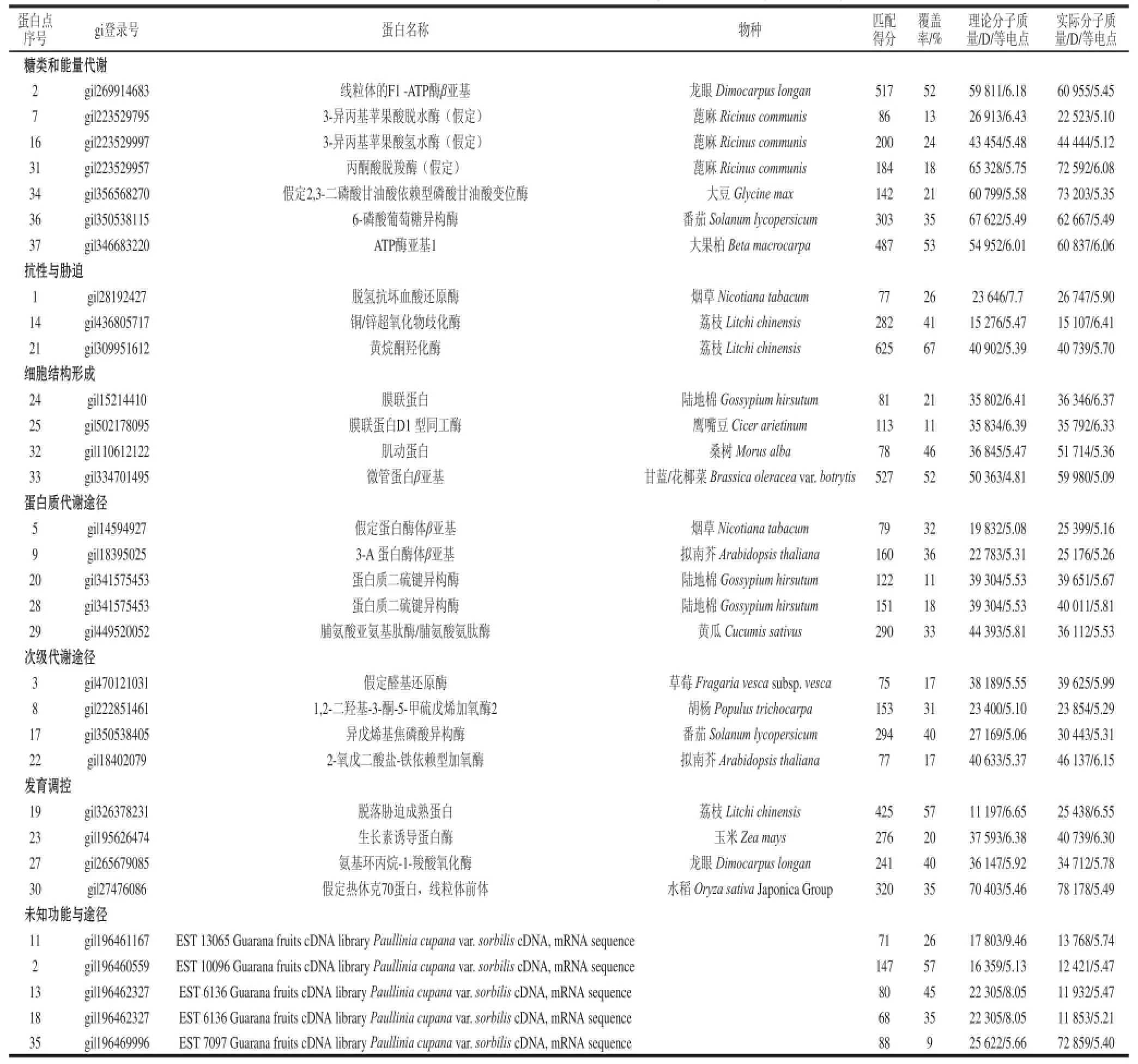
表1 “乌叶”和“兰竹”荔枝果实转色期果实差异蛋白质谱鉴定结果Table 1 Protein identification of“WWuuyyee” and “Lanzhu”litchi during color-turning period by MALDI-TOF/TOF-MS

图3 两个荔枝品种转色期果实差异蛋白功能分类饼图Fig.3 Classification chart of protein functions in two litchi cultivars during the color-changing period
3 讨 论
通过分析32 个差异蛋白发现,在糖及能量代谢相关的蛋白中,除三磷酸腺苷(adenosine triphosphate,ATP)合酶上的一个亚基外,其余与糖及能量代谢相关的蛋白在“兰竹”荔枝品种中的表达量均高于“乌叶”荔枝品种。其中,二磷酸甘油酸依赖磷酸甘油酸变位酶dPGM(spot 34)是糖酵解和糖异生过程中的一个重要酶,催化 3-磷酸甘油酸和2-磷酸甘油酸之间的相互转换[16],可调节糖酵解与其他ATP产生通路以及糖异生之间的平衡。dPGM催化反应需要2,3-二磷酸甘油酸作为辅因子,该类型酶在活性位点上具有保守组氨酸序列,以2,3-二磷酸甘油酸上的磷酸基团为供体使酶活性位点上的组氨酸形成磷酸化的酶-辅因子中间体,通过磷酸化组氨酸中间体催化磷酸基团在磷酸甘油酸和辅因子之间的转移[17-18]。dPGM 除作为糖酵解代谢系统中的一个酶分子,已有研究表明在不同生物内该酶的催化机理及行使功能有很大的不同[19-20],这或许反映出dPGM在细胞中除糖酵解代谢外还发挥着其他一些功能作用。6-磷酸葡萄糖异构酶PGI(spot 36)是调控糖酵解代谢过程中的第二步酶,在PGI的作用下,6-磷酸-a-D-葡萄糖被异构化。“兰竹”荔枝中dPGM(spot 34)和PGI(spot 36)的表达量均高于“乌叶”荔枝,这说明“兰竹”荔枝中的与糖酵解有关的酶含量高,葡萄糖及其他糖类物质代谢活跃,降解效率高。这与“兰竹”荔枝糖含量较低,而“乌叶”荔枝糖含量较高有一定关联。另外,丙酮酸脱羧酶(spot 31)是一种依赖于焦磷酸硫胺素(thiamine pyrophosphate,TPP)的非氧化性胞内酶。在TPP及Mg2+的辅助下,丙酮酸脱羧酶可以催化α-酮基羧酸脱羧,进而与醛类物质发生缩合反应[21]。同时,它还是乙醇发酵过程中的关键酶,既能以单一亚基在生物体内行使功能,也可以相同亚基的多聚体形式行使生物功能[22]。“兰竹”荔枝中丙酮酸脱羧酶的表达水平相对于“乌叶”荔枝上升,这暗示“兰竹”荔枝中以丙酮酸为底物的代谢反应活跃,促进糖酵解代谢中将葡萄糖分解成两分子丙酮酸,同时释放出ATP和还原型辅酶Ⅰ(β-nicotinamide-adenine dinucleotide reduced form,NADH)为细胞提供能量这一过程,这也说明“兰竹”荔枝中的糖类物质降解速率高于“乌叶”荔枝,因此“兰竹”荔枝糖含量较低,而“乌叶”荔枝糖含量较高。这些结果正好说明了“乌叶”荔枝和“兰竹”荔枝的在糖分含量上的不同。
膜联蛋白是一类钙依赖的磷脂结合蛋白超家族,分布于各种组织中,在细胞中与膜转运及膜表面依赖于钙调蛋白的活动密切相关[23]。已有大量研究证明,植物中的膜联蛋白参与膜结构的构建、细胞壁的形成以及信号转导等过程[24-25]。此外,膜联蛋白还具有过氧化物酶活性,与逆境胁迫响应的调控过程密切相关,已有研究发现在拟南芥[26]、耐寒小麦[27]、水稻[28]和芥菜[29]等植物中膜联蛋白参与生物和非生物胁迫过程。在“乌叶”荔枝中,膜联蛋白(spot 24和25)和微管蛋白β亚基(spot 33)的表达量高于“兰竹”荔枝的2~3 倍,表明“乌叶”荔枝中参与细胞骨架、细胞壁与细胞膜形成的相关蛋白酶活性高,代谢旺盛,果肉的质地较致密,这与林艺芬等[30]研究发现的“乌叶”荔枝果肉的质地相对较硬,采后果实衰老较慢,耐贮性较好,货架寿命较长的结论相一致。植物受到逆境胁迫时,体内的过氧化氢会大量积累,此时需要过氧化氢酶等物质以消除生物体内的过氧化氢、酚类和胺类等毒性物质。在“乌叶”荔枝品种中在细胞内起过氧化物酶活性作用的膜联蛋白(spot 24和25)的表达量显著高于“兰竹”荔枝,这说明“乌叶”荔枝的抗性或对逆境环境的胁迫反应能力可能强于“兰竹”荔枝。另外,热休克蛋白70(spot 30)在“乌叶”荔枝中的表达量高于“兰竹”荔枝2~3 倍,而且热休克蛋白70可参与逆境胁迫下错误折叠蛋白的修复或加速蛋白降解,使细胞保持稳态,防止细胞受损害[31],这也说明“乌叶”荔枝响应胁迫的能力优于“兰竹”品种,这正好验证了前人关于“乌叶”品种的抗性强于“兰竹”品种的论点[30]。总的来说,这些结果证实了“乌叶”荔枝果肉致密,耐贮藏,而“兰竹”荔枝果肉质地较软,贮存性较差。本结果与“乌叶”和“兰竹”这两个品种的实际情况是相一致的。
综上所述,与“兰竹”荔枝相比,在转色期,“乌叶”荔枝中与细胞结构形成和抗性调控相关蛋白(酶)的上调表达,糖酵解途径和能量代谢相关酶的下调表达是形成高糖、质地密集、耐贮存荔枝品种的重要生理代谢机制。
[1] PAULL R E, CHEN N J, DEPUTY J, et al. Litchi growth and compositional changes during fruit development[J]. Journal of the American Society for Horticultural Science, 1984, 109(6): 817-821.
[2] 谢龙莲. 印度荔枝果实生长发育研究[J]. 世界热带农业信息, 2007(5): 31-32.
[3] 李建国. 荔枝学[M]. 北京: 中国农业出版社, 2008: 222-223.
[4] 李开拓. 荔枝果实成熟过程中的差异蛋白质组学研究[D]. 福州: 福建农林大学, 2011.
[5] KATAOKA I, KUBO Y, SUGIURA A, et al. Changes in L-phenylalanine ammonia-lyase activity and anthocyanin synthesis during berry ripening of 3 grape cultivars[J]. Journal of the Japanese Society for Horticultural Science, 1983, 52(3): 273-279. DOI:10.2503/ jjshs.52.273.
[6] KUBO Y, TAIRA S, ISHIO S, et al. Color development of 4 apple cultivars grown in the southwest of Japan, with special reference to fruit bagging[J]. Journal of the Japanese Society for Horticultural Science, 1988, 57(2): 191-199. DOI:10.2503/jjshs.57.191.
[7] GIVEN N K, VENIS M A, GRIERSON D. Phenylalanine ammonialyase activity and anthocyanin synthesis in ripening strawberry fruit[J]. Journal of Plant Physiology, 1988, 133(1): 25-30. DOI:10.1016/ S0176-1617(88)80079-8.
[8] 王家保, 刘志媛, 杜中军, 等. 荔枝果实发育过程中果皮颜色形成的相关分析[J]. 热带作物学报, 2006, 27(2): 11-17. DOI:10.3969/ j.issn.1000-2561.2006.02.003
[9] 胡桂兵, 陈大成, 李平, 等. 荔枝果皮色素, 酚类物质与酶活性的动态变化[J]. 果树科学, 2000, 17(1): 35-40. DOI:10.3969/ j.issn.1009-9980.2000.01.008.
[10] THAKUR S, KUMAR R, BRAHMACHARI V S, et al. Effect of different growth regulators on fruit-set, retention and size of litchi[J]. Indian Journal of Horticulture, 1990, 47(3): 305-308.
[11] SARAVANAN R S, ROSE J K C. A critical evaluation of sample extraction techniques for enhanced proteomic analysis of recalcitrantplant tissues[J]. Proteomics, 2004, 4(9): 2522-2532. DOI:10.1002/ pmic.200300789.
[12] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254. DOI:10.1006/abio.1976.9999.
[13] WANG L X, LIU X, LIANG M, et al. Proteomic Analysis of saltresponsive proteins in the leaves of mangrove Kandelia candel during short-term stress[J]. PLoS ONE, 2014, 9(1): e83141. DOI:10.1371/ journal.pone.0083141.
[14] WAN J, TORRES M, GANAPATHY A, et al. Proteomic analysis of soybean root hairs after infection by Bradyrhizobium japonicum[J]. Molecular Plant-Microbe Interactions, 2005, 18(5): 458-467. DOI:10.1073/pnas.93.20.11074.
[15] JIANG Y Q, YANG B, HARRIS N S, et al. Comparative proteomic analysis of NaCl stress-responsive proteins in Arabidopsis roots[J]. Journal of Experimental Botany, 2007, 58(13): 3591-3607. DOI:10.1093/jxb/erm207.
[16] 宋林霞, 徐振彪. 磷酸甘油酸变位酶[J]. 生命的化学, 2011, 31(1): 86-89.
[17] CAMPBELL J W, WATSON H C, HODGSON G I. Structure of yeast phosphoglycerate mutase[J]. Nature, 1974, 250: 301-303. DOI:10.1038/250301a0.
[18] JEDRZEJAS M J, CHANDER M, SETLOS P, et al. Structure and mechanism of action of a novel phosphoglycerate mutase from Bacillus stearothermophilus[J]. The EMBO Journal, 2000, 19(7): 1419-1431. DOI:10.1093/emboj/19.7.1419.
[19] GIEGE P, HEAZLEWOOD J L, ROESSNER-TUNALI U, et al. Enzymes of glycolysis are functionally associated with the mitochondrion in Arabidopsis cells[J]. The Plant Cell, 2003, 15(9): 2140-2151. DOI:10.1105/tpc.012500.
[20] TAKEDA K, KOMURO Y, HAYAKAWA T, et al. Mitochondrial phosphoglycerate mutase 5 uses alternate catalytic activity as a protein serine/threonine phosphatase to activate ASK1[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(30): 12301-12305. DOI:10.1073/pnas.0901823106.
[21] BRUHN H, POHL M, GROTZINGER J, et al. The replacement of Trp392 by alanine influences the decarboxylase/carboligase activity and stability of pyruvate decarboxylase from Zymomonas mobilis[J]. European Journal of Biochemistry, 1995, 234(2): 650-655. DOI:10.1111/j.1432-1033.1995.650_b.x.
[22] PEI X Y, ERIXON K M, LUISI B F, et al. Structural insights into the prereaction state of pyruvate decarboxylase from Zymomonas mobilis[J]. Biochemistry, 2010, 49(8): 1727-1736. DOI:10.1021/ bi901864j.
[23] 郭敦明, 谈文峰, 王芳. 膜联蛋白I的结构和生物学功能[J].医学综述, 2009, 15(12): 1771-1773. DOI:10.3969/ j.issn.1006-2084.2009.12.005.
[24] CLARK G B, MORGAN R O, FERNANDEZ M P, et al. Evolutionary adaptation of plant annexins has diversified their molecular structures, interactions and functional roles[J]. New Phytologist, 2012, 196(3): 695-712. DOI:10.1111/j.1469-8137.2012.04308.x.
[25] LEE S, LEE E J, YANG E J, et al. Proteomic identification of annexins, calcium-dependent membrane binding proteins that mediate osmotic stress and abscisic acid signal transduction in Arabidopsis[J]. The Plant Cell, 2004, 16(6): 1378-1391. DOI:10.1105/tpc.021683.
[26] KUSH A, SABAPATHY K. Oxy5, a novel protein from Arabidopsis thaliana, protects mammalian cells from oxidative stress[J]. The International Journal of Biochemistry & Cell Biology, 2001, 33(6): 591-602. DOI:10.1016/S1357-2725(01)00040-1.
[27] BRETON G, VAZQUEZ-TELLO A, DANYLUK J, et al. Two novel intrinsic annexins accumulate in wheat membranes in response to low temperature[J]. Plant and Cell Physiology, 2000, 41(2): 177-184. DOI:10.1093/pcp/41.2.177.
[28] GORANTLA M, BABU P R, REDDY LACHAGARI V B, et al. Functional genomics of drought stress response in rice: transcript mapping of annotated unigenes of an indica rice (Oryza sativa L. cv. Nagina 22)[J]. Current Science, 2005, 89(3): 496-514.
[29] JAMI S K, DALAL A, DIVYA K, et al. Molecular cloning and characterization of five annexin genes from Indian mustard (Brassica juncea L. Czern and Coss)[J]. Plant Physiology and Biochemistry, 2009, 47(11/12): 977-990. DOI:10.1016/j.plaphy.2009.08.005.
[30] 林艺芬, 刘木水, 林河通, 等. “乌叶”与“兰竹”荔枝果实的耐贮性比较[J]. 热带作物学报, 2009, 30(10): 1537-1542. DOI:10.3969/ j.issn.1000-2561.2009.10.028.
[31] 蒲力群, 王逢会, 霍满鹏. 热休克蛋白的研究进展[J]. 延安大学学报(自然科学版), 2008, 27(1): 72-75. DOI:10.3969/j.issn.1004-602X.2008.01.024.
Analysis of Differentially Expressed Proteins in Litchi Aril between the Cultivars “Wuye” and “Lanzhu” during the Color-Changing Period
GE Yonghong1,2, ZHONG Canyu1, LIN Weibin1, SHEN Lucen1, QIU Zhimin3, SONG Xiaomin1, HUANG Ronghui1,*
(1. College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 2. Jingtai Testing Station of Quality and Safety of Agricultural Products, Jingtai 730400, China; 3. College of Forestry, Fujian Agriculture and Forestry University, Fuzhou 350002, China)
The objective of this work was to investigate changes in proteins during the color-changing period of litchi aril (Litchi chinensis Sonn.) on the process of quality formation. The comparison of the protein patterns of the li tchi cultivars“Wuye” and “Lanzhu” using gel-based proteomics technique showed that 37 protein spots were more than 2 times differentially expressed in both cultivars, of which 32 were successfully identifi ed by MALDI-TOF/TOF-MS. The identifi ed proteins were divided into categories related to carbohydrate and energy metabolism (21.9%), stres s resistance (9.4%), protein metabolism (15.6%), cell structure formation (12.5%), secondary metabolism (12.5%), developmental regulation (12.5%), and unknown function (15.6%). Compared to the “Lanzhu” cultivar, the proteins related to glycolytic pathway and energy metabolism were decreased in “Wuye” litchi fruits, implying that slow sugar degradation in the litchi cultivar “Wuye”was benefi cial to the accumulation of sugar and formation of high sugar quality. Besides, the increase of proteins associated with cell structure formation and stress resistance contributed to form the quality of dense texture and good shelf stablility in the litchi cultivar “Wuye” when compared to “Lanzhu”. Our fi ndings provide a scientifi c basis for improving the quality of litchi fruits.
Litchi chinensis Sonn.; aril; differentially expressed proteins; qual ity
10.7506/spkx1002-6630-201601015
S567.1
A
1002-6630(2016)01-0082-06
盖永红, 钟灿钰, 林伟彬, 等. “乌叶”与“兰竹”荔枝转色期果肉的差异蛋白分析[J]. 食品科学, 2016, 37(1): 82-87.
DOI:10.7506/spkx1002-6630-201601015. http://www.spkx.net.cn
GE Yonghong, ZHONG Canyu, LIN Weibin, et al. Analysis of differentially expressed proteins in litchi aril between the cultivars“Wuye” and “Lanzhu” during the color-changing period[J]. Food Science, 2016, 37(1): 82-87. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201601015. http://www.spkx.net.cn
2015-01-26
福建省自然科学基金项目(2012J01078;2013J01076)
盖永红(1984—),女,硕士研究生,主要从事农产品质量与安全研究。E-mail:gaihongnihao@126.com
*通信作者:黄榕辉(1963—),男,副教授,学士,主要从事植物学研究。E-mail:fafuhrh@126.com

