液体发酵竹红菌素的提取与表征
邵 颖,陈安徽,*,陈小洁,张传丽,胡 飞
液体发酵竹红菌素的提取与表征
邵 颖1,2,陈安徽1,2,*,陈小洁1,张传丽1,2,胡 飞3
(1.徐州工程学院食品(生物)工程学院,江苏 徐州 221008;2.江苏省食品资源开发与质量安全重点实验室,江苏 徐州 221008;3.安徽省微生物防治重点实验室,安徽 合肥 230036)
利用竹黄无性型菌株ZH-5-1进行液体深层发酵制备竹红菌素,利用正交试验设计优化了提取工艺,并使用萃取及硅胶柱色谱技术进行了分离纯化。结果表明,以丙酮为提取溶剂、料液比为1∶30(m/V)、于30 ℃温度条件下超声浸提30 min时,菌株ZH-5-1液体深层发酵菌丝体中竹红菌素的提取率最高达4.83 mg/g;竹红菌素提取液经萃取分离获得紫红色结晶,该晶体经过薄层层析法及高效液相色谱法分析确定为纯品,质谱分析后发现其分子式为C30H26O10,确定为竹红菌甲素,经统计分析发现其纯度达到98.20%。
液体发酵;竹红菌素;提取;分离;纯化
竹红菌素属苝醌类色素,是药用真菌竹黄菌、竹小肉座菌重要的有效活性成分,也是竹黄子座的红色色素成分,是多种苝醌类衍生物的混合物,包括竹红菌甲素、乙素、丙素、丁素[1]。最初的研究发现,竹红菌素对多种皮肤病具有良好的光敏治疗效果[2-4],因此其作为皮肤病外用药物在临床上得到了广泛应用;随着研究的不断深入,人们发现了竹红菌素抗炎、镇痛及优良的光敏抗肿瘤、抗病毒等多种生物学活性[5-6];进一步研究发现,竹红菌素对多种恶性肿瘤细胞以及人类免疫缺陷病毒(human immunodeficiency virus,HIV)等也具有很好的光敏抑制效果。光动力疗法(potodynamic therapy)是一种正在研究开发的肿瘤新疗法,而竹红菌素显著的光敏抗肿瘤活性使其极有可能成为新一代抗肿瘤光疗药物而服务于人类健康[7-8]。目前对竹红菌素抗肿瘤活性的研究已见多篇文献报道[9-17]。
目前,研究者们对于竹红菌素的相关生物学活性已进行了系统研究。竹红菌素主要来源于竹黄子座,但由于自然竹黄资源的有限性,许多学者将目光投向了竹黄无性型菌株的发酵菌丝体。梁晓辉等[18]对竹黄子座和竹黄液体发酵菌丝体中的成分进行了比较分析,发现竹红菌素在两种原料中的含量接近,竹黄液体发酵菌丝体可以代替竹黄子座成为竹红菌素来源。杜文[19]、杨珠英[20]等利用现代生物技术手段提高了竹黄无性型菌株液体发酵菌丝体中竹红菌素的含量;胡飞[21]、韩钱松[22]、吕腾飞[23]等通过优化竹黄无性型菌株的人工发酵工艺提高了发酵菌丝体中竹红菌素的含量,研究结果发现菌丝体中竹红菌素含量有一定提高;吕腾飞等[24]研究了竹黄菌固态发酵产竹红菌素过程中,培养基组成和培养条件对色素产量的影响。结果表明,在最佳的培养基及培养条件优化后竹红菌素产量达1.66%。目前,竹黄无性型菌株菌丝体中竹红菌素的高产工艺得到了系统研究,对竹红菌素的研究尚有多篇文献报道,但未见对竹黄无性型液体发酵,并对竹红菌素提取和纯化的系统综合研究报道。本实验通过对竹黄无性型菌株进行液体发酵,并对获得的发酵菌丝体中的竹红菌素进行提取及分离纯化的工艺进行研究,以期为竹红菌素的提取及开发应用提供参考。
1 材料与方法
1.1 菌株与培养基
菌株来源:竹黄无性型菌株ZH-5-1分离自安徽宣城地区的竹黄(Shiraia bambusicola Henn.)子实体,保存于安徽省微生物防治重点实验室。
固体培养基:葡萄糖40 g/L、蛋白胨10 g/L、酵母浸出粉10 g/L、琼脂20 g/L,蒸馏水定容。
发酵培养基:葡萄糖30 g/L、蛋白胨5 g/L、NaNO310 g/L、KCl 1.5 g/L、MgSO41.5 g/L、KH2PO42 g/L,pH 6.0。
1.2 试剂与仪器
丙酮(分析纯) 天津市福晨化学试剂厂;甲醇(分析纯) 徐州星光化工厂;甲醇(色谱纯) 江苏恒安试剂公司;柱层析硅胶 中国医药集团上海化学试剂公司;GF254高效薄层硅胶板 青岛海洋化工厂。
SGQ-100发酵设备 常州市三高生物技术工程设备有限公司;冷冻干燥系统(批号040520111G) 美国Labconco公司;SENCO R-502B旋转蒸发器 上海申胜生物技术公司;高效液相色谱仪 美国Agilent公司;分析柱Synergi Hydro-RP18(4.6 mm×250 mm,4 μm)美国Waters公司;LRH-250-G光照培养箱 广东省医疗器械厂;Spectra Max M2全波长扫描酶标仪 美国Molecular Device公司。
1.3 方法
1.3.1 竹红菌素含量的测定
参照胡飞等[21]的方法进行。
1.3.2 竹黄无性型菌株的发酵及菌丝体的获得
参照邵颖等[25]的方法进行。
1.3.3 发酵菌丝体中竹红菌素的提取
1.3.3.1 提取剂的选择
准确称取0.05 g菌丝冻干粉11 份,各分别加入甲醇、无水乙醇、丁醇、正丁醇、丙酮、正己烷、石油醚、乙酸乙酯、二氯甲烷、三氯甲烷和水各1 mL,室温(28 ℃)条件下超声浸提40 min后于10 000 r/min离心5 min去除沉淀,采用全波长扫描酶标仪于465 nm波长处测定竹红菌素含量。
1.3.3.2 提取温度的确定
准确称取0.05 g菌丝冻干粉6 份,各加入1 mL丙酮,分别于4、10、20、30、40 ℃和50 ℃条件下超声浸提40 min后于10 000 r/min离心5 min去除沉淀,采用全波长扫描酶标仪于465 nm波长处测定竹红菌素含量。
1.3.3.3 提取时间的确定
准确称取0.05 g菌丝冻干粉7 份,各加入1 mL 丙酮,于40 ℃条件下,分别超声浸提10、20、30、40、50、60、70、80 min后离心去除沉淀,采用全波长扫描酶标仪于465 nm波长处测定竹红菌素含量。
1.3.3.4 料液比的确定
准确称取等量菌丝冻干粉6 份,分别按料液比1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(m/V)加入丙酮,于40 ℃条件下超声浸提60 min后离心去除沉淀,采用全波长扫描酶标仪于465 nm波长处测定竹红菌素含量。
1.3.3.5 正交试验优化提取条件
在各单因素提取条件的基础上,深入探讨各成分参数交互影响,选取破壁方法、提取温度、提取时间、料液比4 个因素,设计了四因素三水平正交试验。
1.3.4 竹红菌素的分离
1.3.4.1 竹红菌素提取物的萃取
竹红菌素粗提物经减压浓缩干燥后,用氯仿溶解,再用氯仿-水(2∶1,V/V)的溶剂进行反复萃取获得竹红菌素粗提物,将提取物、粗提物及竹红菌素标准品在相同条件下进行薄层层析,观察萃取效果。
1.3.4.2 竹红菌素粗提物的硅胶柱色谱分离
将萃取后的竹红菌素粗提物浓缩至干,得到深棕色浸膏100 mg,与硅胶(H60)拌样上柱(H=30 cm、R=5 cm),硅胶柱床采用湿法装柱。采用二氯甲烷-甲醇洗脱系统进行梯度洗脱,每个梯度的洗脱体积约为400 mL,仅收集红色洗脱液,约每50 mL洗脱液收集一瓶,共收集红色洗脱液8 瓶。将收集到的洗脱液浓缩挥发有机溶剂后进行薄层层析,用氯仿-甲醇-水(35∶2∶1,V/V)的溶剂展开,并于365 nm波长处观察荧光猝灭点,将含有相似成分的洗脱液合并收集,并对其进行编号。浓缩后重复上述步骤重新上柱进行硅胶柱色谱分离,经3 次硅胶柱分离后,洗脱液35 ℃减压浓缩至5 mL置于试管中长时间静置,试管壁上有紫红色结晶贴壁析出。收集紫红色结晶物进行纯度及结构检测。
1.3.5 纯度鉴定
1.3.5.1 薄层层析鉴定
将经过提取分离后得到的紫红色结晶溶于适量丙酮,点样于薄层层析板,分别于3 种不同的展开剂(三氯甲烷-甲醇(70∶1,V/V)、二氯甲烷-甲醇(9∶1,V/V)、三氯甲烷-甲醇-水(35∶2∶1,V/V))中展开,于可见光下观察展开斑点,并于365 nm波长处观察荧光猝灭点,以鉴定物质的纯度。
1.3.5.2 高效液相色谱法(high performance liquid chromatography,HPLC)鉴定
将分离到的紫红色结晶溶于适当溶剂中进行HPLC分析,并在相同色谱条件下进样竹红菌素标准品,根据色谱峰鉴定物质的纯度。色谱条件为:标准品进样量为10 μL,样品进样量为20 μL;分析检测色谱柱为分析型(3.9 mm×150 mm,5 μm),Atlantis柱;流动相:甲醇-双蒸水(65∶35,V/V);检测波长为300 nm;流速为0.5~1.0 mL/min。
1.3.6 纯化合物的质谱分析
取1 mg样品溶于1 mL色谱纯甲醇中,分别采用电喷雾电离(electrospray ionization,ESI)离子化法测试质谱图,确定分子质量及主要碎片的质荷比;HPLC条件:流动相为甲醇,进行梯度洗脱;MS条件:阳离子模式:毛细管电压为4 000 V,加热气的温度为300 ℃,气体流速为10 L/min,喷嘴压力为30 psi;二极管阵列检测器(diode array detector,DAD)条件:全波长扫描。
1.4 统计学分析
采用DPS7.05版软件对实验结果进行统计分析,所有数据均采用±s表示。
2 结果与分析
2.1 竹红菌素的提取
2.1.1 提取剂的选择
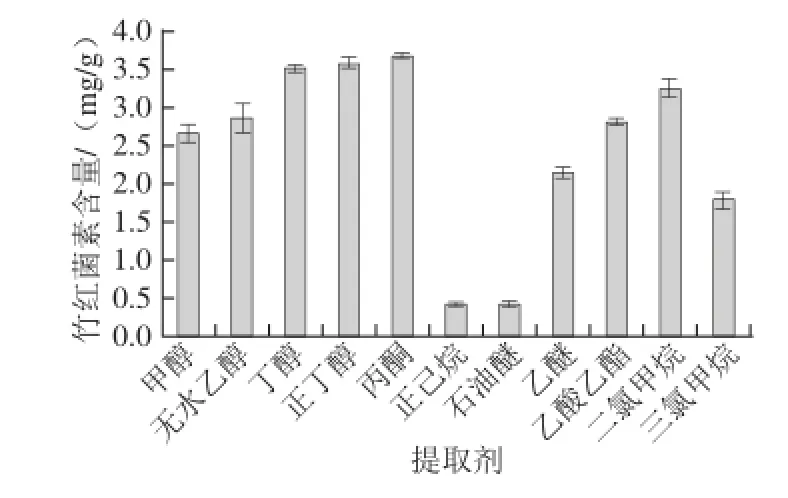
图1 不同提取剂对竹红菌素含量的影响Fig.1 Effect of extraction solvent type on the yield of hypocrellin
由图1可知,竹红菌素在丙酮和正丁醇作提取剂时,提取的竹红菌素含量最高,分别高达3.680 mg/g和3.593 mg/g。但考虑到正丁醇沸点较高,会给后续竹红菌素的制备工作带来困难,故选择丙酮作为最佳提取剂。
2.1.2 提取温度的选择
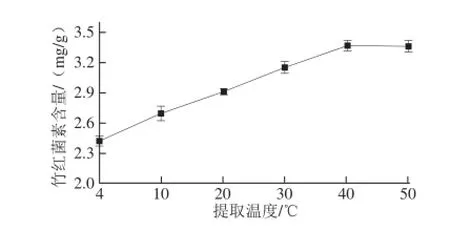
图2 不同提取温度对竹红菌素含量的影响Fig.2 Effect of extraction temperature on the yield of hypocrellin
由图2可知,随着提取温度的升高,提取液中竹红菌素的含量随之增加,但当温度达到40 ℃以后基本不再发生变化。考虑到竹红菌素提取液丙酮的沸点较低,故初步选择提取温度为40 ℃。
2.1.3 提取时间的确定
以丙酮为提取溶剂,在40 ℃温度条件下考察了提取时间对竹红菌素提取效果的影响,结果如图3所示。提取液中竹红菌素的含量随着提取时间的延长而增加,但在60 min以后含量基本不再增加,甚至出现降低的趋势,因此确定提取时间为60 min。

图3 不同提取时间对竹红菌素含量的影响Fig.3 Effect of extraction time on the yield of hypocrellin
2.1.4 料液比的确定
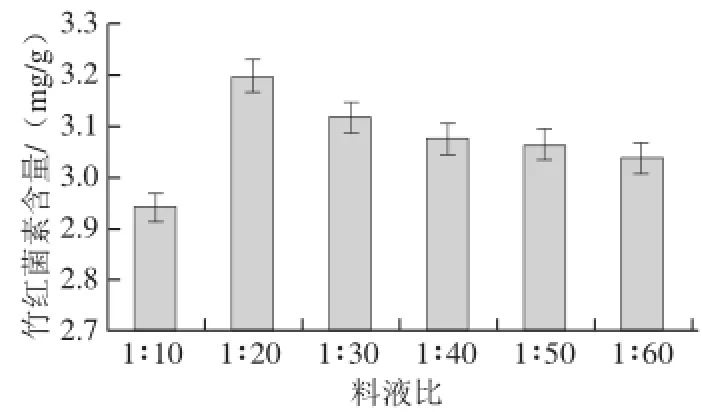
图4 不同提取料液比对竹红菌素含量的影响Fig.4 Effect of solid to solvent ratio on the yield of hypocrellin
由图4可知,当料液比达到1∶20时,竹红菌素的提取效果显著,故最佳料液比选择为1∶20。
2.1.5 最佳提取工艺的正交试验结果
在单因素提取条件筛选的基础上,为了综合考察各因素间的交互影响,以竹红菌素含量为指标,以破壁方法、提取温度、提取时间、料液比等为因素进行正交试验,结果见表1。
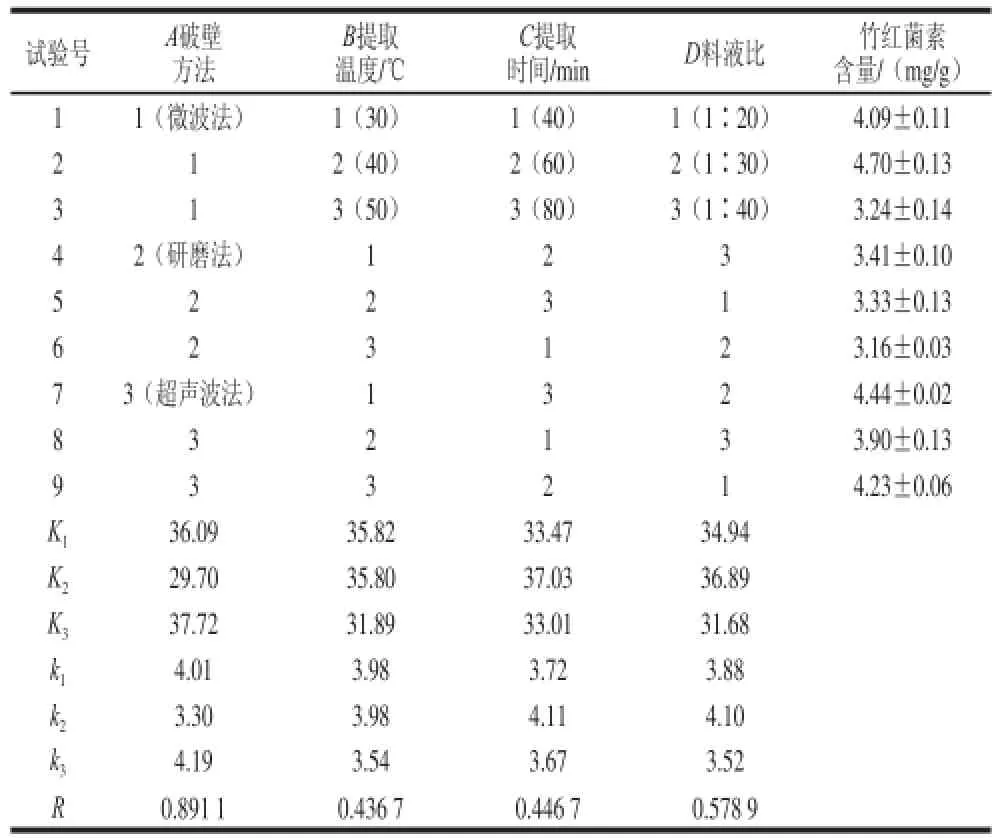
表1 以竹红菌素产量为指标的正交试验方案及结果Table 1 Orthogonal array design with experimental results for hypocrellin production
由表1可知,A因素的极差最大,其次是D、C、B。故各因素对竹红菌素提取效果的影响主次顺序为A>D>C>B。为了进一步考察各因子对指标的影响,进行了随机区组模型方差分析,方差分析结果见表2。
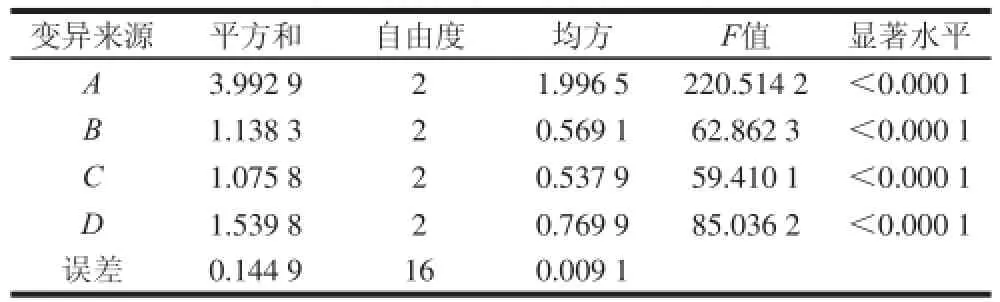
表2 竹红菌素含量方差分析结果Table 2 Analysis of variance for hypocrellin production
由表2可知,4 个因素在95%的置信度下对竹红菌素的提取效果均产生显著影响。因此,竹黄无性型菌株菌丝中竹红菌素最佳提取条件为A3B1C2D2,即选择超声波破壁方式、提取温度30 ℃、提取时间30 min、料液比1∶30,在此最佳条件下,菌丝体中竹红菌素提取率达到4.83 mg/g。
2.2 竹红菌素的分离
2.2.1 竹红菌素提取物的萃取
菌丝体经丙酮提取后获得竹红菌素提取物,提取物中含有的大量水溶性杂质将会影响竹红菌素的分离效果。鉴于竹红菌素为脂溶性苝醌类物质,故选择氯仿-水(2∶1)的溶剂对提取物进行反复萃取。提取物经萃取后的样品作为竹红菌素粗提物进行硅胶柱色谱分离。将竹红菌素提取物和竹红菌素粗提物在展开剂(氯仿-甲醇-水(35∶2∶1,V/V))中展开,并在可见光及365 nm波长处观察样品的展开斑点,薄层层析图谱如图5所示。
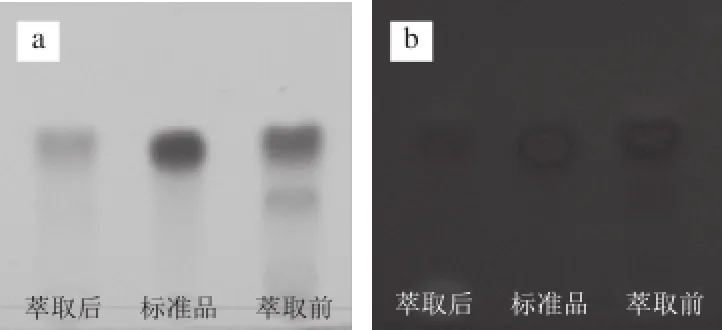
图5 竹红菌素粗样在可见光(a)和365 nm波长处(b)的薄层层析Fig.5 Thin layer chromatograph of the crude hypocrellin sample
由图5可知,竹红菌素提取物在萃取后进行薄层展开显现的斑点数量明显少于萃取前,且萃取后的样品展开后主要斑点的Rf值与竹红菌素标准品的Rf值基本保持一致,说明通过反复萃取可以有效去除竹红菌素提取物中的杂质。
2.2.2 竹红菌素粗提物的硅胶柱层析分离
薄层层析分析检测发现1#和2#瓶洗脱液展开后在365 nm处无荧光斑点;3#~8#瓶收集到的洗脱液点样展开后在365 nm处有砖红色荧光出现,荧光斑点Rf值为0.52,与竹红菌素标准品的Rf值相当。将3#~8#瓶洗脱液合并浓缩后静置,瓶壁上出现紫红色结晶。再连续进行3 次硅胶柱层析,收集贴壁紫红色结晶。根据薄层展开结果及样品迁移率初步判断红色结晶为竹红菌素。
2.3 纯度鉴定
2.3.1 薄层层析鉴定
薄层层析图谱如图6所示,经过硅胶柱层析分离得到的紫红色结晶物质在3 种不同展开剂中展开,在365 nm波长处观察只有单一斑点,而且可见光下也仅呈现一个斑点,初步判断该紫红色结晶为纯化合物。

图6 紫红色结晶物的薄层层析图谱Fig.6 TLC assay of purple-red crystals
2.3.2 HPLC鉴定
将竹红菌素标准品和分离到的紫红色结晶物质分别用适量甲醇溶解后配制成0.2 mg/mL的溶液进行反相HPLC分析。标准品进样量为10 μL,样品进样量为20 μL;分析检测HPLC色谱图如图7所示。图7A中,竹红菌素标准品的HPLC图谱中出现2 个吸收峰,前峰为竹红菌甲素,后峰为竹红菌乙素。由图7B中的HPLC分析图谱可以看出,紫红色结晶物质进样后也得到2 个强吸收峰,且两个峰的出峰保留时间基本与竹红菌素标准品相似,无其他吸收峰出现,说明经硅胶柱色谱分离得到的紫红色结晶为竹红菌素,且该物质为纯化合物。
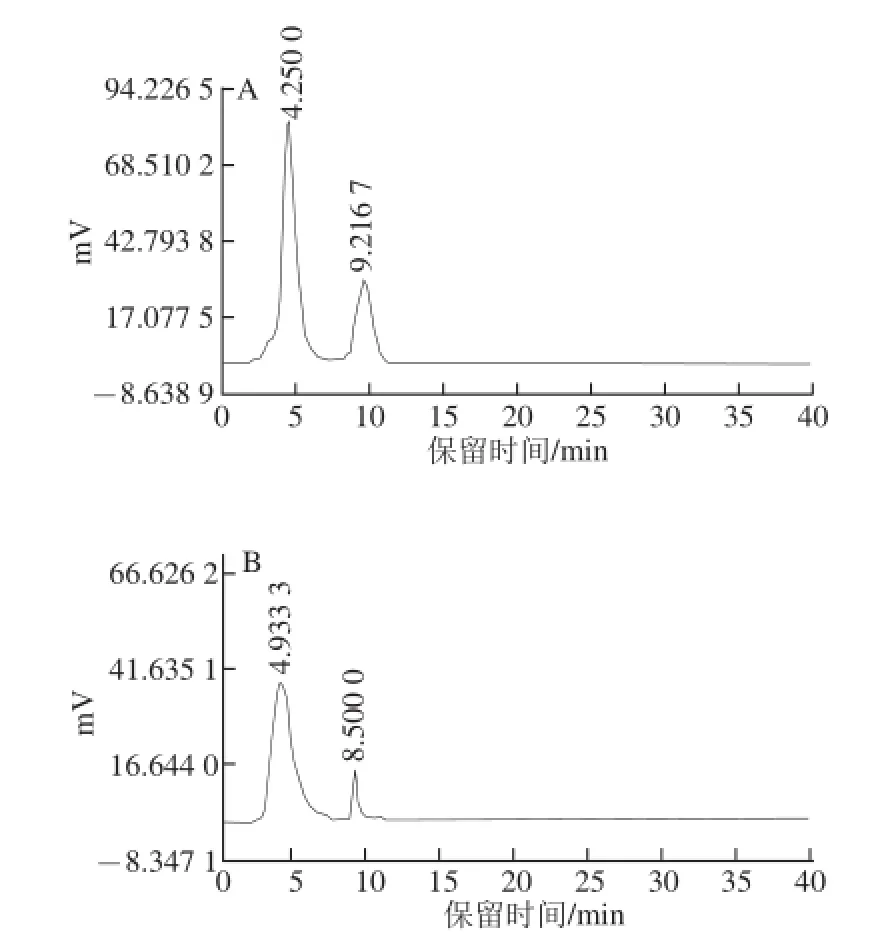
图7 竹红菌素标准品(A)和紫红色结晶(B)的HPLC图谱Fig.7 HPLC of hypocrellin (A) and purple-red crystal (B)
2.4 质谱分析
为了进一步验证分离得到的紫红色结晶物质,将紫红色结晶溶于适量甲醇后按照1.3.6节的方法进行质谱分析,分析图谱如图8所示。从MS阴离子图中可看到只有一个峰,杂质峰信号很弱;离子图的后段有一不规则峰,从分析经验,该不规则峰应为溶剂杂质,而不是样品中的杂质。从液相色谱来看,在全波长扫描的条件下,仅有一个主峰,同时样品中只有一个在465 nm波长处有明显吸收峰的化合物,因此可确定该化合物是一纯品。从MS阴离子图谱中化合物阴离子m/z为545.145 3,得出对应的分子式是C30H25O10,由于其对应的峰是M—H峰,所以该化合物的准确分子式为C30H26O10,与竹红菌甲素的分子式完全一致。通过液相色谱峰面积计算,可知竹红甲素的纯度为98.20%。
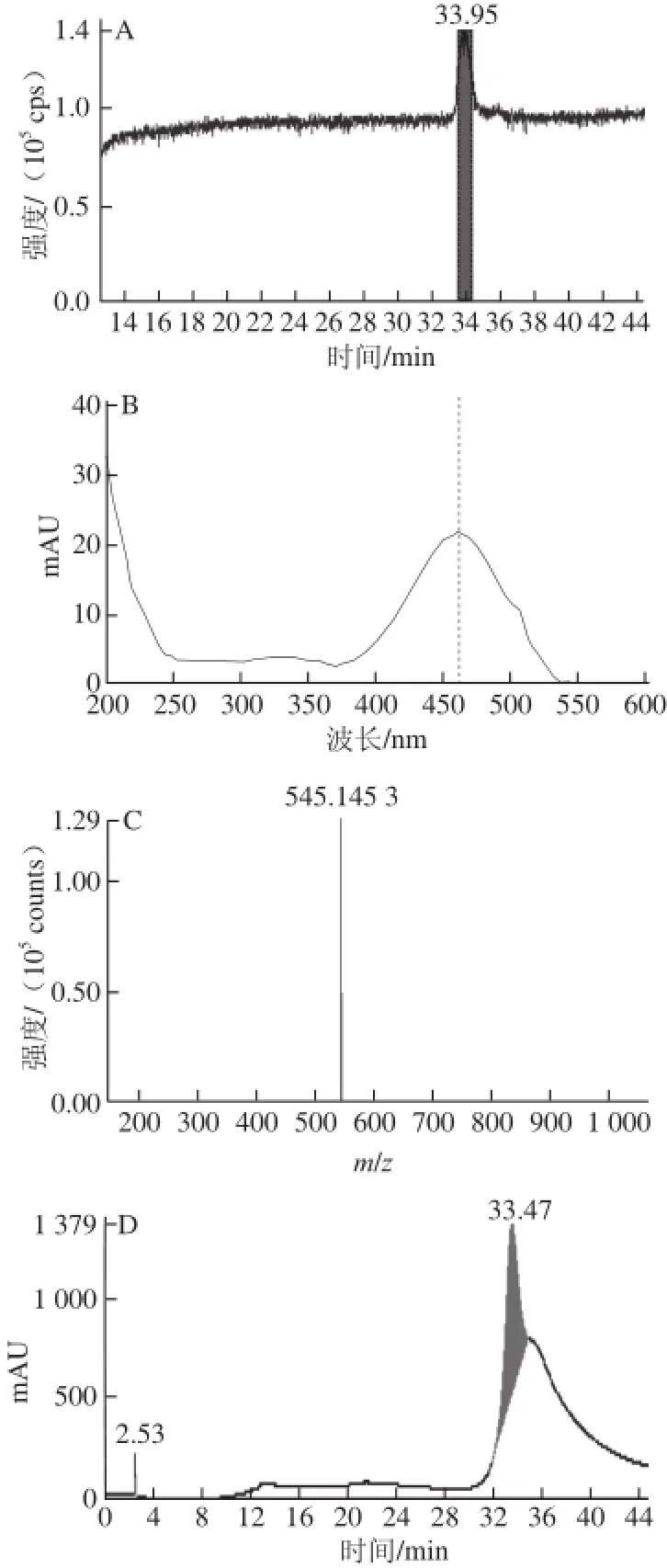
图8 样品的HPLC-MS阴离子质谱图Fig.8 HPLC chromatogram and negative ion mass spectra of purple red crystal
3 讨 论
竹红菌素较好的光敏抗癌活性、抗炎、镇痛等活性已得到了广泛认可,竹红菌素作为一种新型、高效的光敏剂也得到了国内外学者的广泛关注。在竹黄自然资源日益紧缺的条件下,筛选竹黄无性型菌株并从其发酵产物中规模化提取竹红菌素应用于食品、保健品、药品开发等领域具有重要的现实意义。但是,目前竹黄无性型菌株发酵产物中关于竹红菌素提取工艺的系统研究报道还甚少,极大限制了竹红菌素资源的开发与应用。本研究对一株竹黄无性型菌株进行液体发酵,利用获得的发酵菌丝体进行了竹红菌素的提取工艺研究,并对获得的竹红菌素粗提物进行了分离纯化。
在本实验条件下按照料液比为1∶30(m/V)的比例加入提取剂丙酮、于30 ℃温度条件下超声浸提30 min,竹黄无性型菌株ZH-5-1液体深层发酵菌丝体中竹红菌素的提取率最高。提取液经氯仿-水(2∶1)的溶剂反复萃取后可有效去除杂质成分。除杂后的竹红菌素粗提物经简单的硅胶柱色谱分离并收集红色洗脱液即可得到高纯度的竹红菌素样品,经质谱分析后发现分离得到的物质为竹红菌甲素。本研究为竹红菌素的提取和竹红菌甲素的纯化提供了参考。
[1] 黄小波. 药用真菌竹黄的液体发酵工艺优化及竹红菌素的提取研究[D]. 杭州: 浙江农林大学, 2010.
[2] 梁晓辉, 蔡宇杰, 廖祥儒, 等. 药用真菌竹黄的研究进展[J].食品与生物技术学报, 2008, 27(5): 21-26. DOI:10.3321/ j.issn:1673-1689.2008.05.004.
[3] YANG H L, HUANG F R. Quantum chemical and statistical study of hypocrellin dyes with phototoxicity against tumor cells[J]. Dyes and Pigments, 2007, 74: 416-423. DOI:10.1016/j.dyepig.2006.03.002.
[4] 肖彩霞, 刘同军, 杨海龙. 竹红菌素及其衍生物抗肿瘤活性的研究进展[J]. 食品与药品, 2008, 10(7): 55-58. DOI:10.3969/j.issn.1672-979X.2008.04.017.
[5] HUDSON J B, ZHOU J, CHEN J, et al. Hypocrellin form Hypcrella bambusae is phototoxic to human immunodeficiency virus[J]. Journal of Photochemistry and Photobiology B: Biology, 1994, 60: 253-255.
[6] ALI S M, CHEE S K, YUEN G Y, et al. Hypericin and hypocrellin induced apoptosis in human mucosal carcinoma cells[J]. Journal of Photochemistry and Photobiology B: Biology, 2001, 65: 59-73.
[7] 曾佳, 高志, 李倩, 等. 竹红菌素光动力抗肿瘤治疗的研究进展[J]. 激光杂志, 2012, 33(3): 44-45. DOI:10.3969/ j.issn.0253-2743.2012.03.024.
[8] 刘子文, 赵玉沛, 廖泉, 等. 2-丁胺-2-去甲氧基竹红菌乙素光动力作用诱导Capan-1细胞凋亡与线粒体损伤的关系[J]. 中华外科杂志, 2006, 44(1): 36-39. DOI:10.3760/j:issn:0529-5815.2006.01.012.
[9] 博乃武, 黄磊, 全兰萍, 等. 竹红菌甲素对小鼠红细胞膜的光氧化作用[J]. 中国药理学与毒理学杂志, 1990, 4(1): 75-76.
[10] MARX J L. Oxygen free radical linked to many disease[J]. Science, 1987, 235: 529-533.
[11] 傅乃武, 褚衍行, 黄磊, 等. 竹红菌甲素对肿瘤细胞光动力作用和体内代谢的研究[J]. 癌症, 1989, 8(6): 450-451; 478.
[12] 张力, 贾弘提, 董沧玉. 竹红菌甲素敏化S-180肿瘤细胞膜的光氧化反应及机理探讨[J]. 中国医学科学院学报, 1993(2): 93-95.
[13] 王景祥, 何祖泽, 朱丽青, 等. 竹红菌乙素对小鼠肝癌H-22的抑制作用[J]. 中国药理学通报, 1997, 13(2): 187-188.
[14] LIPSON R L. The use of a derivative of hematoporphyrin in tumor detection[J]. Journal of the National Cancer Insititute, 1961, 26: 1-11.
[15] 曹恩华, 程龙生. 竹红菌甲素光敏作用所致死的Hela细胞DNA单链断裂重接的研究[J]. 实验生物学报, 1988, 21(1): 79-85.
[16] 许娜飞, 王景福, 曹丽华, 等. Hela细胞对竹红菌甲素摄取的直接观察与动态过程分析[J]. 生物物理学报, 1995, 11(2): 261-266.
[17] 马岚. 猕猴胚胎干细胞的分离、鉴定、培养及应用研究[D]. 昆明:中国科学院昆明动物研究所, 2000: 109-127.
[18] 梁晓辉, 蔡宇杰, 廖祥儒, 等. 竹黄发酵菌丝与竹黄子座成分比较分析[J]. 食品与生物技术学报, 2009, 28(5): 705-708. DOI:10.3321/ j.issn:1673-1689.2009.05.024.
[19] 杜文, 田维毅, 王平, 等. 微生物激发子对竹黄产竹红菌素的影响[J]. 食用菌学报, 2014, 21(4): 23-26. DOI:10.3969/ j.issn.1005-9873.2014.04.007.
[20] 杨珠英, 潘魏松, 聂云, 等. 甲基磺酸乙酯诱变选育竹红菌甲素高产菌株[J]. 生物加工过程, 2014, 12(2): 24-27. DOI:10.3969/ j.issn.1672-3678.2014.02.005.
[21] 胡飞, 李瑞雪, 李春如, 等. 一株竹黄无性型菌株液态发酵产竹红菌素的初步研究[J]. 生物学杂志, 2008, 25(2): 44-47. DOI:10.3969/ j.issn.2095-1736.2008.02.012.
[22] 韩钱松. 竹黄菌SUPER-H168液态发酵产竹红菌素的优化[D]. 无锡:江南大学, 2013.
[23] 吕腾飞. 竹黄菌固体发酵产竹红菌素的优化和放大[D]. 无锡: 江南大学, 2014.
[24] 吕腾飞, 丁彦蕊, 廖祥儒, 等. 竹黄菌固态发酵产竹红菌素条件的优化[J]. 食品与生物技术学报, 2013, 32(8): 832-837. DOI:10.3969/ j.issn.1673-1689.2013.08.009.
[25] 邵颖, 陈安徽, 贺菊萍, 等. 液体发酵竹红菌素的稳定性及抗肿瘤活性[J]. 食品科学, 2011, 32(23): 96-100.
Extraction, Purification and Characterization of Hypocrellin from Liquid-Cultured Mycelia of Shiraia bambusicola
SHAO Ying1,2, CHEN Anhui1,2,*, CHEN Xiaojie1, ZHANG Chuanli1,2, HU Fei3
(1. College of Food (Biological) Engineering, Xuzhou Institute of Technology, Xuzhou 221008, China; 2. Jiangsu Provincial Key Laboratory of Food Resource Development and Quality Safety, Xuzhou 221008, China; 3. Anhui Provincial Key Laboratory of Microbial Pest Control, Hefei 230036, China)
The extraction of hypocerllin from submerged-cultured mycelia of an anamorphic strain ZH-5-1 isolated from the fruiting body of Shiraia bambusicola was optimized by orthogonal array design, and the purification was investigated using several solvent extraction cycles and silica gel column chromatography. The maximum yield of hypocerllin of 4.83 mg/ g was obtained after 30 min of ultrasonic-assisted extraction at 30 ℃ using acetone as the extraction solvent with a solid to solvent ratio of 1:30 (m/V). Purple-red crystals were obtained after subsequent successive extraction, which were determined to be pure by thin layer chromatography (TLC) and high performance liquid chromatography (HPLC). After HPLC-MS analysis, the molecular formula of the pure purple-red compound was C30H26O10and it was determined as hypocerllin A with a purity up to 98.20%.
liquid-state fermentation; hypocrellin; extraction; isolation; purification
10.7506/spkx1002-6630-201601025
Q939.9
A
1002-6630(2016)01-0139-06
邵颖, 陈安徽, 陈小洁, 等. 液体发酵竹红菌素的提取与表征[J]. 食品科学, 2016, 37(1): 139-144. DOI:10.7506/spkx1002-6630-201601025. http://www.spkx.net.cn
SHAO Ying, CHEN Anhui, CHEN Xiaojie, et al. Extraction, purification and characterization of hypocrellin from liquid-cultured mycelia of Shiraia bambusicola[J]. Food Science, 2016, 37(1): 139-144. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201601025. http://www.spkx.net.cn
2015-06-19
江苏省科技计划(产学研合作前瞻性联合研究项目)项目(BY2015024-04)
邵颖(1979—),女,副教授,博士,研究方向为微生物资源开发与应用。E-mail:shyzhbo2005@126.com
*通信作者:陈安徽(1979—),男,副教授,博士,研究方向为应用微生物学。E-mail:chenah201@126.com

