酶法制取大豆油脂过程中的蛋白酶解动力学
张 辉,齐宝坤,李 杨,隋晓楠,王中江,江连洲,*
酶法制取大豆油脂过程中的蛋白酶解动力学
张 辉1,齐宝坤2,李 杨2,隋晓楠2,王中江2,江连洲2,*
(1.科技部中国农村技术开发中心,北京 100045;2.东北农业大学食品学院,黑龙江 哈尔滨 150030)
通过数学方法推导和对Alcalase碱性蛋白酶酶解大豆中蛋白实验的系统研究,得到Alcalase碱性蛋白酶酶解大豆中蛋白的动力学模型为:R=(18.294 0E0+0.273 4ρ0)exp(-0.256 2DH),式中:E0为初始蛋白酶质量浓度,ρ0为初始底物质量浓度,DH为水解度。通过数学推导和对大豆蛋白酶解反应过程中Alcalase碱性蛋白酶失活的系统研究,得到膨化大豆蛋白的酶解反应过程中Alcalase碱性蛋白酶失活的动力学常数K=4.920 4 min-1。通过拟合实验证明,建立的动力学模型与实验结果具有较好的拟合效果,证明所建立的动力学模型具有较高的实际应用价值。
大豆;酶法制油;蛋白酶解;酶解动力学
酶法提油是在机械破碎的基础上,采用蛋白酶作用于油料,使油脂易于从油料固体中释出,利用非油成分(蛋白质和碳水化合物)对油和水的亲和力差异,同时利用油水比重不同而将油和非油成分分离,主要分为预处理、酶解蛋白、离心分离几个步骤,其中蛋白质的酶解程度对油脂释放有显著影响[1-2]。
蛋白质的酶解是一个复杂的过程[3-4],蛋白质所含的肽键种类不同,蛋白酶对不同肽键的酶解作用强弱也不一样,这都会导致有时很难对蛋白质酶解过程进行控制。因此,从反应机理出发,推导描述蛋白质酶法酶解过程规律的动力学关系式,计算酶动力学参数,建立符合实验数据的实验模型,对于深入理解蛋白质酶解过程有着实际意义[5-6]。
一个能够全面反映酶解过程的高分子底物酶解动力学模型的建立需要大量数据、推导、运算以及反复的验证[7-9]。针对这个问题Marquez等[10]认为,对于机理相同的酶解反应,前人建立的模型可以被用来与实际数据结合,构建酶解过程动力学曲线,进而获得酶解过程中的一些信息。近年来,国内外已经开展了蛋白酶解动力学研究,如王岩等[11]对Alcalase酶解大豆蛋白工艺与动力学进行了研究,郭城等[12]对Alcalase酶解棉籽蛋白工艺与动力学进行了研究,Kilic-apar等[13]建立了Alcalase酶解芝麻饼粕蛋白动力学模型,吴建中等[14]研究了Protamex蛋白酶酶解大豆蛋白的机理及动力学,章绍兵等[15]对花生乳化体系中蛋白质的酶解动力学进行研究,确定了模型,此外翟爱华等[16]研究了碱性蛋白酶酶解米糠蛋白动力学特性。但是现有研究均没有以大豆酶法制油混合体系为研究对象。
基于前面的研究发现,利用碱性蛋白酶酶解膨化全脂大豆是一种同时提取大豆油脂、蛋白质、多肽以及副产物——水溶性糖的方法。挤压膨化后的大豆细胞壁受到破坏,更有利于油脂释放,在高温、高压、高剪切作用下使蛋白质的分子结构发生伸展、重组,分子表面的电荷重新分布,分子间氢键、二硫键部分断裂,导致蛋白质变性,蛋白质的消化率明显提高,通过增加表面积和蛋白变性,从而更有利于酶对大豆蛋白酶解[17-20]。本实验重点对膨化后大豆的酶解动力学进行研究,目的是建立膨化大豆的酶解动力学模型,更加准确地控制膨化大豆的酶法提取工艺,获取蛋白酶失活的动力学常数,对蛋白酶的重复使用有着重要意义,促进了膨化大豆的酶法提取技术的推广与应用。
1 材料与方法
1.1 材料与试剂
大豆,黑龙江农业科学院培植的垦农42,其中蛋白质含量为41.6%,油脂含量为2 1.3%,含水率为10.6%,灰分含量为4.3%;Alcalase碱性内切蛋白酶(酶活力1.2×105U/mL)丹麦诺和诺德公司。
1.2 方法
1.2.1 酶解过程
原料大豆粉碎后,经挤压膨化处理后,粉碎过筛得到膨化大豆粉,放入4 ℃冰箱中备用。准确称量一定质量膨化大豆粉放入四颈瓶中,按照1∶6(m/V)的比例加入水,搅拌混合均匀后,在60 ℃的水浴锅中保持恒温,用1 mol/L NaOH调节大豆水溶液的pH值至9.0并保持。依据所用酶的活力,准确量取所需的蛋白酶加入大豆水溶液中,使酶在搅拌条件下酶解大豆粉。酶解后,测定其水解度(degree of hydrolysis,DH)[21]。
1.2.2 酶活力测定
采用Folin-酚法[22]。
1.2.3 DH的测定
采用pH-stat法[23]。
2 结果与分析
2.1 酶解动力学模型的推导
蛋白质酶法酶解反应符合双底物顺序反应机理[24],由以下几步反应过程组成。

式中:ρ0为初始底物质量浓度/(g/L);E0为加酶量/(mL/L);K2为酶解反应速率常数/min-1;Kd为酶失活反应速率常数/min-1;Km为米氏常数。
根据前人研究结果[7],蛋白质单酶酶解过程的动力学模型为:
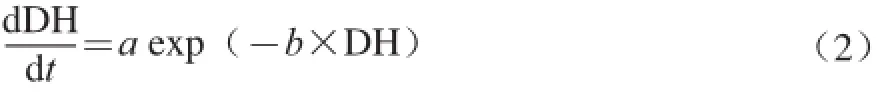
式中:a、b为动力学方程形式参数。
由方程(1)和方程(2)可知:

所以最终由方程(2)和(3)、(4)得到蛋白质单酶酶解过程的动力学模型为:

式中:R为酶解速率/(mol/(L·min))。
由方程(3)可知,a的大小与酶解体系初始底物质量浓度和加酶量有关,随着初始底物质量浓度的上升而减小,随着加酶量的上升而增大;由于K2与酶解温度有关,因此,a的大小也随着酶解温度的变化而变化。由方程(4)可知,b的大小与初始底物质量浓度和加酶量无关,但与酶解温度的高低有关。在恒温酶解反应中,b的大小应为一个常数;a的大小只与酶解体系初始底物质量浓度和加酶量有关。由方程(5)可知,a值越大,反应速率越大,当a小于0时,R为负,酶解反应无法进行。
2.2 酶解动力学模型的建立
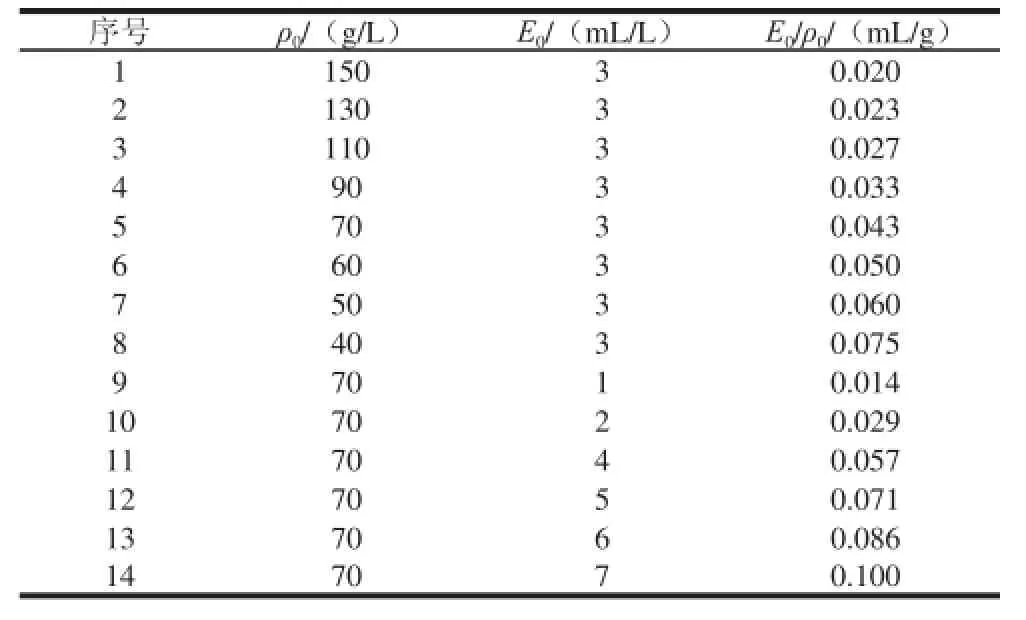
表1 酶解动力学模型研究的实验设计Table 1 Experimental design and arrangement
固定底物质量浓度为70 g/L,在不同加酶量条件下,考察酶解过程中DH的变化规律。固定加酶量为3 mL/L,在不同底物质量浓度条件下,考察酶解过程中DH的变化规律。最终通过实验建立膨化大豆的酶解动力学模型,获得相关动力学参数。具体实验设计见表1,DH的计算结果见表2。
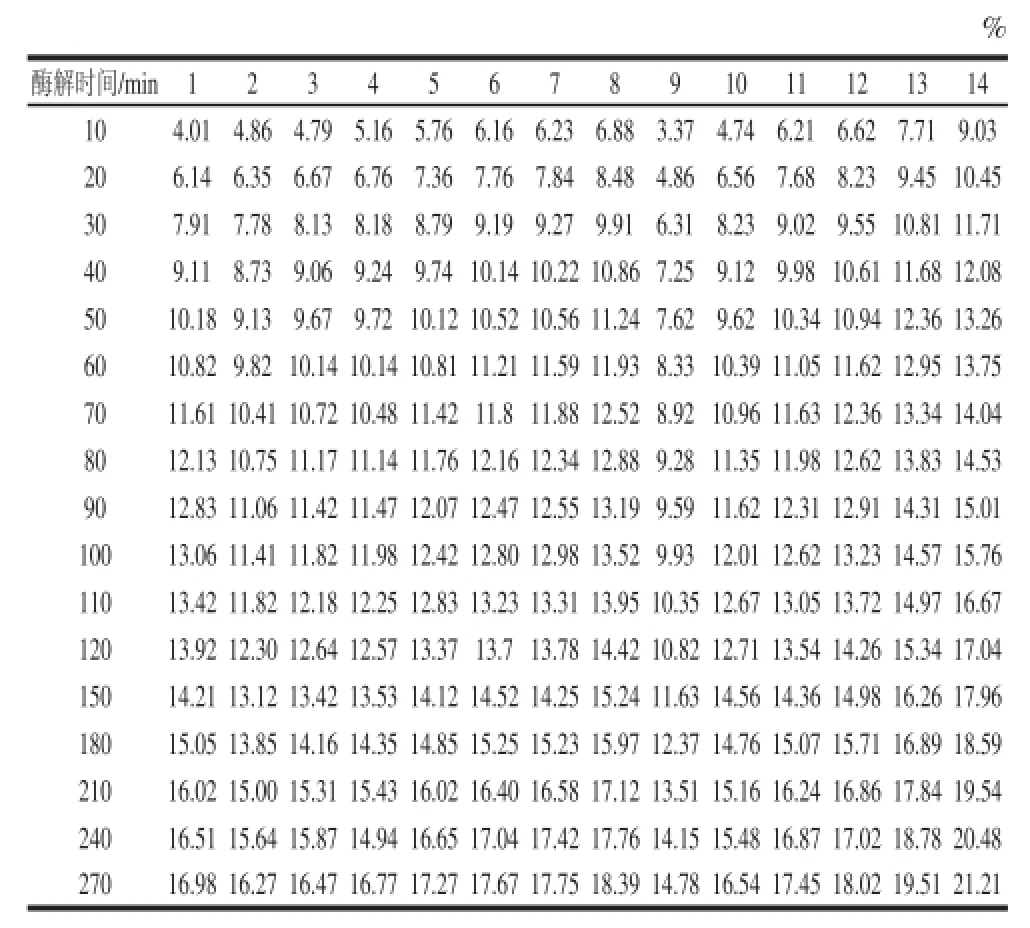
表2 不同加酶量和底物质量浓度条件下水解度与酶解时间的关系Table 2 Relationship of hydrolysis degree and hydrolysis time at different enzyme dosages and substrate concentrations
2.3 Alcalase碱性蛋白酶酶解大豆中蛋白动力学模型参数的推导
采用非线性回归模型对不同底物质量浓度以及不同加酶量的14 组数据进行拟合,并由此推导Alcalase碱性蛋白酶酶解膨化大豆中蛋白的动力学模型参数。根据可行性实验数据发现,采用Logarithm模型拟合效果比较好,酶解过程的拟合结果见表3。
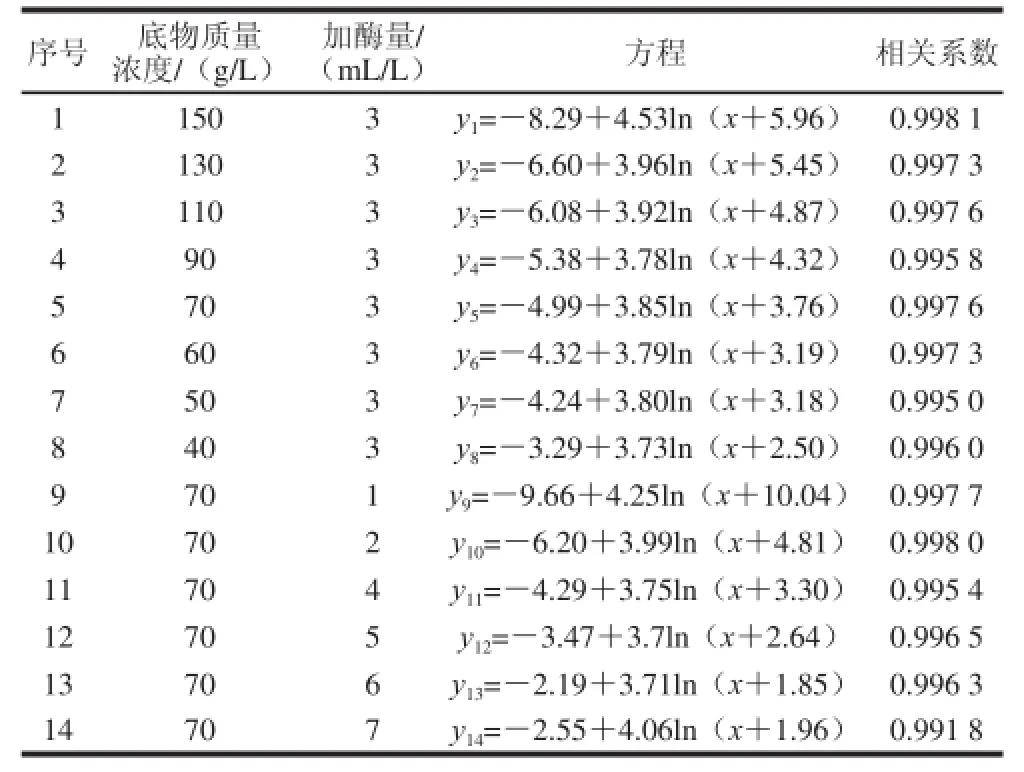
表3 酶解过程的拟合结果Table 3 Fitting results of enzymatic hydrolysis curves
Logarithm模型表示为:

微分后可得:

由表3和图1结果、方程(8)和(9)可得到Alcalase碱性蛋白酶酶解膨化大豆中蛋白过程中底物不同初始质量浓度和蛋白酶初始质量浓度所对应的动力学参数a与b的大小,结果见表4。
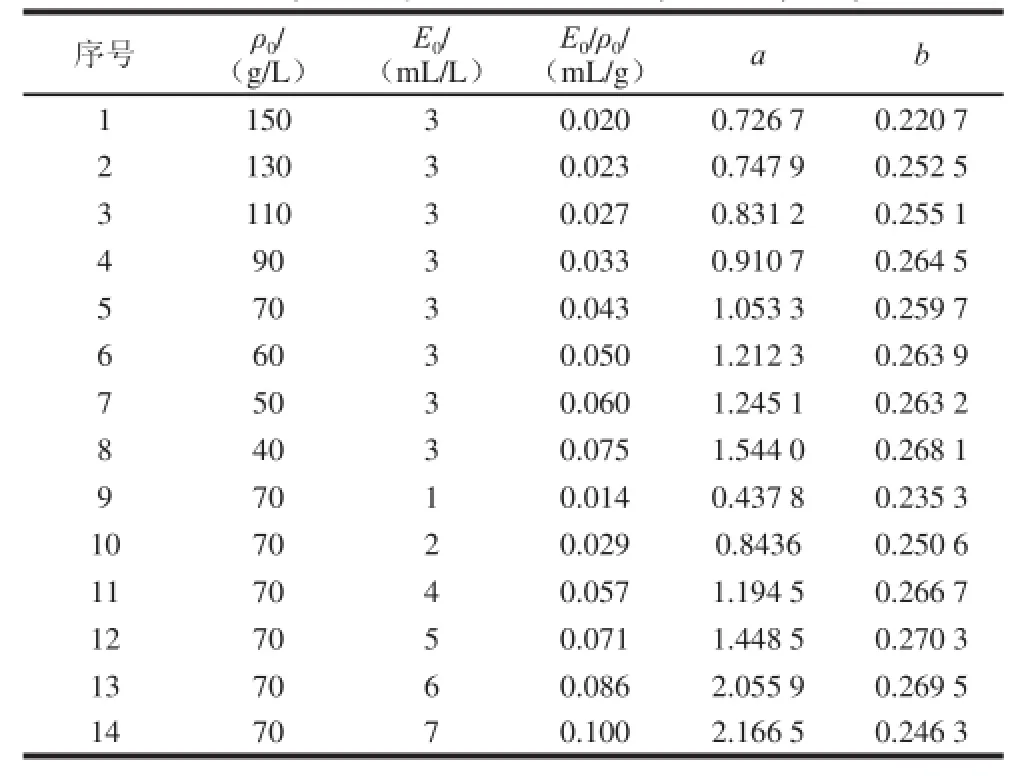
表4 酶解动力学参数Table 4 Dynamic parameters of enzymatic hydrolysis
由表4酶解动力学参数的结果可以看出,动力学参数a随着初始底物质量浓度的增加而减小,随着加酶量的增加而增大。动力学参数b在不同的初始底物质量浓度和加酶量条件下,其数值相互差异不大,且接近一个常数,在其平均值0.256 2附近上下波动,因此在一个恒温酶解反应中,b可以近似看作一个常数,这与相关文献[25]所述和模型推导所得结论一致。
从方程(3)和表4酶解动力学参数的结果可知,在恒温酶解反应中,动力学参数a跟加酶量和初始底物质量浓度的比值()成线性关系。因此,从表4酶解动力0学参数的结果取出相关数据进行线性拟合,得到a值与值的关系线性方程为:

对比方程(3)与(11),可得到:

将a值与b值代入方程(5),可得到Alcalase碱性蛋白酶酶解膨化大豆中蛋白的动力学模型为:
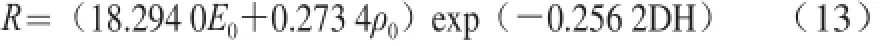
由方程(13)可知,Alcalase碱性蛋白酶酶解膨化大豆中蛋白的反应速率与底物质量浓度和加酶量均有关,并且随底物质量浓度和加酶量的增加而增加。随着反应的进行,反应速率随水解度的增加而降低。在加酶量3 mL/L和底物质量浓度70 g/L条件下测得不同酶解时间的DH数据代入方程(11),得到酶解时间t与酶解速率R的拟合曲线见图1。
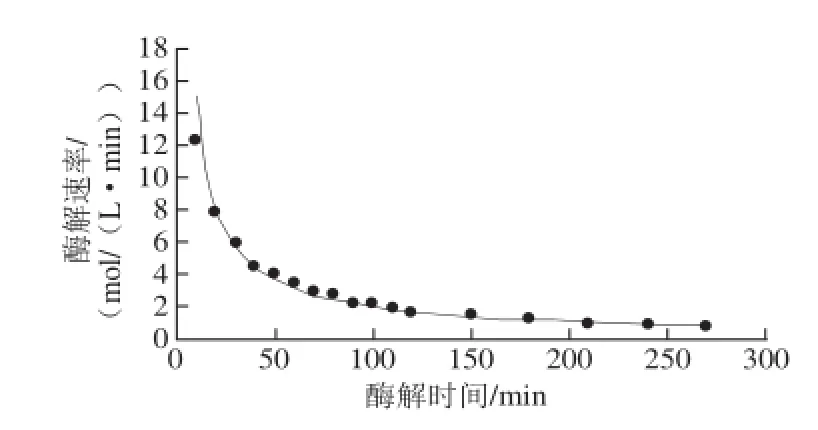
图1 酶解过程中反应速率的变化Fig.1 Reaction rate curve of enzymatic hydrolysis
由图1酶解过程中反应速率的变化可以看出,随着酶解反应的进行酶解速率不断下降,酶解270 min时反应速率为0.683 mol/(L·min)左右,反应已经进行的非常缓慢,所以终止反应进行。酶解到210 min时反应速率为0.94mol/(L·min)左右,反应速率低于1mol/(L·min),而此时的酶法提取油脂、蛋白和多肽得率均已经达到极大值,这与前面研究确定的响应面优化结果相符。
2.4 Alcalase碱性蛋白酶酶解大豆中蛋白失活常数的推导
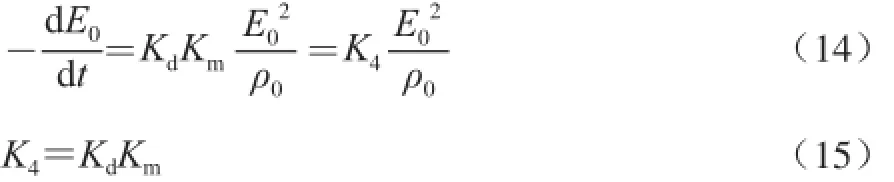
式中:K4为膨化大豆蛋白的酶解反应过程中Alcalase碱性蛋白酶失活常数/min-1。
把方程(3)与(4)相乘,并与方程(14)合并则可得:

经拟合,ab值与E0/ρ0的线性关系方程为:
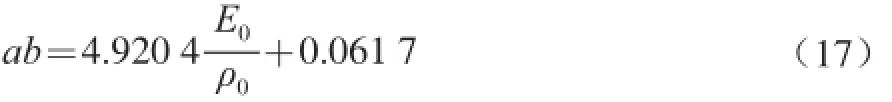
根据方程(14)、(15)可得,膨化大豆蛋白的酶解反应过程中Alcalase碱性蛋白酶失活的动力学常数K4=4.920 4 min-1。
2.5 酶解动力学模型的验证
将酶解动力学模型的计算结果与实际酶解结果进行对比,可以验证动力学模型的实际应用意义。因此在一定酶解条件下,多次测定体系水解度曲线与相对应的动力学模型计算酶解速率R,计算各R值的标准偏差见图2。模型拟合情况较好,绝大多数标准误差小于5%,因此建立的动力学模型具有较高的实用价值。
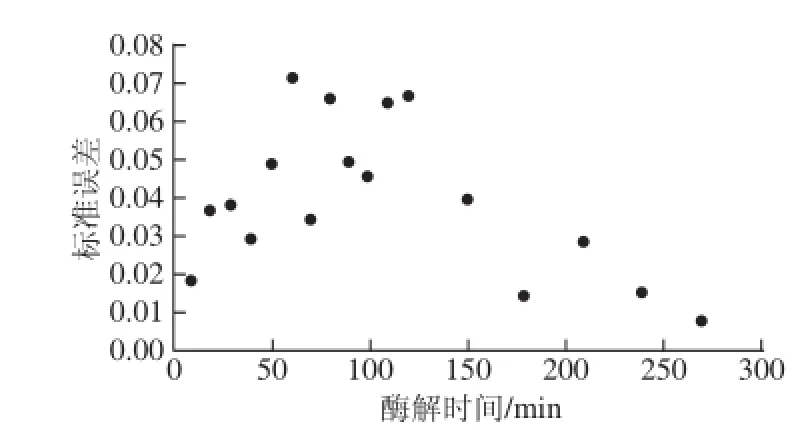
图2 不同酶解时间酶解速率的标准误差Fig.2 Standard error of hydrolysis rate at different hydrolysis times
3 结论与讨论
通过数学方法推导和对Alcalase碱性蛋白酶酶解大豆中蛋白实验的系统研究,得到Alcalase碱性蛋白酶酶解大豆中蛋白的动力学模型为:R=(18.294 0E0+ 0.273 4ρ0)exp(-0.256 2DH)。
通过数学推导和对膨化大豆蛋白的酶解反应过程中Alcalase碱性蛋白酶失活的系统研究,得到大豆蛋白的酶解反应过程中Alcalase碱性蛋白酶失活的动力学常数K= 4.920 4 min-1。
通过拟合实验证明,建立的动力学模型与实验结果具有较好的拟合效果,证明所建立的动力学模型具有较高的实际应用价值。在日后工业化生产中,可以更加准确地控制挤压膨化后大豆的水酶法提取过程,促进挤压膨化大豆水酶法提取技术的推广与应用。
[1] 齐宝坤, 江连洲, 李杨, 等. 挤压膨化后微体化预处理水酶法提取大豆油脂工艺研究[J]. 食品工业科技, 2012, 33(21): 196-200.
[2] 李杨, 江连洲, 张兆国, 等. 模糊评判优化水酶法提取膨化大豆油脂和蛋白[J]. 农业工程学报, 2010, 26(2): 375-380. DOI:10.3969/ j.issn.1002-6819.2010.02.066.
[3] CUCU T, PLATTEAU C, TAVERNIERS I, et al. Effect of partial hydrolysis on the hazelnut and soybean protein detectability by ELISA[J]. Food Control, 2013, 30(2): 497-503. DOI:10.1016/ j.foodcont.2012.07.017.
[4] YUAN B E, REN J Y, ZHAO M M, et al. Effects of limited enzymatic hydrolysis with pepsin and high-pressure homogenization on the functional properties of soybean protein isolate[J]. LWTFood Science and Technology, 2012, 46(2): 453-459. DOI:10.1016/ j.lwt.2011.12.001.
[5] WANG Zebin, LOMBARDI J, SHAFFER J, et al. Kinetics of hydrolyzing isolated soy protein by an endopeptidase and its conceptual application in process engineering[J]. International Journal of Food Studies, 2012, 1(1): 26-32.
[6] SUNPHORKA S, CHAVASIRI W, OSHIMA Y, et al. Kinetic studies on rice bran protein hydrolysis in subcritical water[J]. Th e Journal of Supercritical Fluids, 2012, 65: 54-60. DOI:10.1016/ j.sup flu.2012.02.017.
[7] 张宇昊. 花生短肽制备及其功能活性研究[D]. 北京: 中国农业科学院, 2007.
[8] DEMIRHAN E, APAR D K, ÖZBEK B. A kinetic study on sesame cake protein hydrolysis by Alcalase[J]. Journal of Food Science, 2011, 76(1): C64-C67. DOI:10.1111/j.1750-3841.2010.01938.x.
[9] CONSTANTINIDES A, ADU-AMANKWA B. Enzymatic modification of vegetable protein: mechanism, kinetics, and production of soluble and partially soluble protein in a batch reactor[J]. Biotechnology and Bioengineering, 1980, 22(8): 1543-1565. DOI:10.1002/bit.260220804.
[10] MARQUEZ M C, VAZQUEZM A. Modeling of enzymatic protein hydrolysis[J]. Process Biochemistry, 1999, 35(1/2): 111-117. DOI:10.1016/S0032-9592(99)00041-2.
[11] 王岩. Alcalase碱性蛋白水酶解大豆蛋白的工艺过程及动力学研究[J].粮食科技与经济, 2008(3): 40-41.
[12] 郭城, 罗璇. A l c a l a s e碱性蛋白酶水解棉籽蛋白动力学研究[J]. 粮食与饲料工业, 2010(9): 46-48. DOI:10.3969/ j.issn.1003-6202.2010.09.016.
[13] KILIC-APAR D, OZBEK B. Corn gluten hydrolysis by Alcalase: effects of process parameters on hydrolysis, solubilization and enzyme inactivation[J]. Chemical and Biochemical Engineering Quarterly, 2008, 22(2): 203-212.
[14] 吴建中, 黄雪松, 汪勇, 等. Protamex 蛋白酶水解大豆蛋白的机理及动力学研究[J]. 食品与发酵工业, 2004, 30(5): 18-22. DOI:10.3321/ j.issn:0253-990X.2004.05.005.
[15] 章绍兵, 刘向军, 陆启玉. 花生乳状液体系中蛋白质的酶解动力学研究[J]. 农业机械学报, 2013, 44(9): 157-161. DOI:10.6041/ j.issn.1000-1298.2013.09.028.
[16] 翟爱华, 李新华. 碱性蛋白酶水解米糠蛋白动力学特性研究[J]. 中国粮油学报, 2013, 27(12): 1-5. DOI:10.3969/ j.issn.1003-0174.2012.12.001.
[17] JUNG S, MAHFUZ A A. Low temperature dry extrusion and highpressure processing prior to enzyme-assisted aqueous extraction of full fat soybean flakes[J]. Food Chemistry, 2009, 114(3): 947-954. DOI:10.1016/j.foodchem.2008.10.044.
[18] LAMSAL B P, MURPHY P A, JOHNSON L A. Flaking and extrusion as mechanical treatments for enzyme-assisted aqueous extraction of oil from soybeans[J]. Journal of the American Oil Chemists’ Society, 2006, 83(11): 973-979. DOI:10.1007/s11746-006-5055-5.
[19] LAMSAL B P, JOHNSOM L A. Separating oil from aqueous extraction fractions of soybean[J]. Journal of the American Oil Chemists’ Society, 2007, 84(8): 785-792. DOI:10.1007/s11746-007-1090-0.
[20] de MOURA J M L N, CAMPBELL K, MAHFUZ A, et al. Enzymeassisted aqueous extraction of oil and protein from soybeans and cream de-emulsification[J]. Journal of the American Oil Chemists’ Society, 2008, 85(10): 985-995.
[21] 李杨, 江连洲, 王中江, 等. 混料设计优化复合酶水解水酶法提取大豆油工艺[J]. 食品科学, 2011, 32(6): 66-70.
[22] 王福荣, 庞玉珍. 福林-酚试剂法测定蛋白酶活力的条件试验[J]. 中国调味品, 1981, 12(1): 23-26.
[23] PANYAM D, KILARA A. Enhancing the functionality of food proteins by enzymatic modification[J]. Trends in Food Science & Technology, 1996, 7(4): 120-125. DOI:10.1016/0924-2244(96)10012-1.
[24] FURLANETTO R W, KAISER E T. Kinetics of the reactions of papain with substituted alpha-haloacetophenones[J]. Journal of the American Chemical Society, 1973, 95(20): 6786-6792. DOI:10.1021/ ja00801a043.
[25] BUCIF’SKI A, KARAMAC M, AMAROWICZ R. Application of artificial neural networks for modelling pea protein hydrolysis by trypsin[J]. 2004, 13(2): 163-168.
Kinetics of Protein Hydrolysis during Aqueous Enzymatic Extraction of Soybean Oil
ZHANG Hui1, QI Baokun2, LI Yang2, SUI Xiaonan2, WANG Zhongjiang2, JIANG Lianzhou2,*
(1. China Rural Technology Development Center, Ministry of Science and Technology of China, Beijing 100045, China; 2. College of Food Science, Northeast Agri cultural Uni versity, Harbin 150030, China)
The hydrolysis of extruded full-fat soybean flakes by alkaline protease provides a promising method to extract soybean oil, protein and polypeptide simultaneously. In order to control the enzyme-assisted aqueous extraction of oil from full-fat soybean flakes, it is necessary to model the kinetics of the protein hydrolysis of extruded full-fat soybean flakes and establish the relevant kinetic parameters. In this research, we developed a kinetic mathematical model for the alcalase hydrolysis of full-fat soybean flakes as follows: R =(18.294 0E0+ 0.273 4ρ0) exp(-0.256 2DH), where E0is the initial concentration of alcalase, ρ0is initial substrate concentration, and DH is degree of hydrolysis. The kinetic constant (K) of the inactivation of alcalase during the hydrolysis process was determined to be 4.920 4 min-1. Our experimental data were well fitted to the proposed kinetic model, proving that the mode has a high practical value.
soybean; enzyme-assisted aqueous extraction of soybean oil; protein hydrolysis; enzymatic hydrolysis kinetics
10.7506/spkx1002-6630-201601026
TS221
A
1002-6630(2016)01-0145-05
张辉, 齐宝坤, 李杨, 等. 酶法制取大豆油脂过程中的蛋白酶解动力学[J]. 食品科学, 2016, 37(1): 145-149. DOI:10.7506/ spkx1002-6630-201601026. http://www.spkx.net.cn
ZHANG Hui, QI Baokun, LI Yang, et al. Kinetics of protein hydrolysis during aqueous enzymatic extraction of soybean oil[J]. Food Science, 2016, 37(1): 145-149. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201601026. http://www.spkx.net.cn
2015-02-25
张辉(1981—),男,副研究员,博士,研究方向为科技管理和食品战略。E-mail:zhanghui@yeah.net
*通信作者:江连洲(1960—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:jlzname@yeah.net

