羟基红花黄色素A对Aβ25-35诱导PC12细胞凋亡的保护作用
孔松芝,李东东,李继城,温莎莎,李鸿祥,佘燕敏
(广东海洋大学理学院,广东 湛江 524088)
羟基红花黄色素A对Aβ25-35诱导PC12细胞凋亡的保护作用
孔松芝,李东东,李继城,温莎莎,李鸿祥,佘燕敏
(广东海洋大学理学院,广东 湛江 524088)
为探讨羟基红花黄色素A(HSYA)对β-淀粉样蛋白(Aβ)25-35诱导的神经元样PC12细胞凋亡的影响,并阐明其可能的作用机制,采用Aβ25-35(20μmol/L)诱导PC12细胞凋亡建立AD细胞模型,以不同浓度HSYA(20,40,80μmol/L)对抗干预,使用形态学观察法及Hoechst染色法检测各组PC12细胞凋亡形态,MTT法检测各组细胞存活率,Annexin V-FITC/PI 双染法检测细胞凋亡率,同时应用RT-PCR检测细胞PUMA mRNA的表达变化。结果表明,HSYA可维持PC12细胞及其突触的正常形态,提高细胞存活率,明显抑制细胞凋亡,下调促凋亡蛋白PUMA mRNA的表达,与Aβ25-35组差异均有统计学意义(P < 0.01)。HSYA可明显对抗Aβ引发的神经元样PC12细胞损伤,其保护作用机制与下调PUMA mRNA的表达量有关。
羟基红花黄色素A;阿尔茨海默病;Aβ25-35;PC12 细胞;凋亡
阿尔兹海默病(Alzheimer's disease,AD)即通常所谓的老年痴呆症,是一种与年龄甚为相关的慢性、进行性中枢神经系统退行性疾病[1-2]。AD的病因至今尚未十分明确,当前其最受认可的发病机制是淀粉样沉积说(Amyloid cascade hypothesis);简而言之,氧化应激、炎症以及递质代谢异常等病变因素均可导致β淀粉样蛋白(amyloid beta protein,Aβ)的异常裂解及代谢紊乱,使Aβ生成增多并异常沉积,进而形成神经炎性斑、诱导神经元凋亡,从而导致AD的发生及发展[3-4]。因此,Aβ,尤其是其毒性片段Aβ25-35(由Aβ的第25-35位氨基酸组成),常被应用于AD细胞模型的构建。此外,大鼠肾上腺嗜铬细胞株(Pheochromocytoma,PC12细胞株)因除拥有神经内分泌细胞的典型特性外,还具有类型单一、可传代培养、细胞特性稳定等优势,而被广泛应用于研究神经细胞的病理、生理学研究[5-6]。因此,利用毒性片段Aβ25-35与神经元样PC12细胞作用建立的细胞模型,已成为迄今为止国际上公认的体外AD细胞研究模型。基于此,本研究以PC12细胞为载体,利用Aβ25-35构建AD细胞模型。
羟基红花黄色素A(Hydroxysafflor yellow A,HSYA)来源于菊科植物红花 Carthamus tinctorius L.的干燥花,是红花活血化瘀的主要效应成分[7-9]。目前,已被大量药理研究证实具有良好抗脑缺血、抗氧化、清除自由基、减轻脑组织水肿等作用[10-12],并且对缺血神经元线粒体的损伤有十分明显的保护作用[13];然而,至今仍鲜有其抗AD活性方面的直接报道。因此,本研究选HSYA为处理因素,采用上述经典AD细胞模型,观察HSYA对Aβ25-35诱导PC12细胞凋亡的影响并对其机制进行初步研究,旨在为HSYA用于AD 的防治提供基础药理学依据。
1 实验材料
1.1供试细胞株
大鼠肾上腺嗜铬瘤细胞(PC12细胞)(低分化型),由香港中文大学中医学院林志秀教授惠赠。
1.2药物与主要试剂
羟基红花黄色素A(纯度:HPLC≥98%)由山西华辉凯德制药有限公司惠赠,DMEM 高糖培养基、胎牛血清(FBS)、马血清(HS)、胰蛋白酶购自美国Gibco公司,Aβ25-35、神经生长因子(NGF)由美国Sigma公司提供,Hoechst 33342、四甲基偶氮唑盐(MTT)购于河北博海生物工程公司,台盼蓝购自上海化学试剂总厂,AnnexinV-FITC/PI细胞凋亡检测试剂盒由美国Genzyme公司提供,总RNA提取试剂盒(TRIzol法)、RT-PCR试剂、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)均购于 Invitrogen公司;逆转录试剂盒,由美国Applied Biosystems 公司提供。
1.3主要仪器
超净工作台SW-CJ-1F(江苏苏净集团),倒置荧光显微镜 1X70(日本 Olympus公司),FACSCalibur 流式细胞仪(美国Becton Dickinson 公司),CO2恒温培养箱(美国SHELLAB公司),实时荧光定量PCR 仪(RT-PCR,德国 EPPENDORF 公司)。
2 实验方法
2.1聚集态Aβ25-35的配制
精密称取Aβ25-35粉末溶于去离子双蒸水中,配成1 mmol/L的储存液,0.22 µm滤膜过滤除菌后,于37°C环境中孵育7 d,以使其形成聚集态Aβ25-35,分装,-20°C避光保存,使用时根据需要稀释于DMEM培养基中。
2.2细胞培养及分化
PC12 细胞培养于含有 10% 胎牛血清的高糖DMEM 培养基中,置37℃、5% CO2的恒温箱中培养,第2 天加入NGF(终浓度为50μg/L),2-3 d后细胞分化为神经元样细胞。
2.3实验分组及处理
收集神经元样PC12细胞后调整细胞浓度,并将该细胞以适当的密度接种于96孔(约2×104个/孔)、24孔(约1×105个/孔)或6孔(约1×106个/孔)培养板中,按处理方式不同分为:空白对照组(Control组)、20μmol /L Aβ25-35处理组(Aβ组)、20μmol/L HSYA+Aβ组、40μmol/L HSYA +Aβ组以及80μmol/L HSYA+Aβ组,根据测定指标的不同每组设置3或6个复孔。细胞贴壁培养24h后,吸弃DMEM完全培养液,Control组和Aβ组更换为无血清DMEM培养液,其余3组分别更换为含相应剂量的HSYA的无血清培养液。以上各组换液培养2h后,除Control组外其余各组再给予Aβ25-35处理,继续培养24h。细胞培养结束后,按要求对其进行各项指标的检测。
2.4显微镜观察PC12细胞的形态变化
收集PC12细胞,将其以1×106个/孔的密度接种于6 孔培养板上,按2.3所示的方法分组培养并处理细胞,每组设3个复孔,培养结束后,用倒置荧光显微镜对各组细胞进行形态学观察分析。
2.5MTT法检测PC12细胞的活性
收集PC12细胞,将其以2×104个/孔的密度接种于96 孔培养板上(每孔100μL),按2.3所示的方法分组培养并处理细胞,每组设6个复孔,培养结束后,每孔加入20μL MTT溶液(5 mg/mL),37℃孵育4h后,小心吸弃各孔内液体,每孔再加入150μL 二甲基亚砜(DMSO),避光振荡 10~15min,全自动酶标仪测定570 nm波长处各孔吸收值(D)。细胞存活率按以下公式计算:
细胞存活率= D实验组/ D对照组×100%
2.6Hoechst 33342 染色法检测细胞凋亡
收集PC12细胞,以1×105个/孔的密度接种于24孔培养板中,按2.3所示的方法分组培养并处理细胞,每组设3个复孔。培养结束后,吸去培养液,4%多聚甲醛固定10min,磷酸缓冲液(PBS)轻柔漂洗3min×2 次后,向各孔加入0.5 mL新鲜配制的Hoechst 33342 染色工作液(终浓度10μg/mL),避光孵育5min,PBS 轻柔漂洗 5min×3 次后,各孔均随机选取视野,利用倒置荧光显微镜观察细胞内荧光着色情况并摄片记录。
2.7Annexin-Ⅴ/PI双染流式细胞仪检测凋亡
收集PC12细胞,将其以1×106个/孔的密度接种于6 孔培养板上,按2.3所示的方法分组培养并处理细胞,每组设6个复孔,培养结束后,加入不含EDTA的胰酶消化、离心收集细胞于离心管内,PBS冲洗2次,弃上清,每管加入500μL的Binding Buffer悬浮细胞,并将其移入流式管中,加入5μL的Annexin V-FITC以及5μL Propidium Iodid混匀;避光反应10min,用流式细胞仪检测细胞凋亡情况(激发波长λx=488 nm;发射波长λm=530 nm)。
正常细胞(Annexin V-/PI-)、凋亡细胞(凋亡早期Annexin V+/PI-+ 凋亡晚期Annexin V+/PI+)以及死细胞(Annexin V-/PI+)。
2.8RT-PCR检测PUMA mRNA的表达变化
收集PC12细胞,将其以1×106个/孔的密度接种于6 孔培养板上,按2.3所示的方法分组培养并处理细胞,以1×107个/组的量收获PC12细胞,分别移入1.5 mL EP管中,根据Invitrogen公司生产的TRIzol 的操作手册进行总 RNA 的提取。向RNAase-free 的PCR 管中,加入1.5μg RNA,按逆转录试剂盒(Applied Biosystems 公司)操作,进行第一链cDNA 的合成。引物序列如下:
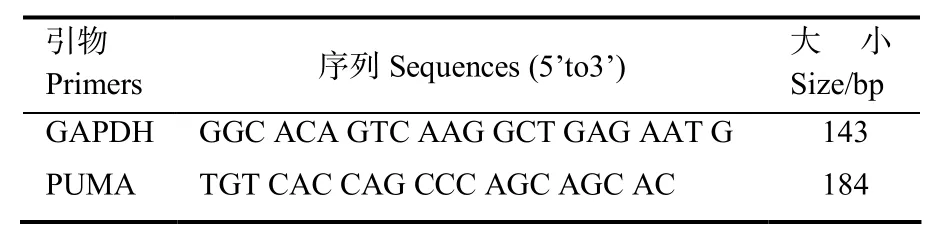
表1 分析mRNA表达量的所用引物序列Table 1 Primers used for analysis of mRNA expression levels
取上述合成的 cDNA产物 1 µL作为模板,DEPC水13.9 µL、l0 × Taq Buffer 10 µL、25 mmol/L MgC12l.2 µL、l0 mmol/L dNTP mix 0.5 µL、Taq DNA聚合酶0.4 µL、上下游引物各0.5 µL,用水补足至50μL,混匀后置于RT-PCR扩增仪上。PCR扩增条件为:95℃ 5min,94℃ 30 s,54℃ 40 s,72℃30 s,30 cycles,72℃ 7min。
反应结束后,采用相对定量法比较各基因的表达差异,以GAPDH作为内参基因,以循环阈值(C)作为计算各样本中 mRNA的相对表达量。计算公式:

2.9统计方法
采用 SPSS17.0 统计分析软件进行统计学处理,计量资料以平均值 ± 标准误差表示,各组间差异比较用单因素方差分析(One-Way ANOVA),方差齐时组内两两多重比较采用LSD法,方差不齐时组内两两多重比较采Dunnett's T3法,以P < 0.05为差异有显著性。
3 实验结果
3.1HSYA对Aβ25-35损伤PC12细胞形态的影响
不同浓度的HSYA和/或Aβ25-35干预细胞结束后,于倒置光学显微镜下观察各组细胞形态。结果如图1所示,正常组PC12细胞呈多角型贴壁状态生长(贴附良好)、胞体饱满并带有数个伸展充分的突起(如图1箭头所示);与Control组细胞相比,Aβ组(20μmol/L for 24h)细胞的状态明显变差,部分细胞胞体肿胀变圆,突起变短、变细甚至消失,细胞间连接变稀疏,视野内可见较多的脱落细胞及其碎片(如图1圈内细胞)。除20μmol/L HSYA对Aβ损伤细胞的保护作用不明显外,HSYA (40,80μmol/L)保护组对Aβ损伤细胞均有一定程度的保护作用,神经元样PC12细胞生长状态良好,细胞肿胀减少且立体感较好,细胞突起基本存在,少见脱落细胞及其碎片。即 40μmol/L及 80μmol/L的HSYA对Aβ25-35损伤的 PC12 细胞形态具有明显改善作用。

图1 HSYA对Aβ25-35损伤PC12细胞形态的影响 (200×)Fig.1 Effect of HSYA on cellular morphology of Aβ25-35-treated PC12 cells (200×)
3.2HSYA对Aβ25-35损伤PC12细胞活性的影响
本实验采用MTT法检测HSYA(20、40、80 µmol/L)对PC12细胞活性的影响。结果如图2所示,Aβ损伤组与空白对照组相比较细胞存活率显著降低(P < 0.001);20μmol/L HSYA保护组的细胞存活率与Aβ损伤组相比有一定程度的增高,但未显示出统计学差异(P > 0.05);40~80μmol/L HSYA药物保护组与Aβ损伤组相比,细胞存活率显著升高(P<0.01),表明HSYA具有拮抗Aβ对PC12细胞毒性的作用。

图2 HSYA对Aβ25-35损伤PC12细胞活性的影响Fig.2 Effect of HSYA on cell viability in Aβ25-35-treated PC12 cells
3.3Hoechst 33342染色显微镜观察细胞凋亡
Hoechst 33342 能够和染色体结合,在荧光显微镜下可观察到正常染色体和浓缩染色体,正常染色体核较大、呈圆形,均匀低强度蓝色荧光;细胞凋亡时其染色质固缩,核断裂并形成凋亡小体,呈致密浓染或碎块状致密浓染的蓝色荧光。Hoechst 核染色实验结果显示,正常对照组PC12细胞仅有少量的染色体深染、核浓缩的凋亡细胞;与 Control组比较,Aβ组细胞出现明显的核深染、核浓缩,凋亡细胞数目明显增加(如图3圈内细胞);与Aβ组比较,各浓度HSYA组细胞凋亡数目均有所减少,且呈剂量依赖性趋势。表明20μmol/L Aβ处理PC12细胞24h能够诱导细胞大幅凋亡,HSYA对Aβ诱导的PC12细胞凋亡具有明显的抑制作用。
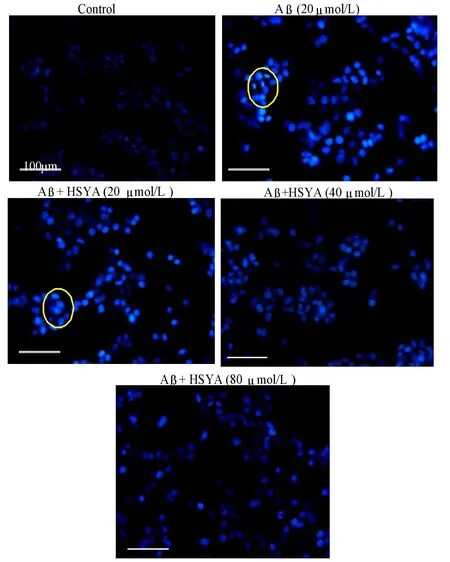
图3 Hoechst 33342染色法检测HSYA对Aβ25-35诱导PC12细胞凋亡的影响 (400×)Fig.3 Effect of HSYA on the PC12 cells apoptosis staining with Hoechst 33342 induced by Aβ25-35(400 ×)
3.4HSYA对Aβ25-35损伤PC12细胞凋亡的影响
本研究采用 Annexin V/PI 双染色法,利用流式细胞仪对PC12细胞的凋亡情况进行了定量分析。实验结果如图4所示,空白对照组细胞的凋亡率(凋亡细胞率 = E2+E4)为4.5%,Aβ25-35损伤组细胞的细胞凋亡率显著增加至45.3%;加入HSYA(20、40、80 µmol)保护以后,各药物处理组分别将Aβ25-35诱导的细胞凋亡率降至35.2%、19.1%、9.8%,与Aβ处理组相较均具有极显著性差异(P < 0.001)。以上研究结果提示:毒性片段 Aβ25-35可以引起明显的PC12细胞凋亡,具有显著的细胞毒性;而 HSYA能够有效地抑制Aβ25-35对PC12细胞的毒性,表现出较强的神经保护作用。

图4 Annexin V-FITC/PI双染法流式细胞术检测HSYA对Aβ25-35诱导PC12细胞凋亡的影响Fig.4 Effect of HSYA on apoptosis rate in Aβ25-35-treated PC12 cells
3.5HSYA对Aβ25-35损伤PC12细胞PUMA mRNA表达的影响
PUMA是属于Bcl-2家族的一种促凋亡蛋白,具有强大的促凋亡作用。RT-PCR分析显示(见图5),与 Control组相比,Aβ组促凋亡蛋白 PUMA mRNA 的表达极显著增加(P < 0.001);与Aβ25-35损伤组相比,HSYA 20µmol处理可降低细胞内PUMA mRNA 的表达水平,但无统计学差异(P >0.05);而较高浓度HSYA(40、80μmol)干预后可不同程度的降低Aβ 诱导升高的PUMA mRNA 水平,其中80μmol HSYA作用极为显著(P < 0.001)。

图5 HSYA对Aβ25-35损伤PC12 细胞PUMA mRNA表达水平的影响Fig.5 Effect of HSYA on Aβ25-35-induced PUMA gene expression in PC12 cells
4 讨 论
羟基红花黄色素 A(HSYA)是具有单查尔酮苷类结构的化合物,其分子质量为612 ku(分子式为 C27H32O16),属于小分子水溶性物质,可以通过细胞的内吞作用、易化扩散进入细胞;此外,当前的市售产品注射用红花黄色素(商品名:乐坦,国药准字:Z20050146),其规格为50 mg/支(含羟基红花色素A 35 mg),已被广泛用于治疗冠心病、心绞痛,然而其在脑部疾病(尤其是当前高发的AD)中的研究鲜有报道[7,10]。本研究中,我们以神经元样PC12细胞为载体,利用Aβ25-35构建AD细胞模型,并在此模型基础上考察HSYA的神经保护作用,为HSYA用于AD 的防治提供初步基础药理学依据;同时,参照前人的研究设计方式,我们采用正常及模型对照对受试物的作用进行评价。本研究利用形态学观察及 MTT法对其保护作用进行初步考察,检测结果一致表明:HSYA能够显著提高Aβ25-35损伤细胞的细胞活性并维持其正常形态,提高受损细胞的存活率,有效对抗Aβ25-35诱发的神经细胞毒性。为进一步检测HSYA的保护作用,本研究同时利用定性、定量手段对细胞凋亡状况进行了系统分析。Hoechst染色后,凋亡细胞的核体明显缩小,断裂成凋亡小体,呈致密浓染的固缩形式或碎块状致密荧光。Hoechst常用的染色剂有Hoechst33258和Hoeehst33342两种,本研究采用的Hoeehst33342细胞渗透性相对较高,具有更好的染色效果。实验中我们在荧光显微镜下观察到Aβ25-35可诱导PC12细胞产生明显凋亡,视野下可见多数呈致密荧光的小核体;HSYA保护后受Aβ25-35诱导凋亡的PC12细胞明显减少,镜下大多为正常细胞核形态,呈均匀低强度蓝色荧光。此外,我们又通过AimexinV-FITC/PI双染流式细胞术对细胞凋亡状况进行了定量分析,并对其凋亡周期进行了相应分析;结果显示,20~80μmol的HSYA能够有效地同时抑制Aβ25-35诱导神经元样PC12细胞的早期及晚期凋亡,使其凋亡率剂量依赖性的大幅降低从而对抗Aβ引发的神经细胞毒性。
随着对AD神经元凋亡研究的日益深入,目前最公认的参与其凋亡的分子调控主要包括Bcl-2家族、caspase家族、P53家族等;其中Bcl-2基因家族是目前研究最为广泛的一类AD神经元凋亡相关基因,其表达和调控水平在神经元凋亡信号转导途径中发挥着核心作用。而PUMA是属于Bcl-2家族的一种具有强大促凋亡作用的促凋亡蛋白,仅有一个BH3结构域。通过该结构域,PUMA可与Bcl-2家族多种抗凋亡成员(如Bcl-2和Bcl-xl等)产生广泛的相互作用,使原本结合于抗凋亡蛋白上的Bax解离并多聚化,进而转位激活线粒体依赖的内源性凋亡通路,而发挥强大的促细胞凋亡作用[14-15]。鉴于以上论述,本研究又利用RT-PCR技术对细胞PUMA mRNA的水平进行检测,以期初步阐明HSYA对Aβ损伤PC12细胞保护作用的机制。实验结果证实 Aβ25-35可显著上调促凋亡蛋白 PUMA mRNA的表达,从而诱导PC12细胞大量凋亡;而HSYA保护处理可明显抑制Aβ25-35诱导的PC12细胞凋亡的发生,显著改善Aβ引发的细胞内PUMA mRNA的异常表达,从而维持细胞的正常生理状态。依据上述实验结果,我们认为 HSYA能有效抑制Aβ25-35诱导的细胞凋亡,其作用机制与下调促凋亡因子PUMA mRNA及Bax的表达相关;然而,其中明确的分子关联以及信号转导途径尚不清晰,亟待进一步的研究。
[1]DE-PAULA V J,RADANOVIC M,DINIZ B S,et al.Alzheimer's disease[J].Subcell Biochem,2012,65:329-352.
[2]杨柯君.阿尔兹海默病[J].上海医药,2012,33(14):22-23.
[3]SELKOE D J.Amyloid beta-protein and the genetics of Alzheimer's disease[J].J Biol Chem,1996,271:18 295-18 298.
[4]TANZI R E,BERTRAM L.Twenty years of the Alzheimer's disease amyloid hypothesis:a genetic perspective[J].Cell,2005,120:545-555.
[5]GREENE L A,TISCHLER A S.Establishment of a noradrenergic clonal line of rat adrenal pheochromocytoma cell which respond to nerve growth factor[J].Proc Natl Acad Sci USA,1976,73(7):2 424- 2 428.
[6]SHAFER T J,ATCHISON W D.Transmitter,ion channel and receptor properties of pheochromocytoma (PC12)cells:a model for neurotoxicological studies[J].Neurotoxicology,1991,12(3):473.
[7]国家药典委员会.中国药典(2015年版) I 部[M].北京:中国医药科技出版社,2015:151.
[8]扈晓佳,殷莎,袁婷婷,等.红花的化学成分及其药理活性研究进展[J].药学实践杂志,2013,31(3):161-168+197.
[9]陈梦,赵丕文,孙艳玲,等.红花及其主要成分的药理作用研究进展[J].环球中医药,2012,5(7):556-560.
[10]夏玉叶,闵肠,盛雨辰.羟基红花黄色素A对大鼠脑缺血损伤的神经保护作用[J].中国医药工业杂志,2005,36(12):760-762.
[11]盛雨辰,夏玉叶,闵肠.羟基红花黄色素A对局灶性性脑缺血后大鼠脑组织诱导型一氧化氮合酶的影响[J].中国药理学通报,2006,22(9):1 134-1 137.
[12]陈亭亭,杜玉娟,刘哓雷,等.羟基红花黄色素A对脑缺血大鼠皮层炎症信号转导途径相关因子的抑制作用[J].药学学报,2008,43(6):570-575.
[13]刘一涛,慕容慎行,许国英.红花对脑缺血大鼠脑区精氨酸加压素的影响[J].新中医,1998,30(7):55-56.
[14]段小娴.Bcl-2基因家族对细胞凋亡的调控[J].中国医学文摘(肿瘤学),2001,15(1):80-81.
[15]NAKANO K,VOUSDEN K H.PUMA,a novd proapoptotic gene,is induced by p53[J].Mol Cell,2001,7(5):683-694.
(责任编辑:任万森)
Protective Effect of Hydroxysafflor Yellow A on Aβ25-35-Induced Apoptosis in PC12 Cells
KONG Song-zhi,LI Dong-dong,LI Ji-cheng,WEN Sha-sha,LI Hong-xiang,SHE Yan-min
(College of Science,Guangdong Ocean University,Zhanjiang 524088,China)
To investigate the protective effect of Hydroxysafflor yellow A (HSYA) on Aβ25-35-induced apoptosis in PC12 cells,the neuron-like cells,and to explore its possible mechanisms,in this study,the cells were pretreated with different concentrations (20,40 and 80μmol/L) of HSYA and then further treated with Aβ25-35(20μmol/L),which was used to establish the classical in vitro model of AD.The morphological observation and Hoechst staining method were applied to evaluate cell apoptosis morphology.MTT assay and flow cytometry were used to measure cell viability and cell apoptotic rate,respectively.Meanwhile,the mRNA expression of pro-apoptotic protein PUMA was detected by RT-PCR.The data showed that HSYA could maintain the normal morphology and structure of the cell as well as its synapses,significantly increased cell viability,and reduced its apoptosis rate and the mRNA level of PUMA.Based on these findings,HSYA could effectively inhibit the apoptosis of the neuron-like cells,PC12 cells,induced by Aβ25-35.The protective effect of this natural compound is,at least partially,associated with inhibiting the mRNA level of PUMA.
hydroxysafflor yellow A; alzheimer's disease; Aβ25-35; PC12 cells; apoptosis
R285.5
A
1673-9159(2016)04-0083-06
10.3969/j.issn.1673-9159.2016.04.014
2016-03-13
广东省自然科学基金-博士启动项目(2015A030310360); 广东海洋大学优秀青年骨干教师特别资助计划项目(002014);广东海洋大学创新强校工程科研项目(GDOU2016050229)
孔松芝(1983—),女,博士,从事中药新药开发研究。Email:kongsongzhi@126.com

