核桃青皮多酚氧化酶的酶学特性*
杨卫民,杜京旗,赵君
(吕梁学院 生命科学系,山西 吕梁 033001)
核桃青皮多酚氧化酶的酶学特性*
杨卫民,杜京旗,赵君
(吕梁学院 生命科学系,山西吕梁 033001)
以吕梁本地的“中林1号”核桃青皮为材料,采用比色法对影响核桃青皮多酚氧化酶(PPO)活性的因素,如底物、温度、pH以及激活和抑制作用开展了研究。结果表明,以邻苯二酚为底物,在其浓度0.05mol/L、温度20℃、pH6.0下,波长294nm处核桃青皮PPO活性最高;浓度0.5mol/L的MgCl2对PPO激活作用最强,酶活力为32.2U/min;CuSO4次之,为19.1U/min;乙醇的激活作用也很强,6%乙醇酶活力为27.5U/min;芦丁、Na2SO3和L-半胱氨酸(L-Cys)对PPO活性有较强的抑制作用,且随浓度的增加其抑制率越来越明显。
核桃青皮;多酚氧化酶;酶促动力;激活剂;抑制剂
多酚氧化酶(EC1.14.18.1,PPO)是由核基因编码的铜金属酶,广泛存在于植物体的根、茎、叶、花、果实和种子中[1]。在生物和非生物胁迫下,植物细胞中的PPO活性被激活,催化多酚类物质氧化成醌类,醌自聚且与氨基酸生成黑色或褐色色素沉淀。其结果是在增加机体对病原体抗性的同时,导致了果蔬等经济作物营养丢失和经济损失[2~3]。
核桃(JuglansregiaL.)青皮含有丰富的多酚类、萘醌类、多糖类等化合物[4]。正常情况下,PPO定位于核桃青皮叶绿体的类囊体和其它质体的基质中,呈无活性状态,而其酚类底物存在于液泡中,彼此被分隔包裹。而在生物和非生物胁迫下,尤其是当核桃受到外力损伤和冻害时,随组织中细胞亚结构的破坏,PPO被激活且与其底物发生反应,将单酚羟化为双酚,再氧化双酚为醌及衍生物。醌自动集合且与细胞内一些氨基酸基团(如-SH,-NH2)发生反应,产生黑色和褐色物质沉淀,导致组织发生褐变[5],造成了核桃产量与品质的下降。这是长期影响我国北方地区核桃产业发展的一个重要因素。对于核桃多酚氧化酶研究,主要是利用核桃青皮酶促褐变的原理,研发植物源生物农药和染发剂等[6~9]。而关于核桃青皮多酚氧化酶的酶学特性未见报道。本文通过研究核桃青皮的PPO的酶学特性,以及对其的激活和抑制作用,不但可以了解核桃果实发生褐变的机制,还可以为核桃青皮产业化再利用提供技术支持。
1 材料与方法
1.1材料采集
核桃青皮于2015年9月25日采集于吕梁本地,树龄为7年,为中林1号品种。
1.2方法
1.2.1核桃青皮中PPO的提取
将新鲜的青核桃洗净、晾干后手工剥皮,快速剪碎青皮后加保鲜膜置于冰箱中冷藏,备用。
准确称取核桃青皮3g,置于研钵中,加12mL预冷的超纯水冰浴研磨至匀浆状。在冰冻条件下,将匀浆物进行超声波细胞破碎(变幅杆Ф6、超声时间3s、间隔1s、破碎总时间10min),于12 000r/min下冷冻离心20min,温度4℃,重复3次,定容至100mL,获得PPO粗酶液,4℃保存备用。
1.2.2核桃青皮PPO酶促反应产物的光谱特性测定
参照文献[10],略有改动。反应体系中pH为6.0,25℃下保温6min,波峰扫描为250~700nm。
1.2.3温度、pH和底物浓度对核桃青皮PPO活
性的影响
参照文献[10],略有改动。
(1)温度对核桃青皮PPO活性的影响反应体系,pH为6.0,在10、25、30、35℃下保温6min。
(2)pH对核桃青皮PPO活性的影响设置pH为4.8、5.2、5.6、6.0、6.4、6.8、7.2磷酸氢二钠-柠檬酸缓冲液体系,在反应体系20℃下保温6min。
(3)底物浓度对核桃青皮PPO活性的影响加0.02mol/L、0.03mol/L、0.04mol/L、0.05mol/L、0.06mol/L、0.07mol/L、0.09mol/L的邻苯二酚溶液2.0mL,在反应体系pH为6.0,20℃下保温6min。
1.2.4激活剂和抑制剂对核桃青皮PPO活性的影响
配制不同浓度的激活剂如MgCl2、CuSO4、乙醇和抑制剂如Na2SO3、芦丁、L-Cys(MgCl2、CuSO4、Na2SO3浓度均为0.1mol/L、0.2mol/L、0.3mol/L、0.4mol/L、0.5mol/L、0.6mol/L;乙醇浓度为2%、4%、6%、8%、10%;芦丁浓度为2mol/L、3mol/L、4mol/L、6mol/L、8mol/L、10mol/L;L-Cys浓度为0.05mol/L、0.1mol/L、0.2mol/L、0.3mol/L、0.4mol/L)。
反应体系参照文献[10]。分别加入不同浓度的激活剂或抑制剂lmL,摇匀,20℃下保温6min,以不加激活剂或抑制剂为对照组,检测其吸光度,并计算酶活性。
1.3统计与计算
核桃青皮PPO活性单位的表达与计算参照文献[10]进行。
2 结果与分析
2.1核桃青皮PPO酶促反应产物的光谱特性确定
由邻苯二酚、柠檬酸-磷酸氢二钠缓冲液(pH6.0)和粗酶液组成的反应体系,在250~700nm范围内进行了波峰扫描,结果见图1。

图1 核桃青皮PPO紫外扫描图Fig.1 The uv scan of PPO in walnut green husk
从图1可以看出,光谱扫描图中只有一个明显的波峰,无其它杂质干扰。其最大吸收波峰为294nm,吸光值为1.429;1min后再检测其结果为,吸光值为1.448,OD值之差为0.019,此时PPO活力为28.5U/min。

图2 温度对PPO活性的影响Fig.2 The influence of temperature on PPO activity
PPO的底物种类较多,包括邻苯二酚、愈创木酚、儿茶酚、绿原酸等,不同来源的PPO对不同底物的催化效果有较大的差异,其产物光吸收峰值也差异明显[11]。
2.2温度对核桃青皮PPO活性的影响
由图2可知,温度对核桃青皮PPO活性的影响差异很大,PPO最适温度区域为15~25℃,在温度为20℃时,酶活力最高,为9.1U/min。当温度在10~20℃范围内时,随温度升高,酶活力随之增大,酶活性增强;当温度超过20℃时,随着温度的升高,酶活力逐渐降低。
温度对酶活性的影响很大,不同的酶最适温度范围也不同[12]。PPO蛋白具有一般蛋白质的特性,对温度很敏感,即使在较低温度(15℃)下也没有影响酶分子和底物结合以及酶活力;温度高于20℃后酶活力下降的原因是温度使得酶的活性部位构象开始发生了变化,与蛋白质变性有关。可见,核桃青皮PPO是一种对温度特别敏感的酶。
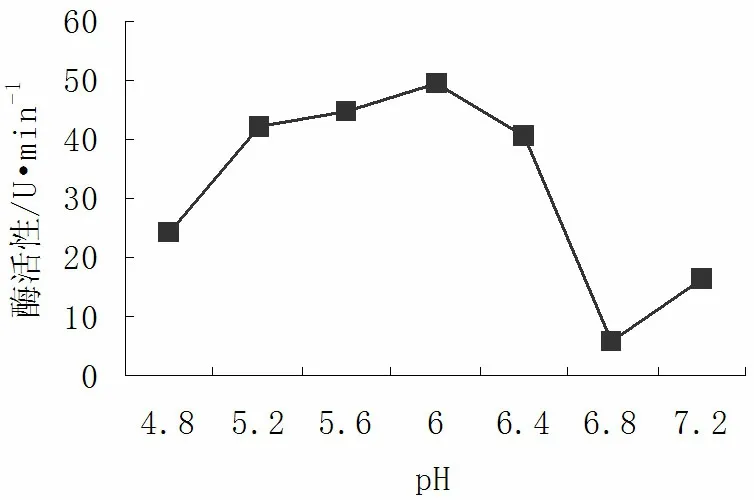
图3 pH对PPO活性的影响Fig.3 The influence of pH on PPO activity
2.3pH对核桃青皮PPO活性的影响
从图3可以看出,不同pH值对核桃青皮中PPO活力的影响差异很大。PPO最适pH值区域为5.2~6.5,最适pH值为6.0,此时酶活力最大,为49.6U/min。高于或低于pH6.0时酶活力都会下降。
PPO是含铜的酶蛋白,其活性对pH值有严格的要求,过酸或偏碱时酶活性都会降低[13]。一般当pH处于4.8~6.5范围内,蛋白酶逐渐达到其等电点。在偏酸性的环境中,PPO活力增强,活性也逐渐增大。
2.4底物对核桃青皮PPO活性的影响
PPO对底物有严格的要求,不同浓度下酶活性差异很大[11~12]。
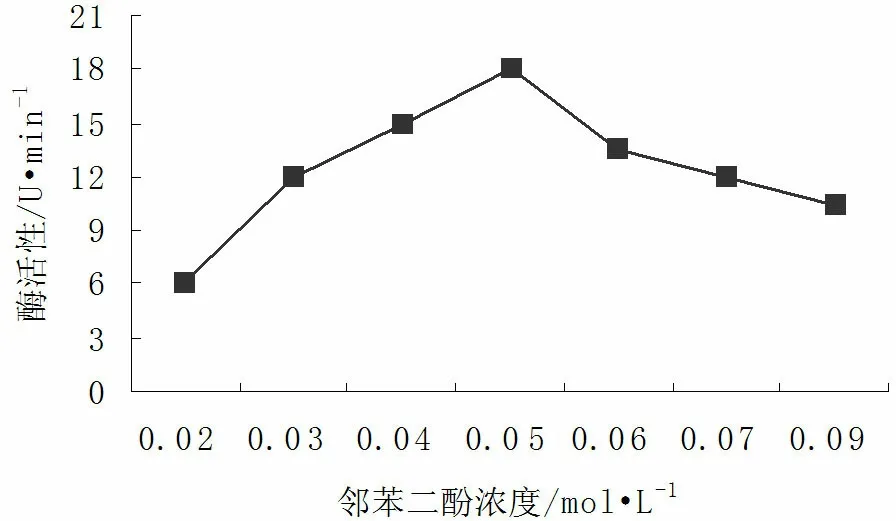
图4 底物浓度对PPO活性的影响Fig.4 The influence of substrate on PPO activity
由图4可知,在不同浓度的邻苯二酚下,核桃青皮PPO活力差异很大。当邻苯二酚浓度为0.03~0.07mol/L时PPO活力水平较高,0.05mol/L时PPO酶活力最高,为18U/min。当浓度大于0.05mol/L时,PPO活力随着底物浓度的增加而下降,酶活性也随之降低。
较高浓度的底物不但未增加酶活力,反而抑制了酶促反应的进行。其原因可能是与植物褐变组织中PPO自杀性失活和酶促褐变两种作用维持着平衡有关。即高浓度的邻苯二酚与PPO的辅基可能发生络合,改变PPO活性中心的构象,使反应向不利于底物与酶结合的方向进行[14~15]。
综上所述,核桃青皮PPO活性与其底物浓度、pH值和温度大小密切相关,可通过控制酶促反应条件,尤其是底物浓度来防止酶促褐变的发生。反之,为了保证酶促反应的进行,生产中除控制温度和pH值大小外,可适量增加酶用量,或减少底物浓度以防止底物与PPO的辅基可能发生的络合。
2.5激活剂对核桃青皮PPO活性的影响
2.5.1CuSO4对核桃青皮PPO活性的影响
由图5可知,CuSO4浓度对核桃青皮PPO活性的影响比较复杂。当CuSO4浓度为0.1~0.2mol/L时,PPO活力随其浓度增加而减弱,PPO呈现抑制状态;浓度为0.2~0.5mol/L时PPO活力快速增强,PPO呈现激活状态;浓度为0.5mol/L时PPO活力达最大值,为19.1U/min,此时酶活性最强;浓度大于0.5mol/L时PPO活力开始下降,PPO活力又被强烈抑制。

图5 CuSO4对PPO活性的影响Fig.5 The influence of CuSO4 on PPO activity
PPO是含铜的蛋白质体,金属(铁、铜、锡、铝等)离子是PPO的激活剂,一定浓度的Cu2+对PPO活性有激活效果[16]。Fe3+、Fe2+、Cu2+不仅能和酚类化合物反应形成褐色物质,而且能催化还原酮类的氧化[17]。
2.5.2MgCl2对核桃青皮PPO活性的影响
由图6可知,MgCl2浓度对核桃青皮PPO活性的影响很大。在其浓度为0.1~0.5mol/L时,核桃青皮PPO活力随着MgCl2浓度的增加而升高,表现为激活作用;当其浓度为0.5mol/L时酶活力最大,为32.2U/min,此时激活作用也最强;当MgCl2浓度大于0.5mol/L时,PPO活力会随MgCl2浓度增加而降低,PPO活力逐渐减弱。

图6 MgCl2对PPO活性的影响Fig.6 The influence of MgCl2 on activity of PPO
MgCl2的存在会稳固PPO结构中Cu2+的2个配位键,使PPO酶活性增强[10]。
2.5.3乙醇对核桃青皮PPO活性的影响
由图7可知,乙醇对核桃青皮PPO活性的影响效果显著,随乙醇浓度的增加PPO活力呈现先升高后降低的趋势,且激活效果显著。当乙醇浓度为2%~6%时,PPO活力先缓慢升高后急剧增强,浓度为6%时PPO活力达到最高,为27.5U/min,此时激活作用也最强;而在浓度为6%~10%时,PPO活力则急速下降,其中,乙醇浓度为6%~8%时降幅最大,浓度为10%时PPO活力降到最低,为1.7U/min,此时PPO完全处于失活状态。
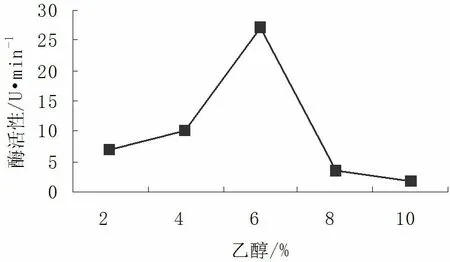
图7 乙醇对PPO活性的影响Fig.7 The influence of ethanol on PPO activity
对PPO而言乙醇也是一种激活剂[17]。同样具备与MgCl2、CuSO4相同的作用。乙醇是带有一个羟基的饱和一元醇,具有还原性。过量的乙醇有可能将PPO中的Cu2+还原成为砖红色Cu2O的沉淀,抑制了PPO活性。
一定浓度的CuSO4、MgCl2和乙醇等3种激活剂,会稳固PPO分子结构中Cu2+的两个配位键,使PPO呈活性状态,有激活PPO分子活性的作用。
2.6抑制剂对核桃青皮PPO活性的影响
2.6.1芦丁对核桃青皮PPO活性的影响
由图8可知,芦丁对核桃青皮PPO活性有明显的抑制作用,且随芦丁浓度的增加PPO活力呈现快速下降的趋势。当芦丁浓度为0.2~0.3mol/L时,PPO活力下降幅度最为明显,分别为37.4U/min和27.2U/min,浓度在0.3~0.8mol/L范围内对PPO活力的抑制作用缓慢降低,当其浓度为0.8mol/L时PPO活力最低,为10.2U/min,此时活性也随之丧失。
黄酮类b环上的羟基的数目和相互位置是其抑制的决定因素,羟基越多抑制一般越强,羟基邻位比间位更利于抑制作用[18~19]。芦丁是黄酮类化合物,具有较强的抗氧化能力。芦丁与酶结合会导致酶活性中心向不利于与底物结合的方向变化,从而降低了酶与底物结合的几率以及产物生成,导致酶活性降低[20]。

图8 芦丁对PPO活性的影响Fig.8 The influence of rutin on PPO activity
2.6.2Na2SO3对核桃青皮PPO活性的影响
由图9可知,Na2SO3对核桃青皮PPO活力有明显的抑制作用,且随浓度的增加PPO活力呈现快速下降的趋势。当Na2SO3浓度在0.1~0.4mol/L范围内时,PPO活力几乎呈直线下降,分别为17U/min、10.2U/min、5.1U/min、1.7U/min,此阶段酶活性快速丧失,抑制效果显著;Na2SO3浓度为0.4~0.6mol/L范围内时,酶活力最低,为1.7U/min,此阶段抑制效果也最好。
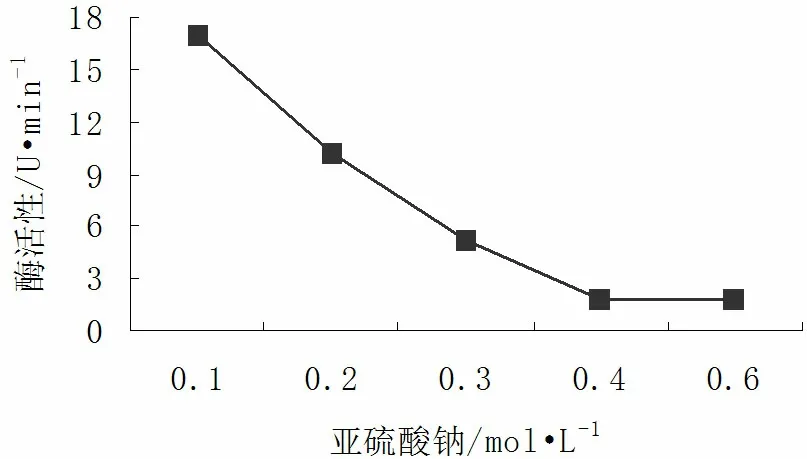
图9 Na2SO3对PPO活性的影响Fig.9 The influence of Na2SO3 on PPO activity
Na2SO3还原性极强,可直接作用于酶本身,降低对单酚和二酚类的催化反应活性,还可与醌类物质发生不可逆的结合,形成无色物质[21]。Na2SO3也会稳固PPO结构中Cu2+的两个配位键,使之难以断裂。同时,Na2SO3与酶蛋白发生键连,修饰了蛋白质结构[22]。
2.6.3L-Cys对核桃青皮PPO活性的影响
由图10可知,L-Cys对核桃青皮中PPO有明显的抑制作用,且随其浓度的增加PPO活力呈现快速下降的趋势。L-Cys浓度大于0.3~0.4mol/L时,PPO酶活力分别为5.1U/min和3.4U/min,降幅由快变慢逐渐趋于平缓,PPO活力也处于最低状态。

图10 L-Cys对PPO活性的影响Fig.10 The influence of L-Cys on PPO activity
L-Cys可以与醌类化合物生成无色和稳定的化合物,防止醌类化合物结合与氨基酸结合,从而阻止其组织发生褐变[23]。L-Cys又是醌的还原剂,可还原醌成酚[24]。L-Cys中的SH基团可去除PPO活性中心的铜,或取代与活性中心的铜紧密配合的组氨酸残基[25]。或通过与PPO的活性部位发生共价结合对活性中心进行结构性修饰,从而使酶活性下降[26]。
L-Cys、芦丁、Na2SO3等3种抑制剂的作用机制是加快了PPO分子结构中Cu2+配位键的断裂,使PPO处于无活性状态。
3 结论与讨论
核桃酶促褐变的发生需要满足酶、底物和以氧为氢受体等条件。控制其中的任意一个因素或几个因素便能够达到控制酶促褐变的发生。在核桃采摘及加工过程中,严格控制PPO活性是防止酶促褐变的重要手段。但在基于核桃青皮生物农药、药物中间体和染发剂的研究中,可通过提高PPO活性、控制底物浓度、温度和增加氧含量来促进酶促褐变的发生。
PPO酶促反应的底物为多酚类物质,常见的底物有儿茶素、绿原酸、苯酚和愈创木酚等[27]。以邻苯二酚为底物,在浓度0.05mol/L,最适温度20℃,最适pH6.0下,在294nm处检测到核桃青皮PPO活力最高。
金属(铁、铜、锡、铝等)离子是多酚氧化酶的激活剂[28]。它们可通过使底物与酶活性部位直接结合,或通过可逆的改变金属离子的氧化态调节氧化还原反应,或通过静电稳定或屏蔽负电荷等途径参加酶的催化反应。其中,Fe3+、Fe2+、Cu2+能促进褐变的主要原因是铁和铜不仅能催化还原酮类的氧化,还能和酚类化合物反应形成褐色物质,具有双重效果。朱显峰等[29]、薛超彬等[30]认为Cu2+能激活菜青虫(Pierisrapae)中PPO和漆酶的活性,GUO Li等[31]、马晓春等[32]、段玉权等[33]和Jimenz等[34]认为Mg2+对荔枝(Litchichinensis)、绿豆(Vignaradiata)和葡萄(Vitisvinifera)中的PPO有激活作用。研究发现;MgCl2和CuSO4对核桃青皮PPO激活作用较强,相同的浓度下,MgCl2对核桃青皮PPO激活作用高于CuSO4;乙醇对核桃青皮PPO激活作用较强,6%乙醇激活作用最强,为27.5U/min。
[1]胡春和.多酚氧化酶的研究现状[J].中国高新技术企业,2009(2):73-75.
[2]贺立红,宾金华.高等植物中的多酚氧化酶[J].植物生理学通讯,2001,37(4):340-345.
[3]Steffens J C,Hare L E,Hunt M D.Polyphenol oxidase.pages in:genetic engineering of plant secondary metabolism[M].Plenum Press:New york,1994:275-312.
[4]Min B S,Nakamuran N,Miyashiro H,etal.Inibition of human immunode ficiency virus type reverse transcriptase and ribonuclease activities by constituents of Juglans mandshurica [J].Chem Pharm Bull ,2000 ,48(2):194- 200.
[5]Anthony San Luis.The cardiovascular benefits of polyphenol compounds [J].Advances in Anthropology,2013,3(4):183-187.
[6]冉翠香,高兴盛,杨卫民,等.酶法辅助超声波微波仪从胡桃青皮中提取胡桃醌的工艺研究[J].氨基酸和生物资源,2014,36(1):73-76.
[7]张世珍,高兴盛,杨卫民,等.核桃青皮中多元酚类化合物的提取及含量分析[J].南方农业,2014,18(34):159-162.
[8]杨卫民,冉翠香,高兴盛,等.核桃青皮废弃物中木霉菌的分离及其适应性研究[J].生物技术通报,2014(12):153-160.
[9]杨卫民,杜京旗,赵君,等.一种基于核桃青皮色素的染发剂制备方法[P].中国专利:ZL201310229503.1,2015-4.
[10]田国政,程超,田莉,等.青蒿多酚氧化酶的酶学特性研究[J].食品科学,2014,39(19):149-152.
[11]Lee MK,Park I.Inhibition of potato polyphenol oxidase by maillard reaction products[J].Food Chemistry,2005,(91):57-61.
[12]李琦.鲜菊芋块茎加工过程中酶促褐变及其控制研究[J].安徽农业科学,2008,36(21):9273-9274
[13]王曼玲,胡中立,周明全,等.植物多酚氧化酶的研究进展[J].植物学通报,2005,22(2):215-222.
[14]王雪静,张子德.核桃果实中影响PPO活性因素的研究[J].河北农业大学学报,2005,28(3) :60-62.
[15]雷东锋,冯怡,蒋大宗.植物中多酚氧化酶的特征[J].自然科学进展,2004,14(6):606-614.
[16]刘文山,肖凯军,郭祀远.苹果多酚氧化酶的提取及其抑制作用的研究[J].现代食品科技,2006(4):82-84,155.
[17]孔俊豪,孙庆磊,涂云飞,等.多酚氧化酶的酶学特性研究及其应用进展[J].中国野生植物资源,2011,30(4):13-17.
[18]长谷川金.昆虫变态的生理化学[M].北京:农业出版社,1988:89-93.
[19]Lowry OH,Rosebrough NJ,Farr AL,etal.Protein measurement with the folin phenol reagent[J].Biolology Chemistry,1951,193(1):265-275.
[20]刘晓燕,马晓军.几种抑制剂对小麦PPO活性抑制效果研究[J].中国粮油学报,2012,21(4):35-39.
[21]韩涛,李丽萍.果蔬PPO的抑制及褐变的防治因素[J].北京农学院学报,1999,14(4):88-93.
[22]李荣林.固定化多酚氧化酶的化学性质研究[J].茶叶,1998,24(1):18-21.
[23]孔维宝,陆健,赵海锋,等.L-半胱氨酸抑制PPO的机制研究[J].食品科学,2007,28(17):66-70.
[24]王璋.食品酶学[M].北京:轻工业出版社,1990:268.
[25]Valero E,Varon R,Garca-Carmona F.A kinetic study ofirreversible enzyme inhibition by an inhibitor that is rendered unstable by enzymic catalysis[J].Biochem J,1991,277:869-874.
[26]Robert C,Cadet F.The Inhibition of studies on polyphenoloxidase by cysteine[J].Biochem Educa,1996,24:157-159.
[27]高路.紫甘薯多酚氧化酶最适底物研究[J].粮食与油脂,2010(10):27-28.
[28]林庆同,王伟,杨美花.金属离子对马铃薯多酚氧化酶活力的影响[J].厦门大学学报(自然科学版),2010,49(4):561-563.
[29]朱显峰,丁涛.常见金属离子对漆酶酶活的影响[J].化学研究,2003,14(3):50-51.
[30]薛超彬,王勤,贺量,等.金属离子对菜青虫酚氧化酶活力的影响[J].厦门大学学报,2005,44(增刊 1):120-122.
[31]GUO Li,MA Ying,SHI J,etal.The purification and characterisation of polyphenol oxidase from green bean[J].Food Chemistry,2009,117(1):143-151.
[32]马晓春,韩宏岩,许维岸.家蚕表皮多酚氧化酶的分离纯化及酶学性质研究[J].安徽农业科学,2009,37(17):7870-7871.
[33]段玉权,董维,张明晶,等.中华寿桃多酚氧化酶的特性研究[J].中国农业科学,2008,41(3):795-799.
[34]Jimenz M,Garcia-Carmona F.Measurement of latent polyphenol oxidase activity in the presence of the divalent cations Ca2+,Mg2+and Mn2+[J].Phytochemical Analysis,1993(4):149-151.
Enzyme Properties of Polyphenol Oxidase in Green Husks of Walnut(Juglans regia L.)
YANG Wei-min,DU Jing-qi,ZHAO Jun
(Department of life science,Lüliang University,lüliang Shanxi 033001,P.R.China)
By taking the green husk from Walnut Zhonglin 1 as the materials,and based on color-comparison approach,the influence factors of polyphenol oxidase(PPO)activity such as substrate,temperature,pH,and activating and inhibitory were studied.The results showed that catechol as substrate with the concentration of 0.05mol/L,temperature of 20℃,pH of 6.0,the PPO activity in green husk of walnut was strongest at 294nm.The effect of 0.5mol/LMgCl2on PPO activation,32.2 U/min,was the strongest,and CuSO4was second with 19.1U /min.The effect of ethanol on enzyme activity was also strong,27.5 U/min under 6% ethanol.The rutin,Na2SO3and L-cysteine (L-Cys) have strong inhibition on PPO activity,and its inhibition rate increased as concentration increasing.
Green husks of walnut; polyphenol oxidase; enzyme kinetics; activator; inhibitor
10.16473/j.cnki.xblykx1972.2016.05.003
2015-10-23
吕梁学院自然科学校内基金(ZRXN201411)。
杨卫民(1960-),男,教授,主要从事植物资源开发与利用研究。E-mail yangweimin0318@ sina.com
Q 946.5;TQ 28
A
1672-8246(2016)05-0012-07

