儿童心肌病的磁共振特征
曹永丽, 彭芸, 王帆宁, 尹光恒
·儿科影像学·
儿童心肌病的磁共振特征
曹永丽, 彭芸, 王帆宁, 尹光恒
目的:分析儿童心肌病磁共振的临床影像学特点。方法:回顾性搜集我院64例临床诊断儿童心肌病患者,其中心内膜弹力纤维增生症(EFE)26例,肥厚型心肌病(HCM)14例,扩张型心肌病(DCM) 16例,限制型心肌病(RCM) 4例,致心律失常性右室心肌病(ARVC) 2例,心肌致密化不全(NVM) 2例。采用1.5T磁共振扫描,不能配合的患儿用0.5 mL/kg水合氯醛镇静。所有患儿行黑血快速自旋回波(TSE)、亮血平衡稳态自由进动梯度回波(balanced SSFP)电影,26例行快速自旋回波心肌延迟增强,28例行相位敏感反转恢复(PSIR)心肌延迟增强扫描。结果:26例EFE均有左室心腔扩大,9例伴心肌变薄;16例心肌收缩运动幅度减低;左房增大7例;左室肌小梁增多增厚13例;瓣膜返流18例;心包积液7例,胸腔积液4例。14例HCM共有66个左室节段心肌增厚,室间隔的增厚14例,共累及45个节段,左室游离壁增厚12例,共累及21个节段。1例右室心尖部受累。左室内乳头肌异常4例。左室肌小梁增多增厚6例。16例DCM均有心腔扩大,左室心肌变薄,左房左室同时显著增大12例,8例为全心增大,仅左室增大2例。13例患者心室壁收缩运动幅度均明显减低。左室游离壁肌小梁增粗增厚11例。瓣膜返流13例。心包积液9例,胸腔积液7例。4例RCM,均为双心室受累,舒张运动受限,心室腔大小正常,双侧心房明显扩张,6例瓣膜返流。下腔静脉扩张4例。心包积液3例。2例ARVC,MRI均可见右室流出道扩张,局部室壁变薄,“手风琴征”阳性。2例NVM,左室心内膜及肌小梁明显增厚,交叉呈网,相邻心肌变薄,NC/C约3.1~7.5。6例延迟强化,HCM 1例,EFE 2例,DCM 3例。结论:儿童心肌病的临床表现多样化,多伴有心功能异常,磁共振影像学表现有一定的特点,两者密切结合可以作出诊断。
儿童; 儿科学; 心肌疾病; 磁共振成像
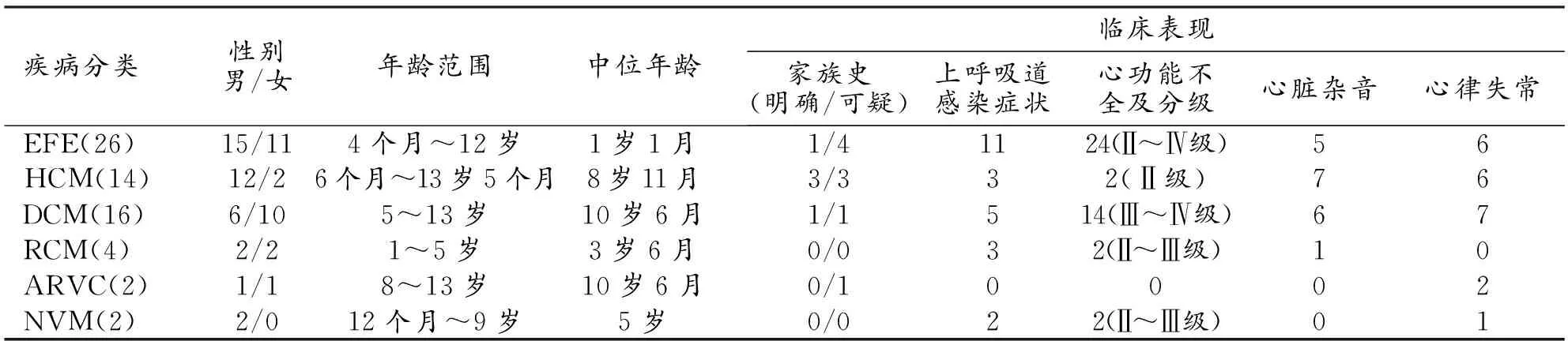
表1 心肌病的种类及临床表现
心肌病是一组非同源性、伴有机械和/或电生理功能异常的心肌疾病。儿童心肌病(CM)在儿童期是严重的疾病,约71%~90%患者合并心力衰竭[1],并且是儿童心脏移植最常见的原因之一[2]。有些心肌病在明确病因,正规积极治疗后,有逆转恢复正常或获得明显改善的希望,因而早期发现、早期诊断和治疗尤为重要。心脏磁共振可以从形态学、功能学及血液动力学上对心脏进行多方面评价,为临床提供重要的参考信息。
材料与方法
1.临床资料
搜集2006年1月-2015年6月64例心肌病患者,包括心内膜弹力纤维增生症(endocardial fibroelastosis,EFE)26例,肥厚型心肌病(hypertrophic cardiomyopathy,HCM)14例,扩张型心肌病(dilated cardiomyopathy,DCM)16例,限制型心肌病(restrictive cardiomyopathy,RCM)4例,致心律失常性右室心肌病(arrhythmogenic right ventricular cardiomyopathy,ARVC)2例,心肌致密化不全(noncompaction of the ventricular myocardium,NVM)2例。男38例,女26例,年龄4个月~13岁5个月,中位年龄5岁6个月。3例行基因检测。 5例有明确家族史,9例可疑家族史。
2.仪器设备与操作方法
飞利浦1.5T Achieva(33例),均采用8通道心脏线圈,早期5例较小患儿(4~5个月)采用体线圈,及Ingenia全数字磁共振(31例)扫描。不能配合的患儿剥夺睡眠,10%水合氯醛0.5 mL/kg口服镇静。平均扫描时间45~90 min。5名患儿屏气下扫描,其余患者均采用自由呼吸下扫描。采用胸前电极心电门控及呼吸触发扫描。电影扫描采用cine 稳态自由进动梯度回波(steady-state free precession,SSFP)序列,进行多平面扫描。黑血序列采用快速自旋回波(turbo spin echo,TSE)序列或单次激发快速自旋回波序列。54例患儿进行了延迟增强扫描,对比剂采用钆喷酸葡胺(马根维显,拜耳先灵制药,柏林) 0.2 mL/kg。注入对比剂后8~10 min开始扫描。扫描序列采用快速自旋回波序列(26例)及相位敏感反转恢复(phase-sensitive inversion recovery,PSIR)序列(28例),行SA多层面扫描(54例),4CH多层面扫描(5例)。
结 果
1.临床表现
64例为临床诊断心肌病,各自临床表现见表1。其中EFE及HCM患者年龄跨度较大。EFF患儿年龄范围为4个月~12岁,平均年龄1岁1个月~12岁,此患儿婴儿期确诊为EFE,经治疗后好转,12岁时常规检查发现心脏再次增大时行心脏磁共振扫描。2例ARVC患者心率失常表现为来自右室心尖部的室性心动过速及早搏。3名患儿行基因检查发现突变(1名8岁男孩经基因诊断为MYH7编码区氨基酸突变的HCM;1名13岁男孩,经基因检测确诊ARVC;1 名8岁女孩,基因检查JUP基因突变)。
2.影像学表现
26例心内膜弹力纤维增生症患者中,MRI显示所有病例均有不同程度左室心腔扩大,其中9例次左室呈球形膨隆(图1);16例次心肌收缩运动幅度减低;左房增大7例次;左室肌小梁增多增厚13例次;18例患者中见瓣膜返流,二尖瓣返流16例次,三尖瓣返流4例次;心包积液7例次,胸腔积液4例次。26例行增强后延迟扫描,2例见心内膜强化。
14例肥厚型心肌病患者中,梗阻型5例,非梗阻型9例。MRI发现共有66个节段心肌不同程度增厚,均为局灶性分布。14例均有室间隔的增厚,共累及45个节段,分别为基底部间前壁11个(图2a)、间下壁4个;心中部间前壁11个(图2b),间下壁8个;心尖部间前壁7个,间下壁4个。左室游离壁增厚共累及12例21个节段,基底部前壁9个(图2c)、前侧壁2个;心中部前壁4个,前侧壁1个;心尖部前壁3个,前侧壁2个。1例右室心尖部受累(图3)。左室内乳头肌异常4例,增厚肥大2例次(图4),数目增多2例次,位置异常2例次。左室肌小梁增多增厚6例。二尖瓣少量返流3例。8例行增强扫描,1例见延迟强化,位于局部明显增厚的心肌内,呈斑点状强化。
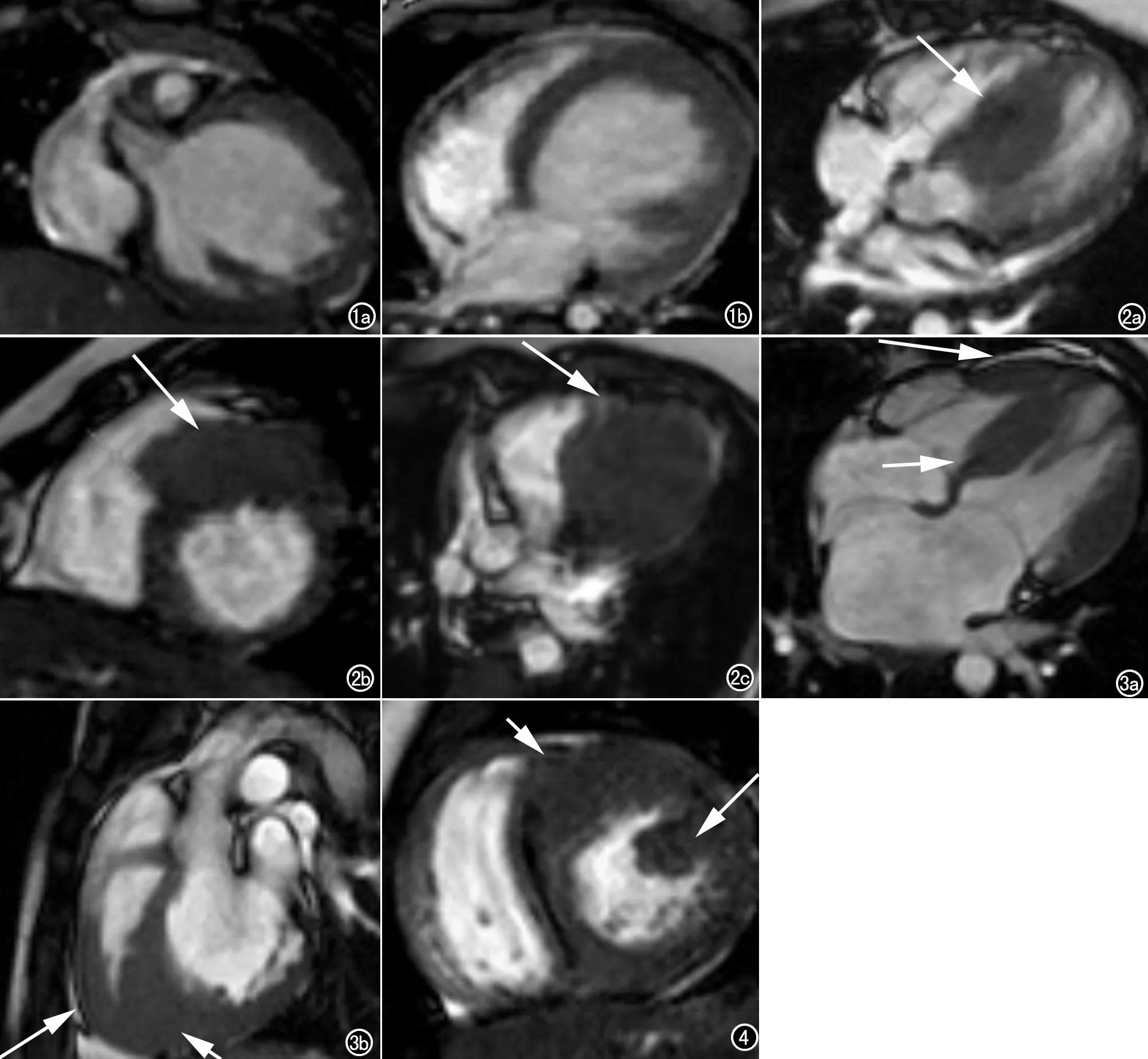
图1 EFE患者。女,9月,呼吸道感染后发现心脏增大就诊。a)亮血序列冠状位显示左室腔球形扩大,肌小梁增多增厚;b)亮血序列轴位显示左室球形扩张,室间隔向右室侧弧形膨隆。治疗3个月后复查心脏彩超,左室腔回缩。 图2 HCM患者,男,9岁,其父亲室间隔增厚。a)四腔心电影序列,基底部室间隔非对称性增厚(箭); b)左室短轴电影序列,基底部至心中部室间隔非对称性增厚(箭),突入右室流出道,局部心腔变窄;c)左室基底部前壁心肌增厚(箭)。
图3 HCM男,13岁5个月。a)四腔心层面显示右室游离壁心尖部(长箭)及室间隔心肌增厚(箭);b)左室流出道层面显示左室心尖部(箭)及右室心尖部心肌增厚(长箭)。 图4 HCM男,6月5天。心中部室间隔前间壁及左室前壁心肌增厚(箭),乳头肌异常粗大肥厚(长箭)。
16例扩张型心肌病中,MRI显示所有患儿均有心腔扩大,左室心肌变薄,左房左室同时显著增大12例(图5a),8例为全心增大,仅左室增大2例。13例患者心室壁收缩运动幅度明显减低。左室游离壁肌小梁增粗增厚11例,但均未累及心尖。13例患者见瓣膜返流,其中二尖瓣返流11例次,三尖瓣返流4例次。心包积液9例次,胸腔积液7例次。12例行增强后延迟扫描,延迟强化3例,位于心肌中层及透壁样强化(图5b)。
限制型心肌病4例,均为双心室受累,收缩运动幅度基本正常,舒张运动明显受限,心室腔大小均显示基本正常,双侧心房均明显扩张(图6),6例次瓣膜返流,二尖瓣返流4例次,三尖瓣返流2例次。下腔静脉扩张4例。心包积液3例。4例均行增强扫描,均未见延迟强化。
致心律失常性右室心肌病2例,MRI均可见右室流出道扩张(图7a),局部室壁变薄;“手风琴征”阳性1例(图7b),未见明确心室壁脂肪化。2例均行增强扫描,未见延迟强化。
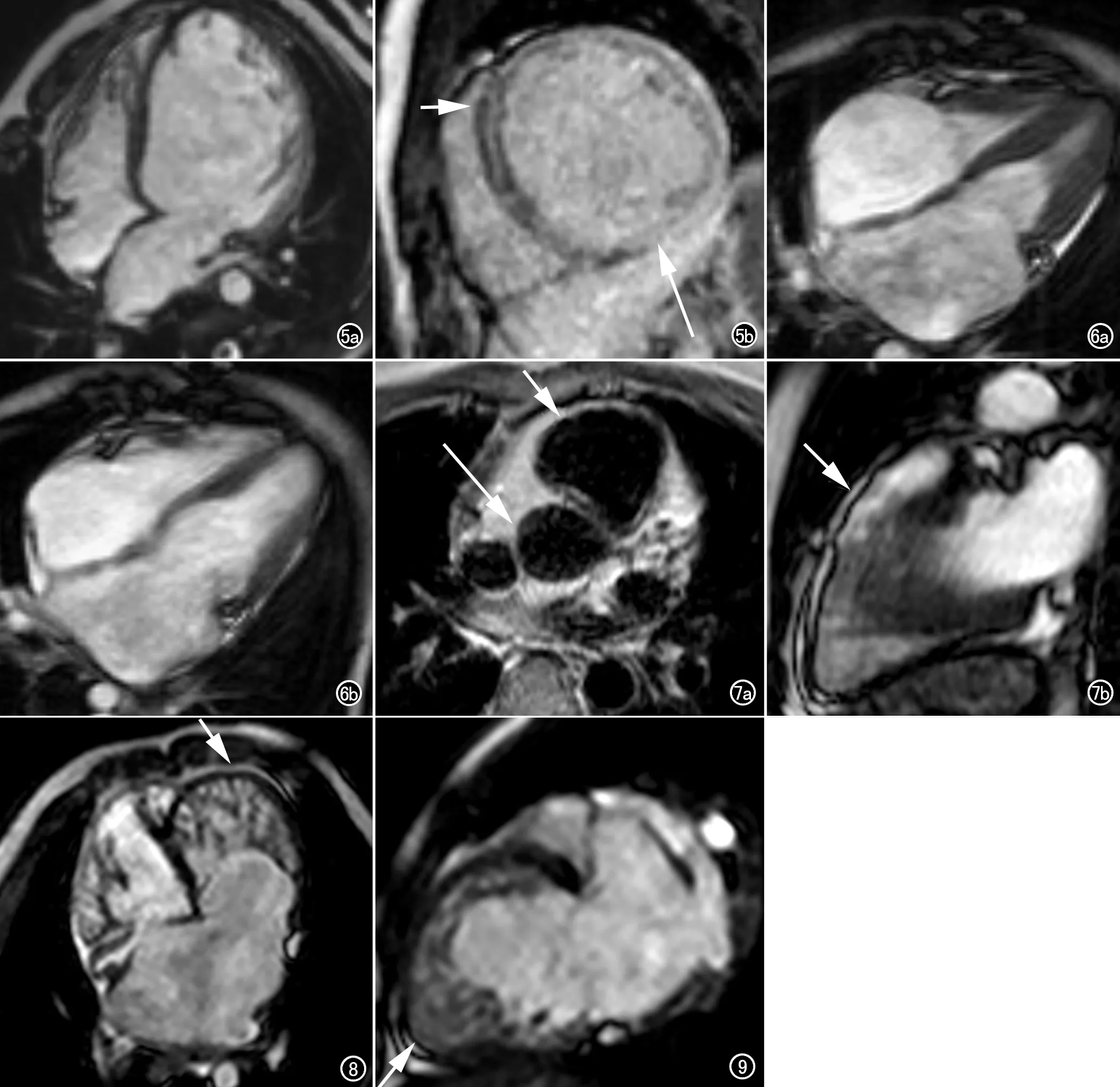
图5 男,13岁。a)左房左室增大,左室心肌壁变薄,肌小梁增多增厚;b)延迟强化短轴,透壁强化(长箭)及心肌中层线状强化(箭)。 图6 男,3岁。a)四腔心收缩末期,双侧心房明显增大,心室收缩幅度正常;b)四腔心舒张末期,双侧心室舒张幅度受限。
图7 男,13岁。a)右室流出道扩张(箭),较同层升主动脉增宽(长箭);b)右室流出道前壁运动异常,局部邹缩(箭)。 图8 NVM,男,9岁。四腔心位左室心内膜及肌小梁明显增厚,交叉呈网,小梁内为血流信号,相邻心肌变薄,NC/C约7.5(箭)。
图9 NVM,男,12个月。左室两腔心示左室心内膜及肌小梁明显增厚,呈网格样改变,心尖部最明显,相邻心肌变薄,NC/C约3.1(箭)。
心肌致密化不全2例,1例MRI发现左室心尖、心尖段全层、心中部前、侧、下,壁,室间隔下部/基底段前、侧、下壁心内膜及肌小梁明显增厚,交叉呈网,相邻心肌变薄,非致密化心肌厚度/致密化心肌厚度(noncompacted myocardium/compacted myocardium,NC/C)约7.5(图8),同时左房明显扩张,伴二尖瓣返流。另1例可见左室心尖、心尖段下壁、侧壁、前壁、中段侧壁、基底段侧壁心内膜及肌小梁增厚,相邻心肌变薄,NC/C约3.1,未见瓣膜返流(图9)。2例患者均行增强扫描,未见强化。
讨 论
心肌病的病因并不都很明确,常见有基因缺陷所致,除此之外还可能与感染,代谢异常,免疫缺陷等相关。如HCM最常见的基因突变为MYH7、MYBPC3[3];ARVC目前已确定有6个基因位点与其有关[4];DCM患者中遗传性约占30%~35%等。因检测技术受限及检测费用较高,本组患者中仅有3例行基因检测,2例检测到与相关疾病对应已证实的基因位点发生突变,另1例检测到JUP基因突变,但尚未有相关位点突变的报导。同一种基因的不同功能区域突变,可以引起不同类型的心肌病,即使同一位点突变,也可引起不同类型的心肌病表现[5,6]。所以心肌病的定义和分类也在不断更新。
儿童期心肌病最常见的类型是扩张型心肌病[7],但本组病例中心内膜弹力纤维增生症所占比例最大(40.6%,26/64),扩张型心肌病其次(25.0%,16/64),肥厚型心肌病第三(21.9%,14/64)。分析原因可能与心肌病的分类有关,EFE在1995年世界公共卫生组织WHO的心肌病分类中归为未定型心肌病,而在2006年美国心脏学会对心肌病分类标准中,EFE在婴儿和儿童期属于由病毒感染引起的扩张型心肌病[2]。如果将EFE归类于原发性获得性DCM,则DCM的发病率最高(65.6%,42/64)。
儿童与成年人相比,体积小,呼吸频率及心率快,呼吸不平稳,且大多不能配合,这就需要结合儿童的特点进行操作。首先是镇静,大多数患儿不能配合,需镇静后检查。我院尚未开展麻醉下心脏磁共振检查,所以患儿需提前剥夺睡眠,配合口服镇静剂,确保检查过程中保持不动。对于新生儿及婴幼儿等体积较小的患儿,需使用较小的体素以达到足够的空间分辨率。也可以通过增大矩阵,缩小扫描野,缩小层厚等调节。年龄越小,心率越快,伴有病变时经常会在100次/分钟以上,为了有充足的纵向信号回复时间,数据采集时间间隔应从每1~2个心动周期增加至3~4个心动周期,并通过减少快速因子来缩短采集持续时间[8]。儿童呼吸快且不平稳,可采用自由呼吸门控触发,或“导航回波”追踪膈肌运动等。虽然经过这些方法做出的图像仍有一定的伪影存在或图像质量不如成人,但都不影响诊断。
心肌病的磁共振特点。①EFE:磁共振平扫没有特异性表现,最常见的是左室增大。增强扫描可见心内膜延迟强化,乳头肌、腱索及二尖瓣等结构也可受累[9,10]。②HCM:特征性改变是心肌的异常肥厚,可呈节段状或弥漫性增厚,诊断标准为舒张末期室壁厚度≥15mm,或肥厚室壁与正常室壁厚度比值≥1.5[11]。左心室前游离壁基底部,及其相邻的室间隔前部是最常见的受累部位。通过左室流出道三腔心电影序列可以动态观察左室流出道有无狭窄,心脏瓣膜运动情况(二尖瓣前叶在收缩早期向室间隔靠拢,即SAM征)和该部位血流动力学特点。HCM可出现各种不同的强化方式及受累层面。③DCM: MRI影像学征象为左心室或者左右心室均扩大,室壁厚度一般较均匀,心肌信号为中等强度信号,伴随心室壁的广泛变薄,收缩幅度降低,射血分数明显减低,伴有不同程度的左心室游离壁肌小梁增粗、增多,增厚。常可见二尖瓣关闭不全。增强扫描心肌中层的强化是DCM的特征,并以此作为与缺血性心肌病的鉴别诊断依据之一[12,13]。④RCM: MRI表现可以右心室受累或双心室受累,流入道短缩,心尖闭塞,收缩功能正常或接近正常,舒张明显受限,心房明显扩张,房室瓣关闭不全,出现返流。可有延迟强化[14]。⑤ARVC:在MRI电影上可以见到右室流出道膨隆,扩张,室壁变薄,节段性功能异常,有特征性的局部皱缩,在收缩期表现更加明显,能够显示“手风琴”征[15]。扩张变薄的心肌发生脂肪变性时,可在T1WI呈高信号显示,压脂序列可分辨其性质,但有时候难以区分心外膜脂肪垫和心室肌壁脂肪化,目前已不将此作为ARVC的主要诊断标准[16]。增强扫描右室壁可广泛的延迟强化,多为透壁性[15,16]。⑥NVM: MRI电影序列上,可以观察到心室肌小梁粗厚,间隙加深,隐窝内有流动的血液,而心外膜下心肌较相邻正常心肌变薄,病变主要位于左心以心尖为中心的区域。非致密化心肌和致密化心肌的比值(NC/C)为舒张末期NC/C>2.3~2.5[17,18]。当心肌存在坏死纤维化时,可有延迟强化,并能显示肌小梁中的血栓。
文献报导心肌病可以有各种不同形态延迟强化,大约有50%~80%的HCM病患者及1/3DCM患者存在心肌延迟钆增强表现[13],并可见附壁血栓形成。而本组患者中54例进行增强扫描,仅6例看到延迟强化(11.1%,6/54),也未见附壁血栓,延迟强化比例明显低于文献,考虑可能与以下因素相关。
延迟扫描序列的选择:本组病例注入对比剂后部分仍选用T1/TFE序列扫描(26例),而6例看到延迟强化的患者均为PSIR序列。增强后T1/TFE序列提示心肌局部充血性改变,PSIR序列显示的是失去活性的心肌在对比剂进入之后流出障碍,廓清比正常心肌晚,而出现局部对比剂聚集,反应心肌坏死及纤维化。二者显示的病理学意义不同。本组病例延迟扫描时间均在注入对比剂8~10min后开始,而有文献指出在注入对比剂20~30min后,病变与心肌之间对比最清晰[19]。本组延迟强化少,可能和扫描时间过早有关。有文献报道新生儿及婴幼儿心肌致密化不全心脏磁共振无延迟强化表现[20],是否儿童心肌病为病变发生的早期,心肌缺血坏死及纤维化尚不明显,所以延迟强化不多见,还需进一步追踪随访,或更多病例分析来证实。
扫描层面有关:大部分只做了SA扫描,仅3例同时做了4CH扫描,对于延迟扫描后心肌的观察不够全面。病例数偏少,不具备普遍代表性。
儿童心肌病的临床表现多种多样,仅靠临床难以明确诊断,心脏磁共振检查每种疾病都有其一定的影像学特点,可以提供重要的参考信息,为诊断提供帮助。由于儿童体积小、心率快、不能配合等特点,对扫描技术有一定的要求,需在实践中不断的摸索和积累经验,以达到更好的图像质量。
[1] 陈树宝.小儿心肌病研究进展[J].实用儿科临床杂志,2008,23(13):980-984.
[2] Marun BJ,Towbin JA,Thiene G,et al.Contemporary definitions and classification of the cardiomyopathies:an American heart association scientific statement from the council on clinical cardiology,heart failure and transplantation committee;quality of care and outcomes research and functional genomics and translational biology interdisciplinary working groups;and council on epidemiology and prevention[J].Circulation,2006,113(14):1807-1816.
[3] Landstrom AP,Aekerman MJ.Beyond the cardiac myofilament:hyper-trophic cardiomyopathy-associated mutations in genes that encode calcium-handling proteins[J].Curr Mol Med,2012,12(5):507-518.
[4] 马力,刘文玲,胡大一,等.中国人心律失常性右心室发育不良或心肌病的临床特点[J].临床荟萃,2006,21(18):1296-1299.
[5] Willott RH,Gomes AV,Chang AN,et al.Mutations in troponin that cause HCM,DCM,AND RCM:what can we learn about thin filament function?[J].J Mol Cell Cardiol,2010,48(5):882-892.
[6] Kubo T,Gimeno JR,Bald A,et al.Prevalence,clinical significance,and genetic basis of hypertrophic cardiomyopathy with restrictive pheno-type[J].J AmCoil Cardiol,2007,49(25):2419-2426.
[7] Wintraub RG,Nugent AW,Daubeney PE,et al.Pediatric cardiomyopathy:the australian experience[J].Prog Pedictr Cardiol,2007,23(1-2):17-24.
[8] Fratz S,Chung T,Greil GF,et al.Guidelines and protocols for cardiovascular magnetic resonance in children and adults with congenital heart disease:SCMR expert consensus group on congenital heart disease[J].J Cardiovascular Magnetic Resonance,2013,15(1):51.
[9] Maredia N,English K,Greenwood J.Assessment of endocardial fibroelastosis by cardiac MRI[J].Can J Cardiol,2008,24(5):e33.
[10] Tworetzky W,del Nido PJ,Powell AJ,et al.Usefulness of magnetic resonance imaging of left ventricular endocardial fibroelastosis in infants after fetal intervention for aortic valve stenosis[J].Am J Cardiol,2005,96(11):1568-1570.
[11] 李坤成.心血管磁共振成像诊断学[M].北京:人民卫生出版社,1997:97-102.
[12] McCrohon JA,Moon JC,Prasad DK,et al.Differentiation of heart failure related to dilated cardiomyopathy and coronary artery disease using gedolinium-enhanced cardiovascular magnetic resonance[J].Circulation,2009,108(1):54-59.
[13] Assomull RG,Prasad SK,Lyne J,et al.Cardiovascular magnetic resonance,fibrosis,and prognosis in dilated cardiomyopathy[J].J Am Coll Cardiol,2006,48(10):1977-1985.
[14] Gupta A,Gulati GS,Seth S,et al.Cardiac MRI in restrictive cardiomyopathy[J].Clinical Radiology,2012,67(2):95-105.
[15] Yoo SJ,Grosse-Wortmann L,Hamilton RM.Magnetic resonance imaging assessment of arrhythmogenic right ventricular cardiomyopathy/dysplasia in children[J].Korean Circ J,2010,40(8):357-367.
[16] Murphy DT,Shine SC,Cradock A,et al.Cardiac MRI in arrhythmogenic rightbentricular cardiomyopathym[J].AJR,2010,194(4):W299-306.
[17] Petersen SE,Selvanayagam JB,Wiesmann F,et al.Left ventricular non-compaction:insights from cardiovascular magnetic resonance imaging[J].J Am Coll Cardiol,2005,46(1):101-105.
[18] 于进超,赵世华,蒋世良,等.扩张型心肌病与左心室心肌致密化不全的临床和磁共振成像特征对比[J].中华心血管病杂志,2010,38(5):392-397.
[19] Stranzinger E,Ensing GJ,Hernandez RJ.MR findings of endocardial fibroelastosis in children[J].Pediatr Radiol,2008,38(3):292-296.
[20] Marín RC,Ossaba VS,Maroto AE,et al.Lack of MR late-enhancement in left ventricular non-compaction in infants and young children[J].Radiologia,2010,52(2):138-143.
A study of magnetic resonance imaging of cardiomyopathy in children
CAO Ying-li,PENG Yun,WANG Fan-ning,et al.
Beijing Children's Hospital,Capital Medical University,Beijing 100045,China
Objective:To study the clinical MR imaging features of children's cardiomyopathy.Methods:In our hospital,64 cases clinically diagnosed with pediatric cardiomyopathy were retrospectively studied.They included endocardial fibroelastosis (EFE) 26 cases,hypertrophic cardiomyopathy (HCM) 14 cases,dilated cardiomyopathy (DCM) 16 cases,restrictive cardiomyopathy (RCM) 4 cases,arrhythmogenic right ventricular cardiomyopathy (ARVC) 2 cases,noncompaction of the ventricular myocardium (NVM) 2 cases.All cases were scanned by Philips 1.5T MR machine.Uncooperative children were sedated by chloral hydrate with dosage of 0.5mL/kg.The scan protocol in all children included black-blood turbo spin echo (TSE),bright blood balanced steady-state free precession gradient echo (balanced SSFP) cine,and fast spin-echo for myocardial delayed enhancement in 26 cases,phase-sensitive inversion recovery (PSIR) for myocardial delayed enhancement in 28 cases.Results:EFE (26 cases ) had varying degrees of left ventricular chamber enlargement,9 cases with myocardial thinning;16 cases had myocardial contractility movement reduced;left atrial enlargement in 7 cases;increased left ventricular trabesix cular in 13 cases;valvular regurgitation in 18 cases;pericardial effusion in 7 cases,pleural effusion in 4 cases.HCM (14 cases) had varying degrees of thickness in 66 myocardial segments.Septal thickness in 14 cases (45 segments),left ventricular free wall thickening in 12 cases (21 segments).One case of right ventricular apical was involved.Left ventricular papillary muscle abnormalities were in 4 cases.Increased left ventricular trabecular thickening were in 6 cases.DCM (16 cases) were expanding of the heart chambers,while the left ventricular myocardial was thinning.12 cases left atrial and ventricular were significantly increased.Only left ventricular enlarged was in 2 case.Ventricular free wall systolic motion was significantly reduced in 13 patients.Trabecular thickening in 11 cases.Valvular regurgitation in 13 cases,pericardial effusion in 9 cases,pleural effusion in 7 cases.RCM (4 cases) biventricular were involved.The ventricular systolic movement was normal;meanwhile the diastolic movement was limited.The ventricular cavity size was normal,but both atria were dilated.Valvular regurgitation was seen in six cases.Expansion of inferior vena cava in 4 cases,Pericardial effusion in 3 cases.In 2 cases with ARVC,expansion of the right ventricular outflow tract,local wall thinning,and "accordion sign" could be seen.In 2 cases with NVM,left ventricular endocardial and muscular trabecular was thickening,while the adjacent myocardial was thinning,by the NC/C was about 3.1~7.5. 6 cases (6/55) had delayed enhancement.One case was HCM.Two cases was DCM.Three cases were DCM.Conclusion:Children's cardiomyopathy reveals a variety of clinical manifestations and usually accompanies with cardiac dysfunction.Magnetic resonance imaging played an important role and showed certain characteristics.
Child; Pediatrics; Cardiomyopathies; Magnetic resonance imaging
100045 北京,首都医科大学附属北京儿童医院
曹永丽(1980-),女,北京人,硕士,主治医师,主要从事儿童心血管疾病诊断治疗工作。
R445.2; R542.2
A
1000-0313(2016)10-0970-06
10.13609/j.cnki.1000-0313.2016.10.015
2015-12-15
2016-04-26)

