雨生红球藻农杆菌转化体系的建立
侯善茹, 冯兴标, 李光伟, 陈丹阳, 袁浏欢, 刘永胜
(合肥工业大学 生物与食品工程学院,安徽 合肥 230009)
雨生红球藻农杆菌转化体系的建立
侯善茹, 冯兴标, 李光伟, 陈丹阳, 袁浏欢, 刘永胜
(合肥工业大学 生物与食品工程学院,安徽 合肥 230009)
文章以植物表达载体pBI121、农杆菌EHA105为体系,建立了农杆菌介导的雨生红球藻转化方法,通过筛选羧苄青霉素、G418等抗生素对雨生红球藻生长的影响,确定了以200 μg/L G418和500 mg/L羧苄青霉素为筛选体系。转化的雨生红球藻以CaMV 35S和来源于番茄的八氢番茄红素脱氢酶基因的启动子(PDS启动子)成功表达了报告基因GFP和YFP,拓宽了pBI121载体的应用范围,为雨生红球藻的转化提供了一个新的遗传转化途径。番茄来源的PDS启动子能够启动报告基因的表达,表明植物源的启动子能够在雨生红球藻中表达,为植物源的启动子验证及基因瞬时表达提供了一个新的方法。
雨生红球藻;农杆菌;遗传转化;PDS启动子
雨生红球藻(Haematococcuspluvialis)属于绿藻门、绿藻纲、团藻目、红球藻科、红球藻属。雨生红球藻能够进行光合自养和化能异养方式生长,在弱光、氮磷丰富的条件下以绿色游动营养细胞状态存在,这种状态下生长旺盛;在胁迫条件下,以不动厚壁孢子形态存在,该阶段能够产生虾青素,虾青素的质量可高达细胞干重的3%~4%。虾青素具有较高的抗氧化性能,广泛地应用于食品、化妆品及医药等领域,雨生红球藻已被批准作为新资源食品,因此对雨生红球藻的资源开发和利用具有重要的意义。
利用基因工程技术改造藻类是藻类资源开发和应用的一个重要方向。莱茵衣藻(Chlamydomonasreinhardtii)是模式生物,已经进行了全基因组测序[1],遗传背景清楚,是转化体系研究较多的藻类。文献[2]利用带有酵母arg基因的质粒转化细胞壁和arg缺陷型莱茵衣藻,获得了arg缺陷营养互补的转基因莱茵球藻,转化子的效率为3~4个/107个细胞。文献[3]将根癌农杆菌用于莱茵衣藻的转化,T-DNA 插入了衣藻的基因组中,转化效率为350 个/106个细胞,该方法是玻璃珠转化效率的50倍,转化子在没有选择压力的情况下稳定存在了 18 个月。文献[4]采用农杆菌介导法,以潮霉素为筛选标记,实现了对雨生红球藻的成功转化,并用 β-胡萝卜素酮化酶(BKT)基因转化雨生红球藻,所获得的转基因球藻虾青素质量分数是野生型的2~3倍[5]。
pBI121载体源于美国Clontech实验室,文献[6]对其进行了重新构建(accession number AF485783),是常用的植物转化载体。本研究利用pBI121载体上的NPTⅡ基因(新霉素磷酸转移酶基因)为抗性基因,G418为筛选标记,分别以CaMV 35S和番茄的八氢番茄红素脱氢酶基因的启动子(PDS promoter)表达GFP和YFP报告基因,利用雨生红球藻进行遗传转化,成功地建立了用农杆菌介导雨生红球藻遗转化体系。
1 材料与方法
1.1 材料
1.1.1 藻种、菌株与质粒
生红球藻购于中国科学院水生生物研究所,藻种编号FACHB-712。大肠杆菌DH5α 和农杆菌EHA105由本实验室保藏。带有报告基因GFP和YFP的植物表达载体pBI121由本实验室保存。
1.1.2 主要培养基和试剂
BBM(bold′s basal medium)培养基[7]、TAP(tris-acetate-phosphate)培养[8]和Z8培养基[9],用于雨生红球藻的培养;LB(Luria-Bertanin)培养基,用于大肠杆菌和农杆菌的培养。
所用的化学试剂均购于国药集团;抗生素利福平、卡那霉素、羧苄青霉素、头孢噻肟钠、G418购于生物工程(上海)股份有限公司。
质粒小量提取试剂盒(货号:EM101-01)和DNA片段琼脂糖凝胶回收试剂盒(货号:EG101-01)购于北京全式金生物技术有限公司。
Pfu聚合酶,XbaⅠ、HindⅢ,PstⅠ限制性内切酶,T4连接酶均购于TaKaRa公司。
1.1.3 仪器和设备
Thermo Fisher Scientific 2720型聚合链式反应(polymerase chain reaction,PCR) 扩增仪;Bio-Rad Molecular Imager Gel DOC XR全自动凝胶成像系统;Thermo Scientific Sorvall ST台式离心机;Thermo Sorvall高速冷冻离心机;OLYMPUS IX81荧光显微镜;BD公司FACSCalibur流式细胞仪。
1.2 方法
1.2.1 雨生红球藻的培养
将藻种接入BBM培养基中,置于45~55 μmol/(m2·s)的光照强度、22 ℃、光周期16/8(光照/黑暗)的条件下培养,除非特殊声明,以下的培养条件与此相同。
1.2.2 抗生素的选择
羧苄青霉素和G418对雨生红球藻的影响。向10 mL BBM液体培养基中加入终质量浓度为10、500 mg/L的羧苄青霉素或加入终质量浓度为50、200、500 μg/L的G418,以不加抗性的培养基作为对照,接种量均约1×105个细胞,于25 mL细胞培养瓶中培养7 d,进行血球细胞板计数;配置BBM固体培养基,加入质量浓度分别为0、5、120、500 mg/L的羧苄青霉素,培养30 d左右;配置Z8固体培养基,加入质量浓度分别为0、50、200、500 μg/L的G418,培养30 d左右,所用固体平板直径为100 mm,每个平板涂布的细胞数均为1×105个。
羧苄青霉素对农杆菌的影响。取生长至OD600为0.5的农杆菌,稀释1×10-5,取200 μL,将其涂在分别含0、200、500 mg/L羧苄青霉素的Z8固体培养基上,28 ℃培养2~3 d,进行平板计数。
以上抗性实验独立重复3次。
1.2.3 载体的构建
本研究所用的载体pBI121-35S-GFP和pBI121-35S-YFP是由本实验室保存。根据番茄(Lycopersiconesculentum)序列X71023设计引物,扩增PDS启动子,替代pBI121-35S-YFP中的CaMV 35S启动子,载体上可用的酶切位点有1个Hind Ⅲ和Xba Ⅰ,而PDS promoter上有4个Hind Ⅲ,采用PCR产生HindⅢ黏性末端的方法[10]来构建pBI121-PDS-YFP表达载体,所用的模板是从番茄中提取的基因组DNA。所用引物如下:
引物PDS-R序列为:CAATTTGAGGCATTCTAGAGAAAAATAACAGT,酶切位点为XbaⅠ;引物PDSF-had序列为:AGGTTCTTGTGCCAAGATTACCTTATGAT,酶切位点为HindⅢ黏性末端;
引物PDSF-HdB 序列为:TCTTGTGCCAAGATTACCTTATGAT 酶切位点为HindⅢ黏性末端;
引物GFP-F序列为:CCGTGTTATGGT GAGCAAG;
引物GFP-R序列为:TTACTTGTACAGCTCGTCCAT。
将载体pBI121-35S-YFP用HindⅢ与XbaⅠ进行双酶切,回收载体片段;将PDS启动子的PCR产物用XbaⅠ进行酶切,回收酶切基因片段,载体片段与基因片段连接转化DH5a,挑单克隆,PCR鉴定,送南京金斯瑞生物科技有限公司测序,测序引物为PDSF-HdB。将表达质粒pBI121-35S-GFP和测序正确的质粒pBI121-PDS-YFP,采用电转法分别转化农杆菌EHA105。
1.2.4 遗传转化
将在BBM培养基中培养7~8 d的雨生红球藻涂布TAP固体培养基上,每个平板1×106个细胞,培养7 d左右。将含GFP或YFP农杆菌接种到10 mL LB培养基中,培养基中含有25 mg/L利福平、50 mg/L卡那霉素以及200 μmol/L乙酰丁香酮,于摇床上28 ℃、220 r/min培养,待吸光度为0.5时取1 mL菌液,于2 790g下离心10 min。用200 μL TAP液体培养基重悬,其中TAP培养液中含有200 μmol/L乙酰丁香酮,涂在长有雨生红球藻的TAP固体培养基上,共培养48 h。
1.2.5 转化子的筛选
将共培养48 h后的转化球藻从TAP平板上用无菌水洗下,置于50 mL离心管中,加无菌水至40 mL,100g离心6 min,将转化球藻用无菌水清洗2次,设置离心机加速度为9,减速度为6。弃上清,向球藻中加入Z8液体培养基,其中Z8培养基含有250 mg/L头孢噻肟钠和500 mg/L羧苄青霉素,静置30 min,然后离心去除上清,保留液体体积不超过300 μL,将球藻全部涂于Z8固体培养基上,培养基中含有200 μg/L G418、250 mg/L头孢噻肟钠和500 mg/L羧苄青霉素。培养7 d后,将Z8培养基上筛选的球藻,用无菌水洗下,离心弃上清,再用40 mL BBM清洗1次,其中BBM培养基含有250 mg/L头孢噻肟钠和500 mg/L羧苄青霉素,离心去上清,将球藻悬浮于10 mL BBM液体培养基中,于25 mL细胞培养瓶中进行培养,培养基中含有200 μg/L G418、250 mg/L头孢噻肟钠和500 mg/L羧苄青霉素。7 d后进行分析和鉴定。
1.2.6 转化的鉴定
取转化球藻和野生型球藻各1 mL,1 000g下5 min进行离心,各弃去900 μL上清,用剩余的培养基悬浮球藻,进行激光共聚焦显微分析。
1.2.7 阳性比例分析
将转化球藻进行传代1次,以获得足够的细胞,进行流式细胞分析,并以野生型雨生红球藻为对照。
1.2.8 转化子的稳定性
每隔14 d进行传代1次,定期进行激光共聚焦显微分析和流式细胞分析。
1.2.9 阳性球藻对G418的耐受
将转化球藻分别接入含有0、100、200、500 μg/L G418的BBM液体培养基中进行培养,检查球藻的生长情况。
2 实验结果
2.1 抗生素的影响
抗生素对雨生红球藻和农杆菌的影响如图1所示。

图1 抗生素对雨生红球藻和农杆菌的影响
由图1可知,羧苄青霉素的质量浓度为10、500 mg/L时,雨生红球藻在BBM液体培养基上生长与无抗生素的BBM中生长基本一致,在BBM固体培养基上的生长两者也无区别,不会抑制雨生红球藻的生长,羧苄青霉素对雨生红球藻生长的影响见表1所列,G418在BBM培养基中会抑制雨生红球藻的生长,导致球藻数目下降。质量浓度为200 μg/L G418的Z8培养基上也不能长出克隆。在Z8培养基上200 mg/L羧苄青霉素就可以抑制农杆菌的生长。

表1 G418对野生型雨生红球藻影响
2.2 表达载体的构建
采用十六烷基三甲基溴化铵(cetyltrimethylammonium ammonium bromide,CTAB)法从番茄绿果中提取基因组DNA,以基因组DNA为模板,分别用引物对PDSF-HdA与PDS-R以及PDSF-HdB与PDS-R扩增PDS启动子,扩增片段大小约2 140 bp。取扩增产物各3 μL混合,95 ℃变性10 min,放置室温自然复性20 min,取3 μL混合物,进行XbaⅠ酶切2 h,反应体系为50 μL,切胶回收酶切片段。pBI121-35S-YFP进行HindⅢ与XbaⅠ双酶切,回收载体片段。用T4连接酶连接回收产物,转化大肠杆菌DH5a,挑取阳性克隆,PCR鉴定。PCR扩增片段大小及酶切验证如图2所示。

图2 构建质粒的PCR扩增以及酶切验证
PCR扩增PDS启动子,PstⅠ与XbaⅠ双酶切阳性克隆质粒,酶切片段包含PDS启动子和部分载体片段。
由图2可看出,PCR扩增片段大小与酶切图谱与预期相符,通过测序表明获得了正确的PDS启动子序列。将构建好的pBI121-PDS-YFP载体转化农杆菌EHA105。
2.3 转化雨生红球藻的鉴定
蛋白的表达是基因表达的最直接证据,GFP或YFP可在488 nm激发光下发出绿色或黄色荧光。CaMV 35S调控的GFP在雨生红球藻中能够正确表达,如图3所示。来源于番茄PDS启动子能够调控YFP基因在雨生红球藻中表达,如图4所示。

图3 转基因H.pluvialis中CaMV 35S启动GFP基因表达

图4 转基因H.pluvialis中PDS启动YFP基因表达
2.4 阳性克隆的比例
为鉴定发荧光雨生红球藻的比例,应用流式细胞技术,以同期培养的野生红球藻为对照,采用设门技术分析GFP或YFP比例,结果如图5所示,由图5可知,pBI121-35S-GFP转化的球藻表达阳性克隆比例为5.93%,而pBI121-PDS-YFP转化的球藻表达阳性克隆比例为7.16%。

图5 农杆菌转化的雨生红球藻阳性克隆比例
2.5 转化子的稳定性
通过连续继代,定期进行激光共聚焦显微观察,连续观察240 d,结果如图6所示,雨生红球藻依然能够发出荧光,而且随着筛选的进行,发荧光球藻的比例逐渐增加,如图7所示。

图6 不同转化时期转基因H.pluvialis表达YFP
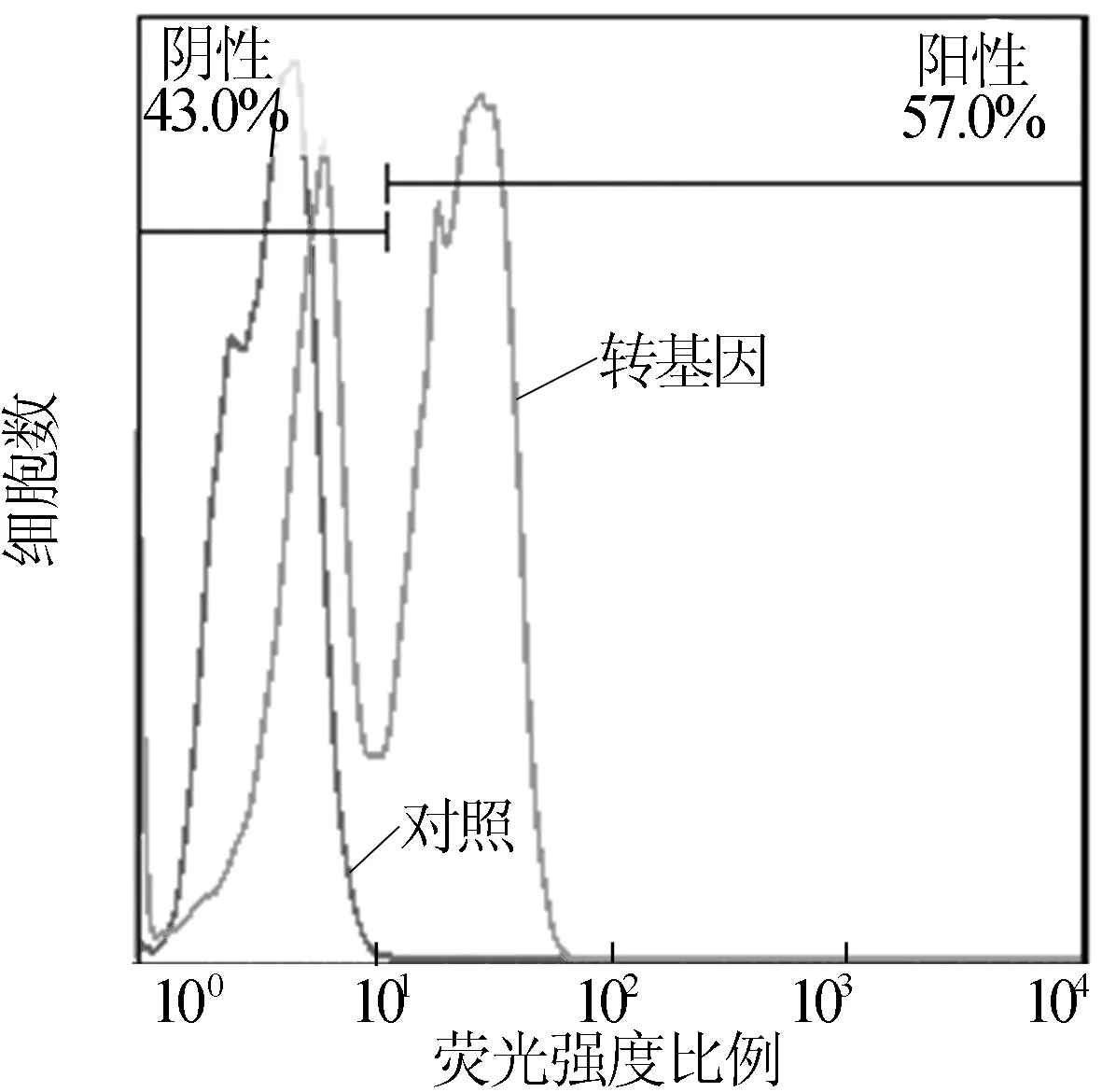
图7 H.pluvialis在转化后240 d表达YFP荧光的细胞比例
2.6 阳性H.pluvialis对G418的耐受
将转化pBI121-PDS-YFP雨生红球藻分别接入含有0、100、200、500 μg/L,G418的BBM液体培养基中进行培养,起始接种量为(0.3~1)×105个/mL,结果见表2所列,转化的球藻能够在G418质量浓度为200 μg/L以下的BBM培养基中生长,随着G418质量浓度的增加,球藻生长受到抑制直至死亡。

表2 阳性H.pluvialis在含G418培养基中的生长速度
3 讨 论
文献[4]应用农杆菌侵染法成功地转化了雨生红球藻,经过至少30个月的培养,雨生红球藻依然保持表达外源基因,所用的农杆菌株为EHA101,质粒为pCAMBIA1301,LB和RB序列之间含有3个表达框,2个报告基因GFP和GUS,另外一个是筛选基因Hpt Ⅱ,3个表达框的启动子均为CaMV 35S。采用潮霉素为筛选标记,结果表明转化的阳性克隆可以耐受10 mg/L的潮霉素。
本研究采用农杆菌株EHA105,质粒pBI121为载体,所用表达质粒LB和RB序列之间含有报告基因和NPTⅡ筛选基因2个表达框,分别用CaMV 35S和NOS启动子或PDS启动子启动基因的表达。CaMV 35S源于花椰菜花叶病毒,是组成型启动子,在植物各组织和各发育阶段均能表达,该启动子具有很强的启动能力,主要应用于双子叶植物,单子叶植物也有一定的启动能力。文献[4]的研究结果证明了CaMV 35S能够在雨生红球藻种工作。
NOS启动子是根癌农杆菌Ti 质粒T-DNA区域的胭脂碱合成酶基因启动子,它具有与植物相似的共有序列,含有与TATA-盒同源的序列,位于5′端上游也有类似的CAT-盒的序列。将转化的雨生红球藻涂布含500 μg/L G418 Z8培养基上,以野生型雨生红球藻为对照。结果表明转化雨生红球藻可以长出克隆,而野生型雨生红球藻没有克隆出现,证明了NOS能够启动NPTⅡ基因的表达,表达了的NPTⅡ基因能够降解G418。
番茄PDS启动子是类胡萝卜素合成过程中调控八氢番茄红素转化为番茄红素和β-胡萝卜素关键基因的表达。Vittorio Corona等构建了PDS/GUS表达载体并转化番茄和烟草瞬时表达,结果表明GUS主要在成色素细胞中表达,烟草花瓣和果实因缺少成色素细胞,GUS表达量较低。在番茄果实转色期GUS基因的表达量增加了7~8倍。
在绿色组织中类胡萝卜素和叶绿素是共调控的,抑制色素的合成会导致PDS启动子启动基因的表达,这表明PDS启动子具有组织特异性和诱导性的特点。YFP的表达表明所克隆的番茄PDS启动子能够在雨生红球藻中启动基因表达,但是还需进一步确认番茄PDS启动子在雨生红球藻中是组成型表达还是诱导型表达。
合适的选择标记是筛选稳定转化子的关键。文献[11]研究了包括G418和潮霉素在内的10余种抗生素对雨生红球藻的影响,结果表明雨生红球藻对青霉素类的抗生素(氨苄青霉素、青霉素G)不敏感,与本实验结果相类似(对羧卞青霉素不敏感),高达500 mg/L羧卞青霉素也不会影响雨生红球藻的生长,200 mg/L的羧卞青霉素能够抑制农杆菌的生长,为提高抑制农杆菌效果,羧卞青霉素和头孢噻肟钠可以联合使用。但是G418对雨生红球藻的影响2个研究结论完全相反,本实验200 μg/L G418在BBM培养基、Z8培养基、TAP培养基均能抑制雨生红球藻的生长,而文献[11]的结果表明高达1 000 μg/mL G418或潮霉素等6种抗生素皆不敏感。文献[4]以潮霉素为筛选标记,建立了雨生红球藻转化系统。这种差异可能是因为培养条件或其他因素所导致的,有待于进一步确认。
利用植物表达载体pBI121携带的新霉素磷酸转移酶 Ⅱ (NPTⅡ)筛选基因对植株进行阳性鉴定[12]。NPTⅡ基因编码新霉素磷酸转移酶,通过将ATP上的磷酸基团转移到抗生素分子上而使抗生素失活,可以降解卡那霉素,卡那霉素和G418都是氨基糖苷类抗生素,分子结构相似,抗菌谱有所差异。抗性机理相同,都是通过结合到核糖体亚基上影响蛋白质合成而产生抗菌作用的。在试验质量浓度范围内(0~120 mg/L),雨生红球藻对卡那霉素不敏感,但对G418比较敏感,200 μg/L就能够完全抑制其生长。
激光共聚焦显微镜观察结果与流式细胞仪的结果可以相互印证,相互补充,前者可以给出直观的观察结果,后者能够对结果进行定量。流式细胞仪结果表明,阳性克隆在平板上培养2周阳性克隆比例就能达到5%~7%。随着筛选压的提高,阳性克隆比例不断增加至57%,这与哺乳动物基因工程筛选方式一致,但是雨生红球藻可以通过铺平板的方式挑取单克隆,获得纯培养。
4 结 论
本实验通过农杆菌介导雨生红球藻转化外源基因,成功并稳定地表达了报告基因GFP和YFP,拓宽了pBI121载体的应用范围,为雨生红球藻的转化开辟了一个新的遗传转化途径。PDS启动子来源于番茄果实,能够启动报告基因的表达,这表明植物源的启动子也能够在雨生红球藻中表达,为植物源的启动子验证、基因瞬时表达提供了一个新的方法。
[1] MERCHANT S S,PROCHNIK S E,OLIVIER V,et al.TheChlamydomonasgenome reveals the evolution of key animal and plant functions [J].Science,2007,318(5848):245-251.
[2] ROCHAIX J D,DILLEWIJN J V.Transformation of the green algaChlamydomonasreinhardtiiwith yeast DNA [J].Nature,1982,296:70-72.
[3] KUMARA S V,RACHEL W M,VANGA S R,et al.Genetic transformation of the green alga:ChlamydomonasreinhardtiibyAgrobacteriumtumefaciens[J].Plant Science,2004,166:731-738.
[4] KATHIRESAN S,CHANDRASHEKAR A,RAVISHANKAR G A,et al.Agrobacterium-mediated transformation in the green algaHaematococcuspluvialis(Chlorophyceae,Volvocales) [J].Journal of Phycology,2009,45:642-649.
[5] KATHIRESAN S,CHANDRASHEKAR A,RAVISHANKAR G A,et al.Regulation of astaxanthin and its intermediates through cloning andgenetic transformation of beta-carotene ketolase inHaematococcuspluvialis[J].Journal of Biotechnology,2015,196/197:33-41.
[6] CHEN P Y,WANG C K,SOONG S C,et al.Complete sequence of the binary vector pBI121 and its application in cloning T-DNA insertion from transgenic plants [J].Molecular Breeding,2003,11:287-293.
[7] BOUSSIBA S,VONSHAK A.Astaxanthin accumulation in the green algaHaematococcuspluvialis[J].Plant Cell Physiol,1991,32:1077-1082.
[8] HARRIS E H.TheChlamydomonassource book:a comprehensive guide to biology and laboratory use [M].San Diego:Academic Press,1989:780.
[9] SIVONEN K,KONONEN K,ESALA A L,et al.Toxicity and isolation of cyanobacteriumNodulariaspunigeneifrom the southern Baltic Sea in 1986[J].Hydrobiologia,1989,185:3-8.
[10] MARSHAK D R,KADONAGA J T,BUTGESS R R,et al.Strategies for protein purification and characterization:a laboratory course manual[M].Cold Spring Harbor:Cold Spring Harbor Laboratory Press,1996:396.
[11] 滕长英,梁成伟,秦松.雨生红球藻(Haematococcuspluvialis)基因工程选择试剂的筛选[J].海洋与湖沼,2005,36(4):302-306.
[12] 周昂,牛向丽,刘永胜.猕猴桃AcGLK2a基因过表达载体的构建及在番茄中的遗传转化[J].合肥工业大学学报(自然科学版),2015,38(2):246-249.
(责任编辑 闫杏丽)
Establishment of transformation system ofAgrobacteriuminHaematococcuspluvialis
HOU Shanru, FENG Xingbiao, LI Guangwei, CHEN Danyang, YUAN Liuhuan, LIU Yongsheng
(School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
TheAgrobacterium-mediated transformation method ofHaematococcuspluvialis(H.pluvialis) was established by using plant expression vector pBI121 andAgrobacteriumtumefaciensEHA105. The optimum concentration of G418 and carbenicillin was 200 μg/L and 500 mg/L, respectively, by screening for the effect of carbenicillin and G418 on algeH.pluvialisgrowth. Reporter geneGFPorYFPdriven by CaMV 35S or tomato PDS promoter, respectively, was successfully expressed inH.pluvialis, suggesting that the application of pBI121 vector was broadened, and thereby providing a new way for the genetic transformation ofH.pluvialis. Tomato-derived PDS promoter is able to activate reporter gene expression, indicating that botanical promoter can be expressed inH.pluvialis, which provides a new method for the verification of promoters from plants and transient gene expression.
Haematococcuspluvialis(H.pluvialis);Agrobacterium; genetic transformation; PDS promoter
2015-05-07;
2016-02-25
安徽省皖江禽产业研究院公共服务平台资助项目(1401032006);国家大学生创新创业训练计划资助项目(201410359056)
侯善茹(1990-),男,安徽涡县人,合肥工业大学硕士生;
刘永胜(1964-),男,重庆市人,博士,合肥工业大学教授,博士生导师.
10.3969/j.issn.1003-5060.2016.09.023
Q78
A
1003-5060(2016)09-1271-07

