三类杀菌剂对牡丹腔孢叶斑病菌生长和发育的影响
徐建强, 杨改凤, 田 娟, 刁兴旺
(河南科技大学林学院, 洛阳 471003)
三类杀菌剂对牡丹腔孢叶斑病菌生长和发育的影响
徐建强*, 杨改凤, 田 娟, 刁兴旺
(河南科技大学林学院, 洛阳 471003)
腔孢叶斑病是牡丹生产上出现的一种新病害,近几年在洛阳及菏泽牡丹种植园危害越来越重。为了筛选防治该病的化学药剂,本文采用菌丝生长速率法测定了3类8种杀菌剂对病菌菌丝生长的抑制活性,采用涂布平板法测定了多菌灵、戊唑醇及嘧菌酯对病菌孢子萌发和芽管伸长的影响,并在含药平板上测定了3种药剂对病菌产孢量的作用。结果表明:三唑类药剂对病菌菌丝生长的毒力最强,EC50为0.020~0.096 μg/mL,且戊唑醇对孢子萌发和产孢也有很强的抑制活性,在0.1 μg/mL时孢子即不能萌发;甲氧基丙烯酸酯类药剂对菌丝生长的毒力较强,EC50为0.408~0.939 μg/mL,嘧菌酯对芽管伸长和产孢量均表现出很强的抑制活性,10 μg/mL时,芽管几乎不再伸长,对产孢的抑制率可达到99%以上;而苯并咪唑类药剂对菌丝生长的毒力较弱,EC50为12.167~30.104 μg/mL,多菌灵对孢子萌发的抑制作用弱,100 μg/mL时孢子萌发率仍达到90%以上,对产孢的抑制作用也较弱,为63.02%。根据药剂对病菌生长和发育各阶段的影响,生产中应采用适宜的施用方法:戊唑醇和嘧菌酯可作为保护剂在病害发生前期喷施,也可作为治疗剂在病害发生流行期应用,但为防止抗药性菌株的出现,两者应当轮换或复配使用。
牡丹腔孢叶斑病; 杀菌剂; 菌丝生长; 孢子萌发; 孢子形成
牡丹(PaeoniasuffruticosaAndrews)隶属于芍药科芍药属牡丹组,素有“花中之王”的美称,具有很高的观赏价值[1]。牡丹还有一定的药用价值,其器官提取物对线虫、杂草及植物病原菌都有一定的抑制活性,显示出在植物病害生物防治上的利用价值[2-4]。近年来,在牡丹栽培管理过程中,由于对土壤和苗木消毒不严、栽培方法不当、管理不善以及气候等因素,真菌病害的危害有逐年加重的趋势,且出现了几种新病害,腔孢叶斑病则是其中危害最为严重的病害之一[5]。目前,腔孢叶斑病在河南洛阳、郑州,山东菏泽、济南、泰安等地的牡丹种植园中发生普遍,叶片发病率在20%~48%,危害日益加重[5-6]。腔孢叶斑病田间主要发生在8-9月份,故对当年牡丹的观赏价值影响较小;但感染叶斑病后,牡丹叶片光合作用及营养物质合成等生理功能受到破坏,导致根养分贮藏减少,对当年的花芽长势及来年的开花品质产生严重影响[7-8]。腔孢叶斑病已成为牡丹生产上的巨大障碍,对该病害的防治迫在眉睫,急需筛选一批对该病有较好防效的化学杀菌剂。
目前国内外对牡丹的研究主要在栽培繁殖、生物学特性、生物技术、应用、分类及系统演化方面,对牡丹病害化学防治药剂筛选的研究较少[9]。由于牡丹腔孢叶斑病是一种新病害,对其研究更少。段亚冰等研究了病菌的生物学特性,获得了菌丝生长和产孢的最适培养条件[10]。张涛等的研究表明,病菌在液体培养时能产生毒素,且在基础培养液中产生的毒素致病力最强[11]。在防治药剂筛选方面,国内仅权淑静等测定了16种药剂对腔孢叶斑病菌的毒力,发现戊唑醇、丙环唑、氟硅唑、嘧霉胺及苯醚甲环唑5种药剂抑菌效果较好[12]。但权淑静等人用的全部是制剂,无法排除助剂对病菌生长的影响;且仅测定了5种药剂对菌丝生长的毒力,未测定药剂对病菌孢子萌发及产孢量的影响。为了筛选防治牡丹腔孢叶斑病的化学药剂,本文测定了苯并咪唑类(多菌灵、甲基硫菌灵)、三唑类(戊唑醇、氟环唑、丙环唑及苯醚甲环唑)及甲氧基丙烯酸酯类(嘧菌酯、醚菌酯)3类8种药剂对病菌菌丝生长的毒力;为进一步了解药剂对病菌生长发育的全面影响,本文选取了多菌灵、戊唑醇及嘧菌酯,研究了其对孢子萌发、芽管形态和产孢量的抑制作用,评估了药剂对病菌生长发育的效应,分析了其应用方法。研究结果为生产中牡丹腔孢叶斑病的化学防治提供理论依据。
1 材料与方法
1.1 供试菌株
2013年8月在洛阳市隋唐城遗址植物园千姿牡丹园采集发病典型、仅有单个病斑的牡丹叶片,采用组织分离法分离纯化后获得病菌纯培养;用无菌水制备孢子悬浮液,调节孢子浓度为1×105个/mL,取0.1 mL 孢悬液涂抹于水琼脂平板(water agar,WA)上,显微镜下挑取单孢,获得单孢菌株;经形态学鉴定与ITS序列比对,并回接到牡丹叶片上进行柯赫式法则验证,鉴定为牡丹绒边胶盘孢(Hainesialythri),菌株放入4℃冰箱保存。
1.2 供试培养基
马铃薯蔗糖琼脂培养基(potato sugar agar,PSA)用于菌株的分离、纯化、孢子萌发率的测定和一般培养与保存;磷酸二氢钾葡萄糖琼脂培养基(KH2PO4dextrose agar,KDA)用于产孢时间的测定,其成分为:KH2PO41.0 g、KNO31.0 g、KCl 0.5 g、MgSO40.5 g、淀粉0.2 g、葡萄糖0.2 g、蔗糖0.2 g、琼脂18~20 g、H2O 1 000 mL[13]。
1.3 供试药剂
97%苯醚甲环唑(difenoconazole)原药和97.5%嘧菌酯(azoxystrobin)原药由先正达(中国)投资有限公司生产;98%多菌灵(carbendazim)原药为山东省双星农药厂生产;98%戊唑醇(tebuconazole)原药、95%醚菌酯(kresoxim-methyl)原药为广西田园生化股份有限公司生产;98%丙环唑(propiconazole)原药和96.5%氟环唑(epoxiconazole)原药由江苏利民化工有限公司生产;97%甲基硫菌灵(thiophanate-methyl)原药由江苏新沂农药有限公司生产;旁路氧化酶专化性抑制剂99%水杨肟酸由Sigma-Aldrich生产。多菌灵原药预溶于0.1 mol/L稀盐酸中;嘧菌酯、戊唑醇和苯醚甲环唑原药预溶于甲醇中;甲基硫菌灵、氟环唑、丙环唑、醚菌酯、水杨肟酸预溶于丙酮中。上述药剂均配制成1.0×104μg/mL的母液备用。
供试生化试剂:蔗糖为分析纯,天津科密欧化学试剂有限公司;琼脂粉:生物技术级,合肥新恩源生物技术有限公司。
1.4 不同药剂对病菌菌丝生长的影响
采用菌丝生长速率法测定。将分离纯化所得菌株在PSA平板上25℃培养7 d后,用打孔器在菌落边缘制成直径5 mm的菌饼,接入含系列浓度药剂的PSA平板上,其中多菌灵、甲基硫菌灵浓度为2.5、5、10、20、40、80 μg/mL;戊唑醇、氟环唑、丙环唑、苯醚甲环唑浓度为0.015 6、0.031 25、0.062 5、0.125、0.25、0.5 μg/mL;对照培养基不加药。甲氧基丙烯酸类杀菌剂嘧菌酯、醚菌酯的设定浓度为0.031 25、0.062 5、0.125、0.25、0.5、1 μg/mL,另外为了抑制旁路氧化作用对病菌呼吸的补偿作用,培养基中还需加入 100 μg/mL的水杨肟酸。25℃下培养10 d后十字交叉法测量菌落直径,每处理重复3次,计算各浓度处理下药剂对菌丝生长的抑制率。菌丝生长抑制率(%)=[(对照菌落直径-菌饼直径)-(处理菌落直径-菌饼直径)]/(对照菌落直径-菌饼直径)×100。
1.5 不同药剂对病菌分生孢子萌发的影响
采用涂布平板法测定[14]。将菌株在PSA平板上25℃黑暗培养10 d后,用无菌水洗下分生孢子,4层纱布过滤除去菌丝,将滤液在5 000 r/min下离心10 min,去除上清液,将分生孢子重悬于无菌水中,调节孢子浓度至105个/mL,制备孢子悬液。取0.1 mL孢子悬液分别涂布在含0、0.1、1、5、10、50、100 μg/mL药剂的PSA平板上(直径9 cm),25℃恒温培养,待对照平板孢子开始萌发后,每隔4 h每皿随机观察100个孢子,统计不同浓度下的孢子萌发率,以芽管长度超过孢子最大直径长度的一半作为萌发标准,直到对照的萌发率达到95%以上,每个处理重复3次。
1.6 不同药剂对病菌芽管伸长和形态的影响
参照侯颖等2014年的方法[13]。按照1.5的方法制备孢子悬液。取0.1 mL孢子悬液分别涂布在含0、0.1、1、5、10、50、100 μg/mL药剂的PSA平板上,25℃黑暗培养24 h后在Olympus CX41光学显微镜下利用MD-50软件中的标尺功能测量孢子萌发后从孢子到芽管顶端的直线长度,每处理随机测50个芽管,求出芽管长度的平均值,并进行方差分析。采用同样的步骤,25℃黑暗培养24 h后,切取含有孢子的PSA培养基块,在XSP-8C型光学显微镜下观察药剂处理后分生孢子及芽管形态,同不含药剂培养基上的做比较,并进行观察拍照。
1.7 不同药剂对病菌产孢结构及数量的影响
参照康业斌等2007年的方法[15]。按照1.5的方法制备孢子悬液。参照多菌灵、戊唑醇、嘧菌酯抑制病菌菌丝生长的有效抑制中浓度EC50,制备相应浓度的含药KDA平板,对照不加药。取0.1 mL孢子悬液均匀涂布在KDA平板上,置25℃恒温培养箱培养,24 h后每天定时用手术刀切取正方形的培养基块置载玻片上,在显微镜下观察病菌分生孢子座的分化形成情况,直至分生孢子出现。以第一次观察到分生孢子为分生孢子座形成时间,每处理3个重复。
用血球计数板测产孢量。制备3种药剂EC50浓度的含药PSA平板,对照平板不加药。将病菌在PSA平板上培养7 d后,用直径0.5 cm的打孔器在菌落边缘打菌饼,分别接种在含药平板上,每皿接一个菌饼,25℃黑暗培养10 d后,用直径1.0 cm的打孔器在接种点附近打菌饼,无菌水洗下孢子,用血球计数板统计孢子数量,重复3次,求出药剂对产孢量的抑制率。产孢量抑制率(%)=(对照产孢量-处理产孢量)/对照产孢量×100。
2 结果与分析
2.1 不同药剂对病菌菌丝生长的抑制作用
由表1可以看出,4种三唑类杀菌剂,氟环唑、苯醚甲环唑、戊唑醇和丙环唑对病菌菌丝生长的抑制作用最强,EC50为0.020~0.097 μg/mL;两种甲氧基丙烯酸酯类杀菌剂,醚菌酯和嘧菌酯的抑制作用较强;而两种苯并咪唑类杀菌剂的抑制作用较弱,EC50均在10 μg/mL以上(表1)。同类杀菌剂不同品种对病菌的毒力相当;三唑类药剂对病菌菌丝生长的毒力最强,而甲氧基丙烯酸酯类药剂次之,两者均可以作为牡丹腔孢叶斑病化学防治的备选药剂。
2.2 不同药剂对病菌分生孢子萌发速率的影响
在不含药剂的PSA平板上,28 h后病菌孢子萌发率接近100%。含多菌灵的平板上,22 h时,各供试浓度下的孢子萌发率均高于对照;28 h时,100 μg/mL孢子萌发率依然能达到90%以上,说明多菌灵对病菌分生孢子萌发无影响(图1a)。嘧菌酯在低浓度(1 μg/mL以下)处理时,22 h时病菌分生孢子的萌发率高于对照,但在5 μg/mL及更高浓度平板上,萌发率显著下降;28 h时,0.1~1 μg/mL平板上的萌发率均可达到90%以上,但在5 μg/mL及更高浓度平板上,萌发率均不到40%,且在100 μg/mL平板上,孢子均未萌发;说明嘧菌酯对分生孢子萌发速率的抑制作用较弱(图1b)。戊唑醇对分生孢子萌发有强烈的抑制作用,28 h后,各浓度含药平板上分生孢子均未能萌发。戊唑醇能强烈抑制牡丹腔孢叶斑菌分生孢子萌发,嘧菌酯对孢子萌发有一定的抑制作用,而多菌灵对病菌分生孢子萌发则有促进作用。

表1 8种药剂对牡丹绒边胶盘孢菌丝生长的毒力Table 1 Toxicity of fungicides on mycelial growth of Hainesia lythri

图1 药剂对牡丹绒边胶盘孢分生孢子萌发率的抑制Fig.1 Effects of fungicides on conidial germination rate of Hainesia lythri
2.3 不同药剂对病菌芽管伸长和形态的影响
由表2可以看出,在不含药剂的PSA平板上,孢子萌发24 h时芽管长度达到10 μm左右。0.1~5 μg/mL的多菌灵对芽管伸长影响不明显,芽管长度长于对照;但随着浓度升高(10 μg/mL以上),尽管分生孢子能够萌发,但芽管伸长受到强烈抑制,同对照相比差异显著,尚不及对照芽管长度的二分之一,说明多菌灵尽管对孢子萌发速率无影响,但对芽管的伸长有一定的抑制作用。嘧菌酯在低浓度时就对芽管伸长有强烈的抑制作用,0.1 μg/mL时的芽管长度已同对照差异显著;随着浓度增加,抑制效果越明显;在浓度为10 μg/mL及以上时,芽管几乎不再伸长,尽管孢子能够萌发,但其芽管却不能生长,已失去正常的生物学功能;说明嘧菌酯不但对孢子萌发有影响,对已萌发的芽管伸长也有抑制作用。由于戊唑醇在供试浓度下孢子均未能萌发,故无法对芽管长度进行测量。
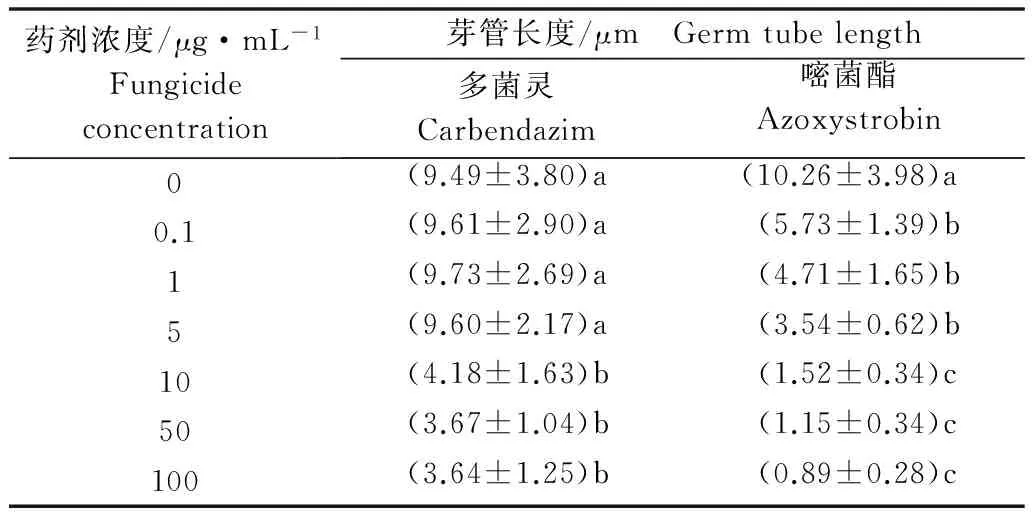
表2 不同浓度药剂处理牡丹绒边胶盘孢分生孢子 24 h时的芽管长度1)Table 2 Germ tube length of Hainesia lythri treated with fungicides at different concentrations for 24 h
1) 表中数据为平均数±标准差。同列数据后不同字母表示经LSD方法检验在P<0.05水平差异显著。
Data are mean±SD.Different letters in the same column indicate significant difference atP<0.05 level by LSD test.
分生孢子萌发试验24 h后观察发现,在不含药剂的PSA平板上,分生孢子大多从一端萌发形成菌丝状芽管,细胞形态正常,能正常生长并分化形成菌丝,但尚未产生分支(图2a)。在含药平板上,分生孢子和芽管均出现畸形。在含嘧菌酯的平板上,随着药剂浓度升高芽管长度明显变短,但芽管和分生孢子形状变化不明显(图2b~g);高浓度下产生的芽管似蝌蚪状(图2f~g)。多菌灵在浓度为0.1~5 μg/mL时对芽管伸长有促进作用,分生孢子从两端萌发产生芽管的数量增多,芽管开始产生分支,形态与对照相同;在10 μg/mL时,芽管伸长受到抑制,且萌发的芽管有基部膨大现象(图2h);随着浓度升高,生长的芽管呈不规则畸形,表现为基部膨大、顶端膨大及中间局部膨大,药剂浓度越高,膨大越明显(图2h~m);高浓度下芽管生长过程中发生过度分支及不规则扭曲(图2i~m)。戊唑醇在各供试浓度下,分生孢子形态正常,但均未能萌发。说明在供试药剂浓度下,药剂对病菌表现出抑菌作用。
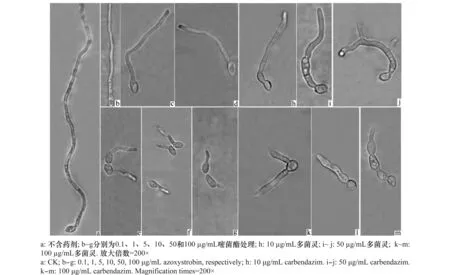
图2 不同浓度药剂处理24 h后牡丹绒边胶盘孢分生孢子及芽管形态Fig.2 Abnormality of conidia and germ tubes of Hainesia lythri treated with different concentrations of carbendazim and azoxystrobin for 24 h
2.4 不同药剂对病菌产孢结构和数量的影响
将病菌孢子分别涂布于含嘧菌酯、多菌灵和戊唑醇的KDA平板以及不含药剂的KDA平板上,经25℃培养60 h后,含戊唑醇和不含药剂的平板上出现分生孢子座和分生孢子,而含嘧菌酯和多菌灵的平板上未形成分生孢子座和分生孢子。含嘧菌酯的平板在72 h时开始有分生孢子座出现,而含多菌灵的平板观察至96 h时仍未形成分生孢子座。说明戊唑醇尽管对分生孢子萌发有抑制作用,但却并不影响分生孢子的形成时间;而嘧菌酯和多菌灵则对分生孢子形成时间有延迟作用。
病菌在PSA上培养10 d后,可大量产孢。由图3可知,嘧菌酯对病菌产孢数量抑制作用最为强烈,抑制率达到99.59%;其次为戊唑醇和多菌灵,抑制率分别为75.02%和63.02%。3种药剂均对分生孢子产生有一定抑制作用。
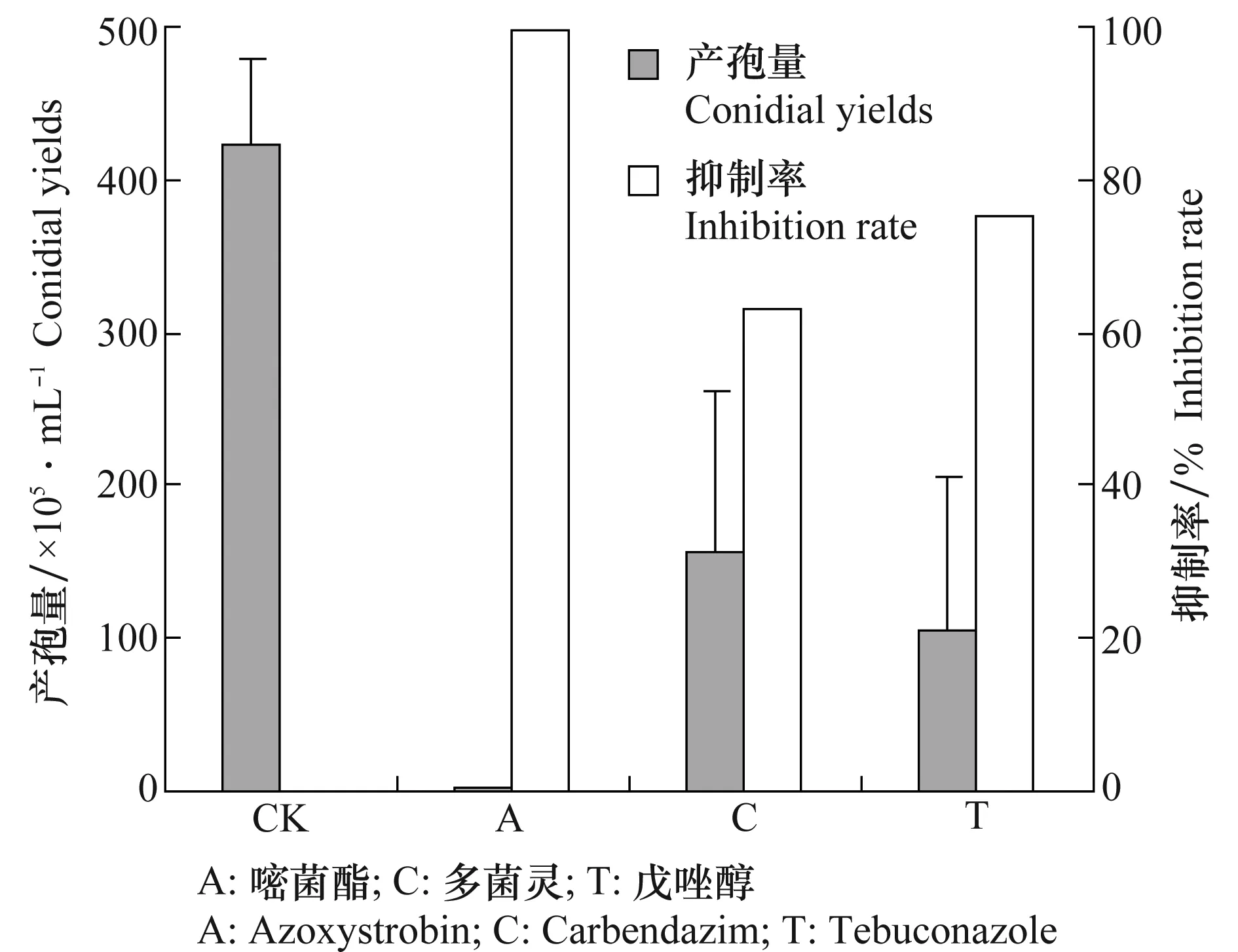
图3 杀菌剂对牡丹绒边胶盘孢产孢量的抑制Fig.3 Inhibition of fungicides on sporulation of Hainesia lythri
3 结论与讨论
本研究中3种药剂对牡丹腔孢叶斑病菌菌丝生长、孢子萌发和产孢量的影响表明,在供试浓度下药剂主要表现为抑菌作用:抑制菌丝生长,降低分生孢子萌发速率,并使分生孢子及芽管畸形,进而降低病菌侵染寄主及在寄主上产孢的能力,达到有效防治牡丹腔孢叶斑病的目的。
权淑静等人测定了16种杀菌剂对腔孢叶斑病菌菌丝生长的抑制率,并选取了5种抑制率高的杀菌剂进行了毒力测定,结果显示:戊唑醇、丙环唑、氟硅唑、苯醚甲环唑对病菌的抑制活性较高,EC50分别为0.032、0.064、0.139及0.584 μg/mL[11]。本文中4种杀菌剂对病菌菌丝生长的EC50分别为0.070、0.096、0.020、0.040 μg/mL,同权淑静等人的结果有所不同,其原因可能是本文所使用的是原药,而权淑静等人用的是制剂;另一方面,菌株采集地的不同也可能是导致此结果的原因之一。
腔孢叶斑病菌除危害牡丹叶片外,其共无性型还可在牡丹枝干引起瘤点病[5,16]。本文供试菌株来自于牡丹叶片,经鉴定为牡丹绒边胶盘孢(H.lythri)。本文中供试药剂对引起牡丹瘤点病的凹状冒孢(Pilidiumconcavum)的毒力如何并未进行测定。有必要测定药剂对分离自牡丹枝条上的P.concavum的毒力,以进一步明确两种病原之间的关系以及筛选牡丹瘤点病的防治药剂。
在牡丹种植园中,每年7、8月份后,各种叶斑病陆续开始出现,除了常发性的黑斑病、红斑病和腔孢叶斑病外,其他叶部病害如柱枝孢叶斑病、灰霉病、黄斑病等也时有发生[1,6]。对牡丹叶部病害可通过药剂复配来达到综合防控的目的。嘧菌酯与戊唑醇复配后对苹果斑点落叶病菌(Alternariamali)的抑菌效果增效显著[17];嘧菌酯与苯醚甲环唑复配不但可以防治西瓜炭疽病、枯萎病,而且对西瓜品质也有一定改善[18]。这为进行戊唑醇和嘧菌酯的复配来提高对牡丹腔孢叶斑病的防效及对牡丹叶部病害进行综合防控提供了参考。此外,甲氧基丙烯酸酯类杀菌剂不但能防治植物病害,而且还可使植物叶片更加浓绿,延缓叶片衰老,导致叶片营养物质合成及储存增加,有利于牡丹当年的花芽长势,增加来年的观赏价值[19],这更有利于牡丹的栽培管理。本研究结果显示,三唑类和甲氧基丙烯酸酯类药剂均可应用到牡丹腔孢叶斑病的化学防治上,但根据其对病菌生长发育的抑制效应,宜采用适宜的施用方法:戊唑醇和嘧菌酯作为保护剂在病害发生前期喷施,可抑制孢子萌发及芽管伸长,降低病菌的侵染率,防止病害发生;作为治疗剂在病害发生期应用时,可抑制牡丹叶片内的菌丝生长,降低菌丝在叶片上的扩展速度;同时,还可以抑制已侵入的病菌产孢,减少再侵染数量,阻止病害流行;但在病害流行期,为防止抗药性菌株的出现,应尽可能将戊唑醇及嘧菌酯轮换或复配使用。本研究仅进行了三类杀菌剂对病菌生长发育的影响,未进行病害防治的田间试验,相关工作有待于进一步开展。
[1] 蓝保卿, 李嘉钰, 段全绪. 中国牡丹全书(上)[M]. 北京:中国科学技术出版社, 2002.
[2] 焦宏伟, 张璐, 刘东, 等. 牡丹皮、黄连、大黄提取物对松材线虫生理代谢的影响[J]. 植物保护, 2014, 40(6): 18-24.
[3] 罗小勇. 牡丹不同器官的除草活性研究[J]. 植物保护, 2011, 37(2): 87-90.
[4] 朱立成, 王祥胜, 刘文, 等. 牡丹皮等16种中草药提取物抑制植物病原菌的研究[J]. 植物保护, 2007, 33(3): 83-86.
[5] 赵新兰, 李宁, 刘爱新, 等. 牡丹腔孢叶斑病及其病原物的共无性型[M]. 菌物学报, 2010, 29(4): 475-480.
[6] 段亚冰. 牡丹叶斑病病原真菌鉴定及生物学特性研究[D]. 洛阳: 河南科技大学, 2009.
[7] 杨德翠, 刘超, 盖树鹏, 等. 牡丹柱枝孢叶斑病(Cylindrocladiumcanadense)对叶片光合系统功能的影响[J]. 园艺学报, 2013, 40(3): 515-522.
[8] 杨德翠, 郑国生. 柱枝孢叶斑病侵染对牡丹生理特性的影响[J]. 北方园艺, 2014, 38(1): 57-61.
[9] 张运兴, 李卫国. 我国牡丹研究核心期刊载文分析[J]. 北方园艺, 2014, 38(19): 213-215.
[10]段亚冰, 余真真, 陈艳丽, 等. 营养因素与培养条件对Pilidiumconcavum病菌菌丝生长及产孢量的影响[J]. 北方园艺, 2010, 34(4): 164-167.
[11]张涛, 康业斌, 任文丽. 牡丹红点病菌粗毒素的提取及致病性测定[J]. 江苏农业科学, 2011, 39(3): 160-161.
[12]权淑静, 武海燕, 张改霞, 等. 不同杀菌剂对牡丹绒边胶盘孢的室内毒力测定[J]. 农药, 2011, 50(7): 520-521, 528.
[13]侯颖, 徐建强, 宋宇州, 等. 三种杀菌剂对牡丹黑斑病菌菌丝生长及分生孢子萌发的影响[J]. 植物保护学报, 2014, 41(3): 367-372.
[14]陈雨, 张文芝, 周明国. 氰烯菌酯对禾谷镰孢菌分生孢子萌发及菌丝生长的影响[J]. 农药学学报, 2007, 9(3): 235-239.
[15]康业斌, 商鸿生, 成玉梅. 丹皮酚对植物病原真菌的体外抑制作用[J]. 植物保护学报, 2007, 34(6): 580-584.
[16]康业斌, 商鸿生, 徐建强. 牡丹上的一种新病害——牡丹瘤点病[J]. 植物保护, 2007, 33(2):137-138.
[17]时春喜,祁志军,杨华,等.嘧菌酯与不同杀菌剂混配对苹果斑点落叶病菌的增效作用[J].植物保护学报,2006,33(4):447-448.
[18]朱春晖, 罗香文, 张战泓, 等. 嘧菌酯与苯醚甲环唑混用防治西瓜炭疽病、枯萎病及对西瓜品质的改善[J]. 植物保护学报, 2006, 33(4): 407-411.
[19]Grossmann K, Kwiatkowski J, Caspar G.Regulation of phytohormone levels, leaf senescence, and transpiration by the strobilurin kresoxim-methyl in wheat (Triticumaestivum)[J]. Journal of Plant Physiology, 1999, 154: 805-808.
(责任编辑:田 喆)
Effects of fungicides on growth and development ofHainesialythricausing coelomycete leaf spot ofPaeoniasuffruticosa
Xu Jianqiang, Yang Gaifeng, Tian Juan, Diao Xingwang
(College of Forestry, Henan University of Science and Technology, Luoyang 471003, China)
Peony coelomycete leaf spot, a new disease whose causal agent wasHainesialythrion peony leaf, occurred more and more commonly in peony gardens in Luoyang and Heze. In order to screen fungicides for controlling the disease, the inhibitory activity of eight fungicides against mycelial growth was measured and the efficacy of carbendazim, tebuconazole and azoxystrobin on conidial germination and sporulation was determined in this study. The results showed that triazoles fungicides, including tebuconazole, epoxiconazole, propiconazole and difenoconazole, could strongly inhibit the mycelial growth with the EC50value from 0.020 to 0.096 μg/mL.The inhibitory activity of tebuconazole on conidial germination rate was the strongest, which could cause the conidia to stop germination even at the concentration of 0.1 μg/mL.Strobilurins fungicides, including azoxystrobin and kresoxim-methyl, could also inhibit the mycelial growth with the EC50value from 0.408 to 0.939 μg/mL.Azoxystrobin had strong inhibitory activity against germ tube growth and sporulation, indicating that it could cause the cease of germ tube growth at the concentration of 10 μg/mL and the inhibition rate of sporulation could reach beyond 99%. Benzimidazoles fungicides, including carbendazim and thiophanate-methyl, had lower inhibitory activity on mycelial growth rate with the EC50value from 12.167 to 30.104 μg/mL.For carbendazim, the germination rate of conidia could still exceed 90% even at the concentration of 100 μg/mL and the inhibition rate of sporulation was only 63.02%, implying that the inhibitory activity was weaker. Tebuconazole and azoxystrobin could be used as protective fungicides before the appearance of the peony coelomycete leaf spot and also as curative fungicides when the disease becomes more prevalent. To delay the onset of resistance, alternate and mixed use of the two fungicides is recommended.
peony coelomycete leaf spot; fungicide; mycelial growth; conidial germination; sporulation
2015-10-29
2016-01-13
国家自然科学基金(31401774);国家公益性行业(农业)科研专项(201303023);河南科技大学大学生研究训练计划(2015148)
S 436.8
A
10.3969/j.issn.0529-1542.2016.05.014
* 通信作者 E-mail: xujqhust@126.com

