肾虚肝郁证迟发性性腺功能减退症大鼠模型的建立与评价
周兴,周青,赖永金
(1.湖南中医药大学第一附属医院,湖南长沙410007;2.萍乡市中医院,江西萍乡337000)
·基础研究·
肾虚肝郁证迟发性性腺功能减退症大鼠模型的建立与评价
周兴1,周青1,赖永金2
(1.湖南中医药大学第一附属医院,湖南长沙410007;2.萍乡市中医院,江西萍乡337000)
目的建立“肾虚肝郁证”迟发性性腺功能减退症(Late onset hypogonadism,LOH)动物模型,并对其进行评价。方法以中医理论“房劳过度伤肾”、“郁久伤肝”为指导,采用“退役种鼠(40周龄)+复合情志刺激+孤养”方法,建立“肾虚肝郁证”LOH动物模型,与正常组(8周龄)比较,以血清总睾酮、悬尾实验、睾丸间质细胞超微结构、睾酮合成相关酶以及Caspase-3 mRNA和蛋白表达为指标。结果模型组大鼠出现一系列典型的LOH精神、心理、体能改变,与正常组比较,模型组大鼠血清总睾酮水平明显降低,悬尾不动时间显著延长,睾丸组织Caspase-3 mRNA和蛋白表达增强,睾酮合成相关酶类固醇激素合成急性调节蛋白(Steroidogenic Acute Regulatory Protein,StAR)[13]、细胞色素胆固醇侧链裂解酶(Cytochrome P450 side-chain cleavage,P450scc)[14]、3β-羟甾脱氢酶(3beta-hydroxysteroid dehydrogenase,3β-HSD)mRNA和蛋白表达下降,差异均有统计学意义(P<0.01);模型组睾丸间质变少,睾丸间质细胞线粒体数量减少,出现水肿,线粒体嵴消失。结论“退役种鼠+复合情志刺激+孤养”方法复制“肾虚肝郁证”LOH模型切实可行,有较高的实用价值。
迟发性性腺功能减退症;动物模型;肾虚肝郁证
迟发性性腺功能减退症(Late onset hypogonadism,LOH),普遍存在于中老年男性,患者出现体能下降、神经精神异常、性功能减退等一系列临床症状,严重影响了中老年男性的日常生活工作。其发
病主要是增龄导致的雄激素水平下降[1],其他诸多因素,如内分泌改变、慢性应激、肥胖、不良生活方式、恶劣生活环境、生理-心理-社会改变等,也参与其中。因此,在LOH动物模型复制中,老龄、低睾酮水平应作为关键性观察因素。中医历代文献无“LOH”之名,可归属于“郁证”、“脏躁”、“阳痿”、“不寐”“肾虚”等范畴,《素问·上古天真论》云:“六八,阳气衰竭于上,面焦,发鬓斑白;七八,肝气衰,筋不能动;八八,天癸竭,精少,肾脏衰”。“肾虚肝郁”证候贯穿于LOH的整个发展过程[2]。因此,在LOH动物模型复制中,本研究又以中医理论“郁久伤肝”、“房劳过度伤肾”为指导,选择退役种鼠(房劳过度),采用孤养、慢性应激等情志刺激(久郁),试图模拟LOH的中医发病过程,构建“肾虚肝郁证”LOH动物模型,并对其进行评价,现报道如下。
1 材料与方法
1.1 材料
1.1.1 动物(1)造模组大鼠:SPF级Sprague-Dawley(SD)雄性大鼠(退役种鼠),40周龄,体质量(400±50)g,40只。购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001;(2)正常对照组大鼠:SPF级SD雄性大鼠,8周龄,体质量230~250 g,15只。购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2013-0004。均饲养在湖南中医药大学SPF级动物实验中心,SPF级动物专用饲料饲养,恒定温度(21±3)℃、湿度(75±5)%,光-暗周期、动物摄食及饮水条件按造模需要设定。适应性喂养1周后进行试验。
1.1.2 主要试剂大鼠血清睾酮检测用ELISA试剂盒(上海巧伊生物科技有限公司,产品编号:JEN-03),TRIZOL试剂(美国BIOMIGA公司),SYBR Green qRCR Mix(美国GeneCopoeia公司),反转录试剂盒(美国GeneCopoeia公司),BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,产品编号:P0010),羊抗鼠二抗(北京康为世纪生物科技有限公司,产品编号:CW0102),羊抗兔二抗(北京康为世纪生物科技有限公司,产品编号:CW0103)。
1.1.3 主要仪器5424R台式高速冷冻离心机(德国Eppendorf),PCR仪(德国Eppendorf),Tannon1600R型凝胶成像系统(上海天能),定量PCR仪(美国Life Technologies),VE 186转移电泳槽(上海天能),SIMSV0000超纯水仪(美国Millipore),Tanon 5500全自动化学发光成像系统(上海天能)。
1.2 方法
1.2.1 造模方法以中医“房劳过度伤肾”为理论基础,选择雄性SD退役种鼠(40周龄,40只),复制肾精亏虚证;同时参考金光亮[3-4]、周力[5]、于琦[6]等用于复制肝郁证的复合情志刺激造模法,每笼一只孤养,每日随机给予以下不良刺激中的一种:(1)禁水(24 h);(2)昼夜颠倒(8∶00-18∶00将动物房门关上、拉下窗帘,置于黑暗环境;18∶00-8∶00打开日光灯,并使房间内照度保持在300 Lux);(3)禁食(24 h);(4)夹尾(用25 mm长尾票夹在距尾端1 cm处夹住鼠尾,30 min);(5)噪音(70分贝,持续2 h)。每日1种,每种刺激不连续使用,每周随机休息2 d,连续4周。正常对照组大鼠正常条件饲养,自由摄食和饮水。
1.2.2 动物分组造模完成后,断尾采血0.8~1.2 mL,离心管分装,3 000 r/min,离心10 min,分离出血清,-80℃冰箱冷冻保藏,ELISA法检测血清睾酮浓度。参照何清湖[7]、周兴[8]等的方法,统计得出15只8周龄SD雄性大鼠血清睾酮10%位数,以此为切点值,凡是经复合情志刺激造模后,大鼠血清睾酮水平均低于该切点值的作为LOH大鼠模型。
经统计分析,15只8周龄SD雄性大鼠血清睾酮10%位数为1.91 ng/mL,以TT 1.91 ng/mL为切点值,40周龄SD雄性退役种鼠中,共有34只复合纳入标准,随机选取6只,设为模型组;随机选取8周龄SD雄性大鼠6只,设为正常对照组。
1.2.3 样本取材造模及分组完成后,正常条件下继续饲养4周,于末次给药24 h后处死动物,进行各项指标检测。20%乌拉坦腹腔注射麻醉,腹主动脉取血,静置并离心后取上清液分装,-80℃冻存待检。取一侧睾丸置4%多聚甲醛固定,另一侧睾丸取出适量组织置于冻存管,-80℃保存备用,另取适量睾丸组织置2.5%戊二酸PE管内固定。
1.2.4 大鼠一般情况观察造模及实验期间密切观察大鼠毛色、精神状态、体质量、活动、饮水、饮食等情况变化。
1.2.5 大鼠悬尾试验(Tail suspension test)[9]本实验于造模前1 d、造模完成后第1天、第28天进行。将大鼠尾端2 cm的部位固定在一水平木板上(木板离地1 m左右),使动物呈倒挂状。悬挂两侧用板隔开动物视线,动物为克服不正常的体位而挣扎活动,但活动一定时间后,出现间断性“不动”,显示“失望”状态。计算6 min内的不动时间,并同时观察大鼠挣扎幅度及抑郁状态。此实验能一定程度地反映动物的肌力及抑郁程度。
1.2.6 大鼠睾丸系数睾丸系数=双侧睾丸质量(g)/体质量(g)×100%。
1.2.7 睾丸组织形态学观察采用HE染色,光镜下观察各组织形态学改变,在湖南中医药大学病理教研室完成。
1.2.8 睾丸组织超微结构观察电镜下观察睾丸间质细胞超微结构改变,在中南大学湘雅医院电镜室完成。
1.2.9 血清睾酮测定采用ELISA法,根据睾酮ELISA试剂盒说明书操作,在湖南师范大学生命科学院完成。
1.2.10 睾丸组织睾酮合成相关酶、Caspase-3 mRNA表达采用Real-time PCR法。根据Trizol RNA提取试剂盒说明书方法提取睾丸组织总RNA,在逆转录酶作用下合成cDNA,确定Real-time PCR的反应体系及反应条件参数如下:见表1-2。

表1 Real-time PCR反应体系

表2 Real-time PCR反应条件参数
在NCBI数据库(http://www.ncbi.nlm.nih.gov/)中查找基因序列,设计Real-time PCR引物序列如下:StAR上游引物5’-G C A A A A G G C C T T G G G C A T A C-3’,StAR下游引物5’–T C T G T C C A T G G G C T G G T C T A-3’;P450 scc上游引物5’–T C A G C G A T G A C C T A T T C C G C-3’,P450 scc下游引物5’–A G T C T G G A G G C A T G T T G A G C-3’;3β-HSD上游引物5’–T G T C A T T G A T G T C T C A C A T G T C C-3’,3β-HSD下游引物5’-A G T A G A T G A A G G C T G G C A C A C-3’;Caspase-3上游引物5’-T C T A C C G C A C C C G G T T A C T A-3’,Caspase-3下游引物5’-C G T A C A G T T T C A G C A T G G C G-3’;ACTIN上游引物5’–A C T A T C G G C A A T G A G C G G T T-3’,ACTIN下游引物5’–A A T G C C T G G G T A C A T G G T G G-3’。
使用Life Technologies公司的实时荧光定量PCR仪对样品进行检测,每个样品重复3次。实验结果采用2-ΔCt法,计算目的基因mRNA转录水平的差异。
1.2.11 睾丸组织睾酮合成相关酶、Caspase-3蛋白表达采用Western blot法。取大鼠睾丸组织,按20 mg:150~250 μL比例,加入RIPA裂解液,用玻璃匀浆器于冰上裂解匀浆,BCA工作液测定样品蛋白浓度,SDS-PAGE电泳2~3 h,至溴酚兰刚跑出即终止,电泳结束后转膜2 h,室温下脱色摇床上摇动封闭1~2 h,加入用TBST稀释的一抗(4℃孵育过夜),再加入用TBST稀释的HRP标记二抗(室温孵育1 h),孵育结束后,ECL发光显色液显色,在全自动化学发光成像系统中拍照,曝光30、60、90 s,保存图片,并用Lab-Works软件对图像进行灰度分析。
1.3 统计学分析
2 结果
2.1 一般情况观察
正常组:大鼠一般情况良好,运动活泼有力,反应敏捷,眼睛明亮有神,食欲健旺,鼠毛柔顺浓密,洁净有光泽,肌肉发达,脂肪丰满,体质量均匀增长。模型组:经4周的造模周期,大鼠出现精神萎靡,倦卧少动,甚者蜷缩至垫料下面,眼睛暗淡少神,进食减少,鼠毛枯干蓬乱萎黄,污浊无光泽,体质量无明显增长。
2.2 造模组大鼠体质量、悬尾试验、血清睾酮情况及与正常组比较
造模组大鼠造模前、后体质量比较,差异无统计学意义(P>0.05),与正常对照组比较,差异有统计学意义(P<0.01)。提示雄性退役种鼠经复合情志刺激
造模后,体质量变化不明显。
造模组大鼠造模前、后以及与正常对照组比较,大鼠悬尾不动时间均有统计学差异(P<0.01),提示老龄大鼠的行为能力较青年大鼠已经出现下降,表现出肌力降低、一定程度的抑郁等,经复合情志刺激造模后,其行为能力出现进一步下降。
造模后,造模组大鼠血清睾酮水平与正常对照组比较,差异有统计学意义(P<0.01)。提示老龄大鼠血清睾酮水平明显低于青年大鼠,符合LOH动物模型要求。见表3。
表3 两组大鼠造模前后情况比较(±s)

表3 两组大鼠造模前后情况比较(±s)
注:与本组造模前比较▲P<0.01;与正常对照组比较△P<0.01。
组别造模组正常对照组t P n 40 15体质量(g)造模前造模后613.65±54.66602.97±54.48△-222.19±19.52 38.152 0.000悬尾试验(s)造模前造模后睾酮(ng/mL)造模后258.43±4.30289.60±4.94▲△1.43±0.60△-186.47±6.443.95±1.33 63.372-9.728 0.0000.000
2.3 造模后两组大鼠情况比较
造模完成后,正常条件下继续饲养4周,比较两组大鼠造模后第1天、第28天情况变化。
2.3.1 睾丸组织形态学观察病理切片显示,正常对照组大鼠各级生精细胞发育正常,层次清晰,睾丸间质正常。模型组大鼠初级精母细胞数量减少,精子细胞坏死紊乱,大量吞噬细胞产生,精子大量减少,睾丸间质变少,细胞与细胞间分界不清。见图1。

图1 睾丸组织HE染色图(×400)
2.3.2 睾丸组织超微结构观察电镜结果显示,正常对照组大鼠睾丸间质细胞线粒体多,线粒体聚集,形成线粒体鞘,线粒体体积大,线粒体嵴清晰,线粒体无水肿。模型组大鼠睾丸间质细胞中线粒体数量明显减少,线粒体体积小,部分线粒体水肿,线粒体嵴不清晰,嵴水肿。见图2。
2.3.3 两组大鼠体质量、睾丸指数、悬尾试验、睾酮浓度变化造模后第1天、第28天比较,模型组在体质量、悬尾不动时间、睾酮浓度方面无明显改变,差异无统计学意义(P>0.05);正常对照组体质量增加明显,差异有统计学意义(P<0.05)。模型组悬尾不动时间、睾丸指数、睾酮浓度与正常对照组比较,差异有统计学意义(P<0.01)。见表4。

图2 睾丸间质细胞超微结构图
2.3.4 两组大鼠睾酮合成相关酶、Caspase-3 mRNA表达(RT-PCR)两组造模后第28天比较,模型组Caspase-3 mRNA表达明显升高,StAR、P450scc、3β-HSD mRNA表达明显降低,差异均有统计学意义(P<0.01)。见表5。
2.3.5 两组大鼠睾酮合成相关酶、Caspase-3蛋白表达(Western Blot)两组造模后第28天比较,模型组Caspase-3蛋白表达明显升高,StAR、P450scc、3β-HSD蛋白表达明显降低,差异均有统计学意义(P<0.01)。见表6、图3。
3 讨论
目前,国内外对于LOH动物模型的复制,主要有以下方法:(1)自然老化造模[10];(2)化学药物诱导
造模,药物如环磷酰胺[7]。自然老化造模一般用18-20月龄的大鼠,该模型与LOH的生物学特性较为接近,但造模周期太长,国内大多数的实验动物中心都不生产,因此来源稀少,价格昂贵。利用环磷酰胺的生殖毒性,造成睾丸间质细胞受损、睾酮合成酶活性降低,睾酮水平下降,能在一定程度模拟LOH特征,但需要使用外源性药物干预,同时对于LOH存在的自主神经紊乱等症状难于复制。同时,国内针对LOH的中医证候模型的复制还几乎是空白。
表4 造模后两组大鼠体质量、睾丸指数、悬尾试验、睾酮浓度情况比较(±s,n=6)
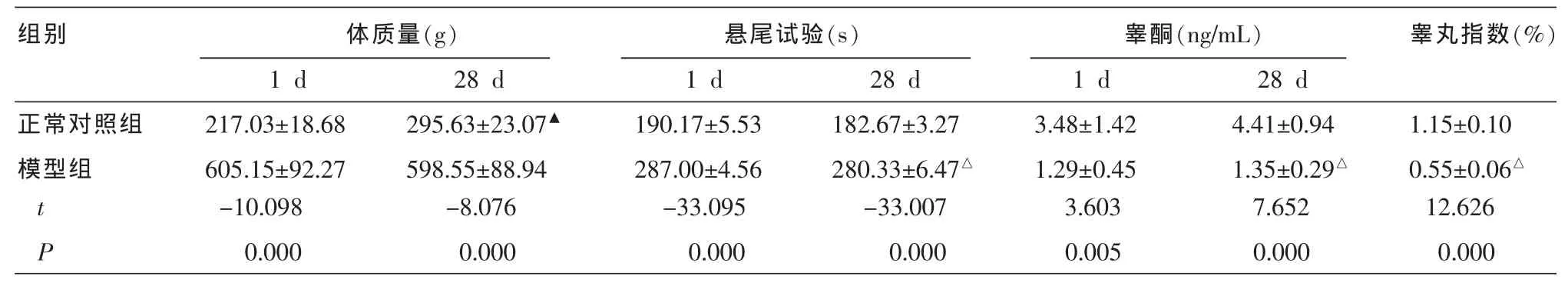
表4 造模后两组大鼠体质量、睾丸指数、悬尾试验、睾酮浓度情况比较(±s,n=6)
注:与本组第1 d比较▲P<0.05;与正常对照组比较△P<0.01。
组别睾丸指数(%)正常对照组模型组体质量(g)1 d28 d 217.03±18.68295.63±23.07▲605.15±92.27598.55±88.94悬尾试验(s)1 d28 d 190.17±5.53182.67±3.27 287.00±4.56280.33±6.47△睾酮(ng/mL)1 d28 d 3.48±1.424.41±0.94 1.29±0.451.35±0.29△1.15±0.10 0.55±0.06△t -10.098-8.076-33.095-33.0073.6037.65212.626 P 0.0000.0000.0000.0000.0050.0000.000
表5 两组大鼠睾丸组织睾酮合成相关酶(2-ΔCt×10-3)、Caspase-3 mRNA(2-ΔCt×10-4)表达(±s,n=5)

表5 两组大鼠睾丸组织睾酮合成相关酶(2-ΔCt×10-3)、Caspase-3 mRNA(2-ΔCt×10-4)表达(±s,n=5)
注:与正常对照组比较▲P<0.01。
组别正常对照组模型组Caspase-3 3.18±0.54 14.66±4.46▲StAR 29.62±12.25 5.53±3.47▲P450scc 22.88±14.51 2.75±0.90▲3β-HSD 30.96±17.38 6.59±3.78▲t -8.4946.0094.5484.410 P 0.0000.0000.0010.001
表6 两组大鼠睾丸组织睾酮合成相关酶、Caspase-3蛋白表达(±s,n=5,Caspase-3、StAR、P450scc、3β-HSD/Actin)

表6 两组大鼠睾丸组织睾酮合成相关酶、Caspase-3蛋白表达(±s,n=5,Caspase-3、StAR、P450scc、3β-HSD/Actin)
注:与正常对照组比较▲P<0.01。
组别正常对照组模型组Caspase-3 0.16±0.02 0.39±0.09▲StAR 0.38±0.01 0.16±0.08▲P450scc 0.70±0.22 0.49±0.17▲3β-HSD 0.45±0.03 0.27±0.03▲t -4.6465.6221.5029.679 P 0.0040.0010.0040.000
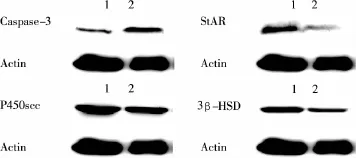
图3 大鼠睾丸组织Caspase-3,睾酮合成相关酶StAR、P450scc、3β-HSD蛋白的表达电泳图
基于现阶段中西医对LOH发病机制、临床表现的认识,本研究团队在以往研究的基础上,结合上述造模方法,选用“退役种鼠+复合情志刺激+孤养”方法,构建“肾虚肝郁证”LOH动物模型。40周龄雄性退役种鼠,价格低廉,易于购买,相比较于18-20月龄的大鼠,其饲养周期明显缩短;同时,种鼠由于反复配种需要,其老化速度明显快于普通的成年大鼠;中医学理论认为,肾藏精,主生殖,房室过度,暗耗肾精,可出现“肾精亏损”的证候;此外,模拟LOH发病的慢性应激、环境、心理等因素,采用复合情志刺激结合孤养方法,中医理论认为,肝主疏泄,长期不良情志刺激、孤养可引发“肝郁证”的出现,从而复制出“肾虚肝郁”证候类型的LOH动物模型。本模型的优势在于,一方面运用的是自然老化大鼠,无需药物干预,能最大程度复制LOH的发病过程,种鼠的运用能加速其老化进程,节约了时间和经济成本;另一方面结合孤养、复合情志刺激等方法,复制出“肾虚肝郁”证候类型,为研究LOH提供了很好的中医证候动物模型,应该是一种比较可靠且操作性较强的造模方法。
造模结束后,模型组大鼠出现精神萎靡、蜷卧少动、进食减少,悬尾不动时间明显延长(P<0.01)等一系列典型的LOH精神心理、体能改变,同时模型组大鼠血清总睾酮水平明显低于正常对照组大鼠(P<0.01),均符合LOH动物模型要求。
关于增龄影响睾酮合成,进而可能影响LOH发病,其机制之一是睾丸间质细胞超微结构的改变。李维仁[11]等研究证实,老年人睾丸间质细胞胞浆中,细胞器较少,可见大量肿胀的线粒体,线粒体嵴消失,少见有脂滴,这与睾酮合成功能降低密切相关。本研究发现,模型组大鼠睾丸间质变少,睾丸间质细胞线粒体数量明显减少,体积小,水肿明显,线粒体嵴消失。引发这一现象的重要原因可能与睾丸间质细胞过度凋亡有关,蔡崇岳[12]等研究显示,衰老大鼠睾丸组织中Caspase-3表达明显增强。而作为诱导细胞
凋亡关键分子的Caspase家族,其Caspase-3是处于最核心位置,它的高水平表达可诱导睾丸间质细胞凋亡的增加。本研究也证实,模型组大鼠睾丸组织中Caspase-3 mRNA及蛋白表达水平均显著升高。
关于增龄影响睾酮合成的另一可能机制是,增龄对睾酮合成酶活性与表达的影响。在睾酮合成过程中,类固醇激素合成急性调节蛋白(Steroidogenic Acute Regulatory Protein,StAR)[13]、细胞色素胆固醇侧链裂解酶(Cytochrome P450 side-chain cleavage,P450scc)[14]、3β-羟甾脱氢酶(3beta-hydroxysteroid dehydrogenase,3β-HSD)[15]均是睾酮合成的关键酶。靳会卿[16]等研究显示,自然衰老大鼠(18月龄)睾丸组织中StAR、P450scc、3β-HSD蛋白表达水平显著低于青年组大鼠(4月龄);李维仁[11]等研究也证实,老年人组(70~90岁)睾丸组织中StAR、P450scc蛋白表达水平显著低于青年组(20~30岁)(P<0.05)。本研究显示,模型组大鼠睾丸组织中StAR、P450scc、3β-HSD mRNA及蛋白表达水平均显著低于正常对照组,与靳会卿[16]等的研究一致。
综上所述,本实验以中医理论“房劳过度伤肾”、“郁久伤肝”为指导,选择退役种鼠(房劳过度),采用孤养、慢性应激等情志刺激(久郁)方法,模拟LOH的中医发病过程,构建“肾虚肝郁证”LOH动物模型,出现有临床典型的LOH症状。基于超微结构、基因组学、蛋白组学研究证实,模型组大鼠睾丸间质细胞线粒体结构改变、Caspase-3表达增强以及StAR、P450scc、3β-HSD表达下降,均符合LOH发病机制的现代研究。因此,可以认为“退役种鼠+复合情志刺激+孤养”方法构建的“肾虚肝郁证”LOH动物模型是成功的,符合中医理论特色。
[1]郭应禄,李宏军.男性更年期综合征[M].北京:中国医药科技出版社,2005:5.
[2]周兴,何清湖,周青,等.中医药治疗男性更年期综合征随机对照试验的系统评价[J].中华中医药杂志,2013,28(9):2 771-2 775.
[3]金光亮,南睿,郭霞珍.慢性应激肝郁证大鼠模型的建立[J].北京中医药大学学报,2003,26(2):18-21.
[4]金光亮,王胜兰.关于建立肝郁证动物模型的思考[J].山东中医药大学学报,2004,28(6):408-409.
[5]周力,蒲琴,申理,等.利用不良情志刺激建立肝郁证动物模型初探[J].中药药理与临床,2008,24(3):114-115.
[6]于琦,金光亮.四逆散、归脾汤与温胆汤对慢性应激肝郁模型大鼠行为学的影响[J].广州中医药大学学报,2009,26(2):148-151.
[7]何清湖,周兴.环磷酰胺复制中老年男性雄激素部分缺乏综合征大鼠模型的研究[J].湖南中医药大学学报,2011,31(1):15-17.
[8]周兴,何清湖,刘朝圣,等.天蚕壮阳散对中老年男性雄激素部分缺乏综合征模型大鼠睾丸间质细胞stAR蛋白表达的影响[J].中国中西医结合杂志,2011,31(4):542-546.
[9]Can A,Dao DT,Terrillion CE,et al.The tail suspension test[J]. J Vis Exp,2012,(59):e3769.
[10]白如鑫,李沛.温和灸对中老年部分雄激素缺乏综合征大鼠模型影响的实验研究[J].针刺研究,2007,32(4):229-233.
[11]李维仁,韩勃萱,刘涛,等.老年人睾丸间质细胞结构及StAR和P450scc蛋白表达的变化[J].北京大学学报(医学版),2011,43(4):505-508.
[12]蔡崇岳,章振保,田生平.衰老雄性大鼠睾丸组织抗氧化酶与血清睾酮水平、凋亡蛋白酶-3基因表达的研究[J].汕头大学医学院学报,2006,19(3):154-156.
[13]Sugawara T,Fujimoto S.The potential function of steroid sulphatase activity in steroid production and steroidogenic acute regulatory protein expression[J].Biochem J,2004,380(Pt 1):153-160.
[14]Culty M,Luo L,Yao ZX,et al.Cholesterol transport,peripheralbenzodiazepinereceptor,andsteroidogenesisinaging Leydig cells[J].J Androl,2002,23(3):439-447.
[15]Zheng D,Zhao Y,Shen Y,et al.Orexin A-mediated stimulationof3beta-HSDexpressionandtestosteroneproduction through MAPK signaling pathways in primary rat Leydig cells [J].J Endocrinol Invest,2014,37(3):285-292.
[16]靳会卿,姜斐,邓冬梅,等.补肾方对自然衰老大鼠睾酮调节作用及机制研究[J].中华男科学杂志,2011,17(8):758-762.
(本文编辑贺慧娥)
Establishment and Evaluation of Rat Model of Late Onset Hypogonadism of Liver Constraint and Deficiency of Kidney-type
ZHOU Xing1,ZHOU Qing1,LAI Yongjin2
(1.The First Affiliated Hospital of Hunan University of Chinese Medicine,Changsha Hunan 410007,China;2.Pingxiang Chinese Medicine Hospital,Pingxiang,Jiangxi 337000,China)
Objective To establish late onset hypogonadism(LOH)rat models with kidney-asthenia and liver depression syndrome and evaluate their value in research.Methods The rat models with kidney-asthenia and liver depression syndrome were established by using retired mated rat(40 weeks)+various emotional stimulation+social isolation methods,which is guided by TCM theory”sexual excess injury kidney essence”and”depressed anger damaging the liver”.Compared with the control group(8 weeks),the serum testosterone,tail suspension test,Leydig cells ultrastructure,the expression of testosterone synthetase and mRNA and protein of Caspase-3 were observed.Results A series of spirit,psychological health and physical fitness on LOH were observed.Compared with the normal group,serum testosterone levels in the model rats were decreased significantly,TST times increased significantly,the expressions of Caspase-3 were increased,the related testosterone synthetase StAR,P450scc,3β-HSD were decreased,the differences were statistically significant(P<0.01).Also the testis interstitium was less,thequantityofLeydigcellsmitochondrionwasreducedandthemitochondrialcristaeinthemodelgroup was disappeared.ConclusionThe LOH rat models with kidney-asthenia and liver depression syndrome can be established by using retired mated rat(40 weeks)+various emotional stimulation+social isolation methods,which are with high practical values.
late onset hypogonadism;models;animals;kidney-asthenia and liver depression syndrome
R256.5;R285.5
A
doi:10.3969/j.issn.1674-070X.2016.03.009
2015-12-02
国家自然科学基金青年科学基金资助项目(81202706)。
周兴,男,副主任医师,博士,从事中西医结合男科学专业。

