1株虎杖根腐病病原菌的分离与鉴定
魏士杰+王颖+陈文强+孔亚男

摘要:以药用植物虎杖为试验材料,采用组织匀浆方法对其根腐病病原菌进行分离,并通过浸根接种和针刺菌液2种侵染方法做植物人工侵染回归试验,筛选出致病菌株P051。经接触酶、氧化酶和糖发酵等生理生化试验与形态学、分子生物学鉴定表明,药用植物虎杖中1株根腐病的致病菌株P051为微球菌科微球菌属藤黄微球菌(Micrococcus luteus)。研究结果为秦巴山区药用植物虎杖的栽培、保护和利用提供了依据。
关键词:虎杖;根腐病;藤黄微球菌;分离;鉴定
中图分类号: S435.672 文献标志码: A
文章编号:1002-1302(2016)09-0141-04
虎杖(Polygonum cuspidatum)别称假川七、土川七、红三七、三七或日本蓼,为蓼科蓼属的多年生草本植物[1],广泛分布于山东、河南、陕西、湖北、湖南等地[2]。虎杖根及根状茎切片可入药,具有祛风利湿、活血化瘀、止咳化痰、消肿止痛等功效[3-4]。虎杖提取物含有白藜芦醇、大黄素、蒽醌类等有效成分[5-6],对心脏病[7]、高血脂[8]、癌症[9]等具有很好的疗效,已成为国内外学者研究的热点。
根腐病是药用植物生长过程中一种常见的顽固性病害。在中药材生产过程中,根腐病会造成药材不同程度地减产,严重影响中药材的生产和品质[10]。近年来,有关虎杖的研究多集中在药理及活性成分[11-12],对种植和栽培过程中的病害研究鲜有报道。梁萍等对虎杖锈病进行了研究,采用形态学方法鉴定其为两栖蓼柄锈菌(Puccinia polygoni)[13]。目前,对虎杖根腐病病原菌的研究尚无报道。因此,本研究对1株药用植物虎杖根腐病病原菌进行分离和鉴定,以期为秦巴山区珍稀药用植物虎杖的栽培、保护和利用奠定基础。
[BT1-*8]1 材料与方法
1.1 试验材料
药用植物虎杖病株采自陕西省汉中市留坝县马道镇,为野生植株。供试1年生虎杖幼苗购自万源市邱佳坪虎杖种植基地。
1.1.1 材料与试剂 营养琼脂(NA)培养基:蛋白胨10.0 g、牛肉膏3.0 g、NaCl 5.0 g、琼脂15.0 g、pH值7.4;液体LB培养基:胰蛋白胨10.0 g、酵母提取物5.0 g、NaCl 10.0 g、pH值7.4;糖发酵培养基:葡萄糖5.0 g、牛肉膏蛋白胨10.0 g、Na2HPO4·12H2O 2.0 g、NaCl 3.0 g、指示剂溴甲酚紫1 mL、pH值7.4;乳糖发酵培养基:乳糖5.0 g、蛋白胨2.0 g、NaCl 3.0 g、Na2HPO4·12H2O 2.0 g、指示剂溴甲酚紫1.0 mL、pH值7.4;甘露糖发酵培养基:甘露醇5.0 g、蛋白胨2.0 g、NaCl 3.0 g、Na2HPO4·12H2O 2.0 g、指示剂溴甲酚紫1.0 mL、pH值7.4;甘露醇发酵培养基:甘露醇5.0 g、蛋白胨3.0 g、NaCl 5.0 g、KH2PO4 0.5 g、指示剂溴甲酚紫1.0 mL、pH值7.4;营养明胶培养基:NaCl 5.0 g、蛋白胨10.0 g、牛肉膏3.0 g、明胶120.0 g、pH值7.4;硝酸盐培养基:KNO3 1.0 g、K2HPO40.5 g、NaCl 0.5 g、MgSO4·7H2O 0.5 g、蔗糖20.0 g、pH值7.2;七叶苷培养基:胰蛋白胨 5.0 g、K2HPO4 1.0 g、七叶苷3.0 g、柠檬酸铁铵0.5 g、pH值6.9~7.1。
大肠杆菌(Escherichia cdi,ATCC8739)、粪肠球菌(Enterococcus faecalis)、藤黄微球菌,均由陕西省食药用菌工程技术研究中心提供。
葡萄糖、Na2HPO4·12H2O、NaCl、KNO3、K2HPO4、MgSO4·7H2O均为分析纯;琼脂、牛肉膏、琼脂、蛋白胨、胰蛋白胨、甘露醇、明胶、指示剂溴甲酚紫,由山西津华晖星制药有限公司提供。格里斯氏(Griess)试剂A:对氨基苯磺酸0.5 g、10%稀乙酸150 mL;格里斯氏(Griess)试剂B:α-萘胺 0.1 g、H2O 20 mL、10%稀乙酸150 mL;二苯胺试剂:二苯胺 0.5 g溶于100 mL浓硫酸中,用20 mL蒸馏水稀释。
1.1.2 仪器与设备 LS-B50L高压蒸汽灭菌锅,上海医用核子仪器厂;TB-214电子分析天平,北京赛得利斯仪器系统有限公司;LRH-250-GS数显式恒温培养箱,广东省医疗器械厂;Q/BKYY31-2000恒温鼓风干燥箱,上海跃进医疗器械厂;SUPL超纯水机,上海申分分析仪器有限公司;SBP100-20可调式微量移液器,美国Select Bioproducts公司;SW-CJ-1F 超净工作台,苏州安泰空气技术有限公司;SA3000普通生物显微镜,北京泰克仪器有限公司;ZHWY-210 2C恒温摇床,上海志成有限公司。
1.2 试验方法
1.2.1 分离与纯化 参考王晓丽等对朝鲜蓟根茎腐烂病病原菌的分离方法[14],用无菌手术刀将根表面泥沙及腐烂组织除去,无菌水冲洗,75%乙醇处理5 min,然后用0.1% HgCl2浸泡2 min,取病健交界处组织约1.0 g,在9.0 mL无菌水中捣碎,制成10-1浓度菌液,依次稀释至10-4浓度。各取10-3、10-4浓度菌液100 μL,涂布于营养琼脂培养基上,30 °C培养18~36 h。挑取不同菌落进行纯化培养。
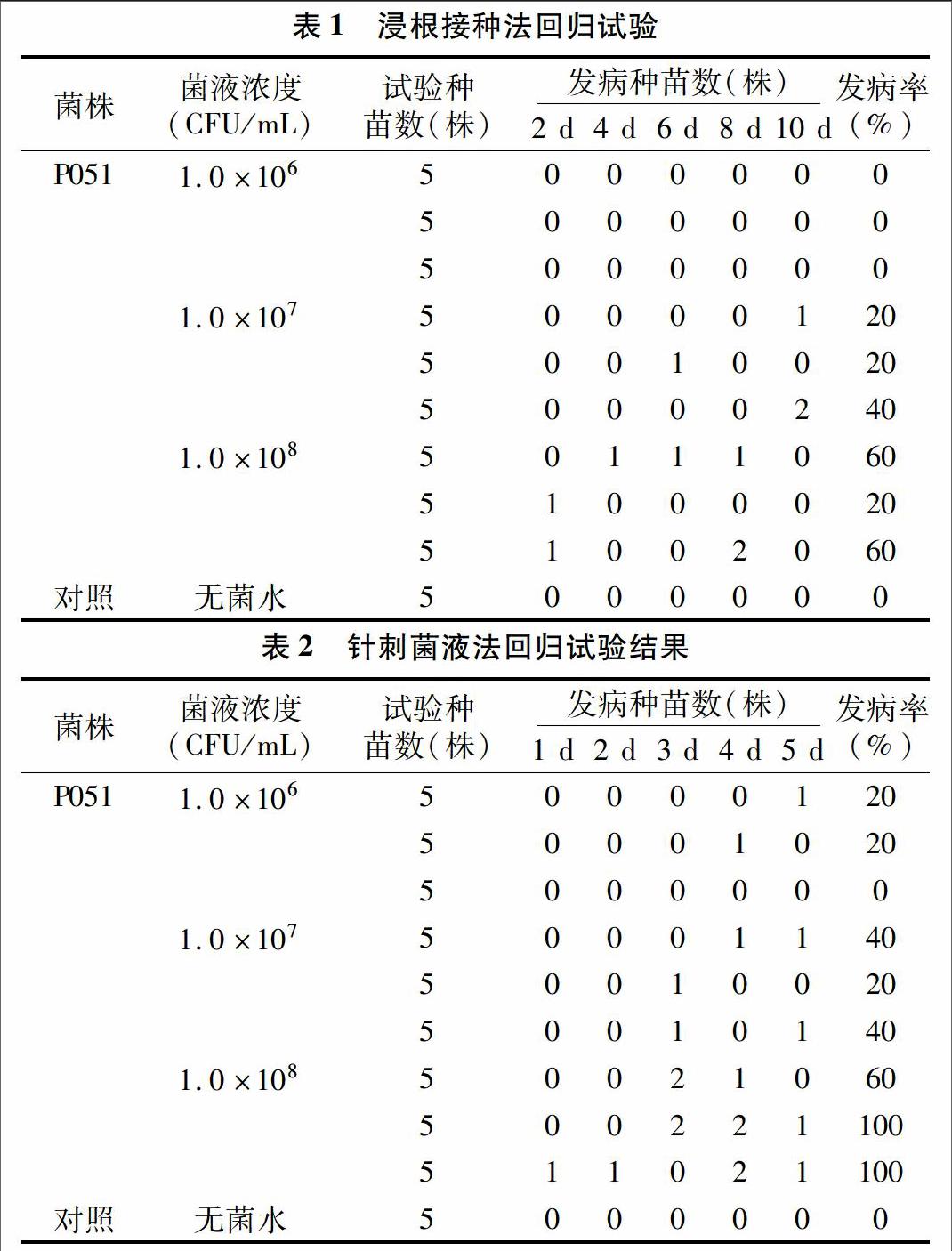
1.2.2 回归试验 采用浸根接种法[15],挑取纯化的病原菌菌落于液体LB培养基发酵24 h,用血球板计数,分别取菌液浓度1.0×106、1.0×107、1.0×108 CFU/mL作为接种液,将购自种植基地的正常虎杖1年生苗根部用无菌水洗净,然后用70%乙醇处理约1 min,去除表面杂菌,再浸入接种液中20 min。各浓度接种液做相同处理。同时将正常虎杖1年生苗根系浸入未接种病原菌的无菌水内作为对照。将试验组及对照组均移栽至备好的花盆内,放置于温度25~30 ℃下,每组5株虎杖根苗,3组重复,观察发病情况。
同时,采用针刺菌液法,取正常虎杖1年生根苗,根部用无菌水洗净,后用70%乙醇处理约1 min,去除表面杂菌,用无菌针蘸取接种液刺伤根部,5~8孔/条为宜,用无菌脱脂棉蘸无菌水覆盖伤口处保湿,用无菌棉线固定。各浓度均做相同处理。同时用无菌针将根部刺伤,以脱脂棉蘸无菌水覆盖伤口,用无菌棉线固定,作为对照。放置于温度28 ℃下,每组5株虎杖根苗,3组重复,观察发病情况。
1.2.3 致病菌株的分离 对回归试验中表现出与发病植株相同症状的虎杖根苗按“1.2.1”节的方法重新分离病原菌,因虎杖根苗较幼嫩,故将消毒时间减半。
1.2.4 致病菌的形态及生理生化反应鉴定 对已确定具有致病性的菌株进行菌落形态观察、革兰氏染色。接触酶试验、氧化酶试验、糖发酵试验、明胶液化试验、七叶苷水解试验按照《伯杰细菌鉴定手册》以及《常见细菌系统鉴定手册》对病原菌进行初步鉴定;硝酸盐还原试验参照文献[16]。
1.2.5 致病菌的分子生物学鉴定 菌株DNA的提取:溶菌酶-SDS法[17]。PCR扩增:以提取的菌株DNA为PCR扩增模板,引物为细菌16S rDNA基因通用引物,27F:(5′-AGAGTTTGATCCTGGCTCAG-3′;1 492R:(5′-GGTTACCTTGTTACGACTT-3′)。PCR反应条件:94 ℃5 min;95 ℃1 min,57 ℃ 70 s,72 ℃2 min,共32个循环。PCR产物经1%琼脂糖凝胶电泳后,将目的条带清晰的PCR产物送生工生物工程(上海)股份有限公司进行双向测序。将所测序列与基因库(GenBank)中相对应的数据进行相似性比对,挑选相似度>98%的模式菌株序列,用MEGA 5软件,选择近邻结合法(Neighbor-Joining,NJ),选择 1 000 个重复作Bootstrap值分析,构建系统发育树并进行分析。
2 结果与分析
2.1 菌株的分离与纯化
从发病的虎杖根中分离得到疑似致病菌,并在1年生正常虎杖根苗中用浸根接种法和针刺菌液法分别对疑似致病菌做回归试验,发现有1株细菌在10 d内使正常虎杖根苗发病,病情与采集到的发病虎杖植株相似。后从发病的虎杖根苗中重新分离致病菌,分离到的菌株与原疑似致病菌在菌落形态上保持一致,将此菌株编号为P051。
2.2 菌株P051的回归试验
菌株P051的菌液分别用浸根接种法和针刺菌液法研究其所致虎杖正常根苗的发病情况。
表1结果表明,采用浸根接种法时,正常虎杖根苗在菌液浓度达到1.0×107 CFU/mL时开始出现病变植株,此浓度的最高发病率为40%;当菌液浓度达到1.0×108 CFU/mL时,根苗的发病率明显提高,达到60%。
表2结果表明,采用针刺菌液法时,菌液浓度为1.0×106 CFU/mL 时就有根苗针刺部位出现轻微腐烂,且发病时间较浸根接种法早;当菌液浓度达到1.0×108 CFU/mL时,根苗几乎全部发病。由此可知,该菌株为虎杖根部腐烂的致病菌或是其中的1种。
2.3 菌株P051的菌落形态
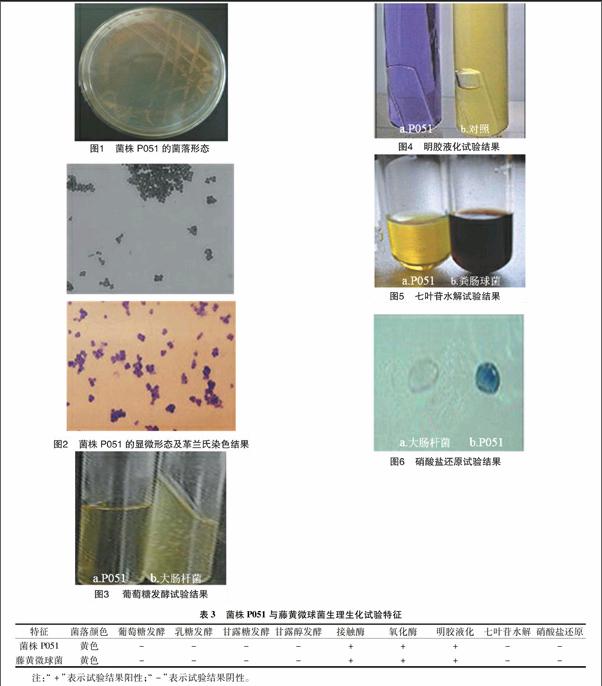
菌株P051在NA培养基上能较好地生长,28 ℃下培养36 h,菌株P051的菌落形态见图1,显微形态及革兰氏染色结果见图2。
图1、图2显示,菌株P051菌落呈圆形,表面光滑,边缘整齐,黄色,有突起,不透明;革兰氏染色阳性,细胞球形,无运动能力,多呈四联或簇状排列,且无芽孢形成。
2.4 菌株P051的生理生化试验
接触酶试验:供试菌中滴加3% H2O2后载玻片上立即出现大量气泡,说明菌株P051含有过氧化氢酶,能催化过氧化氢产生水和氧气,即接触酶试验呈阳性。
氧化酶试验:滴加1%盐酸四甲基对苯二胺溶液,滤纸出现紫色,说明菌株P051含有氧化酶,能与对二苯胺发生反应,生成有色的醌类化合物,即氧化酶反应呈阳性。
糖发酵试验:供试菌分别接种至以葡萄糖、乳糖、甘露糖等为碳源的发酵培养基中,30 ℃下培养24~36 h,以大肠杆菌作为对照。图3显示,菌株P051不能利用葡萄糖碳源发酵。其他糖发酵试验均显示阴性。
明胶液化试验:挑取供试菌穿刺接种于配置好的营养明胶斜面培养基中,36 ℃下培养,以不接种供试菌的营养明胶培养基作为对照,图4显示,菌株P051含有蛋白水解酶,可将明胶水解而液化,明胶试验呈阳性。
七叶苷水解试验:将菌株P051接种于七叶苷试管培养基中,30 ℃下培养2~4 d,以类肠球菌为对照。图5显示,培养基不变色,说明菌株P051不能将七叶苷分解,七叶苷水解试验呈阴性。
硝酸盐还原试验:将菌株P051接种于硝酸盐液体培养基中,30 ℃下培养5 d,以大肠杆菌为对照。图6显示,滴加A液和B液后并未变红。为验证是否出现假阴性,另取培养液少许,滴加二苯胺后变为蓝色,说明菌株P051不能将硝酸盐还原为亚硝酸,硝酸盐还原试验呈阴性。
2.5 菌株P051的生理生化试验特征
表3表明,菌株P051在接触酶、氧化酶、葡萄糖、乳糖、甘露醇、明胶液化、硝酸盐还原、七叶苷水解等方面表现与藤黄微球菌标准均一致。
2.6 菌株P051的分子生物学鉴定
将所测序列与GenBank中相对应的数据进行相似性比对,挑选相似度>98%的模式菌株序列,用MEGA 5软件,采用近邻结合法选择1 000个重复作Bootstrap值分析,构建系统发育树。图7显示,菌株P051与GenBank中的已知种Micrococcus luteus在同一聚类分支上,亲缘关系最相近,且自展支持率为97。结合菌株P051的菌落形态、生理生化反应特征以及16S rDNA碱基序列分析结果,秦巴山区药用植物虎杖根腐病原菌株P051可鉴定为微球菌科微球菌属藤黄微球菌(Micrococcus luteus)。
3 结论
本研究参考对中药材掌叶大黄[18]、麻黄[19]、桑树[20]根部病害的相关报道,对秦巴山区药用植物虎杖根部腐烂的致病菌进行分离,通过回归试验确定1株致病菌,编号为P051。对此菌株进行形态学鉴定及接触酶、氧化酶、葡萄糖发酵、乳糖发酵、甘露醇发酵、明胶液化、硝酸盐还原等生理生化试验和分子生物学鉴定,确定此菌株为微球菌科微球菌属藤黄微球菌(Micrococcus luteus)。在植物回归试验中,分别采取浸根接种法和针刺菌液法2种侵染方法,保证了试验的可信度。
植物根腐病大多是由多种病原菌共同侵染的结果[21-26],本研究分离得到的1株藤黄微球菌可能仅是导致虎杖根部腐烂的病原菌中的1种,是否还有其他微生物导致虎杖根部腐烂,尚须进一步研究。
参考文献:
[1]毛永芬,窦夏睿. 虎杖的性能特点及临床应用[J]. 河北中医,2003,25(8):634-636.
[2]方文清,董昌平. 不同产地虎杖中虎杖苷和总黄酮含量比较[J]. 中国药业,2014,23(24):78-79.
[3]樊惠婷,丁世兰,林洪生. 中药虎杖的药理研究进展[J]. 中国中药杂志,2013,38(15):2545-2548.
[4]孔晓华,周玲芝. 中药虎杖的研究进展[J]. 中医药导报,2009,15(5):107-110.
[5]李菁雯,陈祥龙,孟祥智. 虎杖及其提取物的研究进展[J]. 中医药学报,2011,39(3):103-106.
[6]黄远芬,李蓓蓓,罗霄山,等. 虎杖及其有效成分药理研究进展[J]. 广东药学,2000,10(6):13-15.
[7]Wong R H X,Berry N M,Coates A M,et al. Chronic resveratrol consumption improves brachial flow-mediated dilatation in healthy obese adults[J]. Journal of Hypertension,2013,31(9):1819-1827.
[8]Baur J A,Pearson K J,Price N L,et al. Resveratrol improves health and survival of mice on a high-calorie diet[J]. Nature,2006,444(7117):337-342.
[9]Harikumar K B,Kunnumakkara A B,Sethi G,et al. Resveratrol,a multitargeted agent,can enhance antitumor activity of gemcitabine in vitro and in orthotopic mouse model of human pancreatic cancer[J]. International Journal of Cancer,2010,127(2):257-268.
[10]穆向荣,马逾英,杨枝中,等. 药用植物根腐病防治的研究进展[J]. 中药与临床,2014,5(2):5-8.
[11]黄海量. 中药虎杖药理作用研究进展[J]. 西部中医药,2012,25(4):100-103.
[12]廖 文,李 明. 虎杖的本草考证及药理作用[J]. 中华中医药学刊,2011,29(11):2511-2513.
[13]梁 萍,黄艳花,覃连红,等. 虎杖锈病研究[J]. 安徽农业科学,2008,36(1):55-56.
[14]王晓丽,夏 花,张平喜,等. 朝鲜蓟细菌性根茎腐烂病病原的分离与鉴定[J]. 植物病理学报,2012,42(3):236-241.
[15]朱春雨,刘西莉,董 槿,等. 麻黄根腐病病原物的分离及鉴定[J]. 植物病理学报,2003,33(3):193-197.
[16]阮继生,黄 英. 放线菌快速鉴定与系统分类[M]. 北京:科学出版社,2011:74-77.[HJ1.62mm]
[17]闫莉萍,洪 葵,胡申才,等. 海南近海30株抗B16细胞活性放线菌的16SrDNA多样性分析[J]. 微生物学报,2005,45(2):185-190.
[18]刘亚亚,陈 垣,郭凤霞,等. 掌叶大黄根腐病病原菌的分离与鉴定[J]. 草业学报,2011,20(1):199-205.
[19]朱春雨,刘西莉,董 槿,等. 麻黄根腐病病原物的分离及鉴定[J]. 植物病理学报,2003,33(3):193-197.
[20]方水琴,吴福安,陈明胜,等. 一种引起成年桑树根部腐烂的病害及致病菌分离与初步鉴定[J]. 蚕业科学,2011,37(5):785-791.
[21]陶宏征,张建春,鲁海菊,等. 抗枇杷根腐病病菌的6株枇杷主干内生真菌生物学特性研究[J]. 江苏农业科学,2015,43(9):166-168.
[22]袁孟娟,张 薇,董慧钧,等. 中药材天南星根腐病病原菌的分离与鉴定[J]. 江苏农业科学,2015,43(1):153-154.
[23]关一鸣,潘晓曦,王 莹,等. 哈茨木霉菌、枯草芽孢杆菌对人参灰霉病和根腐病病原菌的拮抗作用[J]. 江苏农业科学,2014,42(5):123-125.
[24]张 扬,郑建秋,谢丙炎,等. 甘蓝枯萎病病原菌的鉴定[J]. 植物病理学报,2008,38(4):337-345.
[25]张 萍. 葫芦巴根腐病病原菌的鉴定[J]. 西北农业学报,2008,17(6):202-204.
[26]沈清清,刘 芳,胡 彦. 药用植物根腐病病原菌研究进展[J]. 北方园艺,2014(11):187-190.

