Mcl-1 siRNA对TRAIL诱导胃癌细胞凋亡的影响
金 玮,吴 萍
Mcl-1 siRNA对TRAIL诱导胃癌细胞凋亡的影响
金 玮1,吴 萍2
目的 探讨转染髓样细胞白血病(Mcl-1)siRNA特异性沉默Mcl-1基因对肿瘤坏死因子相关的凋亡诱导配体(TRAIL)诱导胃癌细胞HGC-27凋亡的影响。方法 采用碘化丙啶(PI)染色法流式细胞术分析TRAIL单独作用的细胞凋亡率以及广谱caspase抑制剂z-VAD-fmk对细胞凋亡的抑制作用;Western blot法分析TRAIL处理前后半胱天冬酶-3(caspase-3)和聚腺苷二磷酸核糖聚合酶-1(PARP-1)的活化以及抗凋亡的Bcl-2、Bcl-XL及Mcl-1的蛋白表达情况;采用Lipofectamine 2000转染Mcl-1 siRNA入HGC-27细胞,Western blot 法验证基因沉默效果,流式细胞术分析转染后细胞凋亡率的变化。结果 HGC-27细胞对TRAIL不敏感,48 h的凋亡率仅为(20.65±3.23)%,z-VAD-fmk能几乎完全阻止TRAIL诱导的凋亡;TRAIL作用晚期caspase-3活化、PARP-1裂解,Bcl-2、Bcl-XL及Mcl-1在TRAIL处理前后没有明显的变化;Mcl-1 siRNA转染后能显著降低细胞中Mcl-1的蛋白表达水平,且细胞转染Mcl-1 siRNA后再加入TRAIL处理,细胞凋亡率明显增加。结论 Mcl-1的高表达可能与HGC-27细胞对TRAIL抵抗有关,Mcl-1 siRNA沉默Mcl-1基因能增加HGC-27细胞对TRAIL的敏感性。
胃癌;细胞凋亡;小干扰RNA;Mcl-1
肿瘤坏死因子相关的凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)是肿瘤坏死因子超家族的成员,具有选择性杀伤肿瘤细胞的特点,相比一般的化疗药物有其独特的优势。TRAIL既可以通过死亡受体途径诱导细胞凋亡,又可以通过线粒体途径使凋亡信号得以放大。Bcl-2家族是调控线粒体途径的关键分子,其25个成员根据结构及功能不同,分为促凋亡和抗凋亡蛋白,两种力量之间的平衡决定了细胞是存活还是死亡。髓样细胞白血病-1(myeloid cell leukemia-1,Mcl-1)属于抗凋亡蛋白,最初在ML-1人髓样白血病细胞系的分化中发现[1]。Mcl-1在多种肿瘤组织及细胞系中高表达,通过反义寡核苷酸或RNA干扰技术抑制Mcl-1的表达可以使肿瘤细胞对化疗药物变敏感[2-3]。该研究选择对TRAIL不敏感的胃癌细胞HGC-27,采用siRNA技术特异性沉默Mcl-1基因,了解其对TRAIL诱导的细胞凋亡的影响。
1 材料与方法
1.1 细胞及主要试剂 未分化的人胃癌细胞HGC-27(中国科学院上海细胞库);RPMI 1640培养基及Opti-MEM培养基(美国Gibco公司);胎牛血清(美国Hyclone公司);重组人可溶性TRAIL(美国Immunex公司);碘化丙啶(PI)(美国Sigma-Aldrich公司);广谱的caspase抑制剂z-VAD-fmk(美国Calbiochem公司);人Mcl-1 siRNA序列由上海吉玛公司设计并合成; Lipofectamine 2000 Reagent(美国Invitrogen公司);小鼠抗人Bcl-2、半胱天冬酶-3(cysteinyl aspartate specific proteinase-3,caspase-3)、聚腺苷二磷酸核糖聚合酶-1(poly[ADP-ribose] polymerase-1,PARP-1)单克隆抗体和兔抗人Mcl-1多克隆抗体(美国Santa Cruz公司);兔抗人Bcl-XL多克隆抗体(美国Cell Signaling公司);小鼠抗人GAPDH单克隆抗体、辣根过氧化物酶标记的山羊抗小鼠IgG及山羊抗兔IgG(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 细胞培养 HGC-27细胞用含20%胎牛血清的RPMI 1640培养基在37 ℃、5% CO2培养箱中常规培养。
1.2.2 流式细胞术检测细胞凋亡 将HGC-27细胞接种于24孔板中,每孔1×105个细胞,次日细胞融合达80%以上,给予不同处理,每组设3个复孔。处理结束后分别收集上清液至流式管中,1 200 r/min离心10 min,弃上清液,孔中贴壁细胞加750 μl PI溶液(含50 mg/L PI、0.1%枸橼酸钠及0.1% Triton X-100)于37 ℃避光作用10~20 min,待孔内细胞完全消化后也收集至对应的流式管中,混匀,置于4 ℃避光染色过夜,次日上流式细胞仪(BD FACSVerse)检测细胞凋亡,FCS Express 4软件分析亚二倍体峰(sub-G1)所占的百分率即为细胞凋亡率。
1.2.3 Western blot法检测蛋白表达 分别收集不同处理的细胞,加入100 μl RIPA裂解液,冰上裂解30 min,然后4 ℃、14 000 r/min离心30 min,上清液即总蛋白;采用BCA法进行蛋白定量,每个样品取20 μg进行SDS-PAGE;将分离开的蛋白从凝胶转移至硝酸纤维素膜上,用5%脱脂奶粉室温封闭2 h,分别加入不同的一抗(caspase-3、PARP-1、Bcl-2、Bcl-XL或Mcl-1抗体),以GAPDH为内参,4 ℃孵育过夜;次日用TBST洗3次,每次10 min,再加入不同的二抗(辣根过氧化物酶标记的山羊抗小鼠IgG或山羊抗兔IgG),室温孵育1 h,TBST洗3次,每次10 min;最后用ECL法显色,天能全自动凝胶成像系统采集图像。
1.2.4 siRNA 转染 Mcl-1 siRNA 正义链:5’-GUGCCUUUGUGGCUAAACA-3’,反义链:5’- UGUUUAGCCACAAAGGCAC-3’。实验分为未转染组(对照组)、转染阴性对照(NC siRNA组)和转染Mcl-1 siRNA组,每组设3个复孔。转染在6孔板及24孔板中进行,转染前1 d接种细胞,使得转染时细胞融合达30%。转染前1 h将孔中培养基更换为无血清的Opti-MEM培养基(6孔板每孔800 μl,24孔板每孔400 μl)。6孔板转染分别用100 μl Opti-MEM稀释100 pmol siRNA和5 μl Lipofectamine 2000 Reagent,二者混合后室温放置20 min,最后将200 μl复合物滴入细胞中,4 h后换液,48 h后提取细胞总蛋白,采用Western blot法判断基因沉默效果。24孔板转染则分别用50 μl Opti-MEM稀释20 pmol siRNA和1 μl Lipofectamine 2000 Reagent,二者混合后室温放置20 min,最后将100 μl复合物滴入细胞中,4 h后换液,待细胞生长至约80%融合时,加入200 μg/L TRAIL继续处理48 h,流式细胞术检测细胞凋亡率。

2 结果
2.1 z-VAD-fmk能抑制TRAIL诱导的HGC-27细胞凋亡 流式细胞术检测结果显示,HGC-27细胞对TRAIL不敏感,200 μg/L TRAIL处理48 h的细胞凋亡率仅为(20.65±3.23)%。z-VAD-fmk对细胞几乎无毒性,而用z-VAD-fmk提前1 h预处理,再加入TRAIL继续作用48 h时,细胞凋亡几乎被完全阻止,凋亡率仅为(6.97±2.12)%(图1),与单用TRAIL组比较,差异有统计学意义(t=5.012,P<0.05),说明TRAIL诱导HGC-27细胞发生的是caspase依赖性的细胞凋亡。
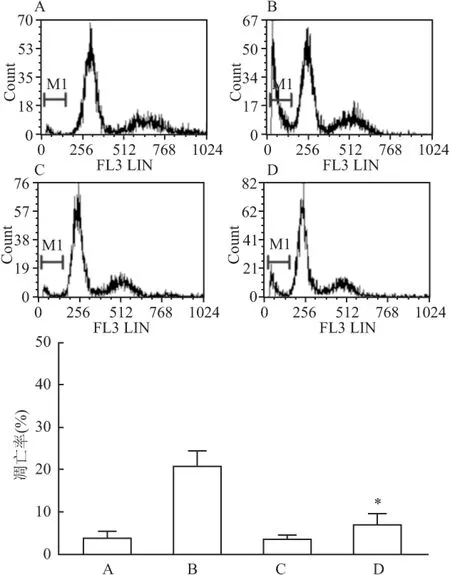
图1 z-VAD-fmk能阻止TRAIL诱导的HGC-27细胞凋亡
A:对照组;B:TRAIL(200 μg/L)处理48 h;C:z-VAD-fmk(20 μmol/L)处理 48 h;D:z-VAD-fmk(20 μmol/L)先处理1 h,再加入 TRAIL(200 μg/L)继续处理48 h;与TRAIL(200 μg/L)处理48 h比较:*P<0.05
2.2 TRAIL处理前后的caspase活化及抗凋亡蛋白的表达情况 caspase-3位于凋亡通路的末端,其激活可以切割多种细胞核蛋白及细胞骨架蛋白,引起凋亡的各种改变,其中最主要的底物是PARP-1。在TRAIL作用晚期cleaved-caspase-3和cleaved-PARP-1才出现,说明caspase活化很有限;而抗凋亡蛋白Bcl-2、Bcl-XL和Mcl-1在TRAIL作用前后都没有明显的改变(图2)。
2.3 转染Mcl-1 siRNA能有效地降低细胞内Mcl-1蛋白的表达水平 采用Lipofectamine 2000将Mcl-1 siRNA转染进HGC-27细胞,Western blot法从蛋白水平验证转染效果,结果显示,与对照组及NC siRNA组比较,Mcl-1 siRNA组几乎检测不到细胞中Mcl-1的蛋白(图3),说明基因沉默效果很好。
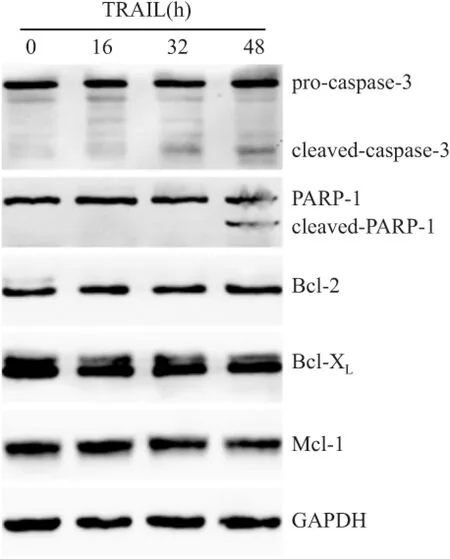
图2 caspase-3、PARP-1、Bcl-2、Bcl-XL、Mcl-1在TRAIL处理前后的表达

图3 Mcl-1 siRNA敲除效果
2.4 转染 Mcl-1 siRNA能增加HGC-27细胞对TRAIL的敏感性 在24孔板中转染后,待细胞生长至约80%融合,加入TRAIL继续处理,流式细胞术检测显示转染Mcl-1 siRNA可以明显增加细胞凋亡率,48 h的凋亡率为(54.78±7.56)%,与NC siRNA组(20.65±3.95)%比较,差异有统计学意义(t=6.927,P<0.05)。
3 讨论
胃癌是世界范围内常见的恶性肿瘤,尽管近年来手术治疗和化疗取得了很大的进展,患者的预后依然很差。TRAIL的优势在于其能选择性杀伤肿瘤细胞,而不损伤正常细胞,因而被寄托了很大的希望,但是仍有许多肿瘤细胞对之不敏感,成为其应用于临床的重大障碍。在TRAIL诱导的细胞凋亡通路中,死亡受体途径和线粒体途径存在相互交叉,因而这两条途径中的任何一个环节都可能使得细胞对TRAIL发生抵抗,如细胞膜表面诱骗受体TRAIL-R3和TRAIL-R4的表达、cFLIP表达水平的升高、凋亡抑制蛋白家族的高表达或者抗凋亡的Bcl-2家族蛋白的高表达等。早期研究[4]显示许多细胞是因为高表达Bcl-2和Bcl-XL才导致其对TRAIL抵抗,而近几年Mcl-1的抗凋亡作用越来越引起人们的注意。
Mcl-1的结构与Bcl-2、Bcl-XL、Bcl-w等有很大的同源性,但也有其自身的特点。Mcl-1的羧基端有一个疏水的跨膜结构域和胞质区的BH2、BH1和BH3结构域,其氨基端比其他抗凋亡蛋白更长,且含有两个PEST(脯氨酸P/谷氨酸E/丝氨酸S/苏氨酸T)基序,这可能是其半衰期短的原因,且这样的结构也是Mcl-1更新、定位、磷酸化的结构基础[5]。Mcl-1主要定位在线粒体外膜上,阻止细胞色素c从线粒体释放入胞质。Mcl-1还能以很高的亲和力与Bim、Bid及Puma结合,但是其对Noxa和Bak的选择性更高。Mcl-1可以通过分离Bak,阻止Bak寡聚化,达到促生存的目的[6]。
Mcl-1基因在人类肿瘤中是高度扩增的基因之一[7],在肿瘤发生中具有重要的作用。Mcl-1在多种肿瘤中高表达[8-9],这可能是肿瘤细胞用来逃逸细胞死亡或者对化疗药物抵抗的机制[10]。目前已知去泛素酶USP9X能结合到Mcl-1上,去除容易被蛋白酶体降解的赖氨酸48-连接的多聚泛素链,从而稳定Mcl-1的结构[11],促进肿瘤细胞的存活。Mcl-1蛋白在胃癌组织中的表达明显高于正常胃黏膜组织,并且与胃癌的T分期、临床分期、转移、血管浸润以及5年生存率密切相关,同样在胃癌细胞株中的表达水平明显高于正常胃黏膜细胞[12]。本研究中,HGC-27细胞对TRAIL不敏感,48 h的凋亡率低于30%。细胞内抗凋亡的Bcl-2、Bcl-XL和Mcl-1都呈高表达,且TRAIL处理之后没有明显改变,这可能是导致HGC-27细胞对TRAIL抵抗的原因。
研究[13-14]显示下调Mcl-1可以增加肿瘤细胞对化疗药物的敏感性,目前下调Mcl-1的药物主要有细胞周期蛋白依赖的激酶抑制剂和去泛素酶抑制剂。而反义寡核苷酸(ASO)和RNA干扰(RNAi)是体外实验中常用的下调Mcl-1基因表达的方法。RNAi能把双链siRNA引入细胞,通过特异性降解相同序列的mRNA,从而阻断相应基因表达。和ASO相比,其能抵御核酸酶降解,但siRNA有瞬时性,在体内停留的时间较短。本研究用脂质体法将Mcl-1特异性siRNA转入HGC-27细胞,48 h后在蛋白水平检测基因沉默效果,Mcl-1蛋白表达明显降低,siRNA序列有效。随即观察转染后对细胞凋亡的影响,结果 Mcl-1 siRNA能显著增加TRAIL诱导的HGC-27细胞凋亡率,这进一步说明了Mcl-1在细胞内的高表达是导致细胞对TRAIL耐受的因素。
综上所述,本研究采用RNA干扰技术特异性沉默Mcl-1基因,从而下调胃癌细胞HGC-27内Mcl-1的表达,且下调Mcl-1后HGC-27细胞对TRAIL的敏感性增强。目前通过高通量筛选的办法鉴定出多种Mcl-1的小分子抑制剂,其中选择性抑制剂UMI-77可以通过与Mcl-1分子的BH3结合沟结合在前列腺癌细胞系及小鼠异种移植物模型中发挥抗肿瘤作用[15]。Mcl-1目前作为肿瘤治疗的新靶点受到了肿瘤研究领域的关注,通过各种办法抑制Mcl-1可能帮助克服肿瘤细胞化疗药物的抵抗。
[1] Thomas L W, Lam C, Edwards S W. Mcl-1; the molecular regulation of proteinfunction[J]. FEBS Lett, 2010, 584(14): 2981-9.
[2] Choi E S, Jung J Y, Lee J S, et al. Myeloid cell leukemia-1 is a key molecular target for mithramycin A-induced apoptosis in androgen-independent prostate cancer cells and a tumor xenograft animal model[J]. Cancer Lett, 2013, 328(1): 65-72.
[3] Skoda C, Erovic B M, Wachek V, et al. Down-regulation of Mcl-1 with antisense technology alters the effect of various cytotoxic agents used in treatment of squamous cell carcinoma of the head and neck[J]. Oncol Rep, 2008, 19(6): 1499-503.
[4] Taniquchi H, Horinaka M, Yoshida T, et al. Targeting the glyoxalase pathway enhances TRAIL efficacy in cancer cells by downregulating the expression of antiapoptotic molecules [J]. Mol Cancer Ther, 2012, 11(10): 2294-300.
[5] Belmar J, Fesik S W. Small molecule Mcl-1 inhibitors for the treatment of cancer [J]. Pharmacol Ther, 2015,145:76-84.
[6] Quinn B A, Dash R, Azab B, et al. Targeting Mcl-1 for the therapy of cancer [J]. Expert Opin Investig Drugs, 2011, 20(10):1397-411.
[7] Beroukhim R, Mermel C H, Porter D, et al. The landscape of somatic copy-number alteration across human cancers[J]. Nature, 2010, 463(7283):899-905.
[8] Wei G, Margolin A A, Haery L, et al. Chemical genomics identifies small-molecule MCL1 repressors and BCL-xL as a predictor of MCL1 dependency [J]. Cancer Cell, 2012, 21(4):547-62.
[9] 吴亚欧, 张林杰, 张旭东, 等. 高表达Mcl-1对衣霉素诱导胃腺癌细胞凋亡的影响 [J]. 安徽医科大学学报, 2010, 45(1):20-3.
[10] Wertz I E, Kusam S, Lam C, et al. Sensitivity to antitubulin chemotherapeutics is regulated by MCL1 and FBW7[J]. Nature, 2011,471(7336): 110-4.
[11] Schwickart M, Huang X, Lill J R, et al. Deubiquitinase USP9X stabilizes MCL1 and promotes tumour cell survival[J]. Nature, 2010,463(7277):103-7.
[12] Likui W, Qun L, Wanqing Z, et al. Prognostic role of myeloid cell leukemia-1 protein (Mcl-1) expression in human gastric cancer[J]. J Surg Oncol, 2009, 100(5): 396-400.
[13] Mitchell C, Yacoub A, Hossein H, et al. Inhibition of MCL-1 in breast cancer cells promotes cell deathinvitroandinvivo[J]. Cancer Biol Ther, 2010, 10(9): 903-17.
[14] Karami H, Baradaran B, Esfehani A, et al. Down-regulation of Mcl-1 by small interference RNA induces apoptosis and sensitizes HL-60 leukemia cells to etoposide [J]. Asian Pac J Cancer Prev, 2014, 15(2): 629-35.
[15] Abulwerdi F, Liao C, Liu M, et al. A novel small-molecule inhibitor of mcl-1 blocks pancreatic cancer growthinvitroandinvivo[J]. Mol Cancer Ther, 2014, 13(3): 565-75.
Effect of Mcl-1 siRNA on TRAIL-induced apoptosis in gastric cancer cells
Jin Wei1, Wu Ping2
(1Dept of Otolaryngology, Chaohu Hospital of Anhui Medical University, Chaohu 238000;2DeptofImmunology,AnhuiMedicalUniversity,Hefei230032)
Objective To explore the effect of Mcl-1 small interference RNA (siRNA) on tumor necrosis factor-related apoptosis-inducing ligand (TRAIL)-induced apoptosis in gastric cancer HGC-27 cells. Methods The apoptotic rates of cells treated with TRAIL and pan-caspase inhibitor (z-VAD-fmk) alone or combination were measured by propidium iodide (PI) method using flow cytometry. The activation of caspase-3, cleavage of PARP-1, as well as the protein level of anti-apoptotic Bcl-2 proteins Bcl-2, Bcl-XLand Mcl-1 before and after TRAIL treatment were monitored by Western blot analysis. Transfection of Mcl-1 siRNA was performed using Lipofectamine 2000 reagent. The efficiency of gene silencing was quantified by Western blot and the effect of Mcl-1 siRNA on TRAIL-induced apoptosis was measured using PI method. Results HGC-27 cells were resistant to TRAIL-induced apoptosis, and z-VAD-fmk pretreatment could block apoptosis nearly completely. Activation of caspase-3 and cleavage of PARP-1 occurred in the late stage of apoptosis. The expression levels of Bcl-2, Bcl-XLand Mcl-1 were not altered after exposure to TRAIL. Transfection with Mcl-1 siRNA could obviously downregulate the expression level of Mcl-1 in HGC-27 cells and enhanced the sensitivity of cells to TRAIL-induced apoptosis. Conclusion Overexpression of Mcl-1 may account for the resistance of HGC-27 cells to TRAIL. Downregulation of Mcl-1 by siRNA can effectively enhance the sensitivity of HGC-27 cells to TRAIL-induced apoptosis.
gastric cancer; apoptosis; siRNA; Mcl-1
http://www.cnki.net/kcms/detail/34.1065.R.20151230.1438.022.html
安徽高校省级自然科学研究项目(编号:KJ2014A113)
1安徽医科大学附属巢湖医院耳鼻喉科,巢湖 238000
2安徽医科大学免疫学教研室,合肥 230032
金 玮,男,医师;
吴 萍,女,讲师,责任作者,E-mail:wuping@ahmu.edu.cn
R 735.2
A
1000-1492(2016)01-0047-05
2015-10-20接收

