NaCl胁迫下Ca2+调控发芽大豆生理代谢和γ-氨基丁酸含量变化
尹永祺,王淑雯,宋吴昱,高 璐,饶胜其,杨振泉,方维明
(扬州大学食品科学与工程学院,江苏 扬州 225127)
NaCl胁迫下Ca2+调控发芽大豆生理代谢和γ-氨基丁酸含量变化
尹永祺,王淑雯,宋吴昱,高 璐,饶胜其,杨振泉,方维明*
(扬州大学食品科学与工程学院,江苏 扬州 225127)
为研究NaCl胁迫下Ca2+对发芽大豆主要生理指标和γ-氨基丁酸(gamma-aminobutyric acid,GABA)富集的调控作用,利用CaCl2和乙二醇二乙醚二胺四乙酸(ethylene glycol tetraacetic acid,EGTA)处理发芽大豆,研究NaCl胁迫下外源和内源Ca2+对发芽大豆主要生理代谢和GABA含量的影响。结果显示,发芽大豆经NaCl联合CaCl2处理,其芽长和呼吸速率显著增加,表明CaCl2缓解了NaCl对发芽大豆生长的抑制,同时过氧化氢酶及过氧化物酶活力显著提高,说明CaCl2可能是通过提高抗氧化酶活力来缓解NaCl胁迫下发芽大豆的抑制效应,而施用EGTA则呈相反的变化趋势;NaCl联合CaCl2处理后发芽大豆中GABA含量与单独NaCl处理无显著差异,但显著高于对照组;在NaCl联合CaCl2或EGTA基础上施用氨基胍,发芽大豆子叶中GABA含量分别下降17.1%和9.8%,胚中分别下降26.5%和8.5%,表明NaCl胁迫下施用CaCl2在促进发芽大豆中GABA富集的同时还可保证生物产量,且CaCl2和EGTA处理下多胺降解途径对GABA富集贡献降低。
大豆;发芽;γ-氨基丁酸;NaCl胁迫
大豆是全球性农作物,亦是我国7大粮食作物之一,其具有产量高和营养丰富等特点,是人类膳食中重要的蛋白质和氨基酸来源[1]。大豆中蛋白质含量高达30%~40%,其籽粒发芽后,内源酶系被激活,不仅可降低植酸和单宁等抗营养因子含量,且大豆蛋白质水解可为累积γ-氨基丁酸(gamma-aminobutyric acid,GABA)提供充足的含氮物质[2-3],而GABA已于2009年被国家卫生部认定为新资源食品,因此大豆已被用于开发富含GABA的功能食品。
高等植物中已经明确的GABA代谢途径包括GABA支路和多胺降解途径[4]。GABA支路中谷氨酸在谷氨酸脱羧酶(glutamate decarboxylase,GAD)作用下直接生成GABA;多胺降解途径则通过多胺在胺氧化酶(二胺氧化酶、多胺氧化酶)和氨基醛脱氢酶作用下经4-氨基丁醛中间产物而生成GABA。二胺氧化酶是GABA合成途径中的限速酶,而氨基胍(amino guanidine,AG)作为其专性抑制剂,已被用于研究GABA支路和多胺降解途径对于GABA累积的贡献率[5-6]。
植物籽粒于NaCl胁迫条件下发芽是富集GABA的有效方式[7-8],然而大豆作为一种盐敏感型作物[9],尽管NaCl胁迫下其GABA含量显著提高,但其生长和生物产量受到严重抑制。因此,如何使大豆在NaCl胁迫发芽期间富集GABA的同时保证其生物量是当务之急。Ca2+已广泛用于提高植物对盐、干旱、重金属和低温等非生物胁迫的耐受性,促进植物生长[10-11]。研究发现,粟米[12]和大豆[13]于低氧胁迫发芽期间施用Ca2+均可促进GABA富集。Ca2+对NaCl胁迫下发芽大豆生理代谢的影响及其调节GABA代谢酶活力以维持两途径富集GABA的动态平衡机制尚不清楚。
本实验利用外源添加CaCl2和乙二醇二乙醚二胺四乙酸(ethylene glycol tetraacetic acid,EGTA)(Ca2+螯合剂)探讨NaCl胁迫下Ca2+对发芽大豆生理生化和GABA富集的影响,分析Ca2+处理下发芽大豆生理生化代谢变化,并通过在各处理中添加AG以明确NaCl胁迫下Ca2+对GABA支路与多胺降解两途径富集GABA的动态平衡调节,以期为大豆保健功能性食品开发提供技术参考和理论依据,推动大豆深加工产业的科学化发展。
1 材料与方法
1.1 材料与试剂
大豆籽粒购于2015年,产自中国吉林省敦化市,封装于密闭容器中,4 ℃保存备用。
GABA标准品、乙腈(色谱纯) 美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
1200 Series高效液相色谱仪 美国Agilent公司;UV-7504C型紫外-可见分光光度计 上海欣茂仪器有限公司;BCD-257SL型冰箱 青岛海尔股份有限公司;PHS-3C pH计 上海精密科学仪器有限公司;ZXDP-A2080电热恒温培养箱 上海智诚有限公司。
1.3 方法
1.3.1 大豆发芽处理
称取20 g籽粒饱满的大豆,经去离子水冲洗后置于体积分数1% NaClO溶液中浸泡消毒15 min,消毒大豆用去离子水冲洗至pH值中性后于30 ℃条件下浸泡4 h;将浸泡后的大豆置于发芽机,于30 ℃避光发芽。分别设以下处理:1)对照(去离子水);2)NaCl胁迫处理(50 mmol/L NaCl);3)NaCl胁迫加AG处理(50 mmol/L NaCl+2.5 mmol/L AG);4)NaCl胁迫加CaCl2处理(50 mmol/L NaCl+6 mmol/L CaCl2);5)NaCl胁迫加CaCl2和AG处理(50 mmol/L NaCl+6 mmol/L CaCl2+ 2.5 mmol/L AG);6)NaCl胁迫加EGTA处理(50 mmol/L NaCl+5 mmol/L EGTA);7)NaCl胁迫加EGTA和AG处理(50 mmol/L NaCl+5 mmol/L EGTA+2.5 mmol/L AG)。发芽4 d,每隔1 d更换培养液至培养结束,期间定时取样测定相关指标。
1.3.2 指标测定
芽长:随机选取30 粒发芽大豆,用游标卡尺测定其芽长;呼吸速率:参照小篮子法[14]测定;过氧化氢酶(catalase,CAT)活力:参照Beers等[15]方法测定;过氧化物酶(peroxidase,POD)活力:按高福元等[16]方法测定;GABA含量:参照Bai Qingyun等[17]的方法测定。
2 结果与分析
2.1 NaCl胁迫下Ca2+对发芽大豆形态特征变化的影响

图1 NaCl胁迫下Ca2+对发芽大豆形态的影响Fig. 1 Effect of Ca2+ treatment on the morphology of germinating soybean under NaCl stress
由图1可知,较正常条件发芽的大豆,NaCl胁迫下大豆生长受到抑制,而外源CaCl2可解除这种抑制效应,发芽4 d后其生长状况优于对照,NaCl联合EGTA处理与NaCl单独处理的大豆生长无明显差异。NaCl及其联合CaCl2或EGTA处理的发芽大豆再经AG处理其生长均被进一步抑制。
2.2 NaCl胁迫下Ca2+对发芽大豆芽长变化的影响

图2 Ca2+处理下发芽大豆芽长的变化Fig. 2 Changes in sprout length of germinating soybean under Ca2+treatment
由图2可知,发芽期间各处理下的发芽大豆芽长均随发芽时间延长呈增加趋势,发芽4 d后各处理间芽长具有显著差异(P<0.05)。发芽期间NaCl胁迫处理大豆的芽长显著低于对照处理,发芽4 d时其芽长仅为对照的40%;而CaCl2能够缓解NaCl对大豆芽长生长的抑制,其大豆芽长显著增加(P<0.05),发芽4 d后其芽长分别为对照和NaCl胁迫的1.22、3.35 倍,与图1所示一致。NaCl联合EGTA处理的大豆籽粒发芽4 d后其芽长较单独NaCl处理无显著变化,此外,除CaCl2处理,其他处理再经AG处理的发芽4 d的大豆芽长未发生显著性变化(P>0.05)。
2.3 NaCl胁迫下Ca2+对发芽大豆呼吸速率变化的影响
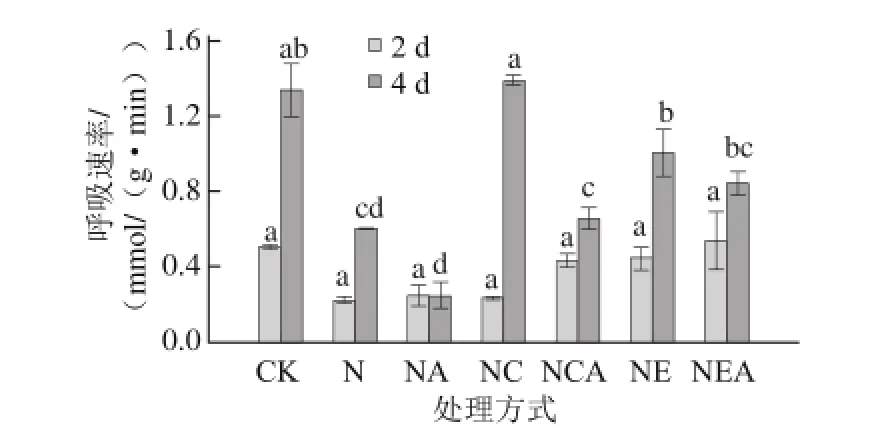
图3 Ca2+处理下发芽大豆呼吸速率的变化Fig. 3 Changes in respiratory rate of germinating soybean under Ca2+ treatment
由图3可知,呼吸速率与芽长变化趋势一致,各处理的大豆籽粒发芽期间其呼吸速率均呈增加趋势,NaCl联合CaCl2处理的呼吸速率显著高于单独NaCl处理及对照(P<0.05)。NaCl胁迫下大豆呼吸速率亦受到抑制,经EGTA处理后的大豆发芽4 d时呼吸速率显著高于NaCl单独胁迫处理(P<0.05)。而AG处理的呼吸速率都低于同水平未经AG处理的呼吸速率。
2.4 NaCl胁迫下Ca2+对发芽大豆CAT活力变化的影响
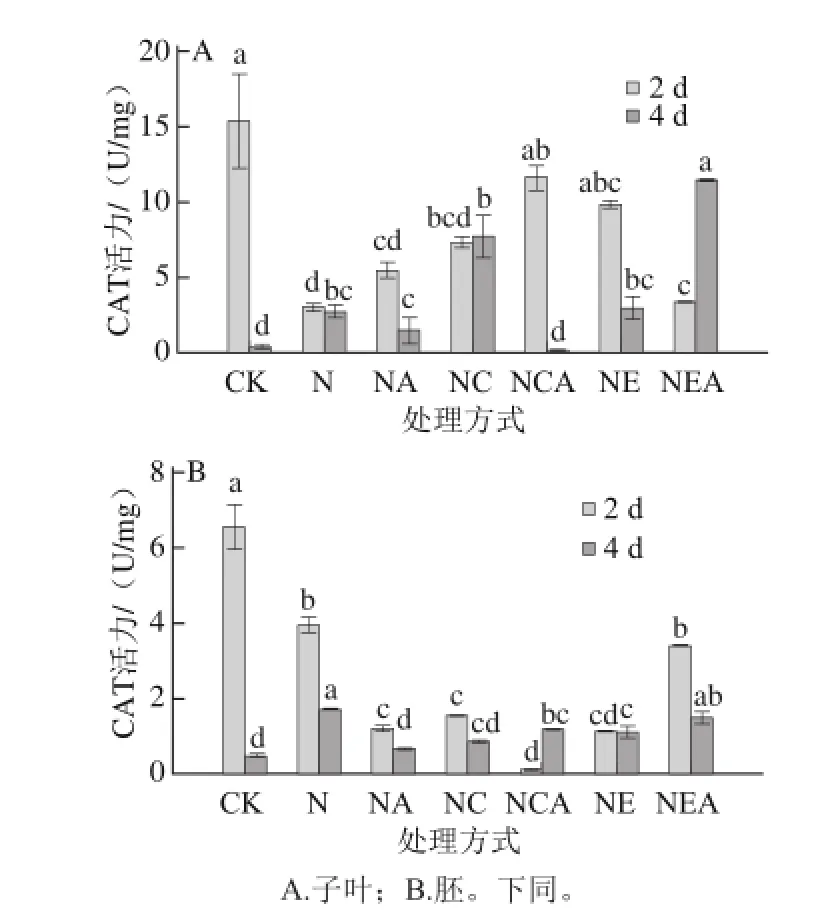
图4 Ca2+处理下发芽大豆CAT活力变化Fig. 4 Changes in CAT activity of germinating soybean under Ca2+ treatment
NaCl胁迫4 d后发芽大豆子叶和胚中CAT活力与对照相比均显著增加(P<0.05)。NaCl联合CaCl2处理4 d后,其子叶中CAT活力显著高于单独NaCl处理,而胚中CAT活力较单独NaCl处理显著下降(P<0.05)。NaCl联合EGTA处理4 d后,子叶中CAT活力与NaCl处理无显著差异(P>0.05),而胚中显著下降(P<0.05)。此外子叶中经过AG处理的CAT活力,除NaCl联合EGTA处理比未经AG处理的显著上升外,其余各处理均显著降低;胚中除NaCl单独处理的CAT活力比未经AG处理的显著降低外,其余均显著上升。
2.5 NaCl胁迫下Ca2+对发芽大豆POD活力变化的影响

图5 Ca2+处理下发芽大豆POD活力变化Fig. 5 Changes in POD activity of germinating soybean under Ca2+ treatment
如图5所示,发芽期间各处理发芽大豆子叶中POD活力变化趋势并不一致,而随发芽时间延长,对照组胚中POD活力呈下降趋势,NaCl联合CaCl2处理及其AG共同处理的无明显变化,其余处理组均呈增长趋势,且其活力均显著低于子叶。NaCl胁迫联合CaCl2处理后,发芽4 d的大豆子叶中POD活力显著高于单独NaCl处理(P<0.05),而胚中则显著降低。发芽大豆经NaCl联合EGTA处理后,其子叶与胚中POD活力较NaCl处理均显著下降(P<0.05)。此外子叶和胚中经过AG处理后的POD活力,除NaCl联合EGDA处理与同水平未经AG的POD活力显著升高外,其余各处理较同水平未经AG处理的POD活力均显著降低。
2.6 NaCl胁迫下Ca2+对发芽大豆GABA含量变化的影响

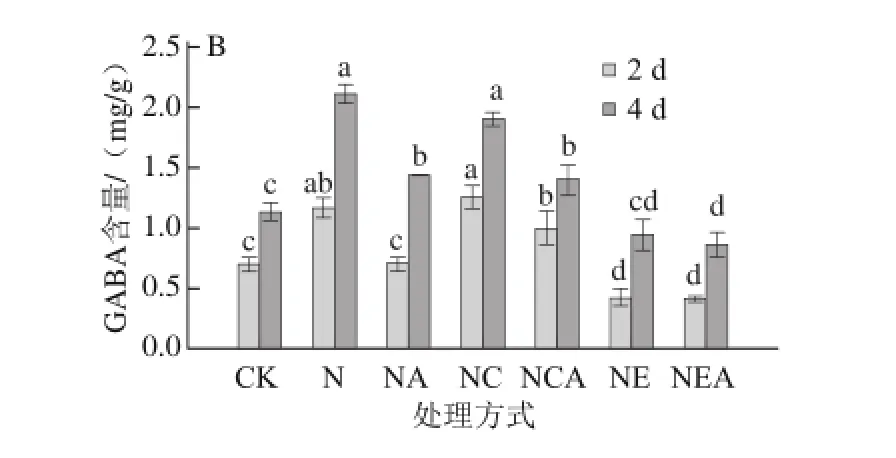
图6 Ca2+处理下发芽大豆GABA含量的变化Fig. 6 Changes in GABA content of germinating soybean under Ca2+ treatment
由图6可知,各处理下发芽大豆子叶和胚中GABA含量都随发芽时间延长显著增加(P<0.05)。发芽4 d,单纯经NaCl胁迫处理的发芽大豆子叶和胚中GABA的含量显著高于对照组,子叶中为对照组的1.57倍,胚中则为对照组的1.88倍。NaCl联合CaCl2处理的发芽大豆子叶和胚中的GABA含量均显著高于对照组,与单纯经NaCl胁迫处理的大豆子叶和胚中的GABA含量无显著差异(P>0.05)。此外,经AG处理后的大豆子叶和胚中的GABA含量均低于同水平下未经AG处理的(P<0.05),子叶中分别下降了35.9%、17.1%、9.8%,胚中分别下降了32.4%、26.5%、8.5%。
3 讨 论
本研究显示,施用Ca2+后发芽大豆由于NaCl胁迫对其造成的伤害有所缓解,其物质代谢加速,恢复正常生长。Bowler等[18]研究结果表明,非生物胁迫下植物细胞内Ca2+浓度与抗氧化酶活力变化在时间上存在顺序性,空间上也具有一致性。相关研究也已证实,细胞内Ca2+浓度与活性氧含量以及抗氧化酶活力紧密相关[19]。本研究发现,发芽大豆经NaCl联合CaCl2处理后其CAT和POD活力均显著增加,发芽大豆芽长和呼吸速率较NaCl胁迫和对照(正常培养)均显著增加,发芽大豆恢复正常生长,这与非生物胁迫下施用Ca2+对黄瓜[19]、水稻[20]、大豆幼苗[21]和西兰花[22]等多种植物中抗氧化酶活力的影响一致。同时,与单独NaCl胁迫相比,发芽大豆经施用Ca2+螯合剂——EGTA后,其生长和代谢均受到严重抑制,其CAT和POD活力降低。这些结果表明,Ca2+可能调控发芽大豆中抗氧化酶活力,CaCl2可通过提高抗氧化酶活力缓解NaCl对发芽大豆造成的胁迫效应,提高生物产量,这与CaCl2缓解非生物胁迫对水稻和大豆等植物的胁迫效应研究结果一致[20-21,23-24];而EGTA抑制了Ca2+对抗氧化酶所起的调控作用,从而严重抑制发芽大豆生长。
发芽大豆经NaCl联合CaCl2处理后,其子叶和胚中GABA含量较单独NaCl胁迫均无显著变化,然而由于CaCl2解除了NaCl胁迫,其子叶和胚的干质量均显著增加,因此单株发芽大豆子叶和胚中GABA含量亦增加,表明NaCl胁迫下施用Ca2+不仅可增加发芽大豆生物产量,还可促进GABA富集。而这种促进作用可被Ca2+螯合剂所抑制,NaCl胁迫联合EGTA处理后,发芽大豆生长严重受抑,且GABA积累量显著下降,表明发芽大豆中Ca2+直接参与GABA的调节。这可能是由于GABA代谢是由GABA支路与多胺降解途径所构成,GAD作为GABA支路中限速酶,是一种Ca2+/CaM依赖型酶,具有一个钙调蛋白结合区。在本研究的NaCl胁迫下,施用外源CaCl2可使Ca2+浓度显著增加,从而显著提高GAD活力以达到富集GABA的目的。有研究表明,盐胁迫添加Ca2+后,粟谷中GAD活力增加,而抑制剂则显著抑制GAD活力[12]。同时,施用Ca2+亦可显著提高低氧联合NaCl胁迫下发芽蚕豆[5]和发芽大豆[25]中GAD活力。此外,利用AG抑制多胺降解途径后显示,NaCl胁迫下发芽大豆中多胺降解途径对GABA的富集贡献率大于30%,这与Xing Suguo等[6]研究结果一致。然而,NaCl胁迫下发芽大豆施用Ca2+或抑制剂EGTA后,各部位中多胺降解途径对GABA的富集贡献有所不同,CaCl2处理和EGTA处理的大豆子叶中分别降低17.1%和9.8%,而胚中分别下降26.5%和8.5%,低于单独NaCl胁迫下的抑制量,表明CaCl2处理和EGTA处理下多胺降解途径对GABA富集的贡献率较单独NaCl胁迫降低。
本研究表明NaCl胁迫下施用Ca2+可以解除NaCl对于发芽大豆生长的抑制作用,促使发芽大豆恢复生长,从而提高生物产量,这种恢复作用可能与Ca2+提高发芽大豆体内相关抗氧化酶活力有关,而EGTA处理抑制了Ca2+对抗氧化酶所起的调控作用,从而进一步抑制了发芽大豆生长。同时,NaCl胁迫下施用Ca2+后,发芽大豆中GABA含量相较单独NaCl处理无显著差异,但是GABA富集的两条途径的贡献发生变化,Ca2+处理下多胺降解途径对于GABA富集的贡献率下降。
[1] 刘志胜. 大豆蛋白营养品质和生理功能研究进展[J]. 大豆科学, 2000, 19(3): 263-268. DOI:10.3969/j.issn.1000-9841.2000.03.011.
[2] AZEKE M A, ELSANHOTY R M, EGIELEWA S J, et al. The effect of germination on the phytase activity, phytate and total phosphorus contents of some Nigerian-grown grain legumes[J]. Journal of the Science of Food and Agriculture, 2011, 91(1): 75-79. DOI:10.1002/ jsfa.4150.
[3] VIDAL-VALVERDE C, FRIAS J, SIERRA I, et al. New functional legume foods by germination: effect on the nutritive value of beans, lentils and peas[J]. European Food Research and Technology, 2002, 215(6): 472-477. DOI:10.1007/s00217-002-0602-2.
[4] SHELP B J, BOZZO G G, TROBACHER C P, et al. Hypothesis/ review: contribution of putrescine to 4-aminobutyrate (GABA) production in response to abiotic stress[J]. Plant Science, 2012, 193/194: 130-135. DOI:10.1016/j.plantsci.2012.06.001.
[5] YANG Runqiang, GUO Qianghui, GU Zhenxin. GABA shunt and polyamine degradation pathway on γ-aminobutyric acid accumulation in germinating fava bean (Vicia faba L.) under hypoxia[J]. Food Chemistry, 2013, 136(1): 152-159. DOI:10.1016/ j.foodchem.2012.08.008.
[6] XING Suguo, JUN Yubing, HAU Z W, et al. Higher accumulation of γ-aminobutyric acid induced by salt stress through stimulating the activity of diamine oxidases in Glycine max (L.) Merr. roots[J]. Plant Physiology and Biochemistry, 2007, 45(8): 560-566. DOI:10.1016/ j.plaphy.2007.05.007.
[7] HYUN T K, EOM S H, JEUN Y C, et al. Identification of glutamate decarboxylases as a γ-aminobutyric acid (GABA) biosynthetic enzyme in soybean[J]. Industrial Crops and Products, 2013, 49: 864-870. DOI:10.1016/j.indcrop.2013.06.046.
[8] 郭元新, 杨润强, 陈惠, 等. 盐胁迫富集发芽大豆γ-氨基丁酸的工艺优化[J]. 食品科学, 2012, 33(10): 1-5.
[9] KAO W Y, TSAI T T, TSAI H C, et al. Response of three glycine species to salt stress[J]. Environmental and Experimental Botany, 2006, 56(1): 120-125. DOI:10.1016/j.envexpbot.2005.01.009.
[10] 贾如, 雷梦琦, 徐佳妮, 等. 植物细胞中钙通道的分布及其在植物抗逆机制中作用的研究进展[J]. 植物生理学报, 2014, 50(12): 1791-1800. DOI:10.13592/j.cnki.ppj.2014.0331.
[11] GUIMARÃES F V A, de LACERDA C F, MARQUES E C, et al. Calcium can moderate changes on membrane structure and lipid composition in cowpea plants under salt stress[J]. Plant Growth Regulation, 2011, 65(1): 55-63. DOI:10.1007/s10725-011-9574-1.
[12] BAI Qingyun, YANG Runqiang, ZHANG Lixia, et al. Salt stress induces accumulation of γ-aminobutyric acid in germinated foxtail millet (Setaria italica L.)[J]. Cereal Chemistry, 2013, 90(2): 145-149. DOI:10.1094/CCHEM-06-12-0071-R.
[13] GUO Yuanxin, YANG Runqiang, CHEN Hui, et al. Accumulation of γ-aminobutyric acid in germinated soybean (Glycine max L.) in relation to glutamate decarboxylase and diamine oxidase activity induced by additives under hypoxia[J]. European Food Research and Technology, 2012, 234(4): 679-687. DOI:10.1007/s00217-012-1678-y.
[14] 王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006: 162-164.
[15] BEERS R F, SIZER I W. A spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase[J]. Journal of Biology Chemistry, 1952, 195(1): 133-140.
[16] 高福元, 张吉立, 刘振平. 冬季低温对 4 种彩叶植物SOD, POD 活性影响的研究[J]. 中国农学通报, 2010, 26(5): 169-173.
[17] BAI Qingyun, CHAI Meiqing, GU Zhenxin, et al. Effects of components in culture medium on glutamate decarboxylase activity and gamma-aminobutyric acid accumulation in foxtail millet (Setaria italica L.) during germination[J]. Food Chemistry, 2009, 116(1): 152-157. DOI:10.1016/j.foodchem.2009.02.022.
[18] BOWLER C, FLUHR R. The role of calcium and activated oxygens as signals for controlling cross-tolerance[J]. Trends in Plant Science, 2000, 5(6): 241-246. DOI:10.1016/S1360-1385(00)01628-9.
[19] 康云艳, 郭世荣, 段九菊. 低氧胁迫对不同耐性黄瓜品种根系抗氧化系统的影响[J]. 植物生理学通讯, 2007, 43(4): 630-634. DOI:10.13592/j.cnki.ppj.2007.04.038.
[20] 伍志权, 郑雪宜, 钱春梅. 钙对铝胁迫下水稻抗氧化酶活性的影响[J]. 安徽农业科学, 2011, 39(35): 32-34. DOI:10.3969/ j.issn.0517-6611.2011.35.067.
[21] 张忠庆, 刘金华, 姜凡琦, 等. 钙对大豆幼苗镍毒害的缓解效应及对抗氧化酶活性的影响[J]. 中国土壤与肥料, 2013(6): 62-65. DOI:10.11838/sfsc.2012.06.13.
[22] 丁能飞, 傅庆林, 刘琛, 等. 外源氯化钙对盐胁迫下西兰花抗氧化酶系统及离子吸收的影响[J]. 中国农学通报, 2010, 26(6): 133-137. DOI:10.11766/trxb2004.04.27.
[23] 王策, 鲁晓燕, 樊新民, 等. CaCl2对NaCl胁迫下酸枣幼苗抗氧化酶活性和膜脂过氧化作用的影响[J]. 石河子大学学报(自然科学版), 2014, 32(3): 285-290. DOI:10.3969/j.issn.1007-7383.2014.03.004.
[24] 朱晓军, 梁永超, 杨劲松, 等. 钙对盐胁迫下水稻幼苗抗氧化酶活性和膜脂过氧化作用的影响[J]. 土壤学报, 2005, 42(3): 453-459. DOI:10.3321/j.issn:0564-3929.2005.03.016.
[25] SNEDDEN W A, KOUTSIA N, BAUM G, et al. Activation of a recombinant petunia glutamate decarboxylase by calcium/calmodulin or by a monoclonal antibody which recognizes the calmodulin binding domain[J].The Journal of Biological Chemistry, 1996, 271(8): 4148-4153. DOI:10.1074/jbc.271.8.4148.
Calcium Regulates the Main Physiological Indicators and Gamma-Aminobutyric Acid Accumulation in Germinating Soybean under NaCl Stress
YIN Yongqi, WANG Shuwen, SONG Wuyu, GAO Lu, RAO Shengqi, YANG Zhenquan, FANG Weiming*
(College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China)
In the present study, the effect of CaCl2and ethylene glycol tetraacetic acid (EGTA) on the main physiological indicators and gamma-aminobutyric acid (GABA) accumulation in germinating soybean under NaCl stress was investigated. Compared with NaCl stress alone, the sprout length and respiratory rate increased significantly under NaCl stress combined with CaCl2treatment, indicating that exogenous CaCl2mitigated the negative effect of NaCl stress. Meanwhile, CaCl2led to a significant increase in catalase (CAT) and peroxidase (POD) activities and could therefore alleviate the harmful effect of NaCl stress on the growth of germinating soybean. In contrast, the above effects were reversed by combination with EGTA. Under the supplemental CaCl2treatment, there was no significant difference in GABA content in the cotyledon and embryo of germinating soybean compared with NaCl stress treatment alone but it was significantly higher than the control. Furthermore, when aminoguanidine (AG), an amine oxidase inhibitor, was added under NaCl plus CaCl2treatment, GABA content in the cotyledon and embryo was decreased by 17.1% and 26.5%, respectively. In addition, AG added under NaCl combined with EGTA treatment resulted in a decrease in GABA content in cotyledon and embryo by 9.8% and 8.5%, respectively. The present study indicates that exogenous calcium countered the harmful effect of salt stress and increased the biomass and GABA content of germinating soybeans. Moreover, CaCl2or EGTA addition decreased the contribution of polyamine degradation pathway to GABA accumulation compared to NaCl stress.
soybean; germination; gamma-aminobutyric acid; NaCl stress
10.7506/spkx1002-6630-201621005
TS210.1
A
1002-6630(2016)21-0026-05
尹永祺, 王淑雯, 宋吴昱, 等. NaCl胁迫下Ca2+调控发芽大豆生理代谢和γ-氨基丁酸含量变化[J]. 食品科学, 2016, 37(21): 26-30. DOI:10.7506/spkx1002-6630-201621005. http://www.spkx.net.cn
YIN Yongqi, WANG Shuweng, SONG Wuyu, et al. Calcium regulates the main physiological indicators and gammaaminobutyric acid accumulation in germinating soybean under NaCl stress[J]. Food Science, 2016, 37(21): 26-30. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621005. http://www.spkx.net.cn
2016-01-12
国家自然科学基金青年科学基金项目(31501401);江苏省自然科学基金青年基金项目(BK20150448);江苏省高校自然科学研究面上项目(15KJB550010);江苏省普通高校研究生科研创新计划项目(SJLX16_0606)
尹永祺(1988—),男,讲师,博士,研究方向为植物功能物质富集机理及技术。E-mail:yqyin@yzu.edu.cn
*通信作者:方维明(1965—),男,教授,博士,研究方向为农产品加工及贮藏。E-mail:wmfang@yzu.edu.cn

