玉米环二肽(组氨酸-脯氨酸)的分离纯化、结构鉴定及其生物活性
樊红秀,刘鸿铖,董 欣,张艳荣
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
玉米环二肽(组氨酸-脯氨酸)的分离纯化、结构鉴定及其生物活性
樊红秀,刘鸿铖,董 欣,张艳荣*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
环二肽(组氨酸-脯氨酸)(cyclo (His-Pro),CHP)是一种活性环二肽,在降血糖、抗氧化方面具有显著效果。实验通过DE-52阴离子交换层析、Sephadex G-25凝胶层析、半制备型高效液相色谱等方法,对高温高压环化后的玉米蛋白水解物进行分离纯化研究,得到CHP。采用超高效液相色谱、傅里叶变换红外光谱、核磁共振氢谱和碳谱对产物的结构进行鉴定,并通过体外降血糖和抗氧化实验初步测定了其生物活性。结果表明:采用本研究的分离纯化方法制备得到的CHP的纯度为97.36%,傅里叶变换红外光谱和核磁共振波谱的测定表明该肽的结构与预期结构相符,初步的生理活性鉴定结果表明,玉米CHP经分离纯化后对α-葡萄糖苷酶和α-淀粉酶活性具有很强抑制能力,半抑制浓度(IC50)分别为1.1、1.9 mg/mL;且具有很强的1,1-二苯基-2-三硝基苯肼自由基清除活性(IC5067 μg/mL)和还原力。
环二肽(组氨酸-脯氨酸);玉米蛋白;分离纯化;结构鉴定
环二肽(组氨酸-脯氨酸)(cyclo (His-Pro),CHP)是一种活性环二肽,广泛分布于人和动物的组织和体液中[1],在抗糖尿病、抗氧化、预防肥胖等方面有明显效果[2-5]。CHP是内源性环二肽,由促甲状腺素释放激素,经氨肽酶水解脱去焦谷氨酸后环化而成[6]。但天然存在的CHP在动物体内含量极低,且原料成本较高,难以实现大量生产供给所需,人工化学合成的CHP成本昂贵且毒性大。近几年人们发现从某些多肽或蛋白质的水解产物中可以得到CHP[7]。Minelli等[8]从一些富含蛋白质的加工食品,如牛奶、火腿、干制虾、金枪鱼罐头以及营养保健品中发现了CHP,其含量是人体血浆的5~1 500 倍,这些CHP被认为是在蛋白质水解过程中释放出来的。Choi等[9]发现乙醇回流后的大豆蛋白水解物中含有大量的CHP活性肽。通过酶解食源性蛋白质获得的CHP不仅安全性好、生物活性高,而且来源广泛、成本低廉,易于工业化生产,越来越受到业内学者及行业的关注[10-11]。
本研究以玉米黄粉为原料,通过可控酶解和高温高压环化技术制备CHP。在之前的研究中通过对酶解工艺和高温高压环化反应条件进行优化,得到了富含CHP的玉米蛋白水解产物。但初始水解物中CHP浓度很低,功能活性差,这限制了CHP的高附加值利用。在实际应用中,根据在食品、保健品或者医学上对CHP纯度的不同要求,需要采用不同的分离手段对其进行分离纯化,此外,CHP的分离纯化也成为制约进一步研究其结构及功能的关键所在。尤其是利用酶解技术得到的小分子肽中,成分非常复杂,分子质量分布多样,其中有些杂质的物理化学性质和目标产物接近,这就给CHP的分离纯化带来很大困难。本研究借鉴目前新的色谱分离技术和手段,综合运用离子交换色谱、凝胶色谱和超高效液相色谱(ultra performance liquid chromatography,UPLC)技术,在定量跟踪的基础上从酶解液中分离富集CHP,首次建立了一套可大规模产业化富集CHP的分离纯化体系;综合运用傅里叶变换红外光谱、核磁共振(nuclear magnetic resonance,NMR)技术对其结构进行分析,完成其结构鉴定,最终得到纯度95%以上的玉米CHP,并初步探究了玉米CHP的活性,本研究建立从蛋白水解物中分离纯化玉米CHP的方法,为玉米黄粉的深度开发利用以及玉米蛋白CHP的研究提供基础数据和参考。
1 材料与方法
1.1 材料与试剂
玉米黄粉(蛋白质质量分数55.76%) 黄龙食品工业有限公司。
DE-52阴离子交换纤维素 英国Waterman公司;Sephadex G-25葡聚糖凝胶 北京索莱宝有限公司;α-葡萄糖苷酶(来自酵母,酶活力50 000U/g) 上海叶源生物有限公司;α-淀粉酶(来自猪胰腺,酶活力50 000 U/g)、三氟乙酸(trifluoroacetic acid,TFA,纯度98%)、1,1-二苯基-2-硝基苦肼(2,2-diphenyl-1-picrylhydrazyl hydrate,DPPH) 美国Sigma公司;碱性蛋白酶(酶活力286 000 U/mL)、风味蛋白酶(酶活力247 000 U/g)(均为食品级) 丹麦诺维信公司;CHP标准品(纯度98%) 上海吉尔生化有限公司;乙腈(色谱纯) 美国Fisher公司;蒸馏水 广州屈臣氏有限公司;葡萄糖测定试剂盒 中生北控生物科技股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
AVANCE 600超导脉冲傅里叶变换-NMR波谱仪瑞士布鲁克公司;IR Prestige-21傅里叶变换红外光谱仪、LC-6AD半制备液相色谱仪(包括LC-6AD并联双柱塞泵、紫外检测器、LabSolutions色谱工作站)日本岛津公司;Acquity H-Class UPLC仪(包括二极管阵列检测器、Sample Mananger FTN自动进样器、Empower色谱工作站) 美国Waters公司;PHS-3BW电脑数显酸度计 上海理达仪器厂;DZKW-4电子恒温水浴锅北京市中兴伟业仪器有限公司;Alpha 1-4 LDplus冻干机德国Marin Christ公司;KDC-1402低速离心机 安徽中科中佳科学仪器有限公司;HYP-1004消化炉 上海纤检仪器有限公司;LDZM-80KCS-Ⅱ立式压力蒸汽灭菌器上海申安医疗器械厂;SPECTRA-MAX190酶标仪美国Molecular Devices公司;TV-1901双光束紫外-可见分光光度计 北京普析通用仪器有限公司;DBS-100电脑全自动部分收集器 上海嘉鹏科技有限公司;HDL-A紫外检测仪 上海金达生化仪器有限公司。
1.3 方法
1.3.1 玉米黄粉中γ-醇溶蛋白的提取
参考Malumba[12]和Gupta[13]等的方法,将脱脂玉米黄粉与60%乙醇溶液按照1∶10的料液比(m/V)混合,于室温条件下200 r/min搅拌90 min,3 800 r/min离心15 min,分别收集上清液和沉淀。对沉淀进行3 次上述操作,上清液即为α-和β-醇溶蛋白;沉淀去除α-和β-醇溶蛋白后,按照1∶10的料液比加入70%乙醇溶液(含0.5%乙酸钠和0.6%巯基乙醇),室温条件下搅拌90 min,3 800 r/min离心15 min,收集上清液。对沉淀进行3 次上述操作,上清液减压浓缩后,蒸馏水透析,真空干燥得到γ-醇溶蛋白,作为制备CHP的原料。
1.3.2 富含CHP的玉米蛋白水解物的制备
1.3.2.1 γ-醇溶蛋白水解液的制备
根据前期实验中优化得到的最佳酶解条件进行制备[14],称取一定质量的γ-醇溶蛋白并加水混合,使γ-醇溶蛋白终质量浓度为50 mg/mL,在90 ℃水浴中预处理10 min,使γ-醇溶蛋白变性,酶解位点暴露出来,方便酶进行酶解。调节温度至55 ℃,同时调节溶液pH值为8.0,加入碱性蛋白酶(加入量为12 100 U/g底物),水解6.5 h。然后调节pH值至7.5,加入风味蛋白酶(加入量为17 000 U/g底物),于55 ℃条件下继续酶解6 h,反应结束后在95 ℃条件下灭酶15 min,酶解液3 800 r/min离心15 min,收集上清液,向上清液中加入3 倍体积的无水乙醇,于4 ℃条件下静置4 h,3 800 r/min离心15 min以去除蛋白酶和部分未反应的大分子蛋白质,收集上清液,经旋转蒸发浓缩后冷冻干燥,得到γ-醇溶蛋白水解产物。
1.3.2.2 高温高压环化法制备CHP
称取一定质量的γ-醇溶蛋白水解产物置于100 mL锥形瓶中,加入适量蒸馏水配成底物质量浓度为20.5 mg/mL的多肽溶液,同时加入0.16 mol/L KHCO3溶液调节溶液pH值为弱碱性。用纱布封口,放入压力蒸汽灭菌器中进行高温高压处理,使样液中的脯氨酸-组氨酸二肽发生环化反应,生成CHP,反应5.3 h后,溶液冷却,经旋转蒸发浓缩后冷冻干燥,得到富含CHP的玉米蛋白水解物。
1.3.3 玉米蛋白水解物中CHP的分离纯化
1.3.3.1 阴离子交换层析
将富含CHP的水解物溶于0.01 mol/L pH 6.8的磷酸盐缓冲溶液,配制成质量浓度为40 mg/mL的多肽溶液。DE-52阴离子交换层析柱用0.01 mol/L pH 6.8的磷酸盐缓冲液充分平衡后上样,分别用含0.0、0.2、0.4 mol/L NaCl的磷酸盐缓冲溶液进行阶段洗脱,流速为1 mL/min,用自动部分收集器以5 min/管进行收集,于220 nm波长处检测,收集CHP所在部分洗脱液,冷冻干燥。
1.3.3.2 Sephadex G-25 凝胶柱层析
用0.1 mol/L乙酸铵溶液平衡凝胶层析柱,流速为0.7 mL/min。将阴离子交换柱分离所得的CHP含量最高的组分复溶于平衡液中,终质量浓度为20 mg/mL,上柱后用0.1 mol/L乙酸铵溶液以0.7 mL/min的流速进行洗脱,于220 nm波长处检测,用自动部分收集器以5 min/管收集洗脱液,收集CHP所在部分洗脱液,冷冻干燥。
1.3.3.3 反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)法分离纯化
经过凝胶层析法分离纯化所得的CHP含量最高的组分用10%乙腈溶液溶解后,用RP-HPLC进行分离,采用半制备柱Shim-pack PREP-ODS(250 mm×20 mm,5 μm),流动相为乙腈-水(90∶10,V/V),上样量300 μL,样品质量浓度5 mg/mL,流速5 mL/min,柱温35 ℃,检测波长220 nm,多次进样,收集CHP所在部分洗脱液,冷冻干燥。
1.3.4 CHP的定量分析
样品中CHP含量的测定采用UPLC法。色谱柱:Waters Acquity UPLC HSS T3柱(100 mm×2.1 mm,1.8 μm);保护柱:VanGuard Pre-Column HSS T3(5 mm×2.1 mm,1.8 μm);流动相A为含0.05% TFA的超纯水,流动相B为乙腈;线性洗脱梯度:0~5 min,5% B;5~6 min,5%~80% B;6~20 min,80% B。流速0.2 mL/min;柱温35 ℃,检测波长220 nm,进样量1 μL,样品质量浓度0.2 mg/mL。

式中:X为CHP质量分数/%;c为根据标准曲线计算得到的样液中CHP的质量浓度/(mg/mL);V为样液体积/mL;m为样品质量/mg。
1.3.5 傅里叶变换红外光谱分析
傅里叶变换红外光谱依据文献[15]方法进行扫描。将CHP样品用甲醇配制成2 mg/mL的样品溶液,将50 μL样液添加至300 mg干燥的KBr中,于105 ℃条件下挥发去除溶剂;将干燥的CHP样品与KBr研细均匀,在10 MPa条件下压片,采用傅里叶变换红外光谱仪在4 000~400 cm-1波数范围测定吸收光谱。
1.3.6 NMR分析
称取样品10 mg,加入0.5 mL D2O,置于样品管中,采集1H-NMR和13C-NMR谱图。
1.3.7 体外降血糖活性的测定
1.3.7.1 α-葡萄糖苷酶抑制活性的测定

表 1α-葡萄糖苷酶活性抑制各实验组的溶液配制Table 1 Reagents used in each experimental group forα-glucosidasey inhibition assay μL
[16]的方法,实验分为空白组、不加抑制剂的阴性组、CHP标准品阳性对照组和待测样品组。将10 U/mL α-葡萄糖苷酶溶解在0.1 mol/L pH 6.8磷酸盐缓冲液中。在96 孔板中,依次加入如表1所示的各试剂,于37 ℃条件下温育15 min;再加入24 μL 30 mmol/L麦芽糖溶液,于37 ℃温育20 min;温育结束后,每孔加入100 μL 0.1 mol/L Na2CO3中止反应。取10 μL中止后的反应液于另一96 孔板中,加入200 μL葡萄糖测定试剂盒溶剂,于37 ℃条件下温育15 min,在505 nm波长处用酶标仪测定吸光度,吸光度与葡萄糖生成量呈线性相关,每组实验重复3 次。根据公式(2)计算该样品对α-葡萄糖苷酶的抑制率。
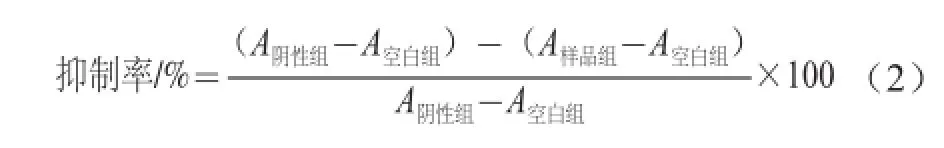
式中:A阴性组、A空白组、A样品组分别为阴性组、空白组、待测样品组的吸光度。
最终实验结果表述为半抑制浓度(half maximal inhibitory concentration,IC50):当α-葡萄糖苷酶的抑制率为50%时,加入抑制剂的有效质量浓度(mg/mL)。
1.3.7.2 α-淀粉酶抑制活性的测定

表 2α-淀粉酶活性抑制各实验组的溶液配制Table 2 Reagents used in each experimental group ofα-amylase inhibition assay mL
参考Yu Zhipeng等[17]的方法,α-淀粉酶溶解于20 mmol/L pH 6.9的磷酸盐缓冲液中,使酶质量浓度达到5 mg/L。向比色管中依次加入如表2所示的各种试剂,将混合溶液置于37 ℃水浴锅中温浴15 min,然后往该溶液里加入0.2 mL质量分数为0.5%的马铃薯淀粉溶液(溶于磷酸盐缓冲液中),37 ℃条件下恒温浴5 min。最后再加入1 mL 3,5-二硝基水杨酸试剂终止反应,并将反应液置于100 ℃水浴中10 min,于冰水浴中迅速冷却,加3 mL蒸馏水稀释后测定540 nm波长处的吸光度,每组实验重复3 次。根据公式(2)计算该样品对α-淀粉酶的抑制率。
最终实验结果表述为IC50:当α-淀粉酶的抑制率为50%时,加入抑制剂的有效质量浓度(mg/mL)。
1.3.8 体外抗氧化活性的测定
1.3.8.1 清除DPPH自由基能力的测定
参考马井喜等[18]的方法,取2.0 mL各种质量浓度的样品溶液、阴性对照(蒸馏水)和阳性对照(CHP标准品),分别加入到2.0 mL 0.2 mmol/L DPPH的乙醇溶液中,振荡混匀,室温暗室反应30 min后,以2 mL乙醇加入2 mL蒸馏水调零,在517 nm波长处测定其吸光度。空白组为2 mL样品溶液和2 mL乙醇混合,每组实验重复3 次,根据公式(3)计算样品的DPPH自由基清除率。
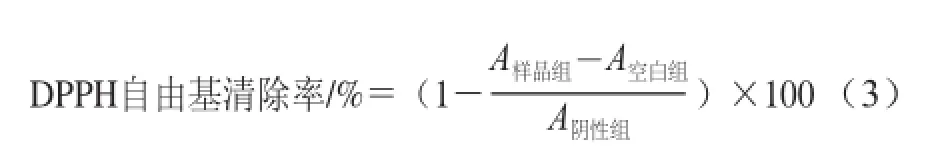
式中:A阴性组、A空白组、A样品组分别为阴性组、空白组、待测样品组的吸光度。
最终实验结果表述为IC50:当DPPH自由基清除率为50%时,加入抗氧化剂的有效质量浓度(mg/mL)。
1.3.8.2 还原力的测定
参考顾敏[19]的方法,取1 mL各种质量浓度的样品溶液、空白 (蒸馏水)和阳性对照(CHP标准品),分别与2.5 mL 0.2 mol/L磷酸钠缓冲液(pH6.6)和2.5 mL质量分数为1%铁氰化钾溶液混合,并置于50 ℃水浴20 min。加入2.5 mL 10%三氯乙酸溶液,3 800 r/min离心10 min。取2.5 mL上清液,与2.5 mL蒸馏水混合,并加入0.5 mL 0.1%氯化铁溶液,摇匀后于室温条件下静置5 min,用空白组调零,测定其在700 nm波长处的吸光度。吸光度A700nm越高,表征样品的还原力越强。所有实验重复3 次。
2 结果与分析
2.1 γ-醇溶蛋白的提取及其氨基酸序列组成
玉米醇溶蛋白是玉米黄粉中的主要储藏蛋白质,约占玉米黄粉蛋白质含量的68%,根据蛋白质结构和溶解性,醇溶蛋白可分为4 类:α-、β-、γ-和δ-醇溶蛋白[20-21]。使用美国国立生物信息中心(National Center for Biotechnology Information,NCBI)的核酸数据库—— GenBank数据库(www.ncbi.nlm.nih.gov/Database/index.html)对已收录的玉米蛋白质进行氨基酸序列搜索,发现γ-醇溶蛋白的一级结构中富含组氨酸-脯氨酸(His-Pro和Pro-His)序列(图1),而α-、β-和δ-醇溶蛋白的一级结构中His-Pro和Pro-His序列很少,由此可知γ-醇溶蛋白是制备高附加值CHP的良好来源。本研究参考文献[12-13]方法,依次用乙醇溶液和含还原剂的醇溶液提取α-、β-和γ-醇溶蛋白。α-和β-醇溶蛋白具有良好的成膜性,可以生产可食性蛋白膜、缓释性壁材等[22];γ-醇溶蛋白则作为下一步酶解实验的原料,经凯氏定氮法测定其蛋白质质量分数为87.78%。由此可见本研究的蛋白质分类提取法可大大提高玉米黄粉蛋白的综合利用率。

图 1γ-醇溶蛋白(GenBank登陆号:AF371261.1)的氨基酸序列Fig. 1 Amino acid sequence of γ-zein (GenBank accessing number: AF371261.1)
2.2 玉米蛋白水解物中CHP的分离纯化结果
按1.3.1节方法,1.0 g玉米γ-醇溶蛋白中可以得到富含CHP的蛋白水解物682 mg,CHP的质量分数仅为0.66%,为了进一步去除一些杂多肽,提高目标产物的浓度,将富含CHP的玉米蛋白水解物分别用DE-52阴离子交换柱层析、Sephadex G-25凝胶柱层析和C18反相制备柱进行分离和纯化。
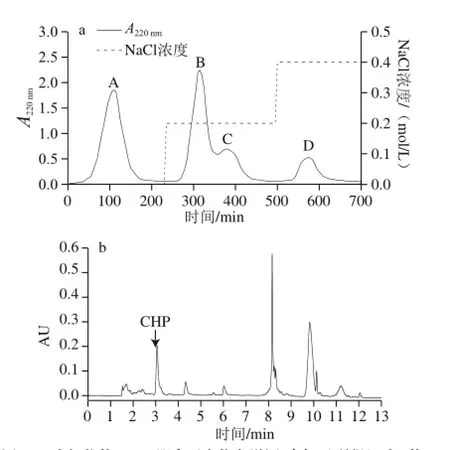
图2 水解物的DE-52阴离子交换色谱图(a)及所得组分A的UPLC色谱图(b)Fig. 2 Anion exchange chromatography of the hydrolysate on a DE-52 column (a) and UPLC chromatogram of the obtained fraction A (b)
如图2a所示,用阴离子交换层析对富含CHP的水解物进行分离纯化得到3 个洗脱组分,其中组分A未被离子交换剂吸附,表明这部分肽段组成是碱性氨基酸;B、C、D组分是0.2~0.4 mol/L NaCl梯度洗脱所得,说明B~D峰以酸性肽组分为主。收集各组分冷冻干燥,UPLC法测定各峰的CHP质量分数,可见A组分的CHP质量分数最高,为10.53%(图2b),而B、C、D组分中均不含CHP,由此推测CHP属于弱碱性肽。故取A组分通过Sephadex G-25凝胶层析柱进一步分离,如图3a所示,得到3 个组分(A1、A3和A2)。分别对其进行UPLC分析,结果表明A2组分的CHP质量分数最高,为46.44%(图3b),而A1、A3组分中均不含CHP,故选取A2组分进行下一步的分离纯化。
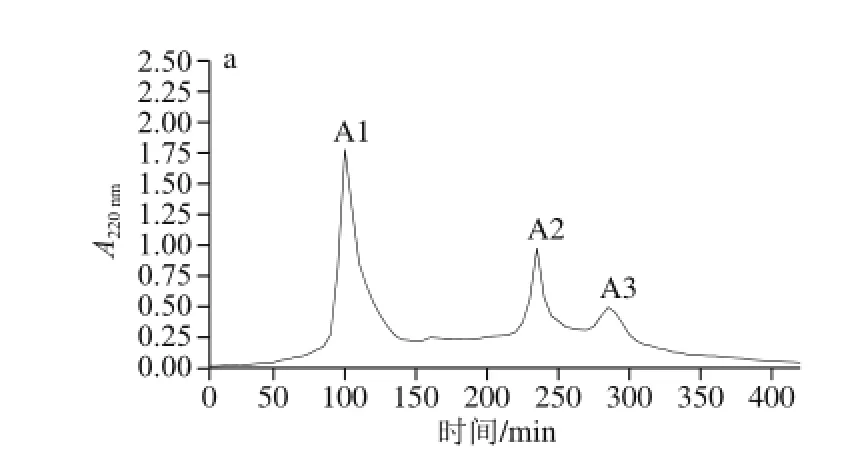
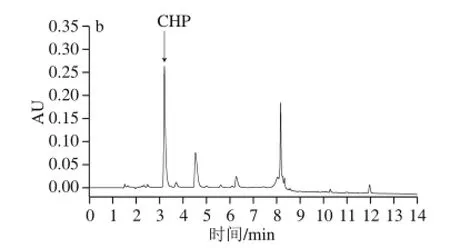
图3 组分A的Sephadex G-25凝胶层析色谱图(a)及所得组分A2的UPLC色谱图(b)Fig. 3 Gel filtration chromatography of fraction A on a Sephadex G-25 column (a) and UPLC chromatogram of the obtained fraction A2 (b)
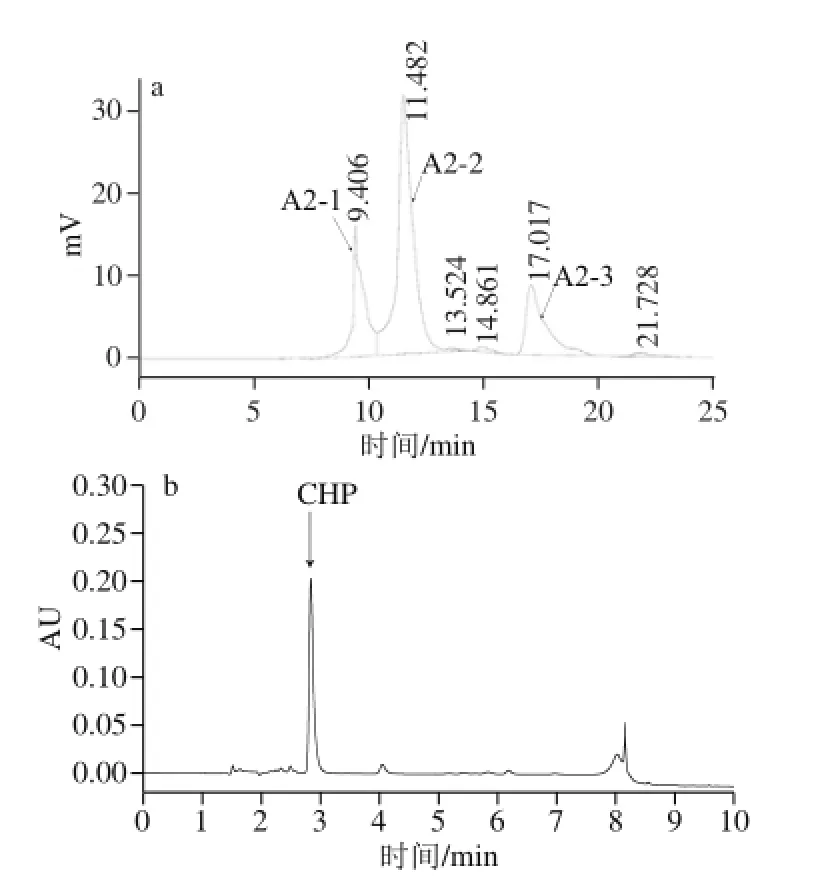
图4 半制备型RP-HPLC分离A2组分的色谱图(a)及所得组分A2-2的UPLC色谱图(b)Fig. 4 Elution profile of fraction A2 separated by semi-preparative RP-HPLC (a) and UPLC chromatogram of the obtained fraction A2-2 (b)
经过Sephadex G-25分离所得的A2组分进一步通过RP-HPLC进行分离纯化,如图4a所示,组分A2加载到半制备柱上,被分为3 个峰(A2-1、A2-2和A2-3),根据CHP标准品的出峰时间可以确定A2-2为CHP峰,将此峰组分多次收集、冷冻干燥后,采用UPLC进行CHP定量分析,结果如图4b所示。组分A2-2为单一峰,已达到很高的纯度,其CHP质量分数为97.36%。
2.3 组分A2-2的傅里叶变换红外光谱鉴定
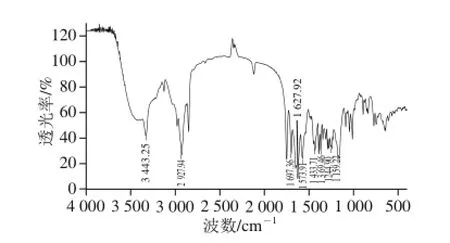
图5 组分A2-2的傅里叶变换红外光谱图Fig. 5 Infrared spectrum of fraction A2-2
由图5可知,组分A2-2的傅里叶变换红外光谱在3 443 cm-1处显示酰胺N—H的伸缩振动峰,在1 627 cm-1和1 697 cm-1处的峰分别为游离酰胺(-CONHR)和缔合酰胺(-CONR1R2)的吸收峰,在1 433 cm-1和1 369 cm-1处出现的峰可归属为二酮哌嗪环C—H的弯曲振动峰,证明二酮哌嗪环骨架的存在;1 573 cm-1处的峰为咪唑环的C=C吸收峰,1 244 cm-1和1 159 cm-1处的峰为咪唑环的C-N吸收峰,证明组氨酸咪唑环的存在;在2 927 cm-1处出现的峰为-CH2的C-H伸缩振动峰,在794 cm-1处显示吡咯环的特征吸收峰,证明了脯氨酸吡咯环的存在。红外测定结果表明,所制备的A2-2组分与文献[23]报道的CHP的光谱特征一致。
2.4 组分A2-2的NMR分析
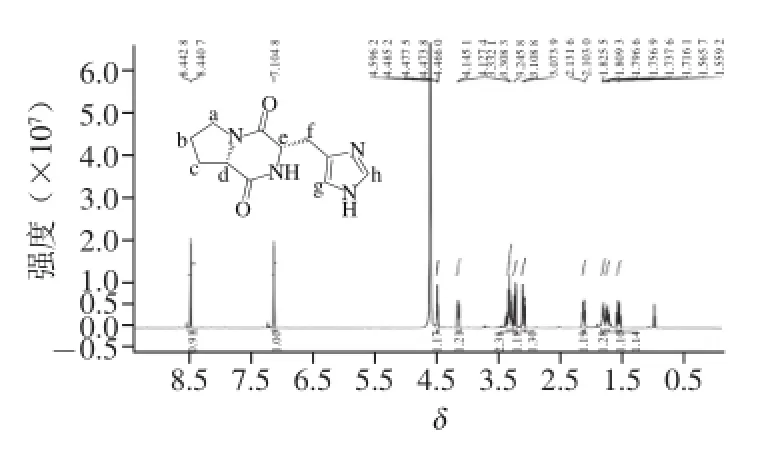
图6 组分A2-2的1H-NMR图谱Fig. 6 1H-NMR spectrum of fraction A2-2
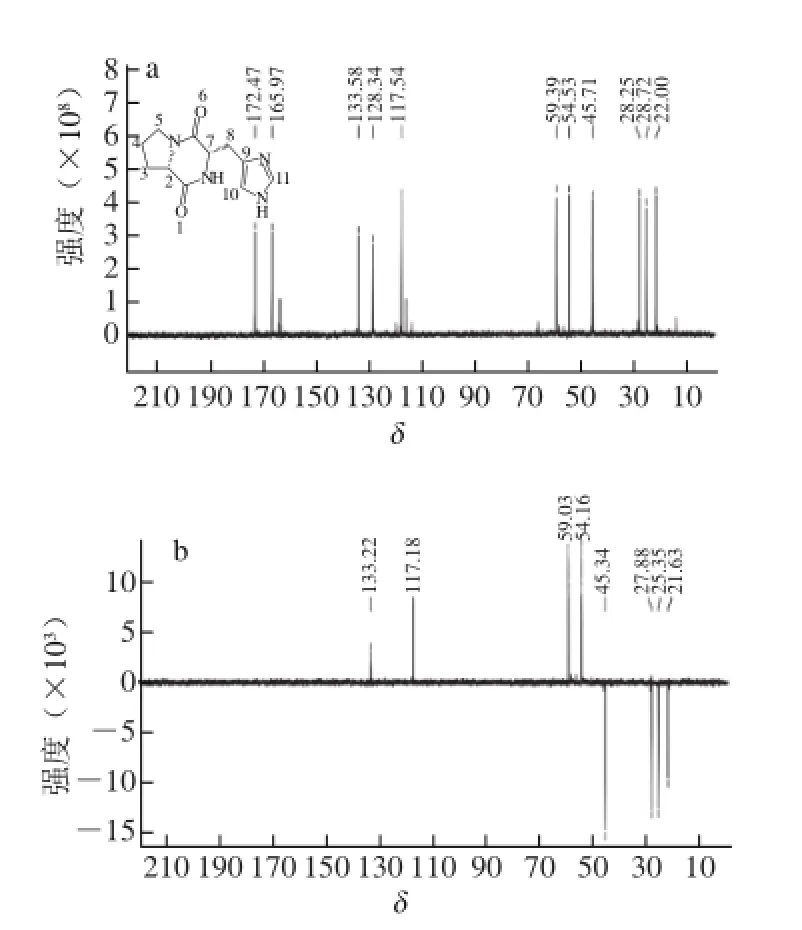
图7 组分A2-2的13C-NMR谱图(a)和13C-NMR的135°无畸变极化转移增强谱图(b)Fig. 713C-NMR spectrum of fraction A2-2 (a) and 135° distortionless enhancement by polarization transfer spectrum (b) of13C-NMR
将分离纯化后的组分A2-2进行1H和13C-NMR分析,结果见图6、7。由图6可知,1H-NMR(600 MHz,D2O)δ:1.563 0(1H,m,J=7.74 Hz,H-c)、1.716 1~1.768 2(1H,m,H-b)、1.796 6~1.834 1(1H,m,H-b)、2.123(1H,m,J=5 Hz, H-c)、3.091 4(1H,d,J=16 Hz,H-f)、3.236 2(1H,d,J=16 Hz,H-f)、3.294 0~3.357 2(2H,m,H-a)、4.127 4~4.16(1H,m,H-d)、4.475 7(1H,m,H-e)、7.104 8(1H,s,H-g)、8.440 7(1H,s,H-h),通过与文献[24]比较,其NMR数据与报道的CHP化合物基本一致。
图7为组分A2-2的13C-NMR图谱以及13C-NMR的135°无畸变极化转移增强谱,由图7可知,13C-NMR(600 MHz,D2O)δ:22.00(C-4)、25.72(C-3)、28.25(C-8)、45.71(C-5)、54.53(C-2)、59.35(C-7)、117.54(C-10)、128.34(C-9)、133.58(C-11)、165.97(C-6)、172.47(C-1),结合氢谱数据,可进一步证明该组分为CHP。
2.5 玉米CHP分离纯化各目标产物的体外降血糖活性和抗氧化活性
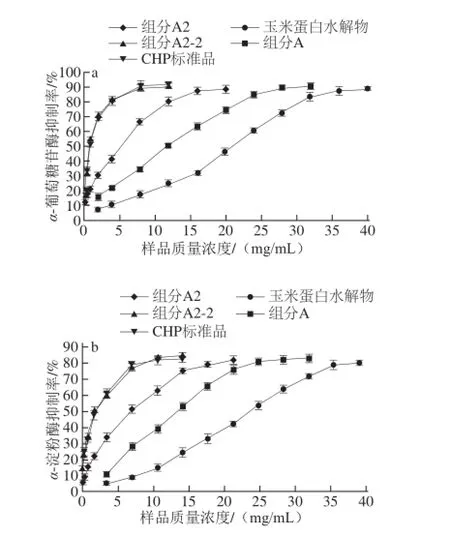
图8 不同质量浓度的玉米蛋白水解物、组分A、A2和A2-2以及阳性对-淀粉酶(b)活性的抑制Fig. 8 Inhibitory activities of corn protein hydrolysate, fractions A, A2 and A2-2, and positive control (CHP standard) at various concentrations on α-glucosidase (a) and α-amylase (b)照组(CHP标准品)对α-葡萄糖苷酶(a)和α
由图8可知,玉米蛋白水解物和各分级组分均具有一定程度的抑制α-葡萄糖苷酶和α-淀粉酶活性,且随着样品质量浓度的升高,4 种物质对酶的抑制率均增大。玉米CHP的分离纯化步骤及目标组分体外α-葡萄糖苷酶和α-淀粉酶抑制活性的IC50值如表3所示,可发现随着CHP纯度的增大,对酶的抑制作用也逐渐增强。经过阴离子交换层析、凝胶层析和RP-HPLC纯化得到的组分A2-2表现出最高的α-葡萄糖苷酶抑制活性和α-淀粉酶抑制活性(IC50分别为1.1 mg/mL和1.9 mg/mL),其IC50值与CHP标准品差异不显著(P>0.05),表明玉米蛋白水解物中对降血糖活性起主要作用的是CHP。本研究制备的玉米CHP能够很好地抑制α-葡萄糖苷酶和α-淀粉酶的活性,这为后续研究其体内降血糖及作用机制的阐明提供了一定的参考。

表3 玉米CHP分离纯化及各目标产物对α-葡萄糖苷酶和α-淀粉酶抑制活性的IC50值以及对DPPH自由基清除能力的IC50值(n=3)Table 3 IC50for inhibition ofα-glucosidase andα-amylase as well as DPPH scavenging by the purified fractions from corn CHP and CHP standard (n= 3)
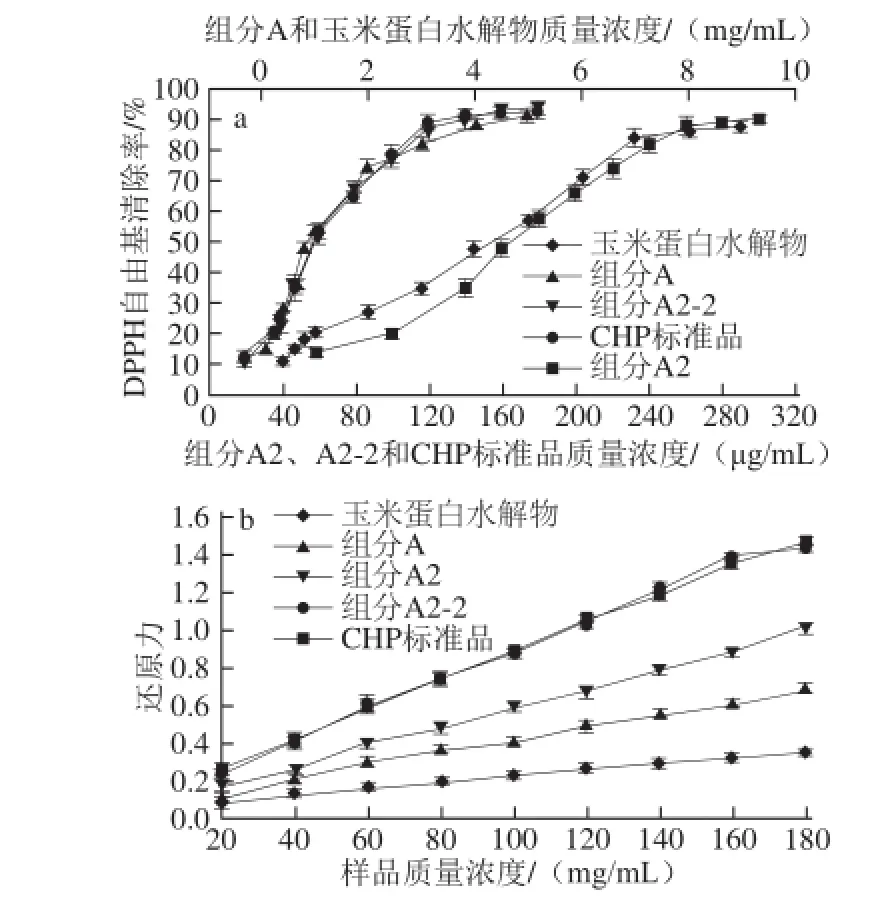
图9 不同质量浓度的玉米蛋白水解物、组分A、A2和A2-2以及CHP标准品的DPPH自由基清除率和还原力Fig. 9 DPPH scavenging rates and reducing capacities of corn protein hydrolysate, fractions A, A2 and A2-2, and CHP standard at various concentrations
通过DPPH自由基清除活性实验和还原力实验来比较玉米蛋白水解物及其各分级组分的抗氧化活性,如图9所示,玉米蛋白水解物和组分A、A2、A2-2都具有一定的清除DPPH自由基活性和还原力活性,且随着样品质量浓度的升高,4 种物质对DPPH自由基的清除率和还原能力均增大。组分A2-2表现出最高的DPPH自由基清除活性(IC50= 67 μg/mL)和还原能力,并且其DPPH自由基清除活性和还原能力与CHP标准品差异不显著(P>0.05),表明玉米蛋白水解物中对抗氧化起主要作用的是CHP。
3 讨 论
本研究以高温高压环化后的玉米蛋白酶解物为原料,采用离子交换色谱、凝胶过滤色谱和半制备型RP-HPLC技术,成功建立了玉米CHP的分离、纯化体系。采用UPLC法对各级分离产物的CHP含量进行测定,结果显示经离子交换色谱、凝胶过滤色谱和半制备型RP-HPLC逐级分离纯化后,玉米CHP的纯度由0.66%提高到97.36%,纯化倍数高达148 倍,与购买的CHP标准品的纯度(98%)差异不显著。对纯化后终产物的结构进行了鉴定,综合UPLC、傅里叶变换红外光谱和NMR波谱的结果,最终确定产物为目标化合物CHP。Park等[11]采用超滤和活性炭吸附法从酵母蛋白的水解物中对CHP进行纯化,得到的CHP的纯度仅为5%;Song等[25]采用溶剂萃取(乙酸乙酯法和异丙醇法)、两次正相硅胶柱层析和一次反相硅胶柱层析法从狗的前列腺中分离富集CHP,得到的CHP的纯度为97.2%,纯化倍数为97,但工艺繁杂,消耗大量的有机溶剂,溶剂泄漏和环境污染的隐患较大,不适合工业化应用。而本研究的分离纯化工艺操作简便、条件温和、无污染,符合市场要求,因此适合大规模产业化富集。
分别测试分离纯化各目标产物的α-葡萄糖苷酶抑制活性、α-淀粉酶抑制活性、清除DPPH自由基活性和还原力,结果显示用经分离纯化得到的玉米CHP表现出最高的体外降血糖和抗氧化活性,其α-葡萄糖苷酶抑制活性、α-淀粉酶抑制活性和清除DPPH自由基活性比分离前的玉米蛋白水解物分别提高了19、14 倍和62.7 倍,与购买的CHP标准品相比差异不显著。实验结果表明,采用本实验建立的玉米CHP分离富集法,每千克玉米黄粉可以制备673 mg高纯度的玉米CHP,以目前CHP的市场价格计算(10 美元/mg),可创产值6 730 美元,与将玉米黄粉直接作为饲料相比,可增值20 000 倍。我国玉米黄粉来源广泛,利用率很低,很多未经利用即自然排放,据统计数字显示每年全国通过废液自然排放的玉米黄粉的产量达8万 t以上[26]。因此将玉米黄粉通过生物技术、分离技术等手段生产CHP,不仅可以在一定程度上解决我国粮食资源的浪费和环境污染问题,还能带来巨大的经济效益,对促进降血糖、抗氧化等肽类药物及保健食品的开发,提高玉米蛋白的附加值,推进玉米精深加工进程,具有重要意义。
参考文献:
[1] 张艳荣, 樊红秀, 刘婷婷, 等. 环(组氨酸-脯氨酸)二肽的高温高压辅助合成工艺优化[J]. 食品科学, 2016, 37(8): 18-25. DOI:10.7506/ spkx1002-6630-201608004.
[2] RA K S, SUH H J, CHOI J W. Hypoglycemic effects of cyclo (His-Pro) in streptozotocin-induced diabetic rats[J]. Biotechnology and Bioprocess Engineering, 2012, 17: 176-184. DOI:10.1007/s12257-011-0618-1.
[3] UYEMURA K, DHANANI S, YAMAGUCHI D T, et al. Metabolism and toxicity of high doses of cyclo (His-Pro) plus zinc in healthy human subjects[J]. Journal of Drug Metabolism & Toxicology, 2010, 1(2): 2-9. DOI:10.4172/2157-7609.1000105.
[4] MINELLI A, GROTTELLI S, MIERLA A, et al. Cyclo (His-Pro) exerts anti-inflammatory effects by modulating NF-κB and Nrf2 signalling[J]. The International Journal of Biochemistry & Cell Biology, 2012, 44(3): 525-535. DOI:10.1016/j.biocel.2011.12.006.
[5] SONG M K, ROSENTHAL M J, SONG A M, et al. Body weight reduction in rats by oral treatment with zinc plus cyclo-(His-Pro)[J]. British Journal of Pharmacology, 2009, 158(2): 442-450. DOI:0.1111/ j.1476-5381.2009.00201.x.
[6] ABIRAM A, KOLANDAIVEL P. Structural analysis and the effect of cyclo (His-Pro) dipeptide on neurotoxins-a dynamics and density functional theory study[J]. Journal of Molecular Modeling, 2010, 16(2): 193-202. DOI:10.1007/s00894-009-0531-0.
[7] KOO K B, SUH H J, RA K S, et al. Protective effect of cyclo (His-Pro) on streptozotocin-induced cytotoxicity and apoptosis in vitro[J]. Journal of Microbiology and Biotechnology, 2011, 21(2): 218-227. DOI:10.4014/jmb.1012.120.
[8] MINELLI A, BELLEZZA I, GROTTELLI S, et al. Focus on cyclo (His-Pro): history and perspectives as antioxidant peptide[J]. Amino Acids, 2008, 35(2): 283-289. DOI:10.1007/s00726-007-0629-6.
[9] CHOI S A, YUN J W, PARK H S, et al. Hypoglycemic dipeptide cyclo (His-Pro) significantly altered plasma proteome in streptozocininduced diabetic rats and genetically-diabetic (ob/ob) mice[J]. Molelular Biology Reports, 2013, 40(2): 1753-1765. DOI:10.1007/ s11033-012-2229-0.
[10] MINELLI A, CONTE C, GROTTELLI S, et al. Cyclo (His-Pro) promotes cytoprotection by activating Nrf2-mediated up-regulation of antioxidant defence[J]. Journal of Cellular and Molecular Medicine, 2009, 13(6): 1149-1161. DOI:10.1111/j. 1582-4934.2008.00326.x.
[11] PARK Y, LEE H J, CHOI J W, et al. Anti-diabetic effect of cyclo-His-Pro (CHP)-enriched yeast hydrolysate in streptozotocin-induced diabetic mice[J]. African Journal of Biotechnology, 2013, 12(35): 5473-5479. DOI:10.5897/AJB12.1556.
[12] MALUMBA P, VANDERGHEM C, DEROANNE C, et al. Influence of drying temperature on the solubility, the purity of isolates and the electrophoretic patterns of corn proteins[J]. Food Chemistry, 2008, 111(3): 564-572. DOI:10.1016/j.foodchem.2008.04.030.
[13] GUPTA J, WILSON B W, VADLANI P V. Evaluation of green solvents for a sustainable zein extraction from ethanol industry DDGS[J]. Biomass and Bioenergy, 2016, 85: 313-319. DOI:10.1016/ j.biombioe.2015.12.020.
[14] 樊红秀, 刘婷婷, 刘鸿铖, 等. 响应面试验优化高温高压制备玉米环(组氨酸-脯氨酸)二肽关键工艺[J]. 食品科学, 2016, 37(20): 6-12. DOI:10.7506/spkx1002-6630-201620002.
[15] 孙素琴, 周群, 陈建波. 中药红外光谱分析与鉴定[M]. 北京: 化学工业出版社, 2010: 67-69.
[16] 田应娟. 啤酒糟多肽的分离纯化及降血糖活性研究[D]. 广州: 华南理工大学, 2011: 30-32.
[17] YU Zhipeng, YIN Yongguang, ZHAO Wenzhu, et al. Antidiabetic activity peptides from albumin against α-glucosidase and α-amylase[J]. Food Chemistry, 2012, 135: 2078-2085. DOI:10.1016/ j.foodchem.2012.06.088.
[18] 马井喜, 孙永杰, 冯印, 等. 鲤鱼肽的酶法制备工艺及其抗氧化性[J].食品科学, 2013, 34(1): 225-230.
[19] 顾敏. 青养蛋白抗氧化肽的分离纯化及胃肠道消化特性研究[D]. 广州: 华南理工大学, 2014: 35-36.
[20] 徐艳艳. 玉米黄粉中蛋白质的提取和性质研究[D]. 郑州: 河南农业大学, 2012: 3-4. DOI:10.7666/d.y2157044.
[21] 蔚欣. 玉米醇溶蛋白突变性状的分子表征[D]. 太原: 山西大学, 2013: 2-4.
[22] ANDERSON T J, LAMSAL B P. Development of New method for extraction of α-zein from corn gluten meal using different solvents[J]. Cereal Chemistry, 2011, 88(4): 356-362. DOI:10.1094/ CCHEM-08-10-0117.
[23] 覃显灿, 虞正鹏. 环(L-组-L-脯)二肽的合成[J]. 海南师范大学学报(自然科学版), 2008, 21(2): 173-176. DOI:10.3969/ j.issn.1674-4942.2008.02.015.
[24] 于燕. 手性含脯氨酸环二肽的合成、抗菌抗肿瘤活性及作为不对称催化剂的研究[D]. 青岛: 青岛科技大学, 2010: 45-47. DOI:10.7666/d.y1740344.
[25] SONG M K, ROSENTHAL M J, HONG S, et al. Synergistic antidiabetic activities of zinc, cyclo (His-Pro), and arachidonic acid[J]. Metabolism, 2001, 50(1): 53-59. DOI:10.1053/meta.2001.19427.
[26] ZHUANG Hong, TANG Ning, DONG Shuting, et al. Optimisation of antioxidant peptide preparation from corn gluten meal[J]. Journal of the Science of Food and Agriculture, 2013, 93(13): 3264-3270. DOI:10.1002/jsfa.6170.
Separation, Purification, Structural Identification and Bioactivities of Corn Cyclo (His-Pro)
FAN Hongxiu, LIU Hongcheng, DONG Xin, ZHANG Yanrong*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Cyclo (His-Pro) (CHP) is an active dipeptide that has remarkable anti-diabetic and antioxidant activities. In the present study, CHP was isolated and purified from corn protein hydrolysate treated by high pressure/temperature treatment using DE-52 anion-exchange chromatography, gel filtration chromatography and semi-preparative high performance liquid chromatography (HPLC). The structure of the purified product was identified by ultra-high performance liquid chromatography (UPLC), Fourier infrared (FI-IR) spectroscopy and1H and13C nuclear magnetic resonance (NMR), and its bioactivities including in vitro anti-diabetic and antioxidant capacity were determined. The results showed that the purity of the prepared corn CHP was more than 97.36%. FI-IR and NMR spectra showed that the corn CHP was the target compound. The results of physiological activities indicated that the CHP exhibited strong α-glucosidase and α-amylase inhibitory activity with half maximal inhibitory concentrations (IC50) of 1.1 and 1.9 mg/mL, respectively, as well as high scavenging activity on 2,2-diphenyl-1-picrylhydrazyl hydrate with IC50of 67 μg/mL and potent reducing capacity.
cyclo (His-Pro); corn protein; separation and purification; structural identification
10.7506/spkx1002-6630-201621010
O629.73
A
1002-6630(2016)21-0053-08
樊红秀, 刘鸿铖, 董欣, 等. 玉米环二肽(组氨酸-脯氨酸)的分离纯化、结构鉴定及其生物活性[J]. 食品科学, 2016, 37(21): 53-60. DOI:10.7506/spkx1002-6630-201621010. http://www.spkx.net.cn
FAN Hongxiu, LIU Hongcheng, DONG Xin, et al. Separation, purification, structural identification and bioactivities of corn cyclo (His-Pro)[J]. Food Science, 2016, 37(21): 53-60. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621010. http://www.spkx.net.cn
2016-06-30
“十二五”国家科技支撑计划项目(2013BAD16B08);吉林省重大科技攻关项目(2012ZDGG007)
樊红秀(1987—),女,博士研究生,研究方向为粮油植物蛋白工程。E-mail:xcpyfzx@163.com
*通信作者:张艳荣(1965—),女,教授,博士,研究方向为粮油植物蛋白工程及功能食品。E-mail:xcpyfzx@163.com

