超声波作用于大豆分离蛋白-磷脂复合体系的流变性和拉曼光谱变化
毕 爽,隋晓楠,韩天翔,李 杨,王中江,齐宝坤,江连洲
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
超声波作用于大豆分离蛋白-磷脂复合体系的流变性和拉曼光谱变化
毕 爽,隋晓楠,韩天翔,李 杨,王中江,齐宝坤,江连洲*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
研究超声波低功率(100 W)、中功率(300 W)和高功率(450 W)在不同的时间条件下(12、24 min)对大豆分离蛋白-磷脂复合体系结构和功能性质的影响。扫描电子显微镜及流变学实验显示低、中功率超声波处理形成的凝胶结构致密均匀、弹性模量G’较高,且300 W条件下处理24 min时,样品凝胶性质最好。采用光谱学实验验证后发现,大豆分离蛋白-磷脂复合体系构象的变化是影响其凝胶性质的主要因素;拉曼光谱实验结果表明:超声波改变了大豆分离蛋白的二级结构以及色氨酸、酪氨酸所处的微环境,暴露疏水性基团,使其更易与大豆卵磷脂发生疏水相互作用,且低、中功率条件下超声波对大豆分离蛋白和磷脂交互作用的影响较大。超声波功率进一步增大(450 W)使大豆分离蛋白发生不溶性聚集,减弱了与磷脂间的相互作用,复合体系的功能性质随之下降。
超声波处理;大豆分离蛋白-磷脂复合体系;荧光光谱;拉曼光谱;空间结构
大豆分离蛋白由于营养丰富而被广泛使用,作为食品成分用来增强食品营养和风味。但天然大豆蛋白对温度、离子强度、pH值等因素敏感,使它们在食品加工中的应用受到限制。为拓宽其应用范围,大豆分离蛋白的天然改性已经成为学者们的研究热点[1-2]。大豆卵磷脂是食品中重要的营养成分,具有改善食品风味和质地的作用。作为一种两性离子表面活性剂,它可以通过疏水结合的方式使蛋白质的表面活性发生改变[3]。
近年来,较多研究指出蛋白质与磷脂可以通过静电作用或疏水相互作用结合形成复合体系,也有学者对其功能性质进行了一定的研究。Mantovani[4]和Yamamoto[5]等发现磷脂的添加可以提高乳清分离蛋白在接近等电点处的稳定性,同时,大豆分离蛋白-磷脂复合乳液粒径分布均匀且体积平均粒径较小,是一种良好的天然乳化剂。有研究者研究发现pH值和热处理会在一定程度上影响大豆分离蛋白-磷脂复合体系功能性质的表达[6-8]。目前,超声波技术在食品工业中得到广泛应用,其在液体介质中的动态剪切、空化等作用,可以改变大豆分离蛋白的柔性空间结构[9-10],诱导磷脂结构变化,促进大豆分离蛋白与磷脂间的融合与交互。然而,鲜有关于不同超声波条件对大豆分离蛋白-磷脂复合体系功能性质的影响研究,而采用荧光光谱和拉曼光谱研究大豆分离蛋白-磷脂复合体系构象变化与凝胶性质之间的构效关系也相对较少。
本实验探究不同超声波功率(150、300、450 W)和超声波作用时间(12、24 min)对大豆分离蛋白-磷脂复合体系结构和功能性质的影响,解析复合体系结构变化对功能性质产生的影响,以期为超声波技术在食品加工中的合理应用提供参考。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白 东北农业大学食品学院实验室自制;大豆卵磷脂 美国Sigma公司。
盐酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠 北京新光化学试剂厂;正己烷 天津北科化学品有限责任公司。
1.2 仪器与设备
超声波细胞破碎仪 宁波新芝生物科技股份有限公司;AL204型分析天平 梅特勒-托利多仪器(上海)有限公司;S-3400扫描电子显微镜、F-4500荧光分光光度计 日本Hitachi公司;离心机 德国Eppendorf公司;FD5-3型冷冻干燥机 美国SIM公司;PerkinElmer Raman Station 400 拉曼光谱仪 美国PE公司。
1.3 方法
1.3.1 大豆分离蛋白的制备
参考Wolf[11]的方法。新鲜大豆磨粉后与正己烷以料液比1∶3(m/V)的比例混合,在40 ℃条件下搅拌2 h。将所得混合物在4 ℃、10 000×g条件下离心20 min,弃去上层油脂,再重复离心过程3 次,室温条件下风干备用。将脱脂豆粉按1∶10的料液比(m/V)与水混合,然后用2 mol/L NaOH调节溶液的pH值至8.5,45 ℃条件下搅拌2 h后,将其悬浮液在4 ℃、10 000×g条件下离心20 min,取上清液再用2 mol/L HCl调节pH值至4.5。静置后在4 ℃、6 000×g条件下离心20 min,得蛋白质沉淀水洗2 次,最后用2 mol/L NaOH调节蛋白质pH值至7.0。将此蛋白溶液冷冻干燥后研磨即得粉末状大豆分离蛋白。1.3.2 超声波处理制备大豆分离蛋白-磷脂复合体系
将大豆卵磷脂与大豆分离蛋白以1∶10(m/m)的比例混合于锥形瓶中,配制成大豆分离蛋白质量浓度为1 g/100 mL的水溶液,室温条件下搅拌2 h。超声波处理的方法及条件设定参考Hu Hao等[12]并进行一定修改。将超声波处理器的钛探头(直径0.636 cm)插入液面,20 kHz条件下分别在输出功率为150、300、450 W条件下处理12、24 min,超声波作用时间4 s,间隔时间2 s,并每隔5 min向冰水浴中加入冰块保持低温,各样品处理条件见表1。

表1 超声波处理制备大豆蛋白-磷脂复合物Table 1 Ultrasonic treatments applied to soybean protein isolate-lecithin complex
1.3.3 扫描电子显微镜观察大豆分离蛋白-磷脂凝胶样品
将超声波处理的大豆分离蛋白-磷脂样品制备成质量浓度为100 mg/mL的分散液。在90 ℃条件下加热20 min后冷却至室温形成大豆分离蛋白-磷脂凝胶,在4 ℃条件下冷藏24 h以完全形成凝胶。样品前处理:将制好的凝胶切成块状,浸泡在固定液中24 h。再用体积分数30%~100%的乙醇溶液梯度洗脱至凝胶基本呈硬块状。切成表面较为平整的片状凝胶,用冷冻干燥机干燥[13]。将干燥后的凝胶脆断、镀金,样品置于扫描电子显微镜(15 kV)下观察其显微结构。
1.3.4 流变学性质测定
流变学性质测定采用温度扫描模式。将经过不同条件超声波处理的大豆分离蛋白-磷脂溶液加到流变仪平板上,平板直径为40 mm,探头型号及尺寸:pp为20 mm,板间距为0.5 mm。采用石蜡油对两平行板间的缝隙封口,防止水分蒸发。测定参数:初始温度25 ℃,以5 ℃/min升温速率升温至90 ℃后保温20 min,之后以5 ℃/min降温速率降温至25 ℃。角频率为0.63 rad/s,固定形变0.01[14]。记录下弹性模量G’数值的变化。
1.3.5 拉曼光谱的测定及分析
拉曼光谱仪在室温条件下相关参数设定:功率80 mW,激发光波长785 nm,曝光时间60 s,扫描400~2 000 cm-1范围内的波数谱段,每个样品都重复扫描3 次以上,由计算机做信号累加平均并绘图输出,峰位误差控制在±3 cm-1内。扫描后各样品的拉曼数据利用Origin 9.1软件进行平滑处理,先进行基线校正,然后以苯丙氨酸(1 003±1) cm-1作为归一化因子[15]。采用Peakfit Version软件进行拟合分析各蛋白样品二级结构组分的含量。
2 结果与分析
2.1 扫描电子显微镜观察大豆分离蛋白-磷脂凝胶样品

图1 不同超声波处理条件下大豆分离蛋白-磷脂样品凝胶扫描电子显微镜图(500×)Fig. 1 Scanning electron microscope image of soybean protein isolatelecithin gel prepared under different ultrasonic conditions (500 ×)
由图1可知,未处理的大豆分离蛋白-磷脂凝胶结构不均匀,表面不平整并且现大面积孔洞。经过低、中功率超声波处理的样品凝胶具有聚集结构并夹杂一些疏松的网络结构。当150 W超声波处理24 min时,样品从网状结构变为胶状结构、表面平整、致密有序。但经过高频率、长时间超声波处理的样品,凝胶空间结构表面不均一并出现较大的空洞。适宜强度的超声波处理可以加速大豆分离蛋白-磷脂的相互作用,易于凝胶聚集体的形成,这与Zuniga等[16]结果一致。超声波的空化作用使大豆分离蛋白和磷脂的空间结构展开,功能基团(如疏水基团)暴露,蛋白质与蛋白质、蛋白质与磷脂之间彼此发生相互作用从而形成蛋白质聚集体,呈现网状结构。不同样品间凝胶性的差异可能与大豆分离蛋白二级结构变化有紧密联系。也可能因为超声波处理减少了大豆分离蛋白-磷脂体系的粒度,在凝胶过程中形成较小的聚合物,更好地填充在蛋白质-磷脂的凝胶网络空间内,使凝胶结构更致密、均一。
2.2 超声波处理对大豆分离蛋白-磷脂复合体系流变学性质的影响分析
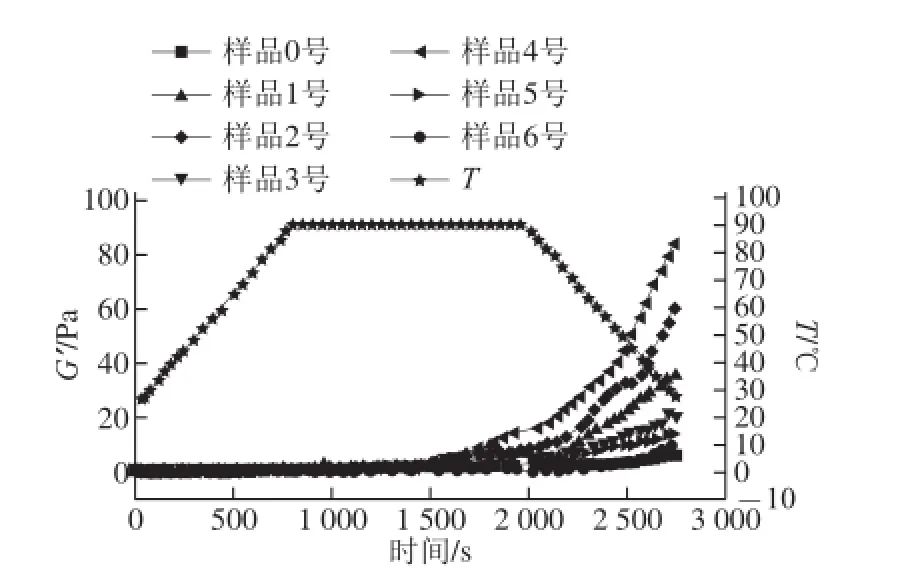
图2 不同超声波条件下大豆分离蛋白-磷脂复合体系的流变学特性Fig. 2 Rheological properties of soybean protein isolate-lecithin composite system prepared under different ultrasonic conditions
弹性模量可以衡量样品的凝胶强度,代表凝胶在弹性形变过程中积蓄的能量[17]。由图2可知,经过不同条件超声波处理后,所有样品的弹性模量G’变化趋势均相同,但在升温过程中各样品的G’几乎不发生变化。在加热过程中蛋白质分子逐步解折叠,发生部分变性,暴露出疏水基团与磷脂发生相互作用。但升温过程中,样品还未形成凝胶,所以大豆分离蛋白-磷脂体系的G’没有升高。在保温过程中,由于凝胶初始阶段蛋白质-蛋白质/蛋白质-磷脂间发生一定的相互作用,因此样品的G’升高但并不明显[18]。在降温过程中,样品的G’开始持续上升,蛋白质分子间氢键、二硫键或蛋白质与磷脂间的疏水相互作用等作用力使其结合并形成凝胶网状结构。经过150 W、24 min条件下超声波处理的样品最先形成凝胶,说明其形成凝胶能力最强[19]。但相同时间条件下(24 min),随着超声波功率的增加,样品降温结束后的G’降低,可能是高功率协同长时间超声波处理会使大豆蛋白结构发生不可逆转变,形成不溶性聚集体后与大豆卵磷脂间的交互作用程度减弱,导致最终凝胶强度降低,与扫描电子显微镜观察到的结构一致。当超声波作用时间为12 min时,最终凝胶的G’随超声波功率的升高先增加后下降,较低超声波功率(150 W)时,空化作用不明显,大豆分离蛋白与磷脂交互作用较差。中等强度超声波功率(300 W)使大豆分离蛋白结构打开,蛋白质的二级结构发生变化,大豆分离蛋白与磷脂相互作用程度增加,形成凝胶强度较高。但高强度超声波会破坏大豆分离蛋白的结构[20],同时降低大豆分离蛋白-磷脂复合体系的溶解性,影响最终凝胶的G’。为了进一步探究凝胶状态与样品结构之间的构效关系,本实验采用拉曼光谱分析大豆分离蛋白-磷脂样品的结构。
2.3 不同超声波处理条件下大豆分离蛋白-磷脂复合体系的拉曼光谱分析
大豆分离蛋白-磷脂复合体系中蛋白质的拉曼光谱特征峰和峰位归属见表2,根据表中振动来源与波数的对应关系可在图3中标注出不同超声波处理条件下大豆分离蛋白-磷脂复合体系的拉曼谱带。
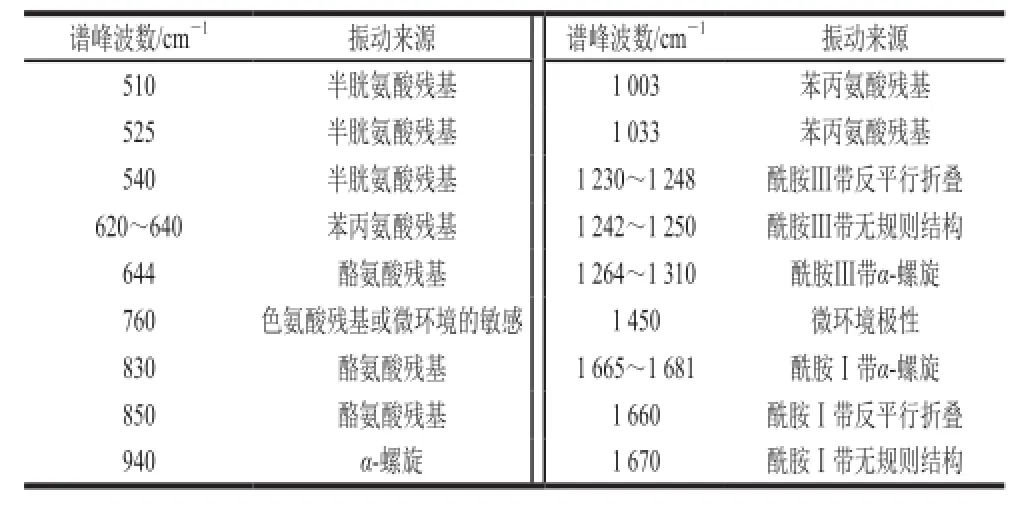
表2 大豆分离蛋白-磷脂复合体系中蛋白质的拉曼光谱特征峰和峰位归属Table 2 Tentative assignment of some bands in the Raman spectrum of soybean protein isolate-lecithin complex system
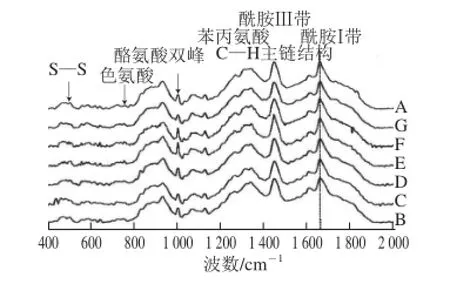
图3 不同超声波处理条件下大豆分离蛋白-磷脂复合体系的拉曼光谱Fig. 3 Raman spectra of soybean protein isolate-lecithin composite system under different ultrasonic treatments
大豆分离蛋白-磷脂复合体系中的各种功能键以及大豆蛋白的二、三级结构信息均需激光拉曼光谱进行分析。通过拉曼光谱图频率和强度反应大豆分离蛋白-磷脂复合体系所处环境和构象变化等信息。经过不同条件超声波处理后样品在波数400~2 000 cm-1的拉曼光谱如图3所示,在1 003 cm-1波段苯丙氨酸不易受到外界环境变化的影响、结构稳定,故可作为归一化因子[21]。由图3可知,各样品谱线发生不同程度的位移,说明超声波处理后大豆分离蛋白-磷脂复合体系中散射中心和化学键数目发生变化。拉曼光谱的频率和强度变化,反映出大豆分离蛋白-磷脂复合体系空间构象的变化。
2.3.1 大豆分离蛋白-磷脂复合体系中蛋白质主链结构变化
拉曼光谱中的特征峰可用于确定大豆分离蛋白-磷脂复合体系中蛋白质主链结构中酰胺Ⅰ带和酰胺Ⅲ带的构象,酰胺Ⅰ带主要包括C=O与C—N的伸张。酰胺Ⅰ带和Ⅲ带的特征峰位置如表3所示[22]。
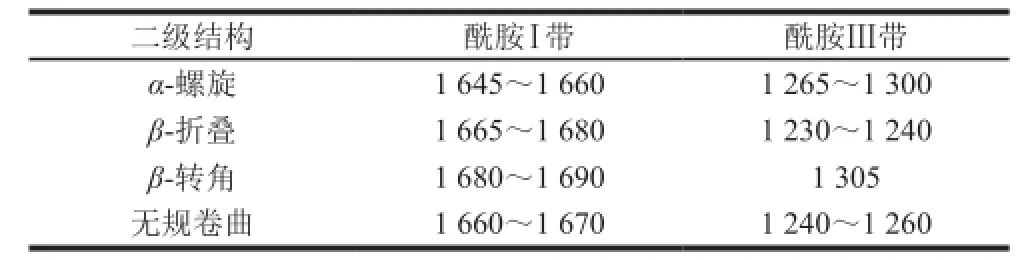
表3 大豆分离蛋白-磷脂复合体系中蛋白的二级结构拉曼光谱频率及归属Table 3 Raman frequencies and band assignments of secondary structures in soybean protein isolate-lecithin complex system cm-1
由表3可知,蛋白质酰胺Ⅰ带和酰胺Ⅲ带可用于表征蛋白质的主链结构,拉曼光谱图中1 665~1 675 cm-1处谱带强度大,表明复合体系酰胺Ⅰ带中主要存在β-折叠及无规卷曲结构。蛋白质的二级结构相对含量可通过蛋白质的酰胺Ⅰ带定量分析,结果见表4。超声波未处理组样品中的蛋白质二级结构组成为:α-螺旋结构24.75%、β-折叠结构25.40%、β-转角结构15.61%及无规卷曲结构34.54%。
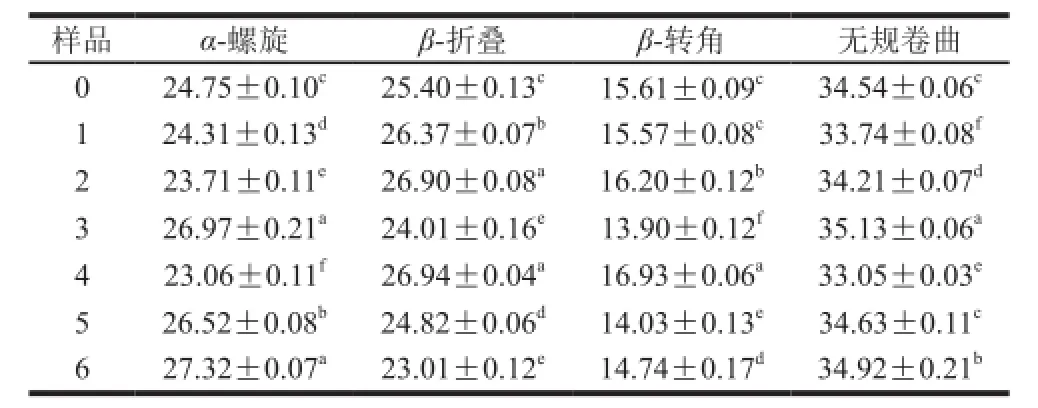
表4 大豆分离蛋白-磷脂复合体系中蛋白质的二级结构含量(n=3)Table4 Percentages of protein secondary structures in soybean protein isolate-lecithin composite system?under different?ultrasonic conditions (n= 3) %
由表4可知,低功率(150 W)时大豆分离蛋白-磷脂复合体系中α-螺旋及无规卷曲结构含量随着超声波作用时间的延长下降,β-折叠结构含量上升。当超声波作用功率为150 W时,超声波处理使α-螺旋含量由24.75%分别降低到24.31%(12 min)和23.06%(24 min)。这与Li Chen等[23]的研究一致,可能是大豆卵磷脂结合到了α-螺旋结构中的疏水性氨基酸区域,从而使蛋白质分子展开改变了大豆分离蛋白-磷脂复合体系中二级结构的组成。超声波的空化效应使蛋白质暴露疏水基团与磷脂发生疏水相互作用,进而降低大豆分离蛋白的α-螺旋结构,但高功率超声波作用下,大豆分离蛋白分子由于空穴效应运动加速,会发生一定程度的聚集,降低了磷脂与大豆分离蛋白的疏水相互作用。相对于未处理样品而言,经过450 W、12 min和24 min超声波处理时,大豆分离蛋白-磷脂复合体系样品中的α-螺旋结构含量呈现出明显的增加趋势,而β-折叠结构含量呈现出下降趋势。这与Hu Hao等[12]研究结果一致,由于蛋白质的二级结构取决于氨基酸序列和蛋白质分子与其他分子的交互作用,上述结果说明超声波破坏了这些作用,导致二级结构变化。相似地,Chandrapala等[9]也指出较高的超声功率(20 kHz,450 W)导致蛋白质表现出β-折叠结构向α-螺旋结构结构转移。450 W超声波条件下,当超声波作用时间延长至24 min时,α-螺旋结构含量变化相比于超声波处理12 min时更加明显。形成的凝胶结构无序且分布不均匀,凝胶立体感差。
2.3.2 大豆分离蛋白-磷脂复合体系中蛋白质侧链结构变化
2.3.2.1 色氨酸残基的变化
色氨酸在拉曼光谱图上会表现出多个拉曼光谱谱带,对于观察蛋白质微环境的极性及氢键变化规律有着重要作用。Li-Chan等[24]研究表明在波长760 cm-1附近区域,色氨酸残基可观察到“埋藏式”到“暴露式”的转变。在本研究中,经过超声波处理的大豆分离蛋白-磷脂复合体系拉曼光谱峰强度在760 cm-1附近区域有所增加(表5),表明色氨酸残基由“埋藏式”微环境转为“暴露式”展开形式[25]。
2.3.2.2 酪氨酸侧链环境的变化
超声波处理后磷脂与大豆分离蛋白的交互作用对蛋白质侧链结构的影响采用的相对强度衡量,在拉曼光谱图中830、850 cm-1附近是酪氨酸环吸收振动和面弯曲振动产生的特征振动峰。二者的相对强度能够鉴定酪氨酸组分“暴露”或“埋藏”的程度。酪氨酸残基数通常由公式(1)、(2)计算。
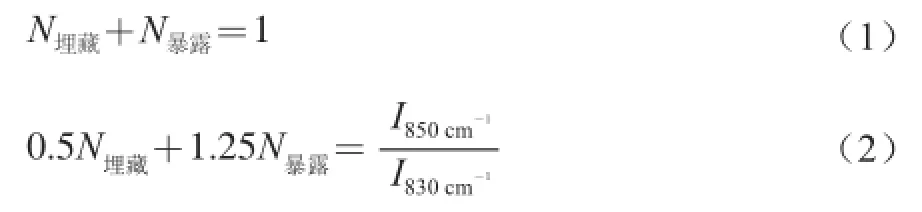
式中:N为“暴露”或“埋藏”的酪氨酸残基数;I为不同波数的拉曼光谱峰强度。
850 cm-1和830 cm-1是酪氨酸残基苯环的呼吸振动和面外弯曲倍频之间的费米共振,通过2 条谱线的强度比,推测酪氨酸是氢键的供体或是受体[22]。若比值为2.5,酪氨酸苯环上的羟基氧原子是强氢键受体;如果比值为1.25,此时酪氨酸苯环上的羟基氧原子为中强度氢键的供体或受体;如果比值为0.3,表明酪氨酸的苯环上的羟基氧原子是强氢键的供体。而在本研究中,酪氨酸振动峰谱带的比值范围为0.975~0.998,说明经过不同强度超声波处理后大豆分离蛋白-磷脂复合体系中的酪氨酸部分暴露到溶液的极性微环境中,且作为中性强度氢键的供体或受体。由表5可知,超声波处理显著影响酪氨酸残基在850 cm-1和830 cm-1的峰强比,未处理样品比值最低,超声波处理后样品的比值有不同程度的升高,表明酪氨酸苯环上的羟基氧原子由强氢键的供体向强氢键的受体趋势转变。
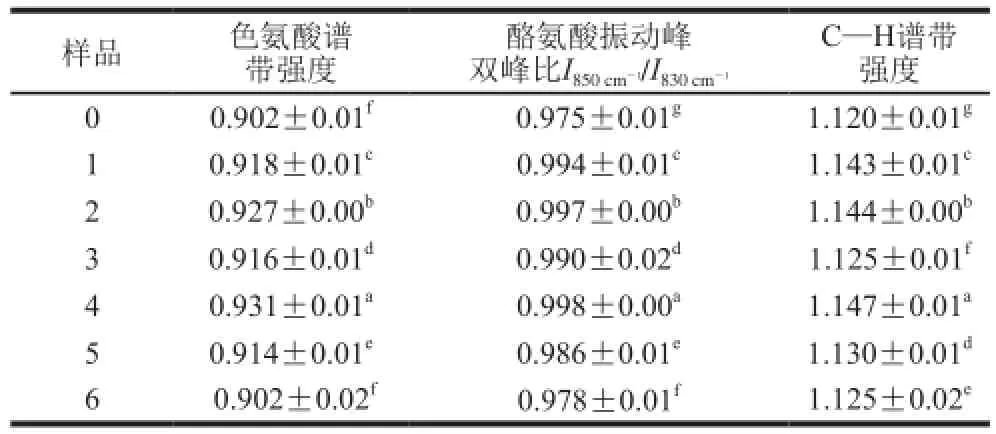
表5 不同超声波处理条件下大豆分离蛋白-磷脂复合体系中色氨酸、酪氨酸双峰比、C—H振动谱带强度Table 5 Normalized intensities of tryptophan band, tyrosyl doublet and C–H band in SPI-lecithin composite system under different ultrasonic conditions
2.3.2.3 脂肪族C—H键弯曲振动模式变化
由表5可知,CH2和CH3的弯曲振动在1 450 cm-1波数附近可以观察到,超声波作用12 min时拉曼光谱中1 450 cm-1的谱带强度随着超声波功率强度的增强呈先增加后下降趋势;超声波作用24 min后,样品4号谱带强度达到最大值,但随着超声波作用功率进一步增强,谱带强度反而下降。在1 450 cm-1处C—H键强度的增加说明样品中的疏水基团暴露到极性环境中[26]。当超声波功率进一步增加时,蛋白聚集导致疏水基团包埋并向微极性环境转变,谱带强度降低。与磷脂的疏水相互作用减弱,最终形成的凝胶样品弹性弱。
2.3.2.4 二硫键分析
二硫键的伸缩振动带在500~550 cm-1波长范围处,由图3可知,未处理的蛋白质-磷脂样品在525 cm-1和540 cm-1波数处出现拉曼峰,说明此时二硫键的主要构象为g-g-t和t-g-t构象。经过不同条件超声波处理后,g-g-t构象发生了不同程度地向t-g-t构象转变的现象,说明超声波处理对复合体系中的二硫键构象产生影响,形成的t-g-t构象利于样品凝胶的形成。
3 结 论
本实验选用不同条件的超声波处理大豆分离蛋白-磷脂复合体系。并采用拉曼光谱对体系功能性质与结构的构效关系进行分析可知,经过低(150 W)、中功率(300 W)超声波处理后,样品凝胶具有较为致密、均一的结构,G’较高。但高功率(450 W)超声波处理致使凝胶表面不均一,且随着时间的延长,凝胶表面出现孔洞,G’随之下降。
当超声波处理条件为150 W、24 min时,大豆分离蛋白-磷脂复合体系凝胶具有最致密的胶状结构。同时,流变学实验结果显示其G’最高。通过拉曼光谱的测定发现,大豆分离蛋白-磷脂复合体系构象上的变化是影响其凝胶性质和流变学性质的主要因素。
拉曼光谱显示低(150 W)、中功率(300 W)条件下样品中β-折叠含量上升,疏水基团暴露,二硫键的主要构象g-g-t构象发生了不同程度地向t-g-t构象转变的现象,大豆分离蛋白与磷脂间的疏水相互作用更显著。高超声波功率导致复合体系中蛋白质发生不溶性聚集,因此形成的凝胶结构无序、立体感差。
本实验采用从宏观到微观、先规律后结构的讨论模式,具体分析了大豆分离蛋白-磷脂复合体系功能性质随超声波条件变化的规律及构象变化对复合体系功能性质的影响。凝胶性质和流变学性质(温度扫描模式)是复合体系重要的功能性质,与疏水基团的暴露、蛋白质二级结构组成及二硫键构象的变化息息相关。因此采用拉曼光谱法分析复合体系构象的变化有利于解析超声波对复合体系构象功能性质的影响规律。实验结果为超声波技术运用于加工大豆分离蛋白-磷脂复合产品和其他蛋白与磷脂复合的食品加工过程提供了一定的理论依据。
[1] MA L, LI B, HAN F, et al. Evaluation of the chemical quality traits of soybean seeds, as related to sensory attributes of soymilk[J]. Food Chemistry, 2015, 173: 694-701. DOI:10.1016/ j.foodchem.2014.10.096.
[2] KATO A, OSAKA Y, MATSUDOMI N, et al. Changes in the emulsifying and foaming properties of proteins during heat denaturation[J]. Agricultural and Biological Chemistry, 1983, 47(1): 33-37. DOI:10.1080/00021369.1983.10865579.
[3] SCURIATTI M, TOMAS M, WANGNER J. Influence of soybean protein isolates-phosphatidycholine interaction on the stability on oilin-water emulsions[J]. Journal of the American Oil Chemists’ Society, 2003, 80(11): 1093-1100. DOI:10.1007/s11746-003-0825-7.
[4] MANTOVANI R A, CAVALLIERI Â L F, NETTO F M, et al. Stability and in vitro digestibility of emulsions containing lecithin and whey proteins[J]. Food & Function, 2013, 4(9): 1322-1331. DOI:10.1039/C3FO60156K.
[5] YAMAMOTO Y, ARAKI M. Effects of lecithin addition in oil or water phase on the stability of emulsions made with whey proteins[J]. Bioscience, Biotechnology and Biochemistry, 1997, 61(11): 1791-1795. DOI:10.1271/bbb.61.1791.
[6] McCLEMENTS D J. Emulsion design to improve the delivery of functional lipophilic components[J]. Annual Review of Food Science and Technology, 2010, 1(1): 241-269. DOI:10.1146/annurev. food.080708.100722.
[7] WANG X S, TANG C H, LI B S, et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4): 560-567. DOI:10.1016/j.foodhyd.2007.01.027.
[8] BECKWITH A C. Interaction of phosphatidylcholine vesicles with soybean 7S and 11S globulin proteins[J]. Journal of Agricultural and Food Chemistry, 1984, 32(6): 1397-1402. DOI:10.1021/jf00126a045.
[9] CHANDRAPALA J, OLIVER C, KENTISH S, et al. Ultrasonics in food processing[J]. Ultrasonics Sonochemistry, 2012, 19(5): 975-983. DOI:10.1016/j.tifs.2010.04.003.
[10] NIEUWENHUYZEN W, SZUHAJ B F. Effects of lecithins and proteins on the stability of emulsions[J]. Lipid, 1998, 100(7): 282-291. DOI:10.1002/(SICI)1521-4133(199807)100:7<282:AIDLIPI282>3.0.CO;2-W.
[11] WOLF W J. Soybean proteins. their functional, chemical, and physical properties[J]. Journal of Agricultural and Food Chemistry, 1970, 18(6): 969-976. DOI:10.1021/jf60172a025.
[12] HU H, WU J, LI-CHAN E C Y, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655. DOI:10.1016/j.foodhyd.2012.08.001.
[13] TANG C H, WANG X Y, YANG X Q, et al. Formation of soluble aggregates from insoluble commercial soy protein isolate by means of ultrasonic treatment and their gelling properties[J]. Journal of Food Engineering, 2009, 92(4): 432-437. DOI:10.1016/ j.jfoodeng.2008.12.017.
[14] 孙哲浩. 大豆分离蛋白与卡拉胶共凝胶体流变学特性的研究[J]. 食品工业科技, 2000, 21(6): 87-92.
[15] HERRERO A M, JIMENEZ F, CARMONA P, et al. Elucidation of structural changes in soy protein isolate upon heating by Raman spectroscopy[J]. International Journal of Food Science & Technology, 2009, 44(4): 711-717. DOI:10.1111/j.1365-2621.2008.01880.x.
[16] ZUNIGA R N, KULOZIK U, AGUILERA J M. Ultrasonic generation of aerated gelatin gels stabilized by whey protein beta-lactoglobulin[J]. Food Hydrocolloids, 2011, 94(5): 958-967. DOI:10.1016/ j.foodhyd.2010.09.010.
[17] HU H, WU J H, CHAN E C, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655. DOI:10.1016/ j.foodhyd.2012.08.001.
[18] 朱建华, 杨晓泉. 超声处理对大豆分离蛋白流变学性质的影响[J].食品科学, 2005, 26(12): 52-57.
[19] STATHOPULOS P B, SCHOLZ G A, HWANG Y M, et al. Sonication of proteins causes formation of aggregates that resemble amyloid[J]. Protein Science, 2004, 13(11): 3017-3027. DOI:10.1016/ j.foodhyd.2012.05.011.
[20] RINGGENBERG E, ALEXANDER M, CORREDIG M. Effect of concentration and incubation temperature on the acid induced aggregation of soymilk[J]. Food Hydrocolloids, 2013, 30(1): 463-469. DOI:10.1110/ps.04831804.
[21] MOON S Y, LI-CHAN E C Y. Assessment of added ingredient effect on interaction of simulated beef flavour and soy protein isolate by gas chromatography, spectroscopy and descriptive sensory analysis[J]. Food Research International, 2007, 40(10): 1227-1238. DOI:10.1016/ j.foodres.2007.08.002.
[22] OVERMAN S A, THOMAS Jr G J. Raman spectroscopy of the filamentous virus Ff (fd, f1, M13): structural interpretation for coat protein aromatics[J]. Biochemistry, 1995, 34(16): 5440-5451. DOI:10.1021/bi00016a015.
[23] LI C, HUANG X, PENG Q, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics Sonochemistry, 2014, 21(5): 1722-1727. DOI:10.1016/j.ultsonch.2014.03.018.
[24] LI-CHAN E C Y. The applications of Raman spectroscopy in food science[J]. Trends in Food Science & Technology, 1996, 7(11): 361-370. DOI:10.1016/S0924-2244(96)10037-6.
[25] WONG H W, CHOI S M, PHILLIPS D L, et al. Raman spectroscopic study of deamidated food proteins[J]. Food Chemistry, 2009, 113(2): 363-370. DOI:10.1016/j.foodchem.2008.09.027.
[26] LIPPERT J, TYMINSKI D, DESMEULES P. Determination of the secondary structure of proteins by laser Raman spectroscopy[J]. Journal of the American Chemical Society, 1976, 98(22): 7075-7080. DOI:10.1021/ja00438a057.
Effect of Ultrasound on Rheological and Raman Spectroscopy Properties of Soybean Protein Isolate-Phospholipid Composite System
BI Shuang, SUI Xiaonan, HAN Tianxiang, LI Yang, WANG Zhongjiang, QI Baokun, JIANG Lianzhou*
(School of Food Science, Northeast Agricultural University, Harbin 150030, China)
The aim of this study was to compare the effects of ultrasonic treatments at three different power levels (150, 300 and 450 W) for different durations (12 and 24 min) on the structural and functional properties of soybean protein isolate (SPI)-phospholipid composite system. Scanning electron microscope observation and rheology experiments showed that ultrasonic treatments at low and medium powers were suitable to generate compact and uniform gel with high elastic modulus. When the ultrasonic condition remained at 300 W for 24 min, the sample showed the best gel properties. It was confirmed that gel properties were influenced by the conformation of soybean protein-phospholipid composite system. Raman spectra showed that ultrasonic treatment could change the secondary structure of SPI. The microenvironment of tryptophan and tyrosine residues was changed at the same time. The interactions between SPI and lecithin easily occurred because of the exposure of hydrophobic groups. Low and medium power ultrasonication had a stronger effect on the composite system. Insoluble protein aggregates occurred when ultrasonic power increased to 450 W, and the functional properties of the composite system decreased because the interactions between soybean protein isolate and lecithin became weaker.
ultrasonic treatment; soybean protein isolate-phospholipid composite system; fluorescence spectroscopy; Raman spectroscopy; spatial structure
10.7506/spkx1002-6630-201621011
TS214.9
A
1002-6630(2016)21-0061-06
毕爽, 隋晓楠, 韩天翔, 等. 超声波作用于大豆分离蛋白-磷脂复合体系的流变性和拉曼光谱变化[J]. 食品科学, 2016, 37(21): 61-66. DOI:10.7506/spkx1002-6630-201621011. http://www.spkx.net.cn
BI Shuang, SUI Xiaonan, HAN Tianxiang, et al. Effect of ultrasound on rheological and Raman spectroscopy properties of soybean protein isolate-phospholipid composite system[J]. Food Science, 2016, 37(21): 61-66. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621011. http://www.spkx.net.cn
2016-02-01
“十二五”国家科技支撑计划项目(2014BAD22B00);国家高技术研究发展计划(863计划)项目(2013AA102104);黑龙江省自然科学基金重点项目(ZD201302);高等学校博士生学科点专项科研基金博导类资助课题(20132325110013)
毕爽(1992—),女,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:13163436989@163.com
*通信作者:江连洲(1960—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:jlzname@163.com

