海参皂苷Echinoside A通过uPA信号通路抑制高转移95D细胞转移
赵 芹,林 栋,刘海梅
(1.鲁东大学食品工程学院,山东 烟台 264025;2.滨州医学院药学院,山东 烟台 264003)
海参皂苷Echinoside A通过uPA信号通路抑制高转移95D细胞转移
赵 芹1,林 栋2,刘海梅1
(1.鲁东大学食品工程学院,山东 烟台 264025;2.滨州医学院药学院,山东 烟台 264003)
研究海参皂苷Echinoside A对高转移人肺巨细胞癌95D细胞增殖和转移的影响及其分子机制。采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐法检测Echinoside A对95D细胞生长的影响;采用Transwell实验、黏附实验评价Echinoside A抗95D细胞转移活性;采用鸡胚尿囊膜(chicken chorioallantoic membrane,CAM)实验评价Echinoside A抗血管新生活性;采用逆转录-聚合酶链反应和蛋白质印迹法检测95D细胞转移相关基因和蛋白的表达。结果表明,Echinoside A能显著降低95D细胞增殖(P<0.01)、侵袭(P<0.01)、迁移(P<0.01)以及黏附能力(P<0.01);还能显著抑制CAM上的血管新生。Echinoside A能显著降低尿激酶型纤溶酶原激活剂(urokinase plasminogen activator,uPA)、基质金属蛋白酶(matrix metalloproteinases,MMP)-2、MMP-9 mRNA的表达,显著上调金属蛋白酶组织抑制剂(tissue inhibitor of matrix metalloproteinases,TIMP)-1、TIMP-2 mRNA的表达,同时在基因和蛋白水平显著下调血管内皮生长因子的表达。提示Echinoside A可通过调控uPA信号通路,保护细胞外基质结构,从而抑制95D细胞转移。
海参皂苷;95D细胞;肿瘤;转移;血管新生;信号通路
肿瘤的侵袭和转移是恶性肿瘤最主要的生物学特征,是导致肿瘤复发以及患者临床死亡的主要原因。肿瘤转移过程主要包括细胞外基质(extracellular matrix,ECM)和基底膜(basement membrane,BM)的降解,局部浸润的产生,肿瘤细胞与血管内皮细胞的黏附,通过血管和淋巴管转移到远端器官,然后形成新的转移灶。当肿瘤恶性增殖超过2 mm3之后,其生长则依赖于肿瘤组织中的血管新生[1]。新生血管的形成能向肿瘤组织及时输送营养及排出废物,加速其自身的分裂与增殖,同时也为肿瘤细胞向周围组织进一步转移提供了通路[2]。目前,针对肿瘤转移过程中抗癌细胞迁移、黏附、抗ECM和BM降解和抗肿瘤血管生成等仍是抑制肿瘤转移研究的关键内容。
海参皂苷是海参特有的一类三萜皂苷,也是海参中重要的生物活性成分之一。大量研究发现,其具有抑菌[3]、调节胆固醇代谢[4]、降血压[5]、改善高尿酸血症[6]和促进造血[7]等生理活性,其显著的抗肿瘤活性更是引起广泛的关注[8-9]。革皮氏海参(Pearsonothuria graeffei)食用价值低,但是皂苷含量高达3.514%。Echinoside A是革皮氏海参皂苷的主要成分,约占总量的65%左右,已被证实具有显著的体内体外抑制肿瘤生长的活性[10]。前期研究发现革皮氏海参皂苷ds-Echinoside A具有显著的抗肿瘤转移活性,可通过抑制核转录因子-κB(nuclear factor-kappa B,NF-κB)信号通路,下调基质金属蛋白酶(matrix metalloproteinases,MMP)-9和血管内皮生长因子(vascular endothelial growthfactor,VEGF)的表达,从而抑制肝癌细胞HepG2转移[11],但目前对Echinoside A抗肿瘤转移的活性及作用机理尚缺乏系统的研究。本实验选用高转移细胞株95D为研究对象,深入研究Echinoside A对95D细胞迁移、黏附、侵袭和血管新生各环节的影响和作用机理,为挖掘海参皂苷的药理功效,提高低值海参的附加值提供理论参考。
1 材料与方法
1.1 材料与试剂
海参皂苷单体Echinoside A,以革皮氏海参为原料,采用高速逆流色谱法获得,纯度为95.5%,其分子式为C54H87O26SNa,相对分子质量为1 206,化学结构式见图1。
人肺巨细胞癌95D、人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC) 中国科学院上海生命科学研究院细胞资源中心;RPMI-1640培养基、F-12K培养基、胎牛血清(fetal calf serum ,FBS)、新生牛血清 美国Gibco公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 美国Amresco公司;Matrigel基质胶 美国BD公司;Trizol试剂美国Invitrogen公司;DNA Marker DL2000、Taq DNA聚合酶 大连TaKaRa生物工程有限公司;M-MLV反转录酶 美国Promega公司;引物和随机引物 上海生工生物技术有限公司;GAPDH多克隆抗体、VEGF抗体、二抗 美国Santa Cruz公司;其他试剂均为国产分析纯。
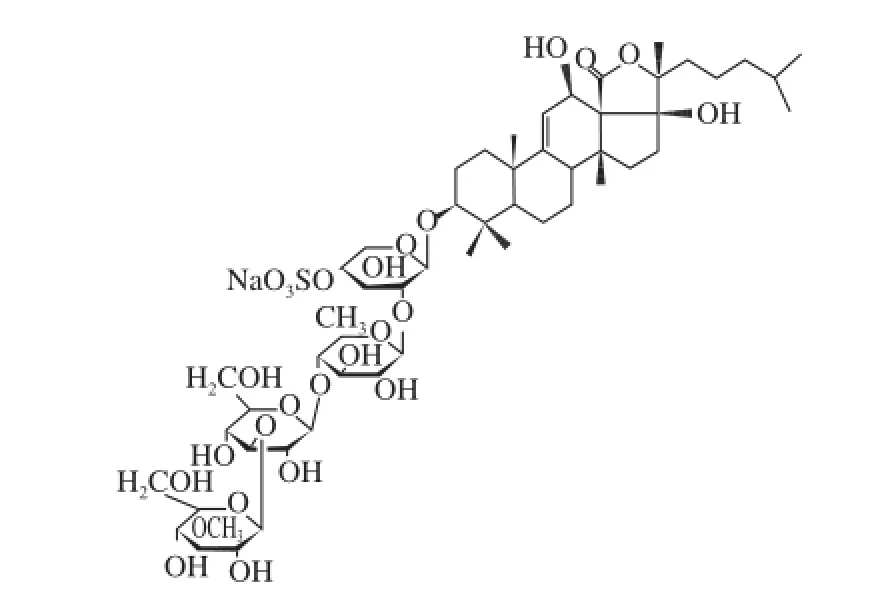
图1 Echinoside A的化学结构Fig. 1 Chemical structure of Echinoside A
1.2 仪器与设备
Transwell小室 美国Corning公司;CKX41型倒置显微镜 日本Olympus公司;BJ5060UV型CO2培养箱德国Heraeus公司;680型酶标仪 美国Bio-Rad公司;TC-96 Life Pro基因扩增仪 杭州博日科技有限公司;JS-780全自动凝胶成像分析仪 上海培清科技有限公司;DYCP-40C型转膜电泳仪、WD-9405A型脱色摇床北京六一仪器厂。
1.3 方法
1.3.1 细胞培养
95D细胞培养于含10%新生牛血清的RPMI-1640培养基中;HUVEC细胞培养于含10%胎牛血清的F-12K培养基中,其中均含2%青/链霉素。2 种细胞均置于37 ℃、5% CO2饱和湿度的培养箱中培养,细胞长成单层融合状态后,以0.25%胰蛋白酶消化传代。选择对数生长期细胞进行实验。
1.3.2 MTT法检测Echinoside A对95D细胞增殖活性的影响
95D细胞以6×104个/mL的浓度接种于96 孔板内,每孔100 μL。24 h后吸弃培养基,分别加入200 μL含不同浓度Echinoside A(0.00、0.42、0.83、1.24、1.66 μmol/L)的完全培养基,每组4 个复孔,分别培养6、12、24 h。采用MTT法测定OD570nm值,拟合曲线求出半数抑制浓度(half maximal inhibitory concentration,IC50)。
1.3.3 Transwell小室法检测Echinoside A对95D细胞侵袭和迁移的影响
95D细胞以无血清RPMI-1640培养基调整细胞密度至5×105个/mL。侵袭实验加入经500 μg/mL Matrigel包被Transwell小室上室中,模拟基底膜;迁移实验加入未经包被的Transwell小室上室中,每孔100 μL。各组分别加入150 μL含不同浓度Echinoside A无血清培养基,使Echinoside A终浓度分别为0.00、0.20、0.40 μmol/L。下室加入750 μL含20% FBS的完全培养基,于37 ℃孵育24 h后,取出Transwell小室,用棉签擦去上层膜面上的细胞,穿过基底膜的细胞黏附于膜下层,用2.5%戊二醛固定30 min后,以0.1%结晶紫染色15 min。每孔随机取5 个视野,计数视野的细胞数,求平均值,按公式(1)计算侵袭率或迁移率。

1.3.4 黏附实验检测Echinoside A对95D细胞黏附能力的影响
1.3.4.1 同基质间黏附的影响
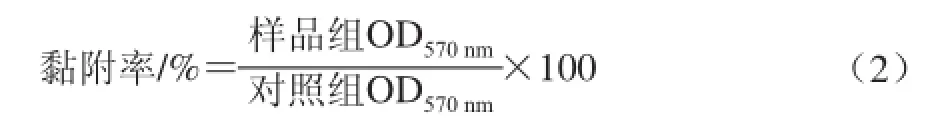
95D细胞以1.5×104个/mL的浓度接种于24 孔板,每孔1 mL,贴壁24 h。吸弃培养基,加入含不同浓度Echinoside A(0.00、0.20、0.40 μmol/L)的完全培养基,继续培养12 h和24 h后收集细胞。以无血清培养基调整细胞密度为2×105个/mL,加入经50 μg/mL Matrigel包被的96 孔板中,每孔100 μL,每组4 个复孔。置于培养箱孵育90 min后,用PBS缓冲液洗去未黏着的细胞。采用MTT法测定光密度值OD570nm,按公式(2)计算肿瘤细胞与基质间黏附率。
1.3.4.2 同HUVEC细胞间黏附的影响
HUVEC细胞以2×105个/mL接种于96 孔板中,每孔100 μL,贴壁24 h。吸弃培养基,PBS洗涤2 次后加入2×105个/mL的95D细胞,每孔100 μL。95D细胞预先经不同浓度Echinoside A(0.00、0.20、0.40 μmol/L)预处理12、24 h。置于培养箱孵育90 min后,用磷酸盐缓冲液洗去未黏着的细胞。采用MTT法测定OD570nm值,按公式(2)计算黏附率。
1.3.5 逆转录-聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)法检测Echinoside A对95D细胞转移相关基因表达的影响
95D细胞转移相关基因:编码MMP-2、MMP-9、金属蛋白酶组织抑制剂(tissue inhibitor of matrix metalloproteinases,TIMP)-1、TIMP-2、尿激酶型纤溶酶原激活剂(urokinase plasminogen activato,uPA)和VEGF的基因的表达采用RT-PCR法检测。95D细胞以每孔5×105个/孔接种于6 孔板中,每孔2 mL,贴壁24 h。吸弃培养基,加入含不同浓度Echinoside A(0.00、0.20、0.40 μmol/L)的完全培养基,继续培养24 h。收集细胞,加入Trizol提取总RNA,进行PCR反应,检测各组细胞转移相关基因的表达。引物序列、退火温度、循环数和产物大小见表1。PCR反应程序为:94 ℃预变性5 min;94 ℃变性45 s;55 ℃退火30 s;72 ℃延伸45 s;最后72 ℃延伸10 min。扩增产物电泳后,凝胶成像系统拍照,以目的基因与β-actin扩增条带的灰度比值代表基因相对表达水平。
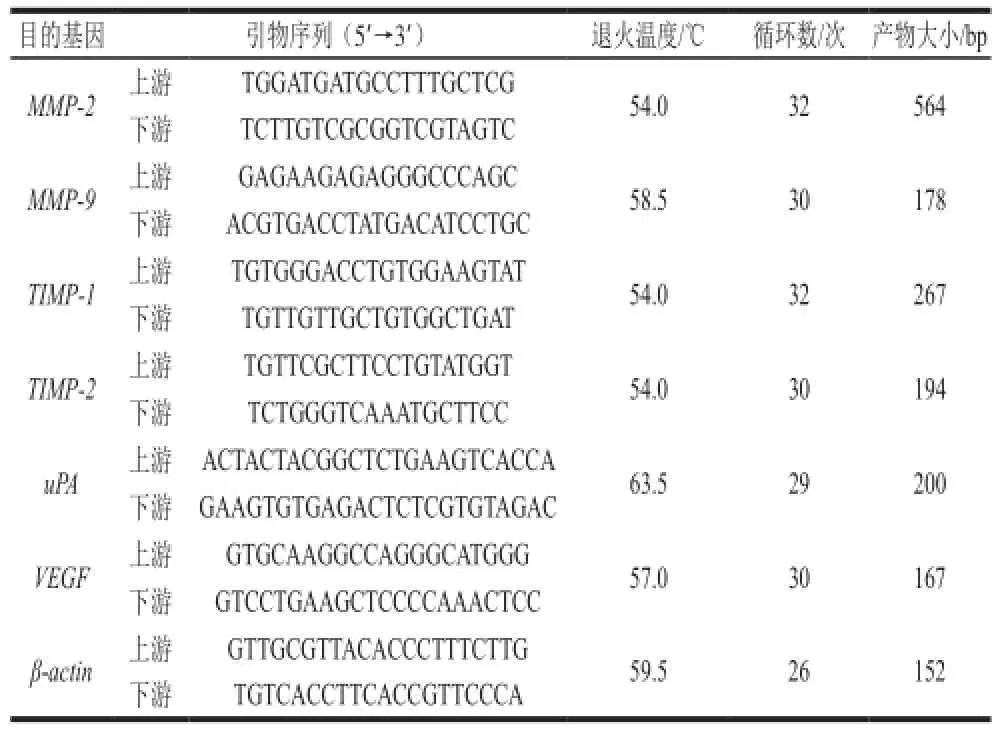
表1 引物序列、退火温度、循环数和产物长度Table 1 Primer sequences, annealing temperatures, cycles and length of products
1.3.6 鸡胚尿囊膜(chicken chorioallantoic membrane,CAM)法检测Echinoside A对血管生成的影响
参照文献[12]方法,挑选新鲜种蛋,置于37 ℃培养箱中孵化。于第9天在无菌条件下暴露出CAM。取直径1 cm的圆滤纸片置于CAM上,然后加入20 μL不同浓度的Echinoside A(0.00、11.32、22.64 μmol/L)。继续孵育24 h后,以2.5%戊二醛固定尿囊膜,剪下加样区尿囊膜,于解剖镜下观察并拍照。
1.3.7 蛋白质印迹法检测Echinoside A对95D细胞VEGF蛋白表达的影响
细胞处理方法同1.3.5节,收集细胞,参照文献[10]制备蛋白、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转膜,用脱脂奶粉封闭。分别加入兔抗人GAPDH多克隆抗体(体积比1∶1 000稀释)和VEGF(1∶200稀释),于4 ℃孵育过夜。以TBST洗涤3 次后加入山羊抗兔二抗(体积比1∶2 000稀释),室温孵育1 h。采用化学发光试剂显影曝光后采集图像,测定条带的灰度值,以VEGF与GADPH灰度比值代表VEGF蛋白的相对表达量。实验重复3 次。
1.4 数据统计分析
采用SPSS 17.0软件进行单因素方差分析,同时进行最小显著性差异分析和Student-Newman-Keuls组间比较,以P<0.05为差异显著。实验结果用±s表示。
2 结果与分析
2.1 Echinoside A对95D细胞增殖活性的影响
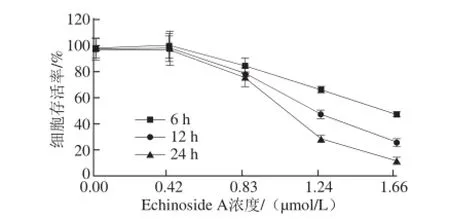
图2 Echinoside A对95D细胞增殖活性的影响Fig. 2 Effect of Echinoside A on the proliferation activity of 95D cells
由图2可知,Echinoside A作用于95D细胞以后,显著抑制了细胞的增殖,且呈现显著的时间-效应和剂量-效应关系。其中在12 h和24 h,Echinoside A对95D细胞的IC50值分别为1.29 μmol/L和1.05 μmol/L。尹一恒[13]研究了棕环海参(Holothuria fuscocinerea Jaeger)皂苷fuscocineroside A对人源性胶质母细胞瘤细胞U251增殖活性的影响。结果显示,fuscocineroside A作用U251细胞48 h的IC50值为7.80 μmol/L。张佳佳等[14]研究了黄疣海参皂苷的体外抗肿瘤活性,结果发现,hillaside A和hillaside B两种皂苷单体对受试的10 株肿瘤细胞均显示很强的细胞毒活性,IC50值为0.15~3.20 mg/L。由此可见,Echinoside A对肿瘤细胞的IC50值均远小于其他海参皂苷,其抑制肿瘤增殖的活性效果显著。
2.2 Echinoside A对95D细胞侵袭能力的影响
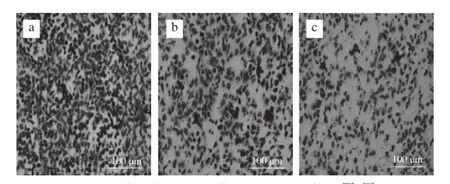
图3 Echinoside A对95D细胞侵袭率的影响Fig. 3 Effect of Echinoside A on the invasion rate of 95D cells
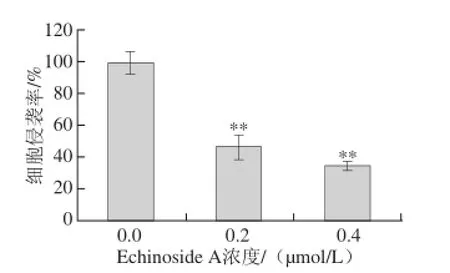
图4 Echinoside A对95D细胞侵袭率的量化图Fig. 4 Quantitative analysis of the invasion rate of Echinoside A on 95D cells
Matrigel可在Transwell小室膜上重组,形成与天然ECM类似的结构[15]。肿瘤细胞对ECM的降解为其突破BM并进一步迁移和浸润基质的创造了必要条件。本实验以细胞穿过重组ECM的数目表示其恶性侵袭能力,结果见图3。经20%胎牛血清诱导,95D细胞可显著降解Matrigel,大量细胞穿过重组基底膜,24 h后Transwell小室底部几乎被细胞铺满。经Echinoside A处理后,穿越重组基底膜到达Transwell小室底部的细胞数目显著减少,经量化分析后(图4),低、高剂量组95D细胞侵袭率分别下降了53.5%和65.8%(P<0.01),表明Echinoside A可显著降低95D细胞的侵袭能力。
2.3 Echinoside A对95D细胞迁移能力的影响
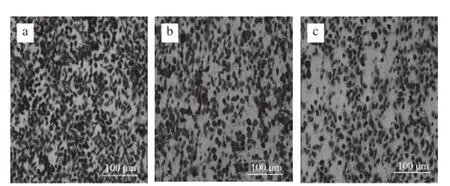
图5 Echinoside A对95D细胞迁移率的影响Fig. 5 Effect of Echinoside A on the migration rate of 95D cells
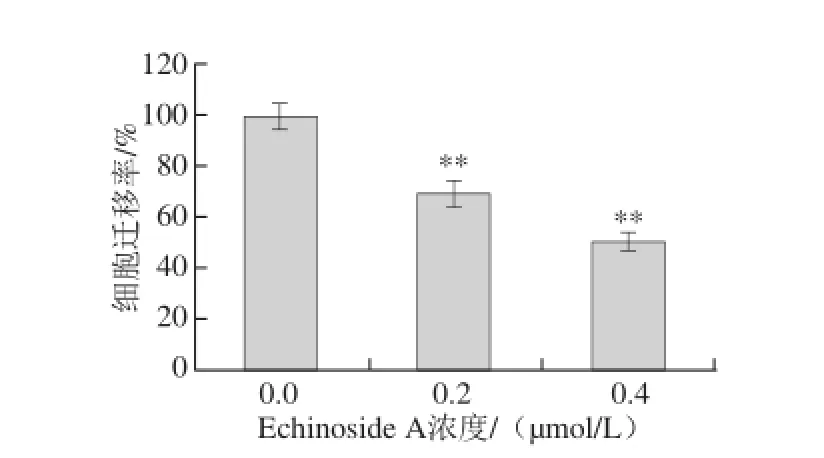
图6 Echinoside A对95D细胞迁移率的量化图Fig. 6 Quantitative analysis of the migration rate of Echinoside A on 95D cells
迁移运动是恶性肿瘤最基本的生物学特征,且与肿瘤的转移潜能呈正相关。由图5可知,经Echinoside A作用后,95D细胞的穿过Transwell小室膜的细胞数目显著减少,即样品组95D细胞迁移能力显著降低。同对照组相比,Echinoside A低、高剂量组迁移率分别降低了30.3%和49.3%(P<0.01),呈现显著的剂量依赖效应(图6),表明Echinoside A可显著降低肿瘤细胞的迁移能力。
2.4 Echinoside A对95D细胞黏附能力的影响
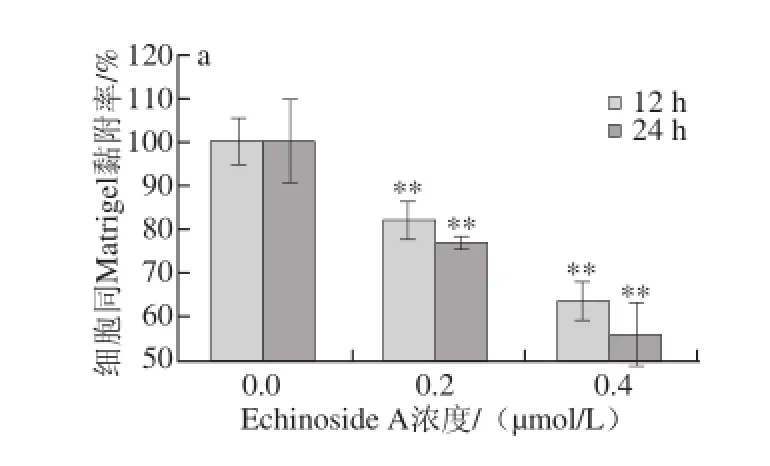
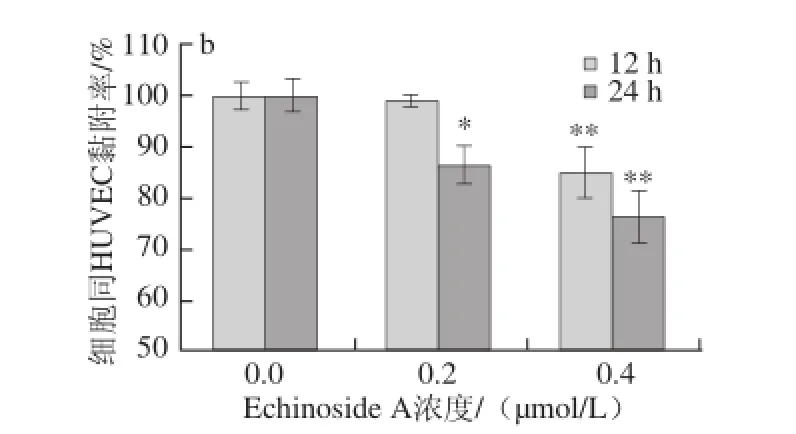
图7 Echinoside A对95D细胞同Matrigel(a)和HUVEC(b)黏附率的影响Fig. 7 Effect of Echinoside A on the adhesion rate of 95D cells
肿瘤细胞的黏附作用既包括与基质间黏附,也包括与血管内皮细胞之间的黏附,在肿瘤细胞从原发灶脱落,与血管和淋巴管基底膜黏附,侵袭到远处器官中都起着极为重要的作用。首先检测了Echinoside A对95D细胞同基质的黏附能力。由图7a可知,经Echinoside A处理后,各剂量组细胞同基质的黏附率均显著降低,且呈现明显的时间-效应和剂量-效应关系。其中,作用24 h后,Echinoside A低、高剂量组95D细胞同基质的黏附率分别下降了36.23%和44.26%(P<0.01)。同时检测Echinoside A对95D细胞和血管内皮细胞间的黏附能力发现,与对照组相比,Echinoside A也显著抑制了95D细胞同HUVEC细胞间的黏附率,且呈现显著的时间-效应和剂量-效应关系(图7b)。其中,作用24 h后,Echinoside A低、高剂量组95D细胞同HUVEC的黏附率分别下降了15.18%和23.58%(P<0.01)。综上可见,Echinoside A可同时抑制高转移肿瘤细胞同基质和血管内皮细胞的黏附。
2.5 Echinoside A对95D细胞转移相关基因mRNA表达的影响
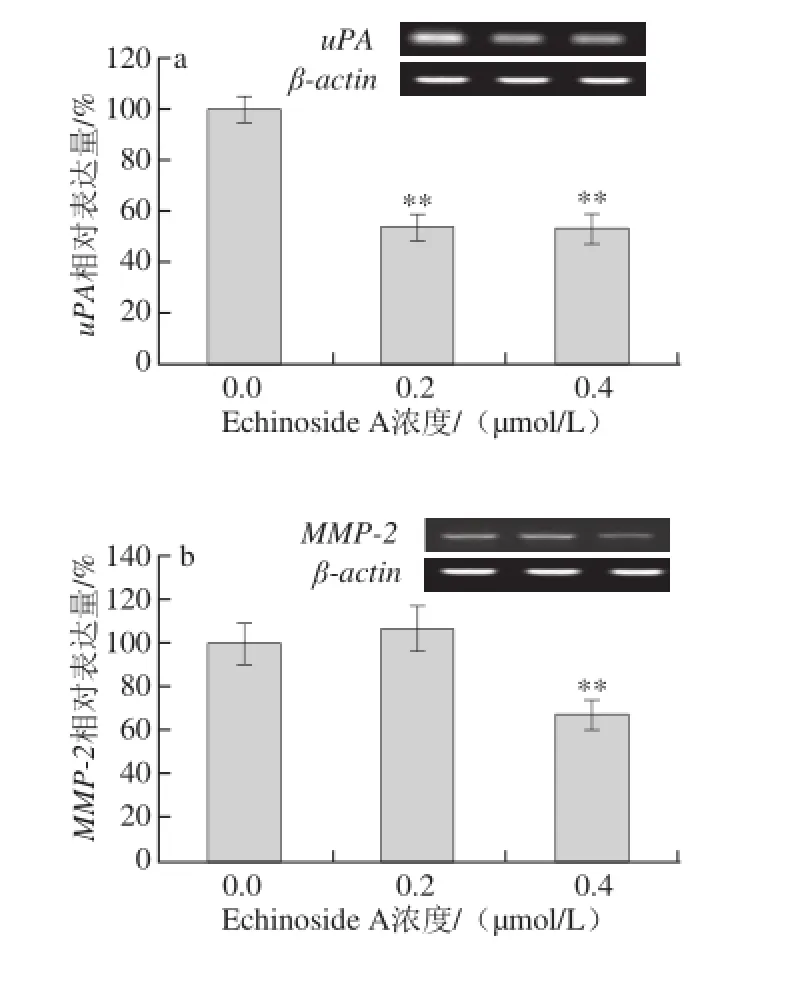
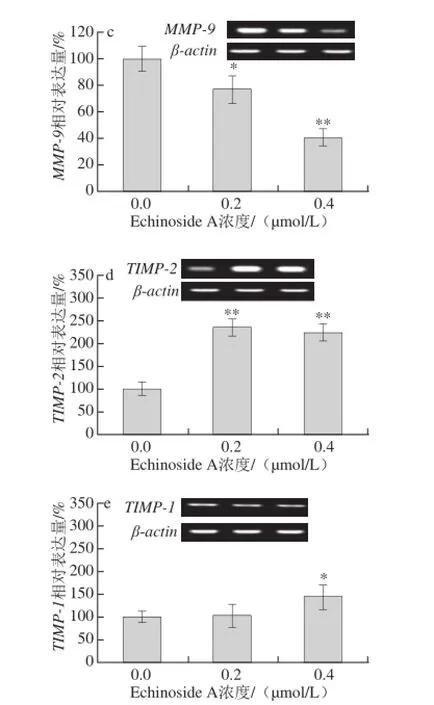
图8 Echinoside A对95D细胞转移相关基因表达的影响Fig. 8 Effect of Echinoside A on the mRNA expression of metastasis-related genes in 95D cells
uPA属于丝氨酸蛋白酶类,是人体纤溶系统的重要组成成员。uPA可激活纤溶酶原生成纤溶酶,促进细胞外基质的降解,在癌细胞的迁移和浸润性生长过程中起着关键性的作用[16-17]。大量研究表明,uPA广泛存在于多种肿瘤组织中,且其表达水平均高于正常组织[18-19]。研究发现高转移肺癌细胞株95D中uPA呈高表达,且其uPA表达水平与侵袭转移能力呈正相关[20]。由图8a可知,同正常对照组相比,Echinoside A可显著下调95D细胞uPA mRNA的表达,其中高剂量组表达量下降了47.1%(P<0.01)。
经uPA激活的纤溶酶除了直接降解ECM蛋白,还可以激活MMPs的前体,活化后MMPs可进一步水解ECM,从而帮助肿瘤细胞向周围组织浸润[21]。MMPs是一组锌依赖性蛋白水解酶,可特异性降解ECM形成的物理屏障,重塑细胞间黏附力,参与肿瘤的免疫等过程,与肿瘤生长和转移密切相关[22]。TIMPs是MMPs的特异性抑制剂,能特异性与MMPs 1∶1结合,封闭其催化活性。因此MMPs与TIMPs间的比例关系决定了MMPs在肿瘤转移中所起的作用。其中,TIMP-2可特异性抑制MMP-2的活性,而TIMP-1则对MMP-9有较高的选择抑制作用[23]。Zhao Qin等[11]研究发现海参皂苷Ds-echinoside A可显著下调MMP-9的表达,同时提高TIMP-1的表达。与其报道类似,Echinoside A可显著降低MMP-2和MMP-9的mRNA的表达(图8b、c),同时显著上调TIMP-2和TIMP-1的mRNA的表达(图8d、e)。其中,与对照组细胞相比,Echinoside A高剂量组细胞MMP-2/TIMP-2和MMP-9/TIMP-1比值分别下降到29.7%(P<0.05)和28.1%(P<0.01)。
综上可知,Echinoside A可通过抑制uPA活性,一方面抑制肿瘤细胞对ECM的降解,另一方面在转录水平下调MMP-2和MMP-9的mRNA的表达,上调TIMP-1和TIMP-2的mRNA的表达,进而抑制肿瘤细胞的浸润与转移。
2.6 Echinoside A对鸡胚绒毛尿囊膜血管生长的影响
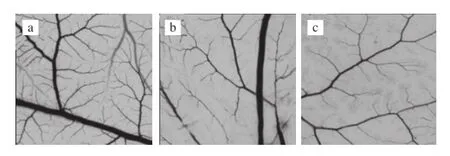
图9 Echinoside A对CAM血管生长情况的影响(×10)Fig. 9 Effect of Echinoside A on the angiogenesis of CAM (×10)
鸡胚绒毛尿囊膜实验因其操作简便、易于观察等优点,已成为研究血管生成的理想体内模型。其中,在鸡胚发育的5~10 d内,尿囊膜新生毛细血管不断出现,此阶段是用来观察血管形成的最佳时期。由图9a可知,鸡胚发育的第10天,正常对照组的CAM上的血管丰富,长势旺盛,血管网络分支多且清晰可见。经Echinoside A处理后,毛细血管的数目较正常对照组显著减少,颜色变浅,结构模糊,且呈现显著的剂量-效应关系(图9b、c),表明Echinoside A具有抑制血管新生的活性。
2.7 Echinoside A对95D细胞VEGF表达的影响
VEGF是公认的调节血管生成的最重要的细胞因子,它可以介导内皮细胞芽生和迁移;还可以诱导内皮细胞分泌蛋白酶类降解ECM,促进肿瘤细胞的侵袭和转移;诱导内皮细胞分化及促进血管网络形成等[24]。分别采用RT-PCR和蛋白质印迹法检测了Echinoside A对VEGF mRNA和蛋白表达的影响。由图10a可知,不同剂量的Echinoside A均能显著下调95D细胞VEGF mRNA的表达。与正常组细胞相比,低、高剂量组95D细胞VEGF mRNA的相对表达量平均下降了45.6%(P<0.01)。同时,Echinoside A也可在蛋白水平显著下调VEGF的表达,其中、高剂量组细胞VEGF的蛋白相对表达量比正常对照组降低了35.8%(P<0.01),见图10b。有研究发现,uPA与其受体结合后可激活纤溶酶,而纤溶酶可释放或激活大量储存于ECM的MMPs前体和VEGF,进而加速ECM和BM降解,促进血管内皮细胞增殖及肿瘤新生血管形成[25]。另外,Bueno等[21]发现uPA还可直接激活MMPs和VEGF,从而引发纤溶机制的瀑布式级联反应、促进血管新生,从而直接参与肿瘤的转移过程。以上结果提示,Echinoside A通过抑制uPA表达,进而在转录和翻译水平下调VEGF的表达,抑制肿瘤的转移和血管新生。
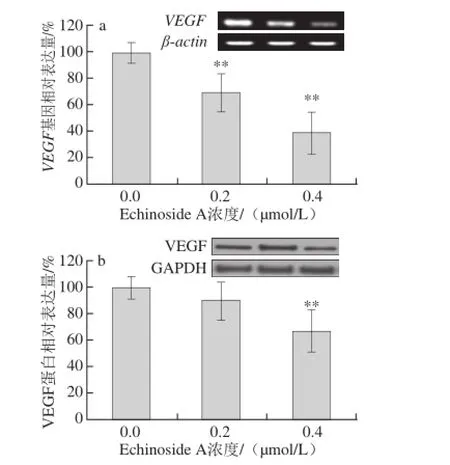
图10 Echinoside A对95D细胞VEGF 基因(a)和VEGF蛋白(b)表达的影响Fig. 10 Effect of Echinoside A on VEGF gene and VEGF protein expression in 95D cells
3 结 论
本研究表明,Echinoside A可以显著抑制高转移95D细胞的增殖,且呈现显著的时间-效应和剂量-效应关系。Echinoside A对95D细胞的IC50值在12 h和24 h分别为0.64 μmol/L和0.38 μmol/L,同其他研究对比发现,其IC50值远小于棕环海参和黄疣海参皂苷,抑制肿瘤增殖的活性效果显著。
本研究采用Transwell小室法、黏附实验系统研究了Echinoside A对95D细胞侵袭、迁移、黏附的影响,结果显示Echinoside A可显著降低95D细胞侵袭、迁移以及同基质和内皮细胞的黏附能力。通过CAM实验研究了Echinoside A对血管新生的影响,结果显示经Echinoside A处理后,毛细血管的密度显著降低,VEGF基因和VEGF蛋白的表达均显著降低。与本实验报道类似,Ds-Echinoside A也可通过下调VEGF的表达从而抑制肿瘤血管新生[11],提示海参皂苷抗血管新生的作用机制与其在转录和翻译水平下调肿瘤细胞VEGF的表达相关。
肿瘤细胞离开原发部位发生浸润转移,首先要诱导产生蛋白溶解酶降解ECM和BM,同时产生多种生长因子促进肿瘤微血管的生成。uPA是尿激型纤溶系统的重要成员,在95D细胞中高表达,并且参与细胞黏附、移动,在肿瘤侵袭转移中起着关键作用。活化的uPA与肿瘤表面的受体结合后,一方面可以直接激活纤溶酶,降解ECM和BM,同时促进储存于ECM中的MMPs前体和VEGF释放,加速ECM和BM的降解,促进肿瘤血管新生。另一方面uPA也可直接激活MMPs和VEGF,参与肿瘤的侵袭和转移的过程[26]。实验结果显示,Echinoside A可在转录水平显著下调uPA的表达,还可同时下调MMP-2、MMP-9和上调TIMP-1、TIMP-2的mRNA的表达。进一步采用RT-PCR和western-blotting法研究发现Echinoside A可显著下调VEGF的基因和蛋白的表达。以上结果提示Echinoside A抑制95D细胞转移的机制可能是通过抑制uPA信号通路,进而减少MMPs和VEGF激活和表达,最终抑制肿瘤细胞的转移和血管新生。
综上所述,Echinoside A具有显著的抑制肿瘤细胞转移和血管新生的活性,这为海参皂苷的药理活性研究提供了科学依据,也为低值海参的开发利用提供了新的思路。
[1] 吴学元, 马巍, 任国文, 等. 肿瘤血管靶向治疗的研究进展[J]. 现代肿瘤医学, 2009, 17(1): 121-125. DOI:10.3969/ j.issn.1672-4992.2009.01.051.
[2] CARMELIET P, JAIN R K. Angiogenesis in cancer and other diseases[J]. Nature, 2000, 407: 249-257. DOI:10.1038/ 35025220.
[3] SOLTANI M, BAHARARA J, NAMVAR F. Evaluation of cytotoxicity and anti-inflammatory effects of saponin isolated from Holothuria leucospilota Sea cucumber[J]. Journal of Cellular Immunotherapy, 2015, 1(1): 17-18. DOI:10.1016/j.jocit.2015.10.019.
[4] 王丹, 丁琳, 董平, 等. 海参皂苷对脂肪肝大鼠胆固醇代谢的调节作用[J]. 营养学报, 2016, 38(1): 67-70. DOI:10.13325/j.cnki.acta.nutr. sin.2016.01.014.
[5] 张铃玉, 宋姗姗, 徐杰, 等. 摄食海参皂苷对肥胖小鼠血压的影响[J].中国药理学通报, 2015, 31(8): 1169-1174. DOI:10.3969/ j.issn.1001-1978.2015.08.028.
[6] 张灏, 徐慧静, 高旖旎, 等. 海参皂苷及多糖对小鼠高尿酸血症的影响[J]. 食品科学, 2013, 34(15): 219-222. DOI:10.7506/spkx1002-6630-201315045.
[7] 李冰, 王静凤, 安淼, 等. 革皮氏海参皂苷对环磷酰胺所致骨髓损伤模型小鼠造血作用的研究[J]. 营养学报, 2011, 33(2):173-177. DOI:10.13325/j.cnki.acta.nutr.sin.2011.02.022.
[8] 刘洁, 王先友, 韩华. 筛选分离黑海参中具有抗肿瘤活性的皂苷成分[J]. 中国海洋药物, 2014, 33(5): 23-30. DOI:10.13400/j.cnki. cjmd.2014.05.004.
[9] YU Siran, YE Xuewei, LU Chen, et al. Cytotoxic and anti-colorectal tumor effects of sulfated saponins from sea cucumber Holothuria moebii[J]. Phytomedicine, 2015, 22(12): 1112-1119. DOI:10.1016/ j.phymed.2015.08.007.
[10] ZHAO Qin, XUE Yong, WANG Jingfeng, et al. In vitro and in vivo anti-tumor activities of echinoside A and ds-echinoside A from Pearsonothuria graeffei[J]. Journal of the Science of Food and Agriculture, 2012, 92(4): 965-974. DOI:10.1002/jsfa.4678.
[11] ZHAO Qin, LIU Zhidong, XUE Yong, et al. Ds-echinoside A, a new triterpene glycoside derived from sea cucumber, exhibits antimetastatic activity via the inhibition of NF-κB-dependent MMP-9 and VEGF expressions[J]. Journal of Zhejiang University Science B, 2011, 12(7): 534-544. DOI:10.1631/jzus.B1000217.
[12] 刘治东. 革皮氏海参皂苷抗肿瘤活性及其作用机制的研究[D]. 青岛: 中国海洋大学, 2009: 51.
[13] 尹一恒. 海参皂苷抑制人脑胶质母细胞瘤细胞生长实验研究[D]. 西安: 第四军医大学, 2009: 32-33.
[14] 张佳佳, 朱可奇, 巫军, 等. 黄疣海参皂苷hillaside A和hillaside B的体外抗真菌及抗肿瘤活性[J]. 中国药业, 2014, 23(8): 20-22.
[15] KLEINMAN H K, MCGARVEY M L, LIOTTA L A, et al. Isolation and characterization of type IV procollagen, laminin, and heparan sulfate proteoglycan from the EHS sarcoma[J]. Biochemistry, 1982, 21(24): 6188-6193. DOI:10.1021/bi00267a025.
[16] 陈羽. uPA通过TEM8诱导EGFR磷酸化的研究[D]. 北京: 中国人民解放军军事医学科学院, 2014: 15.
[17] BLASI F, SIDENIUS N. The urokinase receptor: focused cell surface proteolysis, cell adhesion and signaling[J]. FEBS Letters, 2010, 584(9): 1923-1930. DOI:10.1016/j.febslet.2009.12.039.
[18] WITZEL I D, MILDE-LANGOSCH K, WIRTZ R M, et al. Comparison of microarray-based RNA expression with ELISA-based protein determination of HER2, uPA and PAI-1 in tumour tissue of patients with breast cancer and relation to outcome[J]. Journal of Cancer Research & Clinical Oncology, 2010, 136(11): 1709-1718. DOI:10.1007 /s00432-010-0829-4.
[19] YONG H Y, KIM I Y, KIM J S, et al. ErbB2-enhanced invasiveness of H-Ras MCF10A breast cells requires MMP-13 and uPA upregulation via p38 MAPK signaling[J]. International Journal of Oncology, 2010, 36(2): 501-507. DOI:10.3892/ijo_00000524.
[20] HE Cheng, HE Ping, LIU Liping, et al. Analysis of expression of components in the plasminogen activator system in high and low metastatic human lung cancer cells[J]. Journal of Cancer Research and Clinical Oncology, 2001, 127(3): 180-186. DOI:10.1007/ s004320000192.
[21] BUENO M, SALGADO S, BEAS-ZÁRATE C, et al. Urokinasetype plasminogen activator gene therapy in liver cirrhosis is mediated by collagens gene expression down-regulation and up-regulation of MMPs, HGF and VEGF[J]. The Journal of Gene Medicine, 2006, 8(11): 1291-1299. DOI:10.1002/jgm.961.
[22] 刘韬, 马岩, 张锐. 基质金属蛋白酶与恶性肿瘤侵袭和转移关系的研究进展[J]. 吉林大学学报(医学版), 2004, 30(4): 662-664. DOI:10.13481/j.1671-587x.2004.04.087.
[23] 陈晓锋, 顾振纶, 梁中琴, 等. 基质金属蛋白酶与肿瘤侵袭和转移研究进展[J]. 中国药理学通报, 2001, 17(3): 253-256. DOI:10.3321/ j.issn:1001-1978.2001.03.004.
[24] 向本旭, 刘婷婷, 孙芳玲, 等. VEGF相关信号通路在血管新生中的研究进展[J]. 中国比较医学杂志, 2015, 25(12): 81-86. DOI:10.3969. j.issn.1671-7856.2015.12.016.
[25] SHARIAT S F, ROEHRBORN C G, MCCONNEL J D, et al. Association of the circulating levels of the urokinase system of plasminogen activation with the presence of prostate cancer and invasion, progression, and metastasis[J]. Journal of Clinical Oncology, 2007, 25(4): 349-355. DOI:10.1200/JCO.2006.05.6853.
[26] MEKKAWY A H, POURGHOLAMI M H, MORRIS D L. Involvement of urokinase-type plasminogen activator system in cancer: an overview[J]. Medicinal Research Reviews, 2014, 34(5): 918-956. DOI:10.1002/med. 21308.
The Triterpene Glycoside Echinoside A Inhibits 95D Cell Metastasis via uPA Signaling Pathway
ZHAO Qin1, LIN Dong2, LIU Haimei1
(1. College of Food Engineering, Ludong University, Yantai 264025, China; 2. School of Pharmacy, Binzhou Medical University, Yantai 264003, China)
The effect and mechanism of Echinoside A, a triterpene glycoside derived from sea cucumber, on tumor metastasis in lung cancer 95D cell lines were evaluated. The 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide (MTT) assay was used to determine the anti-proliferation ability of Echinoside A on 95D cells which have high metastasis ability. Transwell assay and cell adhesion assay were used to determine the effect of Echinoside A on tumor metastasis capacity. Chicken chorioallantoic membrane (CAM) assay was used to determine its effect on tumor angiogenesis. Reverse transcription-polymerase chain reaction and western blotting analysis were used to determine the effect of Echinoside A on tumor metastasis-related gene and protein expression. The results show that Echinoside A could inhibit 95D cell proliferation (P < 0.01), invasion (P < 0.01), migration (P < 0.01) and adhesion (P < 0.01), and decrease angiogenesis in CAM. Echinoside A could also reduce the mRNA expression of urokinase plasminogen activator (uPA) and matrix metalloproteinases (MMP)-2/-9 and significantly promote the mRNA expression of matrix metalloproteinases (TIMP)-1/-2. It could also reduce the gene and protein expression of vascular endothelial growth factor. From these data, it is suggested that Echinoside A can prevent metastasis and angiogenesis through specific inhibition of uPA signaling pathway.
triterpene glycoside from sea cucumber; 95D cell; tumor; metastasis; angiogenesis; signaling pathway
10.7506/spkx1002-6630-201621041
R284;R965
A
1002-6630(2016)21-0241-07
赵芹, 林栋, 刘海梅. 海参皂苷Echinoside A通过uPA信号通路抑制高转移95D细胞转移[J]. 食品科学, 2016, 37(21): 241-247. DOI:10.7506/spkx1002-6630-201621041. http://www.spkx.net.cn
ZHAO Qin, LIN Dong, LIU Haimei. The triterpene glycoside Echinoside A inhibits 95D cell metastasis via uPA signaling pathway[J]. Food Science, 2016, 37(21): 241-247. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621041. http://www.spkx.net.cn
2016-06-23
山东省自然科学基金项目(ZR2015PC002;ZR2014BP016);鲁东大学人才引进基金项目(LY2012011)
赵芹(1983—),女,讲师,博士,研究方向为海洋生物活性成分。E-mail:candyffff@163.com

