菲律宾蛤仔对扑草净的生物富集与消除规律
刘丽娟,王玮云,张华威,姜向阳,任利华,姜 芳,孙灵毅
(1.山东省海洋资源与环境研究院,山东 烟台 264006;2.烟台市水产研究所,山东 烟台 264003)
菲律宾蛤仔对扑草净的生物富集与消除规律
刘丽娟1,王玮云1,张华威1,姜向阳1,任利华1,姜 芳1,孙灵毅2,*
(1.山东省海洋资源与环境研究院,山东 烟台 264006;2.烟台市水产研究所,山东 烟台 264003)
采用半静态水质接触染毒法,研究菲律宾蛤仔对养殖海水中扑草净的生物富集和消除规律。生物富集实验结果表明:在水温(20±1) ℃条件下,在扑草净质量浓度分别为1.0、10.0、200.0 μg/L的养殖海水中,菲律宾蛤仔中扑草净残留量随所暴露海水中扑草净质量浓度的升高而逐渐增加,二者之间呈正相关。3 个实验组分别在第24、24、6小时达到最大富集值,最大富集系数分别为40.3、9.54、5.35。随着时间的延长,菲律宾蛤仔的扑草净残留量均表现为先迅速上升,升至最高值后迅速降低,低至一定质量浓度后再次上升至一个高点然后下降,之后维持在某一质量浓度水平呈小幅波动的变化趋势。消除实验结果表明:在消除实验初期,3 个实验组菲律宾蛤仔中扑草净的残留量均迅速下降,24 h时降至原质量浓度的10%左右,此后下降缓慢,1.0、10.0、200.0 μg/L暴露实验组菲律宾蛤仔的扑草净残留量降至10.0 μg/kg以下的时间分别为2、24、768 h,其中1.0 μg/L组在消除实验持续96 h时检测结果低于检出限,其余2 组在为期45 d的消除实验结束时仍可检出扑草净残留量。研究表明,菲律宾蛤仔对扑草净具有快速富集能力,但完全消除需要较长时间。
菲律宾蛤仔;扑草净;富集;消除
扑草净(prometryn)又称扑草净胺、捕草净、割草佳、扑蔓尽,为均三氮苯类选择性除草剂,化学名称为4,6-双异丙胺基-2-甲硫基-1,3,5-三嗪,分子式为C10H19N5S[1]。是一种高效低毒的内吸型除草剂,在农业生产中主要用于防除一年生禾本科及阔叶草[2]。20世纪70年代以来,为了控制水产养殖过程中大型绿藻的泛滥生长,以扑草净为主要成分的除藻剂产品被应用于海水养殖生产[3],主要用于清除鱼、虾、蟹、贝、海参等养殖水体中的丝状藻类(青苔)、大型藻类及有害藻类。由于扑草净在鱼体内代谢情况不明,无法对食品安全性进行评价,2010年水产用扑草净粉被列入中华人民共和国农业部公告第1435号(《兽药试行标准废止目录》)中[4]。但国内某些地区仍把扑草净作为环境改良剂在水产养殖中使用。扑草净化学性质稳定,半衰期长,难降解,容易随着降水、淋溶和径流的作用由土壤迁移入水体[5];水产养殖用扑草净除藻后随养殖用水直接排入大海,对海洋生态环境产生影响,同时威胁着水产品的质量安全。生活在潮间带或近岸浅海的贝类,由于生长位置比较固定,受扑草净污染的风险相对更高。
2014年我国海水贝类养殖产量为1 316.55万 t,占海水养殖总产量的72.6%[6],是最大的贝类生产国,也是重要的贝类消费国和主要的贝类出口国之一。由于我国现行有效的标准中尚没有扑草净安全限量相关规定[7],缺乏对贝类中扑草净残留量的监管,2012年日本因检测出从我国进口的贝类产品中扑草净残留超基准值(0.01 mg/kg),决定对我国产蛤蜊等双贝壳类中扑草净项目实施强化监控检查[8],此后的几年内,我国贝类扑草净残留超标问题反复出现,引起人们对海产贝类扑草净污染情况的关注。
菲律宾蛤仔(Ruditapes philippinarum)俗称花蛤、蛤蜊,广泛分布在我国南北海区,具有生长迅速、适应性强、离水后存活时间长等优良品质,是我国四大养殖贝类之一[9],其产品大量出口日本及东南亚国家。菲律宾蛤仔是因扑草净残留量超标,最早被日本列入强化监控检查的海水贝类之一。国内外关于扑草净对海水养殖影响的研究主要集中在对藻类的去除效果和对养殖对象的毒性方面[10-13],贝类体内扑草净的富集和消除规律研究鲜见报道。本研究以菲律宾蛤仔为实验对象,研究其对养殖海水中扑草净的生物富集及消除规律,以期为海水贝类食品安全监控和海洋环境保护提供依据。
1 材料与方法
1.1 材料与试剂
菲律宾蛤仔取自烟台牟平区近海,壳长2.5~3.0 cm。
乙酸乙酯(色谱纯,下同)、丙酮、正己烷 德国Meker公司;环己烷 美国Tedia公司;Bong Elut石墨化碳柱(500 mg,6 mL) 美国Agilent公司;CNWBOND固相萃取小柱(500 mg/3 mL) 上海安谱科学仪器有限公司;扑草净标准品(纯度>98.0%)德国Dr. Ehrenstorfer公司;实验用水均为去离子水。
1.2 仪器与设备
6890N/5973N气相色谱-质谱联用仪 美国Agilent公司;AccuprepMps凝胶渗透色谱仪 美国J2 Scientific公司;ASPEC XL4四通道全自动固相萃取仪 法国Gilson公司;Laborota4001旋转蒸发仪 德国Heidolph公司。
1.3 方法
1.3.1 扑草净富集和消除实验
扑草净富集、消除实验参考文献[14]。实验前将菲律宾蛤仔在实验条件下暂养3 d,每天换海水1 次,定时投喂硅藻1 次,连续充氧。暂养期间及时清除状态不佳和死亡个体,选择活动性强的健康菲律宾蛤仔进行实验。实验用海水为贝类育苗生产用水,取自烟台蓬莱近海,经沙滤、调温后使用,水温(20±1) ℃,pH 7.8~8.0,盐度30。经检测实验用菲律宾蛤仔和海水均不含扑草净。设置扑草净质量浓度为1.0、10.0、200.0 μg/L的3 个实验组和1 个对照组(扑草净质量浓度为0.0 μg/L),每组设置一对平行。每个实验水箱内注入新鲜海水100 L,加入扑草净储备液,分别调节扑草净质量浓度为0.0、1.0、10.0、200.0 μg/L,各放入经暂养的健康菲律宾蛤仔100 只。采用半静态水质接触染毒法,每24 h换一半相同扑草净质量浓度的海水。分别在富集实验开始6、24、48、72、96、144、240、336、432、528 h取样,每次从每个水箱内随机取菲律宾蛤仔5 只,分别放入标记清楚的自封口塑料袋中密封,-20 ℃冷冻保存。
富集实验结束后进行菲律宾蛤仔体内扑草净的消除实验。所有实验水箱中均换成清洁海水,分别在换水完毕后2、24、48、96、192、336、528、768、1 080 h进行取样,投喂、取样方法与富集实验一致。实验过程中及时剔除死亡的菲律宾蛤仔。富集、消除实验在烟台海益苗业有限公司完成。
1.3.2 扑草净残留量测定
标准溶液的配制:准确称取一定量标准品,用甲醇溶解定容至100 mg/L,使用前用乙酸乙酯稀释至所需质量浓度。取菲律宾蛤仔所有可食部分,用手动玻璃研磨器研磨匀浆后称取5.00 g进行测定。样品处理和测定均按照张华威等[15]的方法进行,外标法定量,用该方法测得的扑草净检出限为1.0 μg/kg。测定富集、消除实验每个时间点所取菲律宾蛤仔中扑草净的残留量。
1.4 数据分析
检测数据用Excel 2010软件进行统计分析、作图。线性回归分析采用相关系数显著性检验法进行判断。
2 结果与分析
2.1 菲律宾蛤仔对扑草净的生物富集规律
以扑草净暴露质量浓度为自变量x,菲律宾蛤仔中扑草净的残留量为因变量y,不同富集时间的扑草净暴露质量浓度-富集量关系线性回归分析结果见表1。

表1 暴露质量浓度-富集量线性回归分析Table 1 Linear regression analysis between exposure concentration and accumulation level
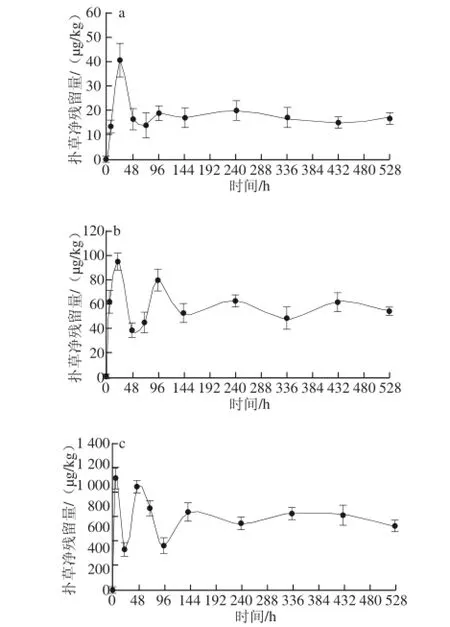
图1 菲律宾蛤仔的扑草净富集质量浓度-时间关系Fig. 1 Time-dependent accumulation of prometryn at various concentrations in Ruditapes philippinarum
查阅相关系数显著性检验表[16]可知,当n=4时,0.950≤R<0.990表示0.01<P≤0.05,相关性显著;0.990≤R时表示P≤0.01,相关性极显著。由表1可知,富集过程中除24、96 h相关系数R为显著水平(P<0.05)外,其他时间的相关系数均达到极显著水平。即随着海水暴露质量浓度的增加,菲律宾蛤仔中扑草净的残留量相应增加,二者呈显著正相关关系。
由图1可知,在528 h的富集实验过程中,菲律宾蛤仔中扑草净残留量表现为先迅速升至最高值后迅速降低,低至一定质量浓度后再次上升至一个高点,然后下降,之后维持在某一水平小幅波动的变化趋势。菲律宾蛤仔体内扑草净残留量在96~144 h达到基本稳定状态。528 h富集实验结束时,菲律宾蛤仔中扑草净残留量分别为17.3、55.1、615 μg/kg,为扑草净暴露质量浓度的17.3、5.51、3.075 倍。富集最高值分别为40.3、95.4、1 070 μg/kg,分别为相应扑草净暴露质量浓度的40.3、9.54、5.35 倍,达到最高值所需时间分别为24、24、6 h,显示菲律宾蛤仔对扑草净具有快速富集效应。

图2 菲律宾蛤仔在扑草净不同暴露质量浓度下的富集系数-时间关系Fig. 2 Time-dependent bioconcentration factors of prometryn at various concentrations in Ruditapes philippinarum
由图2可知,随着养殖海水中扑草净暴露质量浓度的升高,菲律宾蛤仔的富集系数逐步下降,即暴露质量浓度越低,富集系数越高;暴露质量浓度越高,富集系数越低。这与菲律宾蛤仔和淡水贝类对阿特拉津的富集规律一致[17-18],与刺参对扑草净的生物富集现象相同[19]。3 个实验组中菲律宾蛤仔对扑草净的富集系数总体变化趋势相同,均表现为先升高后下降、低至一定数值后再次上升至一个高点然后下降,之后基本维持在某一水平小幅波动。
2.2 菲律宾蛤仔对扑草净的消除
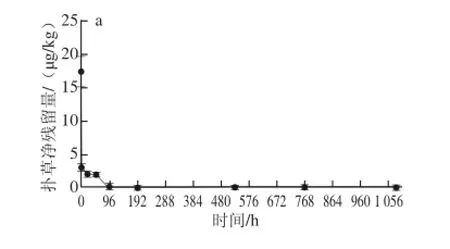
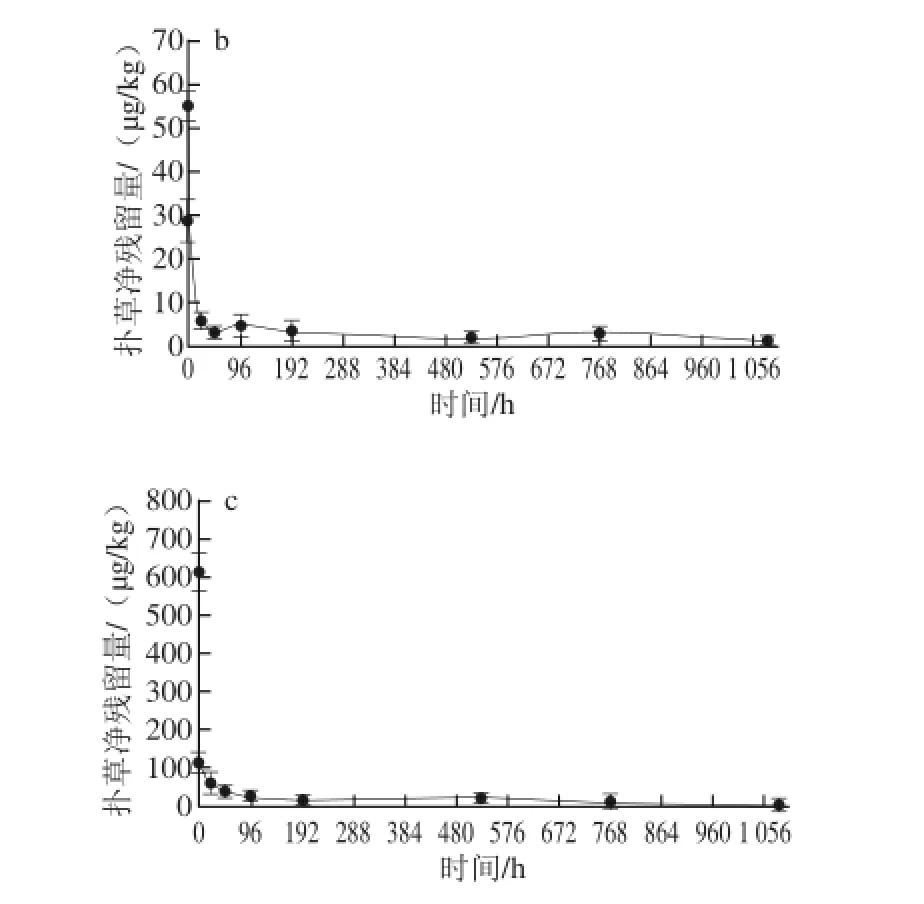
图3 消除阶段菲律宾蛤仔中扑草净的质量浓度-时间关系Fig. 3 Time-dependent elimination of prometryn accumulated at various concentrations from Ruditapes philippinarum
由图3可知,在消除实验过程中,3 个实验组均表现出初始阶段菲律宾蛤仔中扑草净残留量迅速下降,消除24 h时降至扑草净原残留量的10%左右,以后缓慢下降的趋势。其中扑草净暴露质量浓度为1.0 μg/L的实验组,消除实验菲律宾蛤仔中扑草净原残留量为17.3 μg/kg,消除持续2 h时菲律宾蛤仔中扑草净残留量为2.99 μg/kg,96 h时检测结果低于检出限;扑草净暴露质量浓度为10.0 μg/L的实验组,消除实验菲律宾蛤仔中扑草净原残留量为55.1 μg/kg,消除持续24 h时菲律宾蛤仔中扑草净残留量为6.41 μg/kg;扑草净暴露质量浓度为200.0 μg/L的实验组,消除实验菲律宾蛤仔中扑草净原残留量为615 μg/kg,消除持续768 h时菲律宾蛤仔中扑草净残留量为8.97 μg/kg。3 个实验组分别在消除2、24、768 h后菲律宾蛤仔中扑草净残留量一直保持低于日本要求的基准值0.01 mg/kg(10 μg/kg)。扑草净暴露质量浓度为10.0、200.0 μg/L的2 个实验组在为期1 080 h的消除实验结束时仍可检出扑草净。该结果与田秀慧等[19]对刺参的研究结果基本一致,但菲律宾蛤仔对扑草净的消除速率要稍高于刺参。
3 讨 论
3.1 菲律宾蛤仔对扑草净的富集能力
Pacakova等[20]采用化学品的正辛醇/水分配系数(Kow)的对数值lgKow值来估计其在生物体中的生物富集效果。有研究发现,lgKow值在2~6之间的化合物易于在生物体内富集。扑草净lgKow值为2.99[21],显示出扑草净易于在生物体内富集。研究数据显示,在扑草净暴露质量浓度为1.0、10.0、200.0 μg/L时,菲律宾蛤仔的最大富集系数分别为40.3、9.54、5.35,远高于相同暴露质量浓度下刺参对扑草净的最大富集系数4.70、4.38、3.37[19],可见不同水生生物对扑草净的富集能力差别很大,菲律宾蛤仔对扑草净的富集能力明显高于刺参;而相同暴露质量浓度下菲律宾蛤仔对阿特拉津的最大富集系数分别为15.4、6.15、3.56[17],可见菲律宾蛤仔对扑草净富集能力高于阿特拉津,这与扑草净的lgKow(2.99)[21]高于阿特拉津的lgKow(2.7)[20],更易于在生物体内富集的特性一致。
菲律宾蛤仔对扑草净的富集速率快、富集系数高,可能与其摄食方式有关。菲律宾蛤仔为滤食性生物,直接滤食海水中的浮游藻类为食物。浮游藻类具有巨大的总表面积、特殊胞外组分及细胞形态,对农药具有很高的富集能力[22]。通过食物链的传递,扑草净在菲律宾蛤仔中快速富集。并且菲律宾蛤仔具有开放式循环系统[23],与外来物质的接触较为充分,因此在富集实验阶段会很快到达峰值。
3.2 菲律宾蛤仔对扑草净的富集和代谢
研究表明,扑草净在动物中的代谢途径包括N-脱烷基作用、伴有水解作用和/或氨基酸结合作用,而目前动物中最受关注的残留还是扑草净母体[2]。富集实验初期,菲律宾蛤仔中扑草净残留量随时间大幅波动,先后出现2 个峰值,之后维持在某一水平小幅波动。这可能是因为菲律宾蛤仔体内由扑草净的富集引发一系列复杂的生化反应所致。由于富集效应,菲律宾蛤仔体内扑草净残留量随时间推移迅速上升,启动了菲律宾蛤仔体内的扑草净代谢途径,且其代谢效率随着扑草净残留量的升高而提高,但在短时间内扑草净的富集效率远高于代谢效率,表现为残留量的快速增加;随着体内扑草净残留量的升高,代谢效率也不断提高,在残留量达到最高值时,代谢效率达到最高,此时已远高于富集效率,表现为残留量快速下降;代谢效率随着扑草净残留量的下降逐渐降低,在低于其富集效率时又表现为扑草净残留量的升高;由于对环境的适应,菲律宾蛤仔对扑草净的富集和代谢效率达到动态平衡,表现为扑草净残留量基本达到稳定状态。消除实验阶段,海水中扑草净残留量的突然降低,打破了菲律宾蛤仔对扑草净的富集-代谢平衡,由于富集效率接近于零,而代谢效率继续维持在较高水平,导致扑草净残留量的急速下降;随着体内扑草净残留量的减少,菲律宾蛤仔对扑草净的代谢效率也逐渐下降,其体内扑草净消除趋缓。
3.3 菲律宾蛤仔的扑草净安全风险
扑草净对人体健康的影响不明显,但对大多数的水生动物具有轻微至中等毒性,对水生植物具有高毒性[24]。本研究发现,菲律宾蛤仔中扑草净残留量越高,完全消除所需时间越长。徐英江等[25]研究发现莱州湾海域表层海水中扑草净质量浓度为未检出至21.2 ng/L;本课题组对乳山、广饶海域调查结果显示,该海域海水中扑草净质量浓度均远低于1 μg/L,随污染的径流和池塘养殖用水排入海中的扑草净在海水的稀释和自净作用下其质量浓度通常远低于1 μg/L,在此海域生长的菲律宾蛤仔扑草净残留量应该在17.3 μg/kg以下。由于采捕的菲律宾蛤仔食用前为排净体内的泥沙,需在洁净海水中暂养2 h左右,在此期间菲律宾蛤仔中扑草净被迅速净化。结合本实验结果推测,在自然海区中生长的菲律宾蛤仔,经过2 h净化后不存在食用安全风险。但要验证该推测的准确性,还需要对不同养殖区菲律宾蛤仔的扑草净残留量基础数据进行调查。
4 结 论
本研究结果显示,在水温(20±1) ℃条件下,在扑草净暴露质量浓度分别为1.0、10.0、200.0 μg/L的养殖海水中,菲律宾蛤仔中扑草净残留量随所暴露质量浓度的升高而逐步增加,二者之间呈显著正相关关系。3 个实验组分别在第24、24、6小时达到富集最大值,最大富集系数分别为40.3、9.54、5.35。富集实验阶段,3 个实验组菲律宾蛤仔的扑草净残留量均表现为随着时间延长先迅速升至最高值后迅速降低,低至一定质量浓度后再次上升至一个高点然后下降,在96~120 h达到基本稳定状态,3 个实验组分别维持在17.3、55.1、615 μg/kg水平小幅波动,其富集系数随扑草净暴露质量浓度的升高而下降。消除实验开始阶段菲律宾蛤仔中扑草净的残留量迅速下降,24 h时近90%的扑草净被净化,此后消除效率下降。各实验组菲律宾蛤仔的扑草净残留量降至10.0 μg/kg以下的时间分别为2、24、768 h,原质量浓度越高,所需消除时间越长,其中扑草净暴露质量浓度为1.0 μg/L在消除实验持续96 h时检测结果低于检出限,其他2 组在为期1 080 h的消除实验结束时仍可检出扑草净残留。可见菲律宾蛤仔对扑草净具有快速、高效富集能力和快速消除能力,但彻底消除所需时间较长。
[1] 李清波, 黄国宏, 王颜红, 等. 阿特拉津生态风险及其检测和修复技术研究进展[J]. 应用生态学报, 2002, 13(5): 625-628. DOI:10.3321/ j.issn:1001-9332.2002.05.026.
[2] US Environmental Protection Agency. Guidance for the reregistrationof pesticide products containing prometryne as the activeingredient[R]. Washington: EPA, 1987.
[3] 张树林, 邢克智, 张树伟. 养殖水体水华发生及控制的研究[J]. 水利渔业, 2006, 26(2): 67-69. DOI:10.3969/j.issn.1003-1278.2006.02.032.
[4] 农业部. 中华人民共和国农业部公告1435号[EB/OL]. (2010-07-30) [2016-01-01]. http://www.foodmate.net/law/shipin/164493.html.
[5] 张骞月, 吴伟. 扑草净在养殖水体中的生态毒理效应及其微生物降解的研究进展[J]. 生物灾害科学, 2014, 37(1): 64-69. DOI:10.3969/ j.issn.2095-3704.2014.01.012.
[6] 农业部渔业渔政管理局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2015: 1.
[7] 国家农药残留标准委员会. 食品安全国家标准 食品中农药最大残留限量: GB 2763—2014[S]. 北京: 中国标准出版社, 2014: 1-226.
[8] 李庆鹏, 秦达, 崔文慧, 等. 我国水产品中农药扑草净残留超标的警示分析[J]. 食品安全质量检测学报, 2014, 5(1): 108-112.
[9] 刘青, 张越, 付鑫, 等. 菲律宾蛤仔研究进展[J]. 河北渔业, 2011(1): 56-59.
[10] 于举修. 应用扑草净杀灭虾池青苔的试验[J]. 海洋科学, 1995(2): 11-12.
[11] Environmental Protection Agency. Reregistration eligibility decision(RED) prometryn[EB/OL]. (1996-02-01)[2016-01-01]. http:// www.epa.gov/pesticides/reregistration/status_page_p.htm.
[12] 谢剑, 戴习林, 臧维玲, 等. 扑草净对两种虾和两种水草的毒性研究[J]. 湖南农业科学, 2010(23): 147-150. DOI:10.3969/j.issn.1006-060X.2010.23.046.
[13] 王田田, 刘丽娟, 孙灵毅. 4 种除藻剂对菲律宾蛤仔和刺参的急性毒性实验[J]. 中国渔业质量与标准, 2015, 5(2): 35-41.
[14] 陈家长, 孟顺龙, 胡庚东, 等. 鲫鱼对除草剂阿特拉津的生物富集效应研究[J]. 农业环境科学学报, 2009, 28(6): 1313-1318. DOI:10.3321/j.issn:1672-2043.2009.06.039.
[15] 张华威, 刘慧慧, 田秀慧, 等. 凝胶色谱-固相萃取-气相色谱-串联质谱法测定水产品中9 种三嗪类除草剂[J]. 质谱学报, 2015, 36(2): 177-184. DOI:10.7538/zpxb.youxian.2014.0054.
[16] 中国科学院数学研究所概率统计室编. 常用数理统计表[M]. 北京:科学出版社, 1979: 18.
[17] 王玮云, 刘丽娟, 张华威, 等. 菲律宾蛤仔中阿特拉津的富集与消除研究[C]//中国水产科学研究院. 2015年水产品质量安全学术研讨会论文集. 北京: 中国水产科学研究院, 2015: 165-172.
[18] JACOMINI A E, AVELAR W E P, MARTINEZ A S, et al. Bioaccumulation of Atrazine in freshwater bivalves Anodontites trapesialis (Lamarck, 1819) and Corbicula fluminea (Müller, 1774)[J]. Archives of Environmental Contamination and Toxicology, 2006, 51(3): 387-391.
[19] 田秀慧, 宫向红, 徐英江, 等. 除草剂扑草净在海参中的生物富集与消除效应研究[J]. 现代食品科技, 2013, 29(7): 1580-1585.
[20] PACAKOVA V, STULIK K, JISKRA J. High-performance separations in the determination of triazine herbicides and their residues[J]. Journal of Chromatography A, 1996, 754(1): 17-31. DOI:10.1016/S0021-9673(96)00408-6.
[21] KAUNE A, BRUGGEMANN R, KETTRUP A. High-performance liquid chromatographic measurement of the 1-octanol-waterpartition coefficient of s-triazine herbicides and some of their degradation products[J]. Journal of Chromatography A, 1998, 805(1/2): 119-126. DOI:10.1016/S0021-9673(98)00051-X.
[22] 吴颖慧, 蔡磊明, 王捷, 等. 除草剂莠去津对7 种藻类的生长抑制[J].农药, 2007, 46(1): 48-51. DOI:10.3969/j.issn.1006-0413.2007.01.016.
[23] 山东省水产学校. 贝类养殖学[M]. 北京: 中国农业出版社, 1995: 5.
[24] 付晓苹, 刘巧荣, 许玉艳, 等. 扑草净对人体健康及水生环境的安全性评价[J]. 中国农学通报, 2015, 31(35): 49-57.
[25] 徐英江, 刘慧慧, 任传博, 等. 莱州湾海域表层海水中三嗪类除草剂的分布特征[J]. 渔业科学进展, 2014, 35(3): 34-39. DOI:10.11758/ yykxjz.20140305.
Accumulation and Elimination of Prometryn in Ruditapes philippinarum
LIU Lijuan1, WANG Weiyun1, ZHANG Huawei1, JIANG Xiangyang1, REN Lihua1, JIANG Fang1, SUN Lingyi2,*
(1. Shandong Marine Resource and Environment Research Institute, Yantai 264006, China; 2. Yantai Aquatic Products Research Institute, Yantai 264003, China)
The accumulation and elimination of prometryn in Ruditapes philippinarum was studied by the semistatic method. Ruditapes philippinarum were exposed to seawaters containing 1.0, 10.0 and 200.0 μg/L prometryn at (20 ± 1) ℃, respectively. The amount of residual prometryn in Ruditapes philippinarum increased with the increase in prometryn concentration. The maximum accumulation of prometryn in Ruditapes philippinarum at the three concentrations was found after exposure for 24, 24 and 6 h with bioconcentration factors of 40.3, 9.54 and 5.35, respectively. As exposure time increased, prometryn at each concentration could be rapidly accumulated in Ruditapes philippinarum and then reduced, and after another cycle, finally kept fluctuating slightly around a certain level. The amount of residual prometryn in Ruditapes philippinarum from all three concentration groups rapidly dropped during the early stage of elimination, reaching around 10% of the initial level after 24 h, and then fell slowly. The amount of prometryn residue in the 1.0, 10.0 and 200.0 μg/L exposure groups was reduced to below 10.0 μg/kg after 2, 24 and 768 h, respectively. Moreover, the 1.0 μg/L exposure group reached an undetectable level after 96 h, whereas the two other groups were still detectable after 45 days. This research suggested that Ruditapes philippinarum can accumulate prometryn rapidly, but its complete elimination will take a long time.
Ruditapes philippinarum; prometryn; accumulation; elimination
10.7506/spkx1002-6630-201621043
S917.4
A
1002-6630(2016)21-0252-05
刘丽娟, 王玮云, 张华威, 等. 菲律宾蛤仔对扑草净的生物富集与消除规律[J]. 食品科学, 2016, 37(21): 252-256.
DOI:10.7506/spkx1002-6630-201621043. http://www.spkx.net.cn
LIU Lijuan, WANG Weiyun, ZHANG Huawei, et al. Accumulation and elimination of prometryn in Ruditapes philippinarum[J]. Food Science, 2016, 37(21): 252-256. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621043. http://www.spkx.net.cn
2016-03-03
烟台市科技发展计划项目(2013NC334);山东省现代农业产业技术体系贝类创新团队项目(SDAIT-14-08)
刘丽娟(1977—),女,副研究员,硕士,研究方向为海洋生物多样性和水产品质量安全。
E-mail:liu_li_juan_426@aliyun.com
*通信作者:孙灵毅(1963—),女,研究员,学士,研究方向为水产食品安全。E-mail:sunly1963@163.com

