猪源大肠杆菌耐药性与毒力的研究
曾俊棋,岳万福
(浙江农林大学动物科技学院,浙江 杭州 311300)
Zeng Junqi,Yue Wanfu*
(Col lege of Animal Science and Technology,Zhej iang Agricul ture&Forest University,Zhej iang Hangzhou 311300)
猪源大肠杆菌耐药性与毒力的研究
曾俊棋,岳万福⋆
(浙江农林大学动物科技学院,浙江杭州311300)
为了有效预防猪肠道疾病的大面积感染,本试验针对猪源大肠杆菌耐药性与毒力开展研究。结果表明,被测大肠杆菌菌株对卡那霉素、阿莫西林、青霉素等抗生素具有耐药性,对链霉素、磷霉素等抗生素具有敏感性,其对卡那霉素与青霉素的最小抑菌浓度较高,但对于氟苯尼考、庆大霉素、强力霉素与四环素,大肠杆菌菌株的最小抑菌浓度差异较明显。EDL933大肠杆菌菌株中Stx2基因成功转移到PS1、PS2、PS3大肠杆菌菌株的基因组中,并在相应菌株中得到表达,产生毒力蛋白,表明EDL933大肠杆菌菌株的Stx2毒力基因会发生基因水平转移,以期为猪肠道疾病的防控提供科学依据。
猪;大肠杆菌;耐药性;毒力
Zeng Junqi,Yue Wanfu*
(Col lege of Animal Science and Technology,Zhej iang Agricul ture&Forest University,Zhej iangHangzhou 311300)
畜禽大肠杆菌病已成为危害养殖业的最普遍发生且防治最棘手的疾病之一,如产志贺毒素大肠杆菌(Shiga toxin-producing Escherichia col i,STEC)能产生强烈毒素,严重危害畜禽健康,已成为全球性公共卫生问题的焦点,导致畜牧业经济损失日趋严重[1-2]。虽然抗生素的应用对畜禽致病性大肠杆菌起到了一定的抑制作用,但抗生素的滥用却导致了大肠杆菌耐药性的扩散,这使得畜禽疾病的防治更为困难[3]。大肠杆菌的耐药性分为固有耐药和获得耐药[4]。固有耐药是由细菌染色体基因决定,而获得耐药是指细菌在接触抗生素后,通过改变代谢途径使自身不被抗菌药物杀灭的抵抗力,获得耐药可通过耐药基因的传代、转移、传播、扩散、变异形成高度和多重耐药[5-6]。大肠杆菌在大量使用非必要抗生素的环境下,易产生耐药性,并且其耐药性会随时间推移大幅度上升,最终导致耐药菌株的出现[7]。大肠杆菌可通过噬菌体、质粒、转座子等遗传因子,使耐药基因、毒力基因水平转移至其他菌株[8]。本试验对猪场大肠杆菌耐药性和毒力展开研究,旨在阐明抗生素可促进大肠杆菌耐药性的形成、大肠杆菌毒力基因水平转移的可能性,以期为猪肠道疾病的防治提供理论依据。
1 材料与方法
1.1药品和试剂试验用抗生素,药敏试纸,置于-20℃冰箱中备用。模式菌株EDL933,MG1655为微生物实验室保存菌种。Kovacs试剂、甲基红试剂、Luria-Ber tani(LB)培养基、三糖铁和麦康凯等培养基所用原料均购自上海生工生物公司。PCR试剂盒、DL2000Marker、LBKan50、O157∶H7大肠杆菌血清试剂盒、DIG核酸检测试剂盒、ELISA检测试剂盒均购自宝生物工程(大连)公司。
1.2试验方法
1.2.1大肠杆菌的分离在杭州市6个规模猪场采集猪粪样。取6支5 mL灭菌离心管,编号1~6,用灭菌小钥匙刮取猪大肠内少许粪便,装入标记好的离心管中并立刻盖上。采集的样本经PBS稀释后分别划线接种于LB固体培养基,37℃培养24 h,然后各挑取15个单菌落接种于LB液体培养基培养24 h后,于麦康凯固体培养基上划线培养,进行菌株筛选。取筛选获得的具大肠杆菌性状的LB液体培养基中的菌液,穿刺并划线接种于三糖铁斜面培养基作进一步观察。挑取经筛选获得的菌株各3个,分别接种于LB液体培养基,37℃培养24 h,备用。
1.2.2药敏试验采用纸碟法。先制备LB固体培养基平皿,在平皿上均匀涂布菌液。随后,在该平皿上分别放置含供试抗生素的药敏纸片。培养皿先正着放在温箱中培养4 h后,倒置培养20 h,测量抑菌圈的大小,并进行统计,该试验每个菌株,每种抗生素设3次重复,5个平行。卡那霉素、阿莫西林、链霉素、磷霉素、青霉素、氟苯尼考、庆大霉素、强力霉素与四环素等抗生素均购自南京都莱生物公司。
1.2.3最小抑菌浓度(M IC)测定分别取LB液体培养基中500μL各菌液于含4.5 mL LB液体培养基试管中混匀,将要检测的6种抗生素都配成2 560μg/mL浓度,备用。取96孔培养板,第2~11孔加入用LB液体培养基稀释好的菌液0.1 mL。然后于第1孔加入抗生素溶液0.2 mL,混合后吸0.1 mL加入第2孔中,用同样的方法稀释至第11孔,弃去0.1 mL。各孔中药物浓度分别为2 560、1 280、640、320、160、80、40、20、10、5、2.5μg/mL。以第一孔作为对照组。37℃培养24 h,以目测法观察浑浊度,找出第一个澄清的菌液孔,确定为最低抑菌浓度,试验重复3次。
1.2.4大肠杆菌毒力基因Stx2的检测取6个采样点分离鉴定后的大肠杆菌,取单个菌落接种于3 mL的LB液体培养液,37℃培养24 h。热毒力基因Stx2基因的上游引物:AATAGTATACGGACAGCGAT,下游引物:TCTGACATTCTGGTTGACGC。取0.5μL DNA作为10μL PCR扩增体系的模板,包含1μL的dNTP、0.5μL的上下游引物、0.2μL的Taq聚合酶、1μL的10×PCR Buf fer与6.3μL的灭菌蒸馏水,PCR反应条件为预变性(94℃、10 min)、变性(94℃、30 s)、退火(56℃、30 s)、延伸(72℃、40 s),循环数为30次,72℃最后延伸10 min。PCR反应产物用EB染色后在2%(W/V)的琼脂糖凝胶电泳检测,置于紫外检测仪下观察。
1.2.5菌落原位杂交筛选转化形成的Stx2系大肠杆菌将EDL933大肠杆菌和含有庆大霉素的MG1655大肠杆菌在37℃下联合培养24 h;加入庆大霉素80μg/mL进行培养;对新转移得到的STEC大肠杆菌进行原位杂交,并且用DIG标签标记Stx2基因进行原位杂交,将MG1655和经过10倍稀释过的O157大肠杆菌一起放于80μg/mL庆大霉素的LB培养基上培养;将培养出的200~250个菌落,转移至硝酸纤维素滤膜;随后将硝酸纤维素滤膜移至LB-庆大霉素培养基上,在37℃的条件下培养3 h;培养过后,将已干燥的硝酸纤维素滤膜浸于10%的SDS溶液中,然后进行变性溶解和失性溶解,再用2倍的SSC溶液冲洗[17]。将硝酸纤维素滤膜在80℃的条件下烘烤2 h,将交叉结合的DNA与DIG标签进行杂交结合;带有Stx2基因的菌落,被DIG核酸检测试剂盒检测出来。从培养基中筛选出了3组被标记出的菌落,分别编号PS1、PS2、PS3。
1.2.6PCR证实新转化形成的出血性大肠杆菌将有甘油冷冻保存的O157∶H7、MG1655大肠杆菌以及可能存在含有Stx2基因的阳性菌株,通过置于LB液体培养基在37℃、通风的条件下,过夜培养复壮。其中,EDL933设为阳性对照,而MG1655设为阴性对照。取200μL的上述过夜培养物在10 000 r/min的条件下离心3 min,然后重新悬浮在200μL无菌水中煮沸15 min。最后从各个菌液中初步提取DNA,取1μL DNA作为25μL PCR扩增体系的模板;而25μL PCR反应体系还包含200μM的dNTP、200 nM的各游引物和一个单位的Taq聚合酶。其中Stx2基因的上游引物序列为:GGCACTGTCTGAAACTGCTCC,下游引物序列为:TCGCCAGTTATCTGACATTCTG,目标序列长度为255 bp, PCR反应产物用EB染色后在2%(W/V)的琼脂糖凝胶电泳检测。
1.2.7ELISA检测Stx2产物通过ELISA检测试剂盒对新转化形成的STEC毒性大肠杆菌(PS1、PS2、PS3)的毒力蛋白产物志贺毒素进行检测,以及对PS1、PS2、PS3进行检验,并设立EDL933为阳性对照、MG1655为阴性对照,从而判断PS1、PS2、PS3的Stx2毒力蛋白产生情况。ELISA的检测要点为:标本的采取和保存;试剂的准备;加样;保温;洗涤;显色和比色;定性测定。
1.2.8血清型鉴定将由甘油冷冻保存的O157∶H7、MG1655大肠杆菌以及新转移产生的STEC大肠杆菌,置于LB培养基上,在37℃、透气的条件下培养复壮。过夜培养后,在100℃的沸水中沸煮30 min,然后用O157∶H7大肠杆菌血清试验盒来检测O157血清类型。
1.2.9EDL933、MG1655与PS1-3包含O 157抗原基因的PCR检测对EDL955大肠杆菌、MG1655大肠杆菌以及PS1、PS2、PS3大肠杆菌,按O157标志性抗原基因的上游引物序列:CGGACATCCATGTGATATGG,下游引物序列:TTGCCTATGTACAGCTAATCC设计引物,序列长度为259 bp,用于检测大肠杆菌中O157抗原基因的存在情况,通过PCR扩增,之后进行琼脂糖凝胶电泳以及溴化乙锭染色,最后再紫外检测仪下观察并拍照记录。
2 结果与分析
2.1大肠杆菌的分离将从猪粪便中分离的致病性大肠杆菌,置于LB培养液中培养24 h,培养液呈混浊状,试管的液面管壁上有菌环和白色沉淀物;在LB固体培养基上可观察到灰白色、半透明、表面隆起、光滑湿润、边缘整齐的圆形菌落,直径约1~3 mm;在麦康凯培养基上挑取粉红色的菌落,经三糖铁培养基培养,筛选出黄色的菌落。六株大肠杆菌分离菌分别通过吲哚试验、甲基红试验、V-P试验、枸橼酸盐利用试验,鉴定均为大肠杆菌菌株。
2.2药敏试验由图1分析得出,所选取的6组大肠杆菌(每组5个菌)对卡那霉素,阿莫西林、青霉素等抗生素具有耐药性;对链霉素,磷霉素等抗生素具有敏感性。
2.3最小抑菌浓度测定由表1可知,6个采样点的大肠杆菌对卡那霉素、青霉素都有很高的最小抑菌浓度,但是对于氟苯尼考、庆大霉素、强力霉素和四环素,来自杭州6个不同猪场的大肠杆菌菌株的最小抑菌浓度表现出较大的差异。

表1 六种抗生素对大肠杆菌的最小抑菌浓度Table1 The m inima l inhibitory concentration to E.co li o f six antibiotics μg/m L
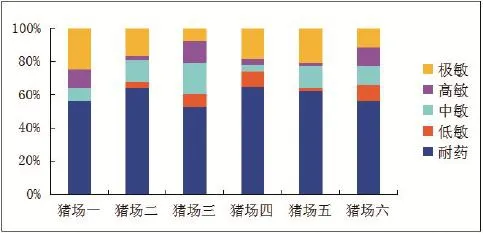
图1 药敏试纸试验结果Fig.1 Drug sensitivity test result
2.4毒力基因S S t t x x22的检测由图2可知,用Stx2、Sta、Stb等基因引物分别对六个猪场分离到的大肠杆菌进行PCR测定,其中Stx2基因的序列长度为563 bp;其中有猪场分离得到的大肠杆菌PCR检测到了Stx2毒力基因。
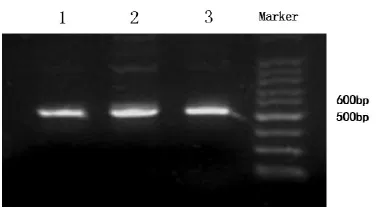
图2 常规PCR检测猪场大肠杆菌Stx2图谱Fig.2 The Stx2 map detected by PCR of E.coli in pig farm in Quzhou
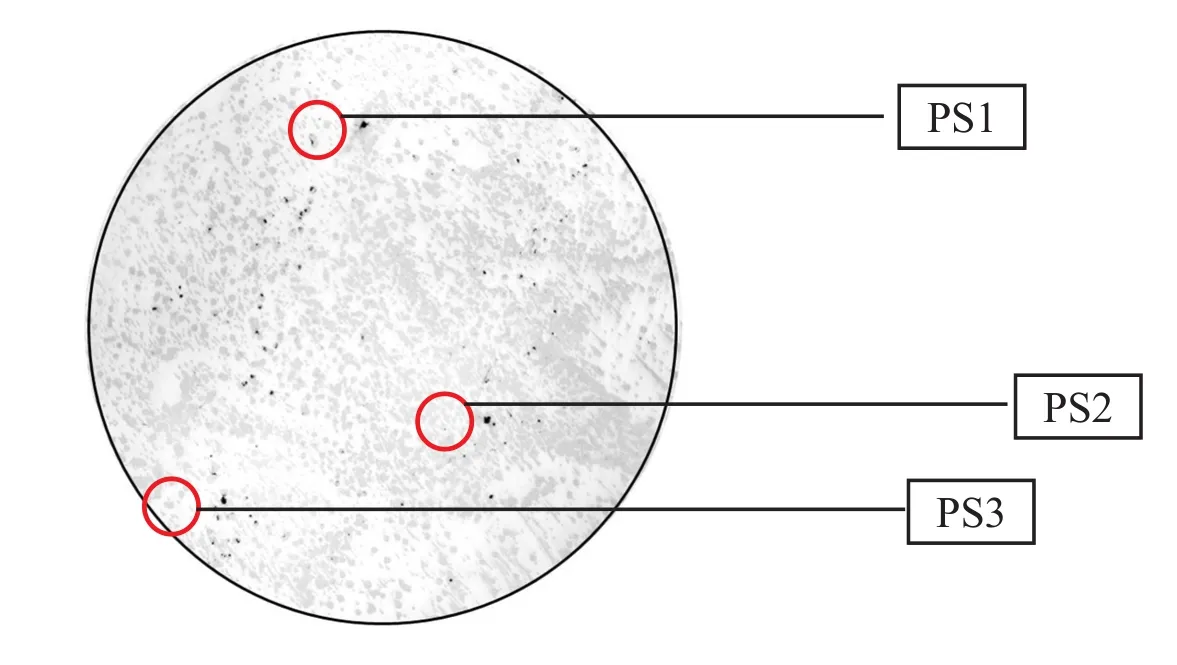
图3 DIG标签原位杂交Fig.3 DIG label in situ hybridization
2.5EDL933毒性大肠杆菌与MG1655无毒性大肠杆菌联合培养由图3可知,将EDL933毒性大肠杆菌与MG1655无毒性大肠杆菌联合培养,并将这两个菌种筛选分离后;用DIG标签进行原位杂交得到结果,黑点为被DIG标签所标记出的菌落(水平转移率约为0.87%);从培养基中筛选出了3个被标记出的菌落,分别编号PS1、PS2、PS3。

图4 EDL933毒性大肠杆菌、MG1655无毒性大肠杆菌与PS1-PS3大肠杆菌的Stx2基因Fig.4 The Stx2 o f EDL933,MG1655 and PS1-PS3 detected by PCR
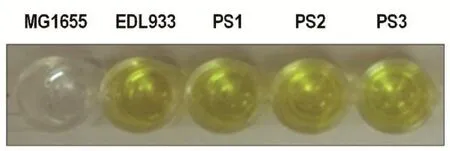
图5 ELISA试验结果Fig.5 The ELISA results

图6 凝集反应结果Fig.6 The resu lts of agg lutination test
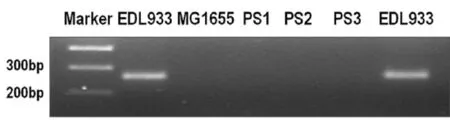
图7 常规PCR检测EDL933、MG1655以及PS1-3大肠杆菌中O157抗原基因Fig.7 The O157 antigen gene o f EDL933,MG1655 and PS1-3 E.co li detected by PCR
2.6EDL933、MG1655与PS1--PS3毒力基因的检测由图4可知,经过DIG标签标记筛选得到的PS1、PS2、PS3三个菌落的大肠杆菌与EDL933毒力大肠杆菌都含有Stx2毒力基因。说明Stx2毒力基因水平转移至MG1655无毒性大肠杆菌。
2.7ELISA试验由图5可知,EDL933毒性大肠杆菌及PS1、PS2、PS3大肠杆菌均可产生Stx2毒力蛋白,ELISA试剂盒的检测结果显示黄色,表明抗原Stx2基因表达产生的毒力蛋白。证实EDL933大肠杆菌中Stx2基因成功转移到PS1、PS2、PS3大肠杆菌的基因组中,并在相应菌株中表达后产生毒力蛋白。
2.8凝集反应鉴定由图6可知,用O157∶H7专用检测试剂盒,对O157基因进行凝集反应试验,表明EDL933毒性大肠杆菌发生凝集反应,而PS1、PS2、PS3大肠杆菌以及MG1655大肠杆菌未发生凝集反应;证明EDL933大肠杆菌含有O157抗原基因,而PS1、PS2、PS3大肠杆菌和MG1655大肠杆菌不含有O157抗原基因。说明PS1、PS2、PS3大肠杆菌中的Stx2毒力基因是由EDL933大肠杆菌转入得到的。
2.9EDL933、MG1655以及PS1、PS2、PS3大肠杆菌的O157抗原基因检测由图7可知,用O157抗原基因的特异性引物,对EDL933、MG1655以及PS1、PS2、PS3大肠杆菌进行检测。PCR反应观察试验结果,只有EDL933大肠杆菌中含有O157抗原基因, MG1665大肠杆菌及PS1、PS2、PS3大肠杆菌中均不含O157抗原基因。结合图6可知,PS1、PS2、PS3大肠杆菌中所具有毒力基因是通过转移得到的,并非本身含有的;PS1、PS2、PS3大肠杆菌是通过Stx2毒力基因水平转移得到的新形成的STEC毒性大肠杆菌。
3 讨论
大肠杆菌耐药性不仅严重阻碍猪肠道疾病的防控与治疗,而且可通过食物链将耐药基因传递给人类,危害人类健康[9]。通过基因的水平转移,获得外源性基因是加快临床耐药菌株产生与扩散的重要原因,SOS介导的诱导毒素合成也使含Stx基因的前噬菌体解离增加,SOS诱导的抗生素的临床应用可能与STEC疾病相关[10]。有猪场的大肠杆菌携带Stx2基因,可能是引起猪场仔猪腹泻的病原体之一,大肠杆菌携带的Stx2基因具有水平转移的能力,可导致正常的大肠杆菌也携带此毒力基因,进而转化成STEC。在猪场肠道病菌防控方面,首先应改变猪饲料的营养结构,如玉米秸杆发酵饲料及有益微生物复合剂,利用微生物间的拮抗作用,提高猪体的免疫能力[11]。其次在猪饲料中应加入既具有促进猪生长,又能够取代抗生素的微生态制剂、中草药、酶制剂等饲料添加剂,减少抗生素的使用量,有效降低大肠杆菌耐药性的积累[12];最后建立耐药性的监测系统,根据监测数据指导兽医临床合理使用抗生素,采取联合用药、交叉用药、轮换用药的方法,停止使用那些耐药水平很高的抗生素,使致病性大肠杆菌的耐药水平下降[13],同时注意改善猪场环境卫生,对病死猪及其粪便进行无害化处理,防止肠道病菌扩散。
[1]苏良科,严亚贤,陆承平.志贺毒素2型噬菌体Min27的stx2基因突变株构建及其感染特性[J].微生物学报,2008,11(48):1227-1233.
[2]Rey J,Sanehez S,Blanco J E.Prevalence,serotypesandvirulencegenesofShigatoxin-producing Escherichia col i isolated f romovine and caprine milk and other dairy productsinSpain[J].IntJFoodMicrobiol, 2006,107∶212-217.
[3]Mora A,Blanco M,Blanco J E,et al.Phage types and genotypes of shiga toxin-producing Escherichia col i O157∶H7 isolates f rom humansandanimalsinSpain∶Identi f ication andcharacterizationoftwopredominating phage types(PT2 and PT8)[J].J Cl in Microbiol,2004,42(9)∶4007-4015.
[4]严亚贤,华修国.大肠杆菌O157:H7的毒力因子的研究进展[J].畜牧与兽医,2003,18(4):39-42.
[5]杨柳,王思芦,罗音久.对规模化猪场大肠杆菌耐药性的调查[J].四川畜牧兽医,2006,22(5):24-25.
[6]孙鎏国,蒋锁俊,姚德法.致病性大肠杆菌的耐药性监测[J].上海畜牧兽医通讯,2004,21(7):18-20.
[7]黎建平.病原性仔猪大肠杆菌的药物试验[J].畜牧兽医杂志,1999,33(1):32-35.
[8]赵静,杨汉春.规模化猪场大肠杆菌对耐药性监测[J].中国兽医杂志,1998,24(11):12-13.
[9]魏智.仔猪致病性大肠杆菌药敏试验[J].福建畜牧兽医,2000,25(4):9-13.
[10]Kirii Y,Danbara H,Komase K,et al.Detection of enterotoxigenic Escherichia col i by colonyhybridizationwithbiotinylatedenterotoxin probes[J].J Cl in Microbiol,1987, 25(12)∶1962-1965.
[11]朱模忠.兽药手册[M].北京:化学工业出版社,2002:42-43.
[12]刘梦,黎建华.微生态制剂在兽药上的现况解析[J].农民致富之友,2013,15(2):155-156.
[13]ImamovicL,MuniesaM.CharacterizingRecA-Independent Induction of Shiga toxin2-EncodingPhagesbyEDTATreatment[J].PLOS ONE,2012,7(2),e32393.
Study on drug resistance and virulence ofporcine originated Escherichia colistrains
In order to prevent widespread infection of swine intestinal disease ef fectively, Drug resistance and virulence of porcine originated Escherichia col i st rains was studied in the experiment.Resul ts showed that Escherichia coli st rains were resistant to Kanamycin,amoxici ll in,penicil l in antibiotics,etc and sensitivity to st reptomycin,fosfomycin antibiotics,etc. The minimal inhibitory concentration(MIC)of Escherichia coli strains was higher between kanamycin and penici l l in,there were the obvious dif ferences for MIC of Escherichia col i st rains to benzene nicol,f luoride,gentamycin,doxycycl ine and tet racycline.Stx2 gene of Escherichia coli strains EDL933 was successful ly t ransfer red to genome of Escherichia coli st rains PS1,PS2 and PS3 and it expressed in the corresponding st rain,then producing toxic proteins.It reveals that virulence genes of Escherichia col i st rains EDL933 could undergo horizontal transfer,so as to provide scienti f ic basis for intestinal disease prevention and cont rol of swine.
Swine;Escherichia col i;Drug resistance;Virulence
S858.31
B
1672-9692(2016)01-0038-07
2015-11-07
曾俊棋(1990-),男,硕士,从事动物药理学研究。
岳万福(1967-),男,博士,副教授,从事动物药理学研究。
浙江农林大学校科研发展基金(2011FR009)资助。

