肺炎支原体感染实验室检测的研究进展
宋 明(SONG Ming),赵芝娜(ZHAO Zhi-na),徐慰倬(XU Wei-zhuo)
(沈阳药科大学生命科学与生物制药学院,辽宁 沈阳 110016)
·综述·
肺炎支原体感染实验室检测的研究进展
宋 明(SONG Ming),赵芝娜(ZHAO Zhi-na),徐慰倬(XU Wei-zhuo)
(沈阳药科大学生命科学与生物制药学院,辽宁 沈阳 110016)
肺炎; 支原体; 发病机制; 检测技术; 抗体; 胶体金; 实验室;
感染性肺炎(infectious pneumonia)指人体受病原微生物感染而发生的肺炎,病原体主要包括细菌、肺炎支原体、真菌和病毒等。每年有数以万计的人患病,且无季节特征,一年四季均可发生,病情严重程度无明显特征,各年龄段人群均可感染,尤其以老年人和儿童患者易感,重症者甚至可导致死亡[1-2]。社区获得性肺炎(community-acquired pneumonia,CAP)患者中3.3%~40%是由肺炎支原体感染引起,其中大约25%的肺炎支原体感染者合并肺外并发症,引起其他器官的损伤。肺炎支原体感染者临床症状多样,肺部体征一般较轻,有时甚至无任何肺部症状,仅以肺外并发症为首要症状。根据患者的流行病史、临床症状、胸片等相关检查,难以将其与一般病毒或其他细菌感染引起的呼吸道疾病相鉴别,所以在肺炎支原体感染的诊断中病原学检查具有重要作用。目前,越来越多的报道提示肺炎支原体感染与支气管炎急性发作、慢性阻塞性肺病、急性呼吸窘迫综合征、急性感染性多发性神经炎(格林-巴利综合征)、中风、冠心病、多发关节炎,以及人类免疫缺陷病毒(HIV)阳性者感染肺炎支原体导致血清阳性率升高有一定的关联[3],因此,呼吸道感染性疾病和非呼吸道感染性疾病均可能是由于肺炎支原体感染引起。临床治疗过程中需要针对不同的病原体而合理使用抗菌药物,因此,早期检测出肺炎支原体对指导治疗非常重要。在头孢类不过敏的人群中,头孢类药物用药安全指数较高,价格较便宜,抗菌效果较好,临床使用经验较多,患者接受性较强,所以临床医生通常首先选择头孢类药物治疗非病毒性感染疾病。因肺炎支原体无细胞壁,所以头孢类药物对肺炎支原体通常无效,鉴于上述原因支原体感染治疗面临的最大问题就是如何尽快选择合理有效的抗菌药物。目前,临床上部分医生一般先给予患者头孢类抗生素,治疗一段时间无效后再换用大环内酯类抗生素;部分基层医院儿科医生在尚未诊断为肺炎支原体感染,即开始给予大环内酯类抗生素治疗,上述做法均不是治疗感染的有效措施,也不能预防抗菌药物耐药。因此,早期、准确检测肺炎支原体,可及时指导临床治疗,进而预防可能发生的流行和并发症,减少抗菌药物的滥用,减轻患者的病痛与负担。
1 支原体肺炎的发病机制及治疗
1.1 生物学特征 目前确认对人致病的支原体有3种,即肺炎支原体(Mycoplasmapneumoniae,MP)、解脲支原体(Mycoplasmaurealyticum,MU),以及人型支原体(Mycoplasmahumenis,MH)。肺炎支原体是人类原发性非典型肺炎的病原体[4]。支原体的大小介于细菌与病毒之间,直径约为125~150 nm,可通过细菌滤器,是已知的独立生活的最小微生物,在含有胆固醇等特殊营养物质的培养基上才能生长,生长速度极其缓慢,接种10~15 d后才出现很小的菌落(<0.5 mm),对非作用于细胞壁的某些抗菌药物敏感。
1.2 发病机制及治疗措施 支原体较少侵入感染患者的血液及组织内,它可以通过特殊顶端结构黏附于感染者呼吸道上皮细胞膜上,这些特殊结构包括P1蛋白(170 kDa)、P30蛋白(30 kDa)、P116蛋白(116 kDa)、HMW1、HMW2、HMW3蛋白,以及肺炎支原体蛋白质A、B、C等,它们在结构和功能上互相协调作用,增加了肺炎支原体对宿主上皮细胞的黏附作用,以此来逃避黏膜纤毛摆动的清除作用。肺炎支原体可刺激机体产生IgM、IgG和IgA抗体,并可引起感染者细胞膜抗原表位发生改变,从而产生抗自身抗原的抗体,导致机体损伤。目前,对肺炎支原体P1蛋白研究较多,它属于膜表面蛋白一种,抗原特异性强[5],常被用来作为检测的目的物,但是P1蛋白并不是肺炎支原体独有的,支原体属中其他种也有该结构,需注意交叉反应。
支原体肺炎的治疗原则与一般肺炎的治疗原则基本相同,通常采取综合治疗措施。抗菌药物的应用在肺炎支原体感染治疗中占据重要位置,尤其是老年人、儿童或重症患者,必须选择合适的抗菌药物治疗支原体感染。通常干扰微生物细胞壁合成的抗菌药物,如头孢类、青霉素类等对肺炎支原体是无效的。因此,治疗肺炎支原体感染,应选用干扰DNA复制、RNA转录或抑制蛋白质合成的抗菌药物,如大环内酯类、四环素类、氯霉素类、喹诺酮类等[6]。在临床治疗过程中,阿奇霉素治疗肺炎支原体感染效果显著,不仅抗菌作用强,而且药效持久,但治疗过程中需要注意药物体内蓄积和抗生素后效应(阿奇霉素长达48 h),否则会引起肝肾损伤。
1.3 诊断标准 支原体肺炎临床症状常见刺激性咳嗽,酷似百日咳样咳嗽,肺部经常无明显阳性体征,血清学检查很精确,但仅在病情好转后才能提供诊断,因此,给临床医生的诊断带来极大的困难。
2 肺炎支原体临床检测方法
2.1 影像学方法 支原体肺炎影像学改变多样化,阳性特征不显著,故影像学检查特异性较差,单独依靠影像学检查结果不能作为诊断依据[7-8]。
2.2 血常规和C反应蛋白(CRP)检测 肺炎支原体感染患者血白细胞计数(WBC)和急性期CRP值与健康者相比,略有升高或无明显变化,因此,单独应用血常规和CRP检测不能诊断支原体肺炎,给临床诊断带来困难[9-10]。
2.3 分离培养 肺炎支原体的分离培养是世界卫生组织推荐的诊断金标准。传统的分离培养方法耗时2~4 周,灵敏度也较低,不能满足临床快速诊断的要求。目前,分离培养方法在临床诊断上依然适用,现采用了新型快速培养法,标本一般采集患者痰,37℃培养5~14 d[11]。培养基由固体培养基变为液体培养基,培养基内含肺炎支原体增殖所需的包括胆固醇等特殊营养物质在内的所有营养成分,并在培养时加入抑制其他微生物生长的青霉素等。肺炎支原体生长的代谢产物会使培养液中指示剂颜色发生改变(由红色变为黄色为阳性),以此判断其生长与否,菌量达104CFU/mL才有诊断意义。
2.4 聚合酶链反应( polymerase chain reaction,PCR)检测 1989年Bernet等[12]将PCR技术应用于肺炎支原体的诊断。PCR方法采用的目标基因引物目前有三种,第一种是根据肺炎支原体编码P1黏附蛋白的基因设计,第二种是根据16SrRNA的基因设计,第三种是根据肺炎支原体延伸因子Tu (elongation factor Tu,EF-Tu)的基因设计[13]。三类引物的设计均需避免与生殖支原体(Mycoplasmagenitalium,MG)的交叉反应。因肺炎支原体的P1蛋白和延伸因子Tu基因与生殖支原体的基因有共同序列,设计PCR探针时候需要注意。
PCR检测的准确性受采样方法和途径的影响。目前,常用的采样方式有两种:患者呼吸道分泌物及血清采样,其中呼吸道采样报道较多。但是呼吸道采样结果经常与临床血清学采样检测结果存在差异,主要是因为一些无症状者的咽喉部存在肺炎支原体[14-15]。
PCR方法灵敏度高(可达20 CFU/5 μL)[16]、特异性强,可用于肺炎支原体感染的早期诊断。但是,该法操作技术要求高,仪器设备昂贵,样品采集、保存和处理要求高(样品、场所污染均可能造成假阳性),不适合在一般实验室开展。而且报道认为,PCR检测结果为阳性的患者可能并未感染支原体肺炎,一种情况是前面所描述的无症状者,另外还可能是既往感染后遗留的片段。Nilsson等[17]报道,急性感染患者喉部残留的DNA片段可以存在较长时间,可以持续45~52 d。
2.5 支原体抗体检测方法
2.5.1 被动凝集法(passive agglutination) 目前,临床上常用的是日本富士瑞必欧株式会社生产的塞乐迪亚-麦可II肺炎支原体抗体诊断试剂盒(SERODIA-MYCOII)。该试剂盒用人造凝胶颗粒代替红细胞成为载体,且避免了既往被动凝集试验以动物红细胞为载体的非特异性反应,测定的是肺炎支原体特异性抗体,包含IgA、IgM、IgG,而非直接测定肺炎支原体。该方法主要通过间接试验检测肺炎支原体,待检血清抗体滴度≥1︰40为阳性,但缺点比较明显,有些既往感染肺炎支原体的患者体内IgG滴度水平本身较高,IgG滴度水平在非感染情况下已经≥1︰40,造成该方法检测的阳性率偏高。吴晓等[18]证实采用被动凝集法的阳性率为(56%),高于冷凝集法(25%)、ELISA法(31%)和金标渗滤法(17%)。被动凝集法的结果判定无需特殊仪器设备,操作方便、快捷,但是该方法可以检测肺炎支原体总抗体,无法判断肺炎支原体感染者血清中升高的抗体具体类型,也无法判断患者属于早期感染还是既往感染,因此影响临床诊断。但若检出高效价滴度(≥1︰160 ),可以作为肺炎支原体感染早期诊断的一个依据[19]。
2.5.2 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA) ELISA可检测肺炎支原体的特异性IgM 或IgG 抗体,操作方法简单。ELISA 法通常以酶标记抗人免疫球蛋白抗体作为示踪物,可以检测人血清中的IgM和IgG, 也可以检测非补体依赖性的抗体,尤其是IgA类抗体。具体操作方法是将抗原物质预先包被在反应板微孔中,然后加入受检者的血清样品,再加入底物3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)显色后,加终止液停止反应,在一定波长下测OD值,OD值与被测抗体的含量成正比。ELISA 法对呼吸道肺炎支原体感染的诊断具有重要参考价值,与传统的支原体培养方法比较,耗时较短,仅需数个小时,且与其他常见的呼吸道病原体无交叉反应[20]。与其他方法比较,受检者接受抗生素治疗不影响ELISA法检测结果,能够避免患者使用抗生素后出现的假阴性结果。
肺炎支原体ELISA检测试剂盒的抗原选择非常重要,它决定了检测肺炎支原体的灵敏度和特异性,目前主要有四大类抗原,分别是肺炎支原体全细胞裂解物(whole cell lysates)、蛋白提取物(protein extracts)、膜制备物(membrane preparations)、糖脂提取物(glycolipid extracts)。由于支原体属中其他种类,以及很多革兰阴性菌均有与肺炎支原体相同或相似的抗原,所以ELISA方法检测肺炎支原体抗体的关键是选择合适的预包抗原,将其固定在反应板微孔中,减少交叉反应。现在已有多家厂商出售ELISA 试剂盒,临床上应用广泛[21]。R-Biopharm,Euroimunn,Medisonic,Novatec,Zeus,Savyon等均有相关检测诊断产品,本文列出了部分市售检测肺炎支原体抗体的ELISA试剂盒。见表1。
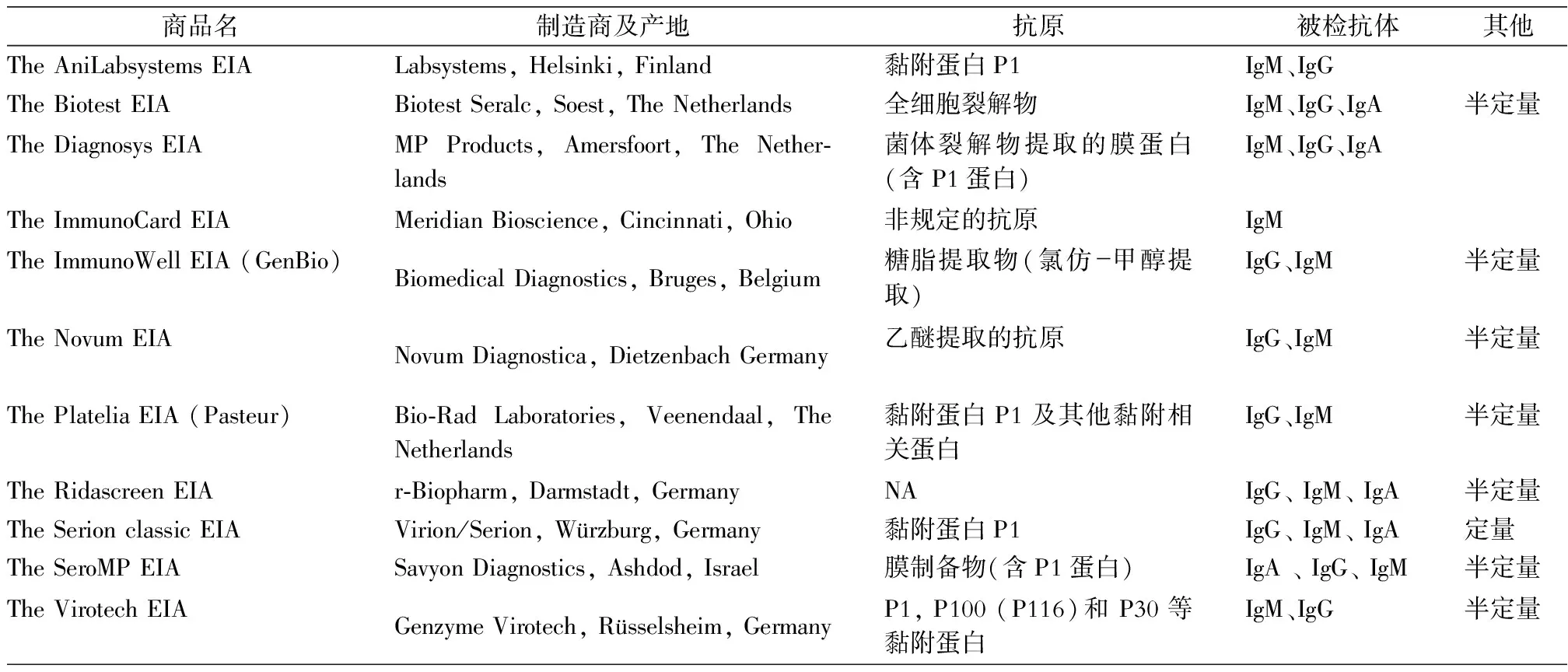
表1 市售检测肺炎支原体抗体ELISA试剂盒比较[21]
NA :Not Available,表示不能提供数据
目前,许多研究者利用人工合成短肽作为检测用抗原,这些抗原的基因克隆扩增后导入异源细胞中进行表达,然后再将这些表达出来的重组蛋白作为抗原制成预包被板,灵敏度高、特异性强。重组ATP合酶β亚单位(recombinant ATP synthase β-subunit,rAtpD)、重组P116蛋白N端片段、重组P1蛋白C端片段、重组P30蛋白质,以及它们的融合蛋白等均是ELISA检测试剂盒中很好的预包被抗原。本文比较了rAtpD、重组P1蛋白C端片段、重组P116蛋白N端片段、重组P30蛋白质,以及它们的融合蛋白作为ELISA检测试剂盒中预包被抗原的检测结果,结果显示这些重组蛋白的灵敏度和特异性均较高,非常适合开发成检测肺炎支原体IgM的试剂盒,为早期检测肺炎支原体提供了重要依据[22]。见表2。
表2 重组蛋白作为包被抗原的ELISA检测试剂盒检测结果比较
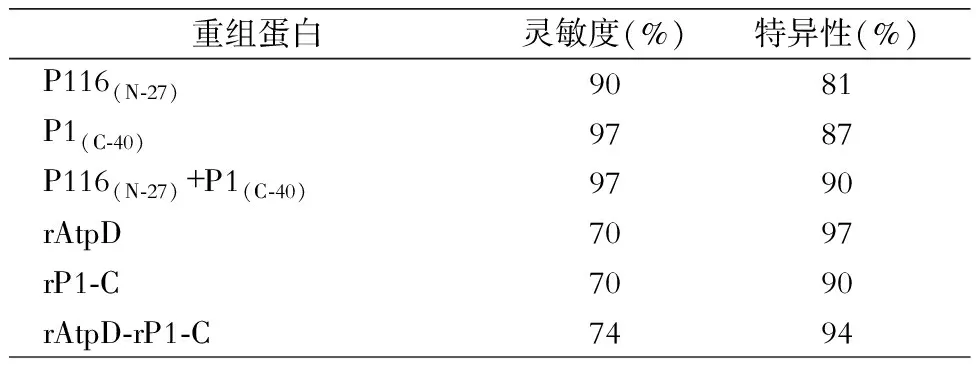
重组蛋白灵敏度(%)特异性(%)P116(N⁃27)9081P1(C⁃40)9787P116(N⁃27)+P1(C⁃40)9790rAtpD7097rP1⁃C7090rAtpD⁃rP1⁃C7494
ELISA检测肺炎支原体主要采用患者血清,也有少量报道采用患者尿。ELISA法的缺点也非常明显,检测过程中常需两份不同时期的血清样本,一份是急性感染期血清样本,另外一份是感染后2周的血清样本,后者的抗体滴度应该是前者的4倍或大于4倍才可确定为阳性。但临床上从感染患者体内采集两次血做检查并不容易,因为两周后患者症状基本缓解,住院患者大部分已经出院,尤其是在儿童医院,更是难以操作。而且,即使收集到两次血清样本,检测结果也符合早期临床诊断,但是2周后的结果属于回顾性检测,此时的检查结果对临床医生合理使用抗菌药物和采取合适的治疗策略无任何指导意义。Chang等[23]发现利用ELISA方法检测IgM所指示的细菌感染量与患者临床表现并不一致,所以单独使用ELISA法检测IgM具有很大的局限性,而且也不符合早期诊断的要求。另外,报道[24]显示,在临床实际应用中部分ELISA试剂盒对成人MP感染的检出率过低,如何保证ELISA检测试剂盒高效的灵敏度和稳定的特异性,还有待于进一步研究。
2.5.3 胶体金免疫层析法 胶体金免疫检测技术是在传统免疫检测技术的基础上发展起来的新型检测技术,其原理是基于抗原抗体反应的高特异性和高亲和性,以及胶体金纳米颗粒的示踪放大效应。1971年Faulk和Taylor两位研究者将胶体金与抗原结合,利用抗原标记的胶体金研究沙门菌细胞壁的抗原成分,首次发现了胶体金标记技术,为胶体金免疫检测技术的发展开辟了新道路[25]。采用胶体金免疫层析试纸条进行检测,试验结果可以在5~10 min内通过肉眼进行观察[26]。目前,检测病原菌或免疫球蛋白等细胞或大分子最常用的方法是双抗夹心法,利用连接于固相载体(硝酸纤维膜)上的抗体(捕获抗体)和胶体金标记抗体(检测抗体)分别与样品中被检测抗原分子上的两个抗原表位相结合,形成固相抗体-抗原-胶体金标记抗体免疫复合物。当抗原分子所在的液体流经金垫时,与溶解了的胶体金标记抗体结合,然后再往前流动,经过检测线(T线)时被捕获抗体捕获,同时部分抗原分子继续前进至控制线(C线),与羊抗鼠抗体结合,见图1。该检测方法无需任何仪器设备,具有方便、快速、便宜、适合现场检测等优点,适宜在一般基层医院开展应用。该检测方法的报告结果只能报告阴性或阳性,不能报告滴度。国内产品如福建海天蓝波、潍坊康华、珠海丽珠和深圳普瑞康等均已经在临床应用。
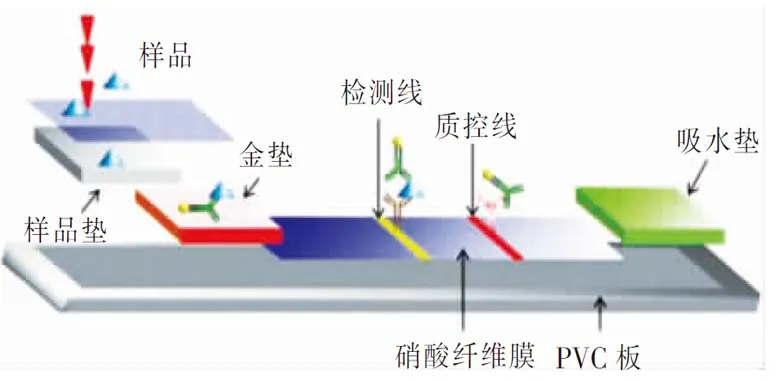
图1 双抗夹心法在胶体金免疫层析中的应用原理示意图
因为该方法检测的物质是针对患者的IgG或IgM,所以也属于回顾性检测,约滞后于早期感染数周,甚至数个月,也无法在早期给临床医生合理用药提供帮助,并且该方法存在假阳性,实验中发现健康人的样品检测结果也呈阳性[27-28]。目前,胶体金免疫层析方法检测肺炎支原体的研究主要集中在两个方向,一是对肺炎支原体半定量或定量的研究,另一个是直接对病原体进行定性检测。
2.6 检测肺炎支原体的新方法 基于Fe3O4磁性纳米颗粒的可视化技术检测病原微生物是近些年发展起来的新技术。传统的Fe3O4磁性纳米颗粒和辣根过氧物酶组成的反应系统中,Fe3O4磁性纳米颗粒是固定化的,整个系统的催化效率受到颗粒大小和相对表面积大小的限制。而MingzhuYang团队开发出一种可溶性Fe3O4磁性纳米颗粒反应系统,这种基于可溶性Fe3O4磁性纳米颗粒(dissolved Fe3O4magneticn anoparticles,DMNPs)的类过氧化物酶性质可视化检测肺炎支原体技术突破了传统反应系统限制因素的制约,其反应机理是Fe3O4磁性纳米颗粒(Fe3O4magneticn anoparticles,MNPs)首先完全溶解在一定浓度的含铁离子的酸中,然后铁离子催化TMB显色液中的H2O2,产生高活性的羟基自由基(·OH),随后·OH氧化底物TMB颜色变蓝,反应物的最大吸收峰在652 nm[29]。见图2。
Mingzhu Yang团队将免疫检测技术与DMNPs可视化检测技术完美融合,开发出基于DMNPs的间接免疫检测肺炎支原体系统。见图3。
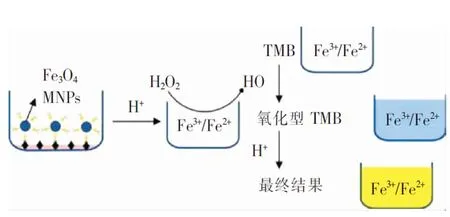
图2 基于DMNPs的类过氧化物酶性质可视化检测技术原理[29]
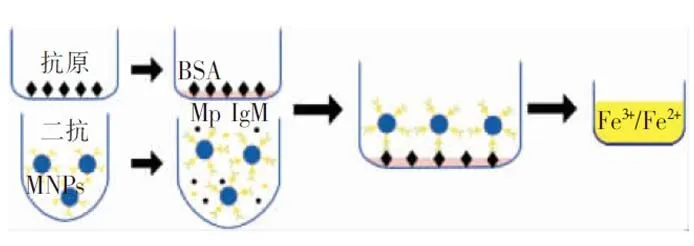
图3 基于DMNPs的间接免疫检测肺炎支原体系统
实验中选择了两种修饰性磁性颗粒,一种是Fe3O4MNPs-NH2,另外一种是 Fe3O4MNPs-PEI(PEI:聚乙烯亚胺),然后将修饰性磁性颗粒与二抗相偶联。若血清样本中存在抗肺炎支原体抗体(被检测抗体IgM),则标记有二抗的修饰性磁性颗粒会与MP IgM结合形成复合物,然后复合物通过IgM与预先固定好的肺炎支原体P1蛋白(抗原)结合,经过孵育后,洗掉未结合的复合物,最后在反应体系会发生图2中的显色反应,然后通过检测可得到具体数值。基于DMNPs的间接免疫检测肺炎支原体系统是一种灵敏性高、价格低廉、耗时少的技术。
近年来,量子点(quantum dots,QDs)凭借其自身独特的光谱特征和光化学稳定性受到人们越来越多的重视。与传统荧光染料相比,量子点这种半导体纳米晶体,具有激发光谱宽、发射光谱窄、发光效率高,发光颜色可调,荧光强度和光稳定性较高,且能够承受多次的激发和光发射等一系列优点[30-31],因此,在实验室诊断得到广泛应用。胡纪文等[32]研究在偶联剂碳二亚胺EDC和N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)的作用下,兔抗人肺炎支原体多克隆抗体与羧基量子点(Cd Se/Ze S)偶联,制备量子点标记物,以抗P1蛋白抗体作为捕获抗体,建立双抗体夹心量子点免疫层析法检测肺炎支抗原。实验中检测了50份临床咽拭子标本,并与培养法相比较,结果显示阴性符合率为97%,阳性符合率为100%,最低检出浓度为0.5 ng/mL,因此,证明该实验方法可用于肺炎支原体感染的早期诊断。
2.7 直接检测肺炎支原体的方法 直接检测肺炎支原体需要克服分离培养的缺点,即必须耗时短,操作简便,漏报率低。Miyashita等[33]报道了一种检测肺炎支原体病原体的免疫层析试剂盒Ribotest Mycoplasma (Asahi Kasei Pharma Co.,Tokyo,Japan),与PCR方法对比,发现其灵敏度、特异性和总体性能分别是62.5%、90.9%和88.9%。该检测试剂盒检测的抗原是患者血清中肺炎支原体核糖体蛋白L7/L12,由于其灵敏度偏低,漏检率偏高,并且检测过程中需要抽血取样,因此不太适合床旁检测。周转等[20 ]制备了抗肺炎支原体的多克隆抗体,通过ELISA方法检测,共耗时约6 h,该检测方法与传统培养鉴定方法进行比较,检测阳性率约为92.86%,并且与其他常见的呼吸道病原体无交叉反应。涂少华等[34]制备了Mp单抗5B9、4D6,利用两个单抗制备了双抗体夹心ELISA 检测肺炎支原体抗原的试剂盒,147份临床标本PCR检测阳性率为13.6%(20/147),双抗体夹心ELISA法检测阳性率为12.2% (18/147),两者符合率达95.9 %。
Li等[35]在2015年开发出一种快速检测肺炎支原体的方法,该方法是基于胶体金免疫层析技术设计的,选取了一对抗肺炎支原体P1蛋白的单克隆抗体(分别是A和B)作为标记抗体和检测抗体,同时以PCR方法检测临床标本为“金标准”,两种方法作了对比实验,实验结果表明胶体金快速检测肺炎支原体试纸条的特异性达100%,灵敏度达97%,最低检测浓度达到103copies/mL,实验结果见表3。该方法可能会成为一种快速、准确、简便的临床检测肺炎支原体的新方法。
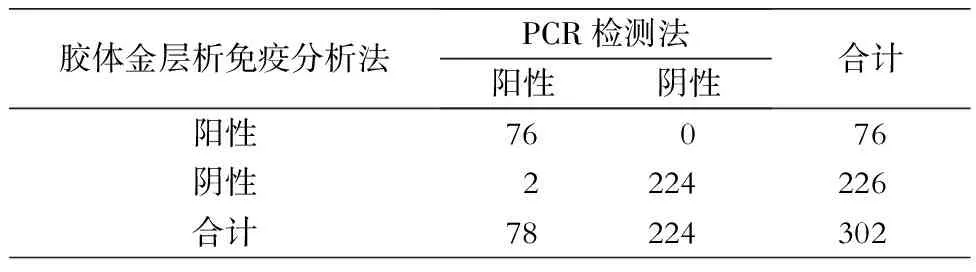
表3 胶体金法和PCR法检测结果的比较
3 展望
目前,肺炎支原体感染实验室诊断方法大致分为分离培养、血清学检查,以及PCR检测技术。肺炎支原体分离培养检测结果最可靠,但缺点是时间长,阳性率低。PCR检测法对仪器设备要求较高,操作繁琐,价格昂贵,也不能满足临床快速诊断的需要,所以,目前MP感染的实验室诊断仍然主要依靠血清学检查,但是血清学检查假阳性或假阴性结果较多。目前,临床上基于磁纳米球和量子点技术的新检测方法应用也较少,主要是因为技术稳定性不够高,仍然需进一步研究。胶体金免疫层析法检测IgG和IgM的特异性强、灵敏度高,且无需任何仪器设备,操作简单快捷。但该方法只能显示阳性结果,无法报告滴度,而且该方法和ELISA法检测抗体相同,均属于回顾性检测,实效性不强,临床应用有一定的局限。另外,重症感染或再感染者可能生成IgM较少,容易出现假阴性,造成漏检,所以检测IgM抗体也不是最好的选择。如果能够利用操作便捷、特异性强的胶体金免疫层析方法直接检测肺炎支原体,就可以实现对肺炎支原体的早诊断、早治疗,从而提高治愈率,减少抗菌药物滥用,减轻患者痛苦及经济负担。
[1] Hortmann M, Heppner HJ, Singler K, et al. Community acquired pneumonia in the emergence department-do standardized care bundles improve quality of care? [J]. Anasthesiol Intensivmed Notfallmed Schmerzther, 2015, 50(2): 92-101.
[2] Marrie TJ. Community-acquired pneumonia[J]. Clin Infect Dis, 1994,18(4): 501-513.
[3] 范炤,王素萍,赵启玉,等.社区获得性肺炎流行特征及病原学分布[J].中国公共卫生,2008,24(7):825-827.
[4] 董宗祈.肺炎支原体感染的致病机制与治疗的关系[J].中华实用儿科临床杂志,2007,22(4):243-245.
[5] 鞠丽丽,任欢,齐颖,等.肺炎支原体感染的研究进展[J].现代生物医学进展,2013,13(26):5190-5193.
[6] Nagalingam NA, Adesiyun AA, Swanston WH, et al. Prevalence ofMycoplasmapneumoniaeandChlamydiapneumoniaein pneumonia patients in four major hospitals in Trinidad[J].New Microbiol, 2004, 27(4): 345-351.
[7] 裘华兴.儿童支原体肺炎的临床X线分析[J].实用放射学杂志,2002,18(11):951-953.
[8] 张晓晔,张伟,朱敏,等.成人支原体肺炎的CT影像表现[J].中国医学影像技术,2007,23(7):1026-1029.
[9] Inamura N, Miyashita N, Hasegawa S, et al. Management of refractoryMycoplasmapneumoniaepneumonia: utility of measuring serum lactate dehydrogenase level[J]. J Infect Chemother, 2014, 20(4): 270-273.
[10] 焦瑞宝,唐吉斌,成冰,等.hs-CRP和WBC联合检测在儿童呼吸道感染中的应用[J].检验医学与临床,2010,7(19):2085-2086.
[11] 孙红妹.肺炎支原体感染的实验室诊断[J].中华实用儿科临床杂志,2007,22(4):245-248.
[12] Bernet C, Garret M, de Barbeyrac B, et al. Detection ofMycoplasmapneumoniaeby using the polymerase chain reaction[J]. J Clin Microbiol, 1989, 27(11): 2492-2496.
[13] Bakula Z, Modrzejewska M, Safianowska A, et al. Proposal of a new method for subtyping ofMycobacteriumkansasiibased upon PCR restriction enzyme analysis of thetufgene[J]. Diagn Microbiol Infect Dis, 2015, 84(4): 318-321.
[14] Daxboeck F, Khanakah G, Bauer C, et al. Detection ofMycoplasmapneumoniaein serum specimens from patients withMycoplasmapneumoniaby PCR[J]. Int J Med Microbiol, 2005, 295(4): 279-285.
[15] 杨文青,吕晓丽,李锐成,等.实时荧光定量PCR检测肺炎支原体DNA在小儿肺炎诊断中的应用价值[J].国际检验医学杂志,2014,35(4):416-418.
[16] Dumke R, Jacobs E. Evaluation of five real-time PCR assays for detection ofMycoplasmapneumoniae[J]. J Clin Microbiol, 2014, 52(11): 4078-4081.
[17] Nilsson AC, Björkman P, Persson K. Polymerase chain reaction is superior to serology for the diagnosis of acuteMycoplasmapneumoniaeinfection and reveals a high rate of persistent infection[J]. BMC Microbiol, 2008, 8:93.
[18] 吴晓,郑颖,赵志钢,等.被动凝集法检测肺炎支原体抗体的实验室研究[J].中国卫生检验杂志,2009,19(12):2886-2888.
[19] 刘学政,董虹,雷选斌.被动凝集定量检测法在早期肺炎支原体感染诊断中的应用[J].海南医学,2012,23(2):97-98.
[20] 周转,李军涛.肺炎支原体抗原酶联免疫检测方法的建立[J].热带医学杂志,2009,9(5):530-532.
[21] Beersma MF, Dirven K, van Dam AP, et al. Evaluation of 12 commercial tests and the complement fixation test forMycoplasmapneumoniae-specific immunoglobulin G(IgG)and IgM antibodies, with PCR used as the “gold standard”[J]. J Clin Microbiol, 2005, 43(5): 2277-2285.
[22] Tabassum I, Chaudhry R, Chourasia BK, et al. Identification of an N-terminal 27 kDa fragment ofMycoplasmapneumoniaeP116 protein as specific immunogen inM.pneumoniaeinfections[J]. BMC Infect Dis, 2010, 10:350.
[23] Chang HY, Chang LY, Shao PL, et al. Comparison of real-time polymerase chain reaction and serological tests for the confirmation ofMycoplasmapneumoniaeinfection in children with clinical diagnosis of atypical pneumonia[J]. J Microbiol Immunol Infect, 2014, 47(2):137-144.
[24] 唐寅.肺炎支原体IgM抗体ELISA检测试剂盒临床应用评价[J].国际检验医学杂志,2012,33(16):2016-2017, 插1.
[25] Faulk WP, Taylor GM. An immunocolloid method for the electron microscope[J]. Immunochemistry, 1971, 8(11): 1081-1083.
[26] 张美玲,檀华,朱虹,等.支原体肺炎快速诊断试纸的研制及初步应用[J].实用医药杂志,2006,23(10):1161-1163.
[27] Alexander TS, Gray LD, Kraft JA, et al. Performance of meridian ImmunoCard Mycoplasma test in a multicenter clinical trial[J]. J Clin Microbiol, 1996, 34(5):1180-1183.
[28] Miyashita N, Kawai Y, Yamaguchi T, et al. Clinical potential of diagnostic methods for the rapid diagnosis ofMycoplasmapneumoniaepneumonia in adults[J]. Eur J Clin Microbiol Infect Dis, 2011, 30(3): 439-446.
[29] Yang MZ, Guan YE, Yang Y, et al. A sensitive and rapid immunoassay forMycoplasmapneumoniabased on Fe3O4nanoparticles[J]. Mater Lett, 2014, 137(15):113-116.
[30] Kobayashi H, Hama Y, Koyama Y, et al. Simultaneous multicolor imaging of five different lymphatic basins using quantum dots[J]. Nano Lett, 2007, 7(6):1711-1716.
[31] 曾晶晶,何梦博,赵芝娜,等.量子点标记肺炎支原体重组蛋白抗体检测抗原方法的建立[J].中国人兽共患病学报,2011,27(8):704-707.
[32] 胡纪文,熊建辉,陈卓诚,等.人肺炎支原体抗原量子点免疫层析法的建立[J].中国热带医学,2015,15(7):795-798.
[33] Miyashita N, Kawai Y, Tanaka T, et al. Diagnostic sensitivity of a rapid antigen test for the detection ofMycoplasmapneumoniae: Comparison with real-time PCR [J]. J Infect Chemother, 2015, 21(6): 473-475.
[34] 涂少华,叶元康,沈昭在.双抗体夹心ELISA检测肺炎支原体抗原方法的建立及临床应用[J].现代医学,2004,32(6):390-392.
[35] Li W, Liu Y, Zhao Y, et al. Rapid diagnosis ofMycoplasmapneumoniaein children with pneumonia by an immuno-chromatographic antigen assay[J]. Sci Rep, 2015, 5:15539.
(本文编辑:孟秀娟)
Advances in laboratory detection forMycoplasmapneumoniaeinfection
(School of Life Science and Biopharmaceutics, Shenyang Pharmaceutical University, Shenyang 110016, China)
2016-04-20
国家高技术研究发展计划(863计划)资助项目(2014AA020901)
宋明(1980-),男(汉族),辽宁省大连市人,博士,主要从事临床检验与微生物药学研究。
徐慰倬 E-mail:weizhuo@263.net
10.3969/j.issn.1671-9638.2016.11.022
R375+.2
A
1671-9638(2016)11-0887-07

