南极适冷菌Psychrobacter sp. G冷激蛋白基因Csp2039的表达分析*
李 阳,车 帅,王 桢,林学政*
(1.国家海洋局 第一海洋研究所,山东 青岛,266061;2.国家海洋局 海洋生物活性物质重点实验室,山东 青岛, 266061)
南极适冷菌Psychrobacter sp. G冷激蛋白基因Csp2039的表达分析*
李 阳1,2,车 帅1,2,王 桢1,2,林学政1,2*
(1.国家海洋局 第一海洋研究所,山东 青岛,266061;2.国家海洋局 海洋生物活性物质重点实验室,山东 青岛, 266061)
以南极适冷菌Psychrobactersp. G为研究对象,利用qRT-PCR和Western blot技术从转录水平和翻译水平对冷激蛋白基因Csp2039在不同温度/盐度胁迫条件下的表达特征进行了研究。在转录水平上,qRT-PCR分析表明,冷激蛋白基因Csp2039的表达于6 h时显著被低温(0 ℃,10 ℃)和高温(30 ℃)诱导;低盐(0)胁迫下,基因Csp2039的表达先被诱导后被抑制,在盐度为15的胁迫下,基因Csp2039的表达均被诱导,高盐(90,120)时基因Csp2039的表达在6 h时显著被诱导;在温度和盐度协同胁迫条件下,温度为0 ℃时,无论盐度高低,基因Csp2039的表达均显著上升,而高温(30 ℃)时,除2 h被低盐诱导以外,其余条件下均显著被抑制。在翻译水平上,Western blot分析表明,冷激蛋白Csp2039的表达被低温(0 ℃,10 ℃)显著诱导,但高温(30 ℃)对其抑制并不明显;在低盐(0,15)胁迫下,Csp2039蛋白的表达均被诱导,高盐(90)胁迫下,Csp2039蛋白的表达先被抑制,然后逐渐升高;在温度和盐度协同胁迫条件下,低温(0 ℃)时,当盐度为15时,Csp2039蛋白的表达被诱导,盐度为90时,Csp2039蛋白的表达量被显著抑制;而高温(30 ℃)时,该蛋白在盐度15时6 h的表达量最大,盐度90时于6 h其表达被显著抑制。比较分析表明,在转录水平上基因Csp2039表达量的变化更容易受温度影响,而在翻译水平上盐度对Csp2039蛋白的影响作用大于温度;基因Csp2039在翻译水平上对温度/盐度胁迫的应答时间要迟于转录水平的。
Psychrobacter;冷激蛋白基因Csp2039;qRT-PCR;Western blot;表达分析
南极具有独特的地理、环境和气候特征,如寒冷、干燥、低营养、强辐射等[1]。微生物在南极生态系统及物质地球化学循环中起着重要作用,同时,基础研究及开发应用前景也很广阔。在这一极端的生态系统中,生态学中处于明显优势的是低温微生物,主要嗜冷菌和适冷菌为主[2],具有多种适应环境的机制,如极地微生物可以产生在低温下具有较高酶活力的低温酶[3];也可以通过降低细胞膜脂肪酸的不饱和度、碳链长度以及增加支链脂肪酸的含量来提高细胞膜的流动性,从而维持细胞膜功能[4-5];冷激基因能够正常表达产生冷激蛋白[6]等。冷激蛋白(cold shock protein,Csp)作为RNA的分子伴侣,可阻止mRNA在低温下形成稳定的二级结构,从而保持基因的表达效率,提高蛋白合成能力,维持正常的生理功能[6]。
冷激蛋白是指生物体在低温刺激下所产生的一系列小分子蛋白质,广泛存在于嗜冷和嗜温微生物中[7-8],包括大肠杆菌[9]、枯草芽孢杆菌[10]、球形节杆菌[11]、假单胞菌[12]等。大肠杆菌Csp蛋白家族主要包括9种冷激蛋白(CspA~CspI),其中CspA,CspB,CspE,CspG和CspI与冷激适应调制机制有关,均能被低温诱导[13],CspD对大肠杆菌生长稳定期的DNA复制有抑制作用,但不能被低温诱导[14]。在对冷激蛋白的研究中以对CspA的研究最多。CspA由70个氨基酸组成,三维结构包括由5个反向平行的β链组成的2个β折叠的β桶状结构和7个表面芳香烃结构,用来结合单链DNA[15]。大肠杆菌CspA基因序列在5'端有一段比较长的高度保守的非翻译区,对CspA基因表达起着非常重要的作用[15];当温度降低时,CspA基因的表达在转录水平上显著上升[16]。在极地细菌适应低温环境中冷激蛋白也起着重要的作用,低温可以诱导冷激蛋白基因的表达以适应外界温度的变化[17]。南极适冷菌Psychrobactersp. G中有3个冷激蛋白基因,qRT-PCR研究表明,属于CspA蛋白家族的基因Csp2039在低温条件下(0 ℃)表达量显著增加[18]。为进一步了解南极细菌的生境适应机制,本研究利用qRT-PCR和Western Blot技术对南极适冷菌Psychrobactersp. G中的Csp2039基因在不同温度、盐度和温盐协同胁迫条件下、在转录水平和翻译水平的表达情况进行了研究。
1 材料与方法
1.1 菌株与培养基
南极适冷菌Psychrobactersp. G分离自南极乔治王岛西南部的海水并保存于本实验室,该菌株的最适生长温度是20 ℃,最适生长盐度是45[19]。
南极适冷菌Psychrobactersp. G最适盐度培养基:胰蛋白胨5 g,酵母粉1 g,NaCl 14 g,溶解于1 L过滤后的青岛近海海水(盐度约为31)中,并于1×105Pa下湿热灭菌20 min[18],所使用不同盐度培养基的成分见表1。

表1 培养基成分Table 1 Component of culture medium
1.2 冷激蛋白基因Csp2039原核表达体系的构建
1.2.1 引物设计与冷激蛋白基因Csp2039的扩增
根据基因组测序结果(CP006265),设计用于冷激蛋白基因Csp2039克隆的特异性引物,在其5′端分别引入相应的限制性内切酶NdeI和XhoI的酶切位点(表2)。

表2 扩增冷激蛋白基因Csp2039的特异性引物Table 2 Specific primers used in amplification of gene Csp2039
特异性引物由博尚生物技术有限公司合成。以南极适冷菌Psychrobactersp. G的基因组为模板,进行PCR扩增。PCR条件如下:95 ℃ 5 min;95 ℃ 45 s,42 ℃ 30 s,72 ℃ 20 s,30个循环;72 ℃延伸10 min。
1.2.2 表达载体pET22b和目的基因的连接
目的基因Csp2039经PCR扩增和琼脂糖凝胶电泳分离后,用琼脂糖凝胶回收试剂盒(北京天根生化科技有限公司)切胶回收目的片段,分别用限制性内切酶NdeI和XhoI对载体pET 22b和目的基因Csp2039进行双酶切,于37 ℃水浴中酶切过夜(12 h)后,用DNA产物纯化试剂盒(北京天根生化科技有限公司)对目的片段进行纯化回收。调整目的基因DNA和载体的摩尔数比例约为1/10~1/5,加入T4 DNA连接酶,将混合反应物于16 ℃水浴中过夜(12 h)连接,连接反应产物直接转化大肠杆菌感受态细胞DH5α。
1.2.3 重组子的鉴定、转化、诱导表达和重组蛋白的纯化
挑取37 ℃过夜培养后在LB培养基平板上长出的单菌落,移种于含终浓度为100 μg/mL Amp的LB培养基中振荡培养。为确定插入基因片段的序列准确性,送新鲜菌液至南京金斯瑞有限公司用T7引物测序。用普通质粒小提试剂盒(北京天根生化科技有限公司)从重组质粒测序结果正确的菌液中提取质粒,然后转化表达型宿主感受态细胞E.coliBL21(DE3),涂布于重组子筛选平板。将获得的表达型宿主菌E.coliBL21(DE3)-pET22b+Csp2039用终浓度为1 mmol/L的IPTG对重组菌进行诱导表达。
利用Ni+亲和层析法纯化目的重组蛋白,将浓缩后的纯化重组蛋白送GenScript公司(南京)制备多克隆抗体(Order ID:5001978-1)。
1.3 胁迫处理
首先将菌株G在最适生长温度(20 ℃)和盐度(45)条件下于250 mL的Zobell 2216E培养基中培养,待培养液OD600达到约0.5时(指数生长期),进行如下胁迫处理:1)温度胁迫:将菌株分别于0,10和30 ℃培养,并分别于2,6和12 h时各取样2 mL于-80 ℃保存,将剩余菌液8 000 g离心5 min后用50 mmol Tris-HCl(pH=8.0)重悬,并用Constant Systems高压细胞破碎仪(One Shot)破碎菌体,破碎后液体置于-20 ℃保存。2)盐度胁迫:将OD600约为0.5的培养液于20 ℃下8 000 g离心5 min,收集菌体。将获得的菌体分别重悬于与离心前体积相等的、盐度分别为0,15,90和120的培养基中。重悬后的菌体分别于20 ℃继续培养2,6和12 h后各取样2 mL于-80 ℃保存,剩余菌液处理方法同温度胁迫。3)温度盐度协同胁迫:按照盐度胁迫的操作方法,将OD600约为0.5的培养液分别于如下条件下继续培养:温度0 ℃,盐度15;温度30 ℃,盐度15;温度0 ℃,盐度90;温度30 ℃,盐度90。菌株于上述条件下分别继续培养2,6和12 h后各取样2 mL于-80 ℃保存。最适生长条件下(温度为20 ℃,盐度为45)继续培养的菌株于相同时间点(2,6和12 h)取样设为对照,进行转录水平和翻译水平的差异表达分析。
1.4 qRT-PCR分析
利用RNA提取试剂盒(北京天根生化科技有限公司)提取了经不同温度、盐度胁迫处理和不同时间处理的菌株G的总RNA,获得的总RNA的质量通过测定其A260/A280值确定。利用反转录试剂盒PrimeScript RT Reagent Kit (大连宝生物工程有限公司)将得到的1 000 ng RNA反转录为cDNA,使用SYBRPremixExTaqTMII(大连宝生物工程有限公司)试剂盒进行qRT-PCR分析。利用软件Primer 5.0设计用于基因Csp2039 qRT-PCR的引物(F:GCTAAAGGTTTTGGTT; R: GCTCAGCTTGTGGG),内参基因选定为GAPDH (F: AGTCAGGCACATTTAGCG; R:GGCATAGCCCCATTCATT)[18,20]。qRT-PCR程序参数设定:95 ℃ 3 min;95 ℃ 30 s,退火(Csp2039:44 ℃,GAPDH:51 ℃)20 s,72 ℃ 20 s,40个循环;95 ℃ 1 min,退火(Csp2039:44 ℃,GAPDH:51 ℃)30 s,95 ℃ 30 s。所有实验均重复3次。基于临界循环值(Ct)对基因Csp2039的mRNA进行定量,采用相对Ct值法(2-ΔΔCt)处理所得数据,对照组基因表达量标准化为1[21],并对样本的重复性以及样本间的差异进行统计分析。本研究中为实验组分别与对照组比较。
1.5 Western blot检测
冷激蛋白Csp2039不同胁迫条件下在翻译水平上的表达研究采用Western blot技术进行[22]。步骤如下:
1)SDS-PAGE电泳完成后,将浓缩胶部分去除,用适量的转膜缓冲液平衡胶大约15 min;
2)根据胶的大小,剪一张同样大小的PVDF膜,剪去一角作为正反面的标记,PVDF膜要用适量的甲醇浸泡30 s后转至转膜缓冲液中平衡膜约15 min;
3)根据PVDF膜的大小剪切4块厚滤纸(滤纸的大小应略大于PVDF膜的大小),将剪好的滤纸放入转膜缓冲液中,平衡约10 min;
4)向转膜器的操作板上倒入少量的转膜缓冲液,从阳极面到阴极面将滤纸、PVDF膜、SDS-PAGE胶按照滤纸-滤纸-PVDF膜-SDS-PAGE胶-滤纸-滤纸的顺序叠加起来,每加一层时用玻璃棒赶出气泡,并加入适量的转膜缓冲液,保持电流恒定为280 mA,转膜时间为100 min;
5)电转完成后,PVDF膜在含5%脱脂奶粉的TBST的封闭液中4 °C轻摇3 h;
6)一抗抗血清以1∶5 000稀释于封闭液中4 ℃过夜;
7)用适量TBST洗膜3次,每次轻摇10 min;
8)Goat Anti Rabbit IgG [HRP]以1∶5 000稀释于封闭液中,4 ℃轻摇3 h;
9)TBST洗膜3次,每次轻摇10 min;TBS洗膜1次,10 min;
10)加入发色液(9 mL TBS,1 mL 4-氯-1-萘酚,6 μL 30%H2O2)暗室中发色约40 min,到适当程度以水终止。
完成以后,将有条带的PVDF膜进行灰度扫描,确定在翻译水平上冷激蛋白基因Csp2039的表达情况。
2 结果与分析
2.1 冷激蛋白Csp2039在重组菌中的表达和纯化
重组菌株pET22b+Csp2039/BL21(DE3)于20 ℃经IPTG(为1 mmol/L)诱导表达24 h,高压细胞破碎后不同细胞组分分别与5×SDS上样缓冲液混合煮沸,进行聚丙烯酰胺凝胶电泳(SDS-PAGE),结果如图1所示。可以看出,与未诱导对照相比较,重组菌株于分子量约7 kDa处出现了明显条带,与预测的Csp2039)分子量(6.5 kDa)基本一致。本研究将纯化后的蛋白作为抗原送至GenScript公司(南京)进行多克隆抗体的制备,经检测后确定为冷激蛋白Csp2039的有效多克隆抗体,制备好的抗体用于Western blotting,检测冷激蛋白Csp2039不同胁迫条件下在翻译水平上的表达情况。

图1 Csp2039蛋白电泳图
2.2 对温度的应答特征
冷激蛋白基因Csp2039的表达在转录水平和翻译水平基本上是被低温诱导的。
qRT-PCR(图2)表明,菌株G的冷激蛋白基因Csp2039的表达在转录水平上于6 h时显著被低温(0 ℃,10 ℃)诱导,相对表达量最大,其中0 ℃时,其表达呈极显著性差异,约为对照的8.0倍;在之后的6 h表达量逐渐下降,于12 h反而被显著抑制。在高温(30 ℃)时,Csp2039基因的表达先被抑制,在随后的6 h显著升高,表达量约为对照组的2.3倍;在之后的6 h中表达量又逐渐下降。
Western blot结果(图3a)经灰度扫描后分析极表明(图3b),冷激蛋白基因Csp2039在蛋白水平上的表达于6 h时被低温(0 ℃,10 ℃)显著诱导,被高温(30 ℃)抑制,但应答速度相对于转录水平滞后。在低温(0 ℃,10 ℃)胁迫下,2 h时Csp2039蛋白的表达没有明显变化;当温度胁迫6 h时,蛋白Csp2039在低温胁迫下的表达达到最大值,分别约为对照组的1.7倍(0 ℃)和1.9倍(10 ℃)。高温(30 ℃)胁迫下,2 h时蛋白Csp2039的表达量也没有明显变化,6 h和12 h时的表达被抑制。
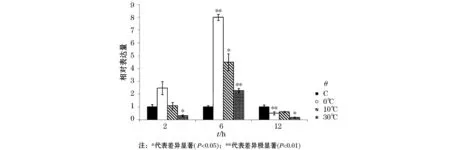
图2 Csp2039基因对温度胁迫的应答特征

图3 温度胁迫下Csp2039蛋白的表达分析
2.3 对盐度的应答特征
qRT-PCR(图4)表明,低盐(0)条件下,基因Csp2039的表达在6 h时被显著抑制;在盐度为15的条件下,基因Csp2039的表达均被诱导,并在12 h达到最大,约为对照组的2.8倍。高盐(90,120)时基因Csp2039的表达在2 h时被显著抑制。
Western blot结果(图5a)经灰度扫描后分析表明(图5b),在低盐(0)胁迫下,Csp2039蛋白的表达均被诱导,在12 h时达到最大;在盐度为15的胁迫下,Csp2039蛋白的表达量显著升高,并于2 h达到最大,约为对照组的3.8倍;在高盐(90)胁迫下,Csp2039蛋白的表达量在2 h被抑制,然后显著上升,于12 h时达到最大值,约为对照组的3.1倍;高盐(120)时Csp2039蛋白的表达在6 h和12 h抑制程度不明显。基因Csp2039在翻译水平与转录水平对盐度胁迫的应答特征并不完全一致。

图4 Csp2039基因对盐度胁迫的应答特征

图5 盐度胁迫下Csp2039蛋白的表达分析
2.4 对温度/盐度的应答特征
qRT-PCR(图6)表明,在温度/盐度协同胁迫条件下,温度为0 ℃时,无论盐度高低,冷激蛋白基因Csp2039在转录水平的表达均显著上升,并且低盐度(15)时其相对表达量要高于高盐度(90)的,并于2 h时达到最大值,分别约为对照组的4.3倍和2.8倍;高温(30 ℃)时,除在2 h低盐(15)情况下基因Csp2039的表达稍被诱导,其余条件下Csp2039基因的表达均显著被抑制。
Western blot(图7a)经灰度扫描后分析表明(图7b),低温(0 ℃)胁迫下,当盐度为15时,Csp2039蛋白的表达于12 h时达到最大,约为对照组的1.7倍;当盐度为90时,Csp2039蛋白的表达被抑制。而在高温(30 ℃)胁迫下,当盐度为15时于6 h Csp2039蛋白的表达量达到最大,约为对照组的2.7倍,之后下降,12 h表达量仅为对照组的0.7倍;当盐度为90时,Csp2039蛋白的表达量在2 h时升高,6 h时显著下降,12 h时无明显变化。在温盐协同胁迫作用下,基因Csp2039在翻译水平与转录水平的应答也不完全一致。

图6 冷激蛋白Csp2039基因对温度盐度协同胁迫的应答特征

图7 温盐胁迫下Csp2039蛋白的表达分析
3 讨 论
由于极地生态系统具有独特性,因此为微生物在极端环境的适应性机制研究提供了丰富的资源。南极细菌Psychrobactersp. G分离于南极乔治王岛西南部海域中,该菌属于适冷菌最明显的特征是:菌株最适生长温度为20 ℃,温度高于30 ℃时菌株则停止生长[23]。本研究从南极适冷菌Psychrobactersp. G中克隆得到了Csp2039基因。研究表明,冷激蛋白Csp2039与冷激蛋白CspA家族蛋白的同源性很高,存在与单链核苷酸结合相关的保守区RNP1和RNP2区[18]。本文针对极地微生物冷激基因能够在低温下正常表达产生冷激蛋白这一适应机制展开研究。
qRT-PCR和Western blot研究表明,温度变化对Csp2039基因的表达有着较大的影响,其表达量在转录水平和蛋白水平上均被低温(0 ℃,10 ℃)诱导,这表明该基因为典型的冷激蛋白基因。对基因Csp2039先前的研究中发现,在转录水平上低温(0 ℃)时于2,6,12 h 基因Csp2039的表达均被显著诱导[18],与本研究结果基本一致。低温可诱导极地适冷菌冷激蛋白的表达以适应外界温度的变化[11,17]。已有研究发现,温度从37 ℃下降到8 ℃时,大肠杆菌中CspA基因在转录水平上的表达量显著增加,在随后的4 h内表达量保持稳定[16]。这些结果均表明CspA蛋白家族在微生物抵御低温胁迫中起着重要的作用。
将从北极细菌PolaribacterirgensiiKOPRI 22228中克隆出的CspA基因经序列比对发现,该基因编码的蛋白序列含有2个在CspA蛋白中高度保守的RNA结合位点RNP1和RNP2[24-25];且将CspA基因导入低温敏感的大肠杆菌Csp四重缺失型菌株BX04后,使该菌株获得了低温存活的能力,表明该CspA基因在菌株KOPRI 22228的低温适应性中起着重要的作用[24]。Schmid等[13]在对ListeriamonocytogenesEGD-e 的温度胁迫中发现,在37 ℃时,冷激蛋白基因CspA的表达量很低,在4 ℃时表达量明显升高,是37 ℃时的23倍,这说明低温诱导明显增强了冷激蛋白的表达。Jung等[25]发现,当CspAPa基因没有导入大肠杆菌中时,对含有质粒pAED4的大肠杆菌进行1次冻融实验,发现仅有不足2%的细胞存活;而将从北极细菌PsychromonasarticaKOPRI 22215中克隆到的CspAPa基因导入大肠杆菌后,使宿主的耐寒能力增强了10倍以上,经1次冻融后发现有多于20%的细胞存活,表明CspAPa蛋白能有助于北极细菌适应极地的低温环境。以上研究结果均表明温度胁迫时,冷激蛋白的表达量在被低温诱导后增加,这与本文研究结果是基本一致的,即冷激蛋白的表达是被低温诱导的,冷激蛋白有助于南极细菌适应极地的低温环境。
盐度胁迫对基因Csp2039在转录水平和翻译水平的表达的影响并不完全一致。在转录水平上,低盐(0)胁迫下,基因Csp2039的表达先受诱导然后被抑制,在盐度为15的胁迫下,基因Csp2039的表达均被诱导,高盐(90,120)时基因Csp2039的表达只在6 h被抑制;而在蛋白水平上,在低盐(0,15)胁迫下,基因Csp2039的表达均被诱导,高盐(90)胁迫下,Csp2039蛋白的表达先被抑制,然后逐渐升高。这说明冷激蛋白可能在菌株G对渗透压变化的适应性中可能起着重要作用。Schmid等[13]研究发现,当向培养基BHI中加入3%的NaCl后,菌株ListeriamonocytogenesEGD-e的CspA基因的表达会显著升高,即高盐会促进CspA基因的表达,这与本文的研究结果基本相同。对基因Csp2039先前的研究中发现,在转录水平上低盐(0,15)胁迫下,基因Csp2039的表达除在12 h(0)盐度外均被抑制,高盐(90,120)时基因Csp2039的表达量在12 h升高[18],表明低盐抑制了冷激蛋白的表达,与本研究在转录水平对盐度胁迫的应答特征并不完全一致。这些结果表明冷激蛋白在细胞对盐度胁迫性中的作用目前仍没有定论,可能原因是冷激蛋白的分子伴侣可以提高钠离子转运蛋白的含量,加快了钠离子的运输,它们可以促进转录和翻译的进行,来参与细胞对渗透压的适应[13]。
尽管CspA基因作为典型的冷激蛋白基因,受低温诱导,但本研究研究表明,该基因的表达在30 ℃、6 h时也被显著诱导,这与Ivancic等的研究结果相类似,其研究也表明,大肠杆菌CspA基因在8~37 ℃温度波动范围内也可以被诱导[16]。通过对基因Csp2039在盐度条件下的表达特征的研究表明,在转录水平上,低盐(0,15)对其表达量有显著的影响,在盐度为15的胁迫下,基因Csp2039的表达均被诱导,高盐(90,120)时基因Csp2039的表达只在6 h被抑制;然而在翻译水平上,在低盐(0,15)胁迫下,基因Csp2039的表达均被诱导,高盐 (90) 胁迫下,Csp2039蛋白的表达先被抑制,然后逐渐升高,这其中的机理仍需进一步探究。在转录水平上,温度和盐度分别胁迫时,温度对Csp2039基因的诱导表达明显高于盐度对基因的诱导增加倍数表达,在温盐协同胁迫时,低温占据了主导作用;而在翻译水平上,盐度对Csp2039蛋白表达的影响作用明显高于温度,其中的机理也需进一步的研究。
多种环境压力在自然条件下同时胁迫南极细菌的生长,常见的有海水的盐度变化伴随着温度变化[26],因此本文对Csp2039基因在温度/盐度协同胁迫下的表达情况也进行了研究。结果发现,在转录水平上,温度为0 ℃时,无论盐度高低,基因Csp2039在转录水平的表达均显著上升;而高温(30 ℃)时,除在2 h低盐被诱导以外,其余条件下均显著被抑制,Csp2039基因在温度/盐度协同胁迫时的表达情况与温度协迫时的表达情况相似,表明在转录水平上Csp2039基因表达的变化更容易受温度影响。而在翻译水平上,低温(0℃)时,低盐(15)时,Csp2039蛋白的表达均被诱导,高盐(90)时,Csp2039蛋白的表达量明显被抑制;而高温(30 ℃)时,该基因在盐度15时6 h的表达量最大,盐度90时于6 h蛋白表达显著抑制,表明在翻译水平上盐度对Csp2039蛋白表达的影响作用大于温度,这其中的机理仍需更深入的研究。对基因Csp2039先前的研究中发现[18],在转录水平上基因Csp2039的表达均被抑制,这可能与不同的实验条件有关,在以后的实验中对温盐协同作用进行研究时可采用正交试验进行互交性分析,实验结果将更具说服力。
[1] PEARCE D A. Climate change and the microbiology of the Antarctic Peninsula region[J]. Science Progress,2008,91(2): 203-217.
[2] ZENG Y X,CHEN B. Process and application prospects in the study on Antarctic cold-adapted microorganisms[J]. Chinese Journal of Polar Research,1999,11(2): 143-152. 曾胤新, 陈波. 南极低温微生物研究及其应用前景[J]. 极地研究,1999,11(2): 143-152.
[3] HUSTON A L,KRIEGER-BROCKETT B B,DEMING J W. Remarkably low temperature optima for extracellular enzyme activity from Arctic bacteria and sea ice[J]. Environmental Microbiology,2000,2(4):383-388.
[4] CHINTALAPATI S,KIRAN M D,SHIVAJI S,et al. Role of membrane lipid fatty acids in cold adaptation[J]. Cellular and Molecular Biology,2004,50(5): 631-642.
[5] LIN X Z,BIAN J,HUANG X H. The application of cold shock protein in the polar cold adaptation microorganisms[J]. Chemistry of Life,2004,24(5): 406-408. 林学政,边际,黄晓航. 冷激蛋白在极地微生物冷适应中的应用[J]. 生命的化学,2004,24(5): 406-408.
[6] BUDDE I,STEIL L,SCHARF C,et al. Adaptation ofBacillussubtilisto growth at low temperature: a combined transcriptomic and proteomic appraisal[J]. Microbiology,2006,152(3): 831-853.
[7] YAMANAKA K,FANG L,INOUYE M. TheCspA family inEscherichiacoli: multiple gene duplication for stress adaptation[J]. Molecular Microbiology,1998,27: 247-255.
[8] XIN Y H,ZHOU Y G, DONG X Z. Biodiversity and cold adaptive mechanisms of psychrophiles[J]. Biodiversity Science,2013,21(4): 468-480. 辛玉华,周宇光,东秀珠. 低温细菌与古菌的生物多样性及其冷适应机制[J]. 生物多样性,2013,21(4): 468-480.
[9] PHADTARE S,ALSINA J,INOUYE M. Cold-shock response and cold-shock proteins[J]. Current Opinion in Microbiology, 1999, 2(2): 175-180.
[10] SCHINDLER T,GRAUMANN P L,PERL D,et al. The family of cold shock proteins ofBacillussubtills. Stability and dynamicsinvitroandinvivo[J]. Journal of Biological Chemistry,1999,274(6): 3407-3413.
[11] BERGER F,MORELLET N,MENU F,et al. Cold shock and cold acclimation proteins in the psychrotrophic bacteriumArthrobacterglobiformisSI55[J]. Journal of Bacteriology,1996,178: 2999-3007.
[12] PANICKER G,MOJIB N,NAKATSUJI T,et al. Occurrence and distribution ofcapBin Antarctic microorganisms and study of its structure and regulation in the Antarctic biodegradativePseudomonassp. 30/3[J]. Extremophiles,2010,14(2):171-183.
[13] SCHMID B,KLUMPP J,RAIMANN E,et al. Role of cold shock proteins in growth ofListeriamonocytogenesunder cold and osmotic stress conditions[J]. Applied and Environmental Microbiology,2009,75: 1621-1627.
[14] MOJIB N,ANDERSEN D T,BEJ A K. Structure and function of a cold shock domain fold protein, CspD,inJanthinobacteriumsp. Ant5-2 from East Antarctica[J]. FEMS Microbiology Letters,2011,319(2): 106-114.
[15] ETCHEGARAY J P,JONES P G,INOUYE M. Differential thermoregulation of two highly homologous cold-shock genes,CspA andCspB,ofEscherichiacoli[J]. Genes to Cells,1996,1:171-178.
[16] IVANCIC T,JAMNIK P, STOPAR D. Cold shock CspA and CspB protein production during periodic temperature cycling inEscherichiacoli[J]. BMC Research Notes,2013,6:248.
[17] KAWAMOTO J,KURIHARA T,KITAGAWA M,et al. Proteomic studies of an Antarctic cold-adapted bacterium,ShewanellalivingstonensisAc10,for global identification of cold inducible proteins[J]. Extremopiles,2007,11(6): 819-826.
[18] SONG W Z,LIN X Z,HUANG X H. Characterization and expression analysis of three old shock protein(Csp) genes under different stress conditions in the Antarctic bacteriumPsychrobactersp. G[J]. Polar Biology,2012,35:1515-1524.
[19] LIN X Z,CUI S S,XU G Y. Cloning and heterologous expression of two cold-active lipases from the Antarctic bacteriumPsychrobactersp. G[J]. Polar Research,2010,29: 421-429.
[20] CHE S,SONG W Z,LIN X Z. Response of heat-shock protein (HSP) genes to temperature and salinity stress in the Antarctic psychrotrophic bacteriumPsychrobactersp. G[J]. Current Microbiology, 2013,67(5): 601-608.
[21] LIVAK K J,SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods,2001,25(4): 402-408.
[22] JENSEN E. The basics of western blotting[J]. The Anatomical Record,2012,295(3): 369-371.
[23] SONG W Z, CHE S,LIN X Z. Cloning and characteristic analysis of universal stress protein(USP) gene of Antarctic bacteriumPsychrobactersp. G in response to stress treatments[J]. Advances in Marine Science,2013,31(1):145-152. 宋维志,车帅,林学政. 南极适冷菌Psychrobactersp. G普遍胁迫蛋白(USP)基因的克隆及其胁迫条件下的应答特征分析[J]. 海洋科学进展,2013,31(1):145-152.
[24] UH J H,JUNG Y H,LEE Y K, et al. Rescue of a cold-sensitive mutant at low temperature by cold shock proteins fromPolaribacterirgensiiKOPRI22228[J]. Journal of Microbiology,2010,48(6): 798-802.
[25] JUNG Y H,YI J Y,JUNG H J,et al. Overexpression of cold shock protein A ofPsychromonasarcticaKOPRI 22215 confers cold-resistance[J]. Protein Journal,2010,29(2): 136-142.
[26] THOMAS D N,DIECKMANN G S. Antarctic Sea ice-a habitat for extremophiles[J]. Science,2002, 295(5555): 641-644.
Received: April 8, 2015
Expression Characteristics of Cold Shock Protein Gene Csp2039 of the Antarctic Psychrotrophic Bacterium Psychrobacter sp. G
LI Yang1,2, CHE Shuai1,2,WANG Zhen1,2, LIN Xue-zheng1,2
(1.TheFirstInstituteofOceanography,SOA, Qingdao 266061, China;2.KeyLabofMarineBioactiveSubstances,SOA, Qingdao 266061, China)
To clarify the adaption mechanism of microorganisms in the severe environment of Antarctica, a cold shock protein geneCsp2039 was cloned from the Antarctic psychrotrophic bacterium Psychrobacter sp. G. qRT-PCR and Western blot were used to investigate the expression characteristics ofCsp2039 under different temperature/salinity stresses at the level of both transcriptional and translational. At the transcriptional level, qRT-PCR showed that the expression ofCsp2039 gene was significantly affected by the temperature shift and remarkably enhanced at 6 h by low temperature (0 ℃, 10 ℃), and high temperature (30 ℃). Under low salinity (0) stress, the expression ofCsp2039 gene was first induced, and then was suppressed; at the salinity of 15, the gene expressions were all increased at different times (2, 6 and 12 h); At high salinity (90, 120), the expression was enhanced at 6 h. Under the combined temperature and salinity stress, the expression ofCsp2039 gene was significantly increased at low temperature (0 ℃) regardless of salinity; on the contrary, the expression ofCsp2039 gene was inhibited by high temperature (30 ℃) except at 2 h. In the translational pattern, Western blot indicated that the expression of Csp2039 protein was remarkably enhanced by low temperature (0℃, 10 ℃), and obviously inhibited by high temperature (30 ℃). Under the low salinity (0, 15) stress, the expression of Csp2039 protein was enhanced; at the high salinity (90, 120), the expression ofCsp2039 gene was gradually increased after being suppressed. Under the combined temperature and salinity stresses, at low temperature (0 ℃), the expression of Csp2039 protein was improved under the salinity of 15 while decreased under the salinity of 90; however, at the high temperature (30 ℃), it had a high expression at 6 h under the salinity of 15 while a low expression at 6 h under the salinity of 90. In summary, the expression ofCsp2039 gene was more likely to be affected by temperature at the transcriptional level; and while in the translational pattern, the influence of salinity onCsp2039 gene was greater than that of temperature; the response time at the translational level ofCsp2039 gene was later than that in the transcriptional level.
Psychrobacter; cold shock protein geneCsp2039; qRT-PCR; Western blot; expression analysis
2015-04-08
国家自然科学基金项目——南极适冷菌Psychrobactersp. G温度与盐度胁迫下基因表达谱分析及冷/热激基因应答机制研究(41176174);南北极环境综合考察与评估专项——北极海域海洋生物和生态考察(CHINARE2015-03-05)
李 阳(1990-),女,山东潍坊人,硕士研究生,主要从事极地微生物学方面研究. E-mail: liyang@fio.org.cn*
林学政(1971-),男,山东栖霞人,研究员,博士,主要从事海洋极端环境微生物学方面研究. E-mail: linxz@fio.org.cn
(王佳实 编辑)
Q751
A
1671-6647(2016)01-0085-10
10.3969/j.issn.1671-6647.2016.01.008

