水稻白叶枯病菌c-di-GMP受体Clpxoo关键结合功能位点的确定
李建宇 李波 陈华民 杨凤环 何晨阳 田芳
(中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京 100193)
水稻白叶枯病菌c-di-GMP受体Clpxoo关键结合功能位点的确定
李建宇 李波 陈华民 杨凤环 何晨阳 田芳
(中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京 100193)
旨在确定水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae,Xoo)c-di-GMP信号受体Clpxoo的关键功能位点。通过对Clpxoo蛋白氨基酸位点基因突变,表达载体构建、蛋白诱导表达及其Ni-NTA Resin亲和层析,进行了Clpxoo 及其点突变蛋白的原核表达和产物纯化;通过等温滴定量热法(ITC),检测了Clpxoo 及其点突变蛋白与c-di-GMP的结合作用。利用基因定点突变和桥接PCR方法,在优化的诱导表达和纯化条件下,成功地获得了Clpxoo点突变蛋白和与c-di-GMP不发生结合的Clpxoo点突变体。结果表明,Clpxoo蛋白第70位天冬氨酸和第99位谷氨酸是与c-di-GMP结合的关键功能位点。
水稻白叶枯病菌;c-di-GMP;信号受体蛋白;点突变体;结合作用
水 稻 白 叶 枯 病 菌(Xanthomonas oryzae pv. Oryzae,Xoo)菌株PXO99A的clp基因(基因组序号:PXO_04006)编码产物蛋白Clpxoo(CRP-like protein)作为一种信号受体和全局性转录调控因子,在Xoo毒性表达上发挥着重要的作用[1]。当clp基因缺失后,Δclp突变体的致病力、运动性、胞外多糖产生能力和对H2O2的抗性都显著降低[2,3]。Clpxoo含有两个保守的结构域,N端为cNMP的结合结构域,其可以作为第二信使环二鸟苷酸(cyclic diguanylate,c-di-GMP)信号受体结构域,C端为保
守的DNA结合结构域(HTH),HTH可以识别和结合下游靶基因[4,5]。
c-di-GMP作为一种新型的第二信使,可以通过改变结构与受体蛋白结合而发挥作用,从而调控细胞生物膜形成、运动性和毒性因子表达等诸多生物学功能[6-11]。在Xoo中,Clpxoo作为c-di-GMP信号受体,通过与c-di-GMP的结合介导c-di-GMP信号途径,并调控生理生化功能。但是Clpxoo调控Xoo基因表达的机理并不完全清楚。通过对野油菜黄单胞菌(X. campestris pv. campestris,Xcc)Clpxcc晶体结构分析和等温滴定量热法(ITC)等试验研究,发现Clpxcc蛋白第70位天冬氨酸位点D70或第166位精氨酸位点R166定点突变成丙氨酸A后,Clpxcc与c-di-GMP结合的能力显著降低[12]。Clpxcc的cNMP结构域中谷氨酸E99也是Clpxcc结合c-di-GMP的关键氨基酸,当第99位谷氨酸位点E99突变成丝氨酸S时,Clpxcc大大降低了对胞外c-di-GMP浓度变化的敏感性[13]。而通过序列同源性分析,发现Xoo和Xcc中的Clp蛋白具有很高的同源性,其中D70、R166和E99更是高度保守。因此,本研究也同样选择了转录调控蛋白Clpxoo中的3个氨基酸位点做下一步研究。
为了进一步阐明Clpxoo在Xoo中的调控作用机制,以及c-di-GMP对Clpxoo的调控作用的影响,本研究构建Clpxoo的3个点突变体;用优化的条件原核诱导表达和纯化点突变蛋白;利用ITC试验检测Clpxoo点突变蛋白与c-di-GMP结合情况,旨在确定Clpxoo蛋白缺失的氨基酸位点是否为Clpxoo和c-di-GMP结合的关键功能位点。
1 材料与方法
1.1 材料
1.1.1 供试菌株、质粒及培养条件 Xoo菌株PXO-99A由本实验室保存;大肠杆菌(Escherichia coil,E. coli)DH5α和BL21(TIANGEN)。Xoo培养基:PSA固体培养基(蛋白胨10 g/L,蔗糖10 g/L,谷氨酸1 g/L,琼脂粉15 g/L);M210液体培养基(酶水解干酪素8 g/L,蔗糖5 g/L,酵母提取物4 g/L,K2HPO43 g/L,MgSO4·7H2O 0.3 g/L);E. coli 培养液为LB培养基,液体与固体的LB培养基在使用前加入终浓度100 μg/mL的Amp抗生素。本研究所用的所有质粒见表1。

表1 本研究所用质粒
1.1.2 主要试剂和仪器 TaqTMDNA聚合酶、T4 DNA连接酶和各种限制性内切酶(TaKaRa公司),胶回收试剂盒、BCA蛋白定量试剂盒、核酸和蛋白 Marker(TIANGEN)、isopropylthio-β-D-galactoside(IPTG)和蛋白纯化 Ni SepharoseTM填料(哈尔滨海基生物公司),PCR仪(Biometra)、电泳仪。
1.2 方法
1.2.1 基因克隆引入点突变 首先选定Clpxoo蛋白序列中第70位天冬氨酸位点D70、第99位谷氨酸E99和第166位精氨酸R166。通过两轮PCR扩增,在clp基因上相应的编码氨基酸序列位点上引入点突变D70A、E99S、R166。在突变位点处合成一对互
补的引物(D70A-F和D70A-R、E99S-F和E99S-R、R166A-F和R166A-R)(表2),分别和外侧引物(F和R)(表2)组合进行第一次扩增,PCR扩增条件为:95℃ 5 min;95℃ 30 s,60℃ 30 s,72℃ 60 s,35个循环;72℃ 10 min。回收相应的 PCR产物后,等摩尔数混合后作为模板,再以外侧引物(F和R)进行第二次PCR,扩增条件为:95℃ 5 min;95℃30 s,55℃ 30 s,72℃ 60 s,35个循环;72℃ 10 min[14,15]。最后,将扩增产物进行1%琼脂糖凝胶检测、回收纯化。回收纯化产物与 pEASY-Blunt载体在 25℃下连接反应5 min后,通过热激法将连接产物转化至E. coli DH5α 感受态细胞。提取质粒进行酶切验证,获得的阳性质粒pEASY-Blunt-clpxooD70A、pEASY-Blunt-clpxooE99S、pEASY-Blunt-clpxooR166A进行测序确证(北京华大基因生物公司)。分别测序确认编码第70位氨基酸(天冬氨酸)密码子GAU被GCU(丙氨酸)代替;第99位氨基酸(谷氨酸)密码子GAG被UCG(丝氨酸)代替;第166位氨基酸(精氨酸)密码子CGC被GCC(丙氨酸)代替。

表2 本研究所用引物
1.2.2 重组表达载体构建和转化 按照文献[16-18]的方法,进行重组表达载体的构建和转化。用BamH I和Sal I分 别 对pEASY-Blunt-clpxooD70A、pEASYBlunt-clpxooE99S、pEASY-Blunt-clpxooR166A和蛋白表达载体pCold-SUMO进行双酶切,利用T4连接酶在16℃条件下过夜连接,通过热激法将连接产物转化到E. coli感受态细胞BL21中,涂布Amp抗性平板,对筛选的转化子进行质粒提取、酶切和测序验证,得到阳性克隆pCold-SUMO-clpxooD70A、pCold-SUMO-clpxooE99S、pCold-SUMO-clpxooR166A。
1.2.3 蛋白表达、纯化和验证 按照文献[16,19]的方法,进行蛋白表达和纯化。通过调整IPTG浓度、诱导时间、咪唑洗脱液浓度,对点突变蛋白ClpxooD70A、ClpxooE99S、ClpxooR166A的诱导表达和纯化条件进行了优化。挑取E. coli BL21菌落接种至LB(100 μg/mL Amp)培养基,37℃ 200 r/min剧烈振荡培养至OD600为 0.6-0. 8。将培养液冷却至15℃,静置30 min,加入终浓度0.5 mmol/L或1 mmol/L IPTG,在15℃下诱导16 h或24 h。离心(4 000×g、15 min、室温)收集菌体,重悬细胞,置于冰上进行超声破碎 5 min,离心(10 000×g、30 min、4℃)取上清,经 SDS-PAGE 凝胶电泳和考马斯亮蓝染色,检测蛋白的表达。
1.2.4 ITC试验 参照文献[12,13,20]报道以及等温滴定量热仪操作说明,进行ITC试验操作。用超纯水和滴定缓冲液进行清洗。量热池内注满30 μmol/L Clpxoo野生型蛋白或者点突变蛋白,滴定针内为60 μL的300 μmol/L c-di-GMP溶液,设置每2 μL一滴,间隔100 s,1 000 r/min拌速率进行滴定,记录热量和变化。滴定试验需重复3次,使用软件MicroCal ORIGIN version 7.0进行数据分析。
2 结果
2.1 Clpxoo蛋白定点突变、原核表达和产物纯化
2.1.1 原核表达载体的构建、转化和诱导表达 通过PCR扩增,成功引入点突变,获得点突变的目的片段。将目的片段进行测序,通过与NCBI上的序列进行比对发现基因序列在定点的位置成功发生了突变。将点突变的目的片段连接到pCold-SUMO的相应的BamHⅠ和SalⅠ酶切位点后成功获得重组表达质粒pCold-SUMO-clpxooD70A、pCold-SUMO-clpxooE99S、pCold-SUMO-clpxooR166A。 经BamHⅠ 和SalⅠ酶切验证,得到大小约为700 bp的片段,与预期结果一致(图1)。将重组质粒转化至 E. coli 表达菌株 BL21感受态细胞中,在优化的诱导表达条件(在菌液浓度 OD600=0.8时,加入终浓度为0.5 mmol/L的IPTG、15℃下诱导16 h)下,得到了大小为45 kD的融合蛋白(加上N端的SUMO和His 6标签),其中点突变蛋白ClpxooD70A和ClpxooE99S以可溶形式在上清中大量表达,而ClpxooR166A则发生了严重的
降解现象(图2-A)。随后不同上样量(5、10和15 μL)的SDS-PAGE分析也可以验证ClpxooR166A降解成多个条带(图2-B)。因此,由于ClpxooR166A的降解,便采用ClpxooD70A和ClpxooE99S做蛋白纯化以及后续的ITC试验研究。

图1 点突变clp基因原核表达载体酶切验证
2.1.2 蛋白的纯化和验证 用不同浓度的咪唑缓冲液(100 mmol/L、200 mmol/L)对镍柱蛋白进行洗脱,发现使用200 mmol/L咪唑洗脱效率高,可获得高纯度的可溶性点突变蛋白(图2-C)。经过Bradford 法测定点突变蛋白浓度约为2 mg/mL。
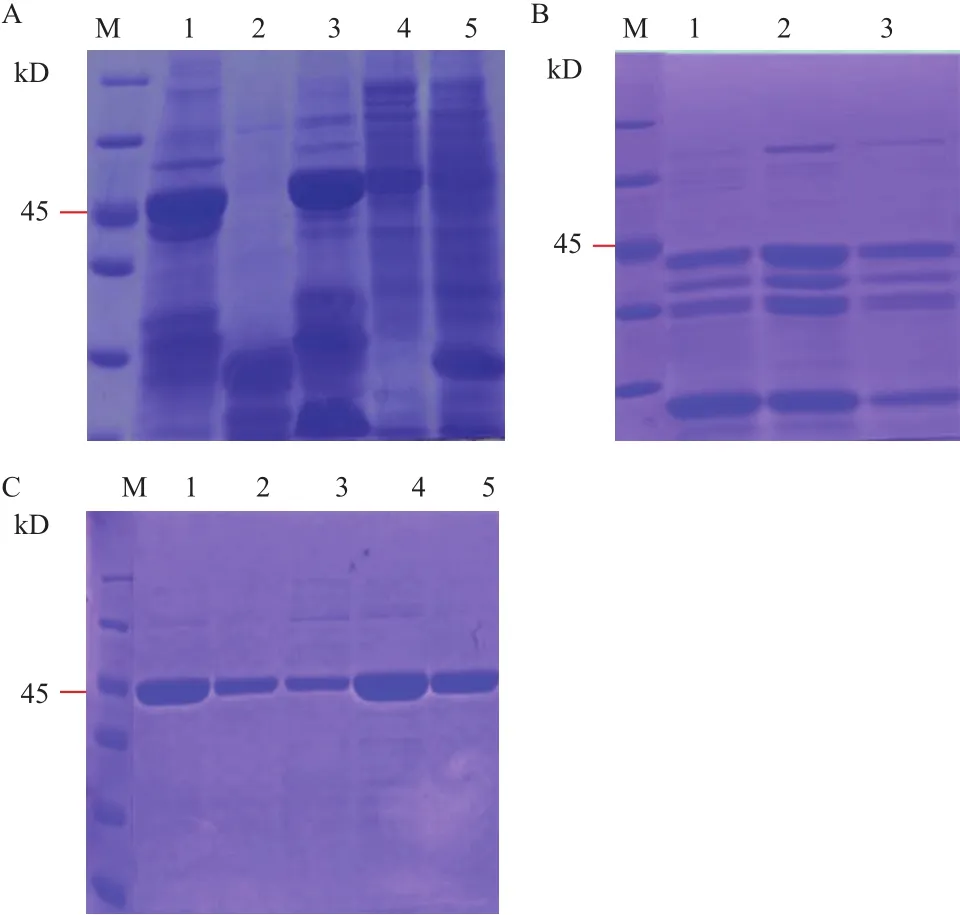
图2 Clpxoo和点突变体蛋白诱导表达以及纯化蛋白的SDS-PAGE分析
2.2 Clpxoo和点突变蛋白与c-di-GMP结合检测
在ITC试验过程中,通过数据处理软件转化计算,得到Clpxoo蛋白与c-di-GMP发生结合比例为N=0.92±0.03,解离常数Kd=(1.64±0.17)μM(图3-A),而点突变蛋白ClpxooD70A没有与c-di-GMP发生结合反应(图3-B);点突变蛋白ClpxooE99S与c-di-GMP发生结合比例为N=0.919±0.12,解离常数Kd=(23.9±18.1)μM(图3-C)。通过比较解离常数可以得知,ClpxooE99S与c-di-GMP结合的解离常数大约是Clpxoo与c-di-GMP的15倍。所以与Clpxoo蛋白相比,ClpxooE99S与c-di-GMP的结合能力大大降低。因此,当Clpxoo蛋白的第70位天冬氨酸突变后,点突变蛋白ClpxooD70A丧失了与c-di-GMP结合的能力;当第99位谷氨酸突变后,点突变蛋白ClpxooE99S减弱了与c-di-GMP结合的能力。

图3 ITC检测蛋白与c-di-GMP的结合反应
3 讨论
目前被研究清楚的是存在于绿脓杆菌(Pseudomonas aeruginosa)中的一类转录调控蛋白FleQ,而且研究表明FleQ也是小分子第二信使c-di-GMP的受体蛋白[21,22]。有研究表明,属于CRP/ FNR家族蛋白的转录调控因子通常会受到小分子效应因子如cAMP、c-di-GMP、O2等的影响[23,24]。其中,小分子第二信使c-di-GMP可以与受体蛋白Clpxoo结合来影响转录调控因子Clpxoo对下游基因表达的调控,最终影响Xoo细菌的生理进程[2]。然而,作为c-di-GMP信号受体蛋白的Clpxoo转录调控靶基因的机制并不清楚。因此,本研究通过确定转录调控因子Clpxoo与c-di-GMP结合的关键功能位点,来揭示调控蛋白Clpxoo与小分子c-di-GMP的结合特征,并为进一步阐明c-di-GMP介导下的Clpxoo调控基因的机制奠定基础。
本研究通过对Clpxoo蛋白的关键氨基酸位点进行定点突变,原核表达载体构建和转化、蛋白诱导表达纯化和验证,在优化的诱导表达条件下,成功获得了大量的Clpxoo点突变蛋白,为后续ITC试验确定水稻白叶枯病菌c-di-GMP受体Clpxoo关
键功能位点的确定做准备。为了验证Clpxoo蛋白第70位天冬氨酸、第166位精氨酸和第99位谷氨酸突变后是否会对蛋白的表达纯化有影响,本研究首先优化了点突变蛋白的表达纯化条件。设置了0.5 mmol/L、1 mmol/L终浓度的IPTG,以及 100 mmol/L、200 mmol/L的咪唑洗脱浓度,发现点突变蛋白在经0.5 mmol/L终浓度IPTG的诱导下表达量最高,经200 mmol/L浓度的咪唑洗脱效率最高。此外,对ITC试验中蛋白与小分子c-di-GMP的比例进行了摸索,最终确定了最佳的点突变蛋白和c-di-GMP的摩尔比为1∶10,即点突变蛋白为30 μmol/L,小分子c-di-GMP为300 μmol/L。将Clpxoo蛋白第166位的精氨酸突变成丙氨酸后,点突变蛋白会发生严重的降解现象,而且随着蛋白放置时间变长降解现象加剧。氨基酸位点的突变后会使蛋白发生降解,说明此位点对于蛋白的稳定性至关重要。而在前期对Clpxcc与c-di-GMP关键结合位点的研究中并没有对点突变蛋白降解的报道。因此,Clpxoo蛋白第166位精氨酸突变成丙氨酸后发生降解的机制有待于进一步试验研究。
通过ITC试验分析,发现与Clpxoo蛋白相比,将第70位天冬氨酸突变后,ClpxooD70A蛋白无法与c-di-GMP结合;第99位谷氨酸突变成丝氨酸后,ClpxooE99S蛋白与c-di-GMP的结合能力大大减弱。表明在Clpxoo蛋白的许多氨基酸中,第70位天冬氨酸和第99位谷氨酸都是Clpxoo的关键功能位点。本研究获得的不结合c-di-GMP的点突变体D70A和结合能力降低的点突变体E99S,为今后利用EMSA技术研究c-di-GMP对Clpxoo与目的基因启动子结合的影响奠定了基础。
4 结论
Xoo的转录调控因子Clpxoo蛋白中第70位天冬氨酸D和第99位谷氨酸E是Clpxoo与c-di-GMP结合的关键功能位点。
[1]He YW, Xu M, Lin K, et al. Genome scale analysis of diffusible signal factor regulon in Xanthomonas campestris pv. campestris:identification of novel cell–cell communication dependent genes and functions[J]. Gastrointestinal Endoscopy, 2000, 51(1):73-76.
[2]管文静, 吴茂森, 何晨阳. 水稻白叶枯病菌核苷酸信号受体蛋白Clpxoo的分子鉴定及其功能[J]. 微生物学报, 2009, 49(1):32-37.
[3]He YW, Ng Alvin YJ, Xu M, et al. Xanthomonas campestris cell-cell communication involves a putative nucleotide receptor protein Clp and a hierarchical signaling network[J]. Molecular Microbiology, 2007, 64(2):281-292.
[4]Hsiao YM, Liao HY, Lee MC, et al. Clp upregulates transcription of engA gene encoding a virulence factor in Xanthomonas campestris by direct binding to the upstream tandem Clp sites[J]. Febs Letters, 2005, 579(17):3525-3533.
[5]Jonas K, Melefors O, Römling U. Regulation of c-di-GMP metabolism in biofilms[J]. Future Microbiology, 2009, 4(3):341-358.
[6]Regine H. Principles of c-di-GMP signalling in bacteria[J]. Nature Reviews Microbiology, 2009, 7(7):263-273.
[7]Kalia D, Merey G, Nakayama S, et al. ChemInform abstract:Nucleotide, c-di-GMP, c-di-AMP, cGMP, cAMP, (p)ppGpp signaling in bacteria and implications in pathogenesis[J]. Chemical Society Reviews, 2012, 42(1):305-341.
[8]Römling U, Galperin MY, Gomelsky M. Cyclic di-GMP:the First 25 Years of a Universal Bacterial Second Messenger[J]. Microbiology & Molecular Biology Reviews Mmbr, 2013, 77(1):1-52.
[9]Krasteva PV, Fong JC, Shikuma NJ. Vibrio cholerae VpsT regulates matrix production and motility by directly sensing cyclic di-GMP[J]. Science, 2010, 327(5967):866-868.
[10] Newell PD, Monds RD, O’Toole GA. LapD is a bis-(3’, 5’)-cyclic dimeric GMP-binding protein that regulates surface attachment by Pseudomonas fluorescens Pf0-1[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(9):3461-3466.
[11]Sondermann H, Shikuma NJ, Yildiz FH. You’ve come a long way:c-di-GMP signaling[J]. Current Opinion in Microbiology, 2012, 15(2):140-146.
[12]Chin KH, Lee YZ. The cAMP receptor-like protein CLP is a novel c-di-GMP receptor linking cell-cell signaling to virulence gene expression in Xanthomonas campestris[J]. Journal of Molecular Biology, 2007, 396(3):646-662.
[13]Tao F, He YW, Wang DH, et al. The cyclic nucleotide monophosphate domain of Xanthomonas campestris global regulator Clp defines a new class of cyclic di-GMP effectors[J]. Journal of Bacteriology, 2010, 192(4):1020-1029.
[14]戴灿, 苗聪秀, 卢光琇. 基于重叠延伸PCR法的定点突变技术[J]. 现代生物医学进展, 2010, 10(3):411-412.
[15]闫振文, 梁秀龄, 杨春水, 等. PCR技术对Wilson病基因进行定点突变的研究[J]. 中山医科大学学报, 2002, 23(2):94-96.
[16]Yang FH, Tian F, Sun L, et al. A novel two-component system PdeK/PdeR regulates c-di-GMP turnover and virulence of Xanthomonas oryzae pv. oryzae[J]. Molecular Plant-Microbe Interactions, 2012, 25(10):1361-1369.
[17]Massimo M, Lee VT, Mamoru H, et al. The second messenger bis-(3’-5’)-cyclic-GMP and its PilZ domain-containing receptor Alg44 are required for alginate biosynthesis in Pseudomonas aeruginosa[J]. Molecular Microbiology, 2007, 65(4):876-895.
[18]Chen CL, Guo YF, Chen XW, et al. Efficient expression of Cap gene of porcine circovirus type 2 by pCold-SUMO expression vector[J]. Journal of South China Agricultural University, 2012, 33(3):393-397.
[19]李波, 田芳, 陈华民, 等. C-di-GMP抑制转录调控因子Clpxoo与葡聚糖酶基因启动子的结合[J]. 微生物学报, 2013, 53(11):1166-1171.
[20]胡晓环, 童威, 邵爽, 等. 等温滴定量热法研究牛血清白蛋白与十二烷基二羟乙基甲基溴化铵的相互作用[J]. 浙江大学学报:理学版, 2011, 38(5):525-529.
[21]Baraquet C, Harwood CS. A FleQ DNA binding consensus sequence revealed by studies of FleQ-dependent regulation of biofilm gene expression in Pseudomonas aeruginosa[J]. Journal of Bacteriology, 2015, 198(1):178-186.
[22]Baraquet C, Harwood CS. The FleQ protein from Pseudomonas aeruginosa functions as both a repressor and an activator to control gene expression from the pel operon promoter in response to c-di-GMP[J]. Nucleic Acids Research, 2012, 40(15):7207-7218.
[23]Lu XH, An SQ, Tang DJ, et al. RsmA regulates biofilm formation in Xanthomonas campestris through a regulatory network involving cyclic di-GMP and the Clp transcription factor[J]. PLoS One, 2012, 7(12):e52646.
[24]Kariisa AT, Grube A, Tamayo R, et al. Two nucleotide second messengers regulate the production of the Vibrio cholerae colonization factor GbpA[J]. BMC Microbiology, 2015, 15(1):1-15.
(责任编辑 马鑫)
Identification of Critical Residues in c-di-GMP Receptor Clpxoo from Xanthomonas oryzae pv. oryzae
LI Jian-yu LI Bo CHEN Hua-min YANG Feng-huan HE Chen-yang TIAN Fang
(State Key Laboratory for Biology of Plant Diseases and Insect Pests,Institute of Plant Protection,Chinese Academy of Agricultural Sciences,Beijing 100193)
The purpose of this study is to identify the critical residues in Clpxoo of a c-di-GMP signal receptor in Xanthomonas oryzae pv. oryzae(Xoo). By the gene mutation of amino acid site of Clpxoo protein,the construction of expressing vector,induced protein expressed,and analysis of Ni-NTA Resin affinity chromatography,the prokaryotic expression of Clpxoo and point mutants was conducted and the protein was purified.. The binding affinities of c-di-GMP with native and variant Clpxoo were measured by isothermal titration calorimetry(ITC)experiments. Under optimized conditions for protein expression and purification,the proteins of Clpxoo point mutants and point mutants of Clpxoo that does not bind with c-di-GMP were acquired successfully while using gene site-directed mutagenesis and bridging PCR. Results showed that site 70 of aspartic acids and site 99 of glutamic acid were found to be the key residues for their binding to c-di-GMP.
Xanthomonas oryzae pv. pryzae;c-di-GMP;signal receptor protein;point mutant;binding affinity
10.13560/j.cnki.biotech.bull.1985.2016.12.020
2016-05-04
国家自然科学基金项目(31100947),北京市自然科学基金项目(5142017)
李建宇,男,硕士,研究方向:分子植物病理学;E-mail:lijianyugood@126.com
田芳,女,博士,研究方向:分子植物病理学;E-mail:ftian@ippcaas.cn

