油菜素内酯参与初生细胞壁代谢研究进展
徐宗昌, 王 萌, 孔英珍
(1.中国农业科学院烟草研究所,山东青岛 266101;2.中国农业科学院研究生院,北京 100081)
油菜素内酯参与初生细胞壁代谢研究进展
徐宗昌1,2, 王 萌1,2, 孔英珍1*
(1.中国农业科学院烟草研究所,山东青岛 266101;2.中国农业科学院研究生院,北京 100081)
综述了油菜素内酯的发现、结构、分布、合成及信号转导途径方面的研究进展,重点阐述了近年来油菜素内酯在初生细胞壁的建成和代谢中的调控作用,并展望了油菜素内酯今后的研究方向。
油菜素内酯;初生细胞壁;代谢调控
油菜素甾醇(brassinosteroids,BRs)是一类存在于自然界中多羟基化的甾醇类植物激素的统称。BRs广泛存在于众多植物当中,在植物的生长和发育等许多重要的生理过程中起着重要的调控作用,如促进种子萌发和根茎的生长,参与植物光形态建成,调控维管束分化,增强植物抵抗高温、低温和高盐等不利条件的能力以及参与细胞壁代谢[1-3]。油菜素内酯(brassinolide,BL)是发现最早并且应用最广泛的一种甾醇类物质,所以也用来泛称这一类甾醇类植物激素(brassinosterods,BRs)。油菜素内酯是植物中继生长素、赤霉素、细胞分裂素、脱落酸和乙烯之后的第六大类植物激素。笔者综述了油菜素内酯的发现、结构、分布、合成及信号转导途径方面的研究进展,重点阐述了近年来油菜素内酯在初生细胞壁建成和代谢中的调控作用,并展望了油菜素内酯今后的研究方向,旨在为油菜素内酯的进一步研究与应用提供参考。
1 BR的发现及结构
Mitchell等[4]最先在油菜(BrassicanapusL.)花粉的提取物中发现有一种能够促进大豆幼苗生长的物质,并将其命名为 “brassins”。自1974年以来,美国农业部NRRC、ERRC和BARC研究中心的科学家历时多年,从227 kg油菜花粉中分离并提纯了brassins,并将得到的4 mg晶体进行X-ray衍射分析其晶体结构,发现这种能够促进植物生长的物质是一种甾类内酯,遂将其命名为油菜素内酯(brassinolide,BL)[5]。至此,“brassins”活性因子的存在得到了确认。1982年,研究者在栗子树的虫瘿中又发现了另外一种能够促进植物生长的甾族物质,命名为栗甾酮[6]。油菜素内酯和栗甾酮的发现使人们认识到具有促进植物生长作用的甾类物质可能普遍存在于植物中。自此,人们开展了大量关于油菜素甾醇及其相关化学物质提取及鉴定的研究。这些甾醇类物质根据被发现的顺序编号为BRs1,BRs2,BRs3,…,BRsn,其中BRs1即为油菜素内酯,是目前发现的最具生物活性的油菜素甾族化合物[7],广泛应用在各种BRs代谢调控及信号传导等相关的实验中。
油菜素内酯的分子式为C28H48O6(MW=480),是一个28碳化合物[5],化学名称为2α,3α,22α,23α-4羟基-24α-甲基-7-氧-5α-胆甾烷-6酮(图1)。油菜素内酯的化学结构与昆虫蜕皮激素类似,差别在于油菜素内酯的A/B环为反式,而昆虫蜕皮激素的A/B环为顺式[8],并且油菜素内酯的A环2,3位为2个α顺式羟基,这是油菜素内酯具有高生物活性的一个重要原因。随后发现的众多天然BRs系列化合物都有1个5-α胆甾烷骨架,它们结构的差异主要是碳环骨架上官能团的种类和空间构象不同[9]。这些甾族化合物根据B环含氧官能团的不同可分为内酯型、酮型和脱氧型3类[10],其中油菜素内酯是发现的第一个环内酯化合物。根据C-24位烷基取代基的不同,这些甾族化合物又可分为C27、C28和C29化合物3个亚类[9]。
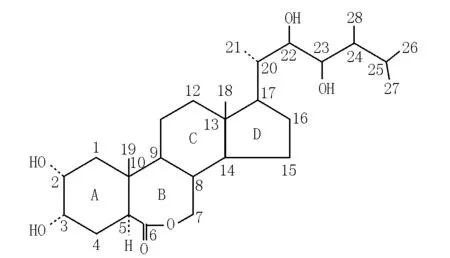
图1 油菜素内酯的结构Fig.1 Structures of the brassinolide
2 BR的生物合成
BR的生物合成需要经过高度复杂的代谢途径才能完成。目前,一般认为鲨烯是合成BR的起始物质[11]。在由鲨烯合成BR的代谢过程中,产生了很多中间产物,如24-亚甲基胆固醇、菜油甾醇、豆甾醇、麦角甾-7,24(24)-二烯醇、谷甾醇、茶甾酮、香蒲甾醇等[11-13]。所有这些中间产物的碳骨架结构基本相似,不同的是碳骨架上不同碳原子上的官能团有所差异。根据碳骨架上不同位碳原子尤其是第6位(C-6)和第22位碳原子(C-22)酮基化的早晚(图1),BR的生物合成可分为早期/晚期C-6氧化途径、早期/晚期C-22氧化途径,以及早期C-22氧化途径和晚期C-6氧化途径交叉途径3种基本合成路径[14-15]。在C-22氧化途径中,DWARF4蛋白催化的C-22羟基化反应是主要的限速步骤[16],而在C-6氧化途径中CYTOCHROME P450、FAMILY 85以及SUBFAMILYA(CYP85A)/BR6OX 催化酶控制着氧化反应的进程[17]。C-6与C-22氧化途径既平行又交叉且共用很多中间产物,进一步说明了BR合成途径的复杂。Fujita等[18]研究表明,在早期C-22氧化途径和晚期C-22氧化途径中,拟南芥(Arabidopsisthaliana)的BR合成主要依赖早期C-22氧化途径。另外,在很多植物包括拟南芥、烟草(NicotianatabacumL.)和豌豆(PisumsativumL.)中,晚期C-6氧化途径的中间产物要比早期C-6氧化途径的中间产物丰富得多,说明在这些物种中BR的合成主要是通过晚期C-6氧化途径。
植物中大多数参与BR合成途径的催化酶都已经被鉴定,它们的功能缺失型突变体也得到了深入研究。例如,拟南芥突变体det2、dim、dwarf1和cbb1,水稻(Oryzasativa)突变体brd1以及豌豆的突变体lka和lkb都表现了矮化的表型,下胚轴、叶柄和茎干较野生型都有不同程度的缩短,叶子也有所变小,试验结果表明矮化表型的出现是由于细胞的伸长受到了抑制所致[3,19-22]。这些突变体的表型变化进一步说明BR对植物正常生长具有非常重要的作用,并且证实了BR能够参与调控细胞的伸长。
3 BR的分布及转运
一般而言,BR在植物中分布广泛,存在于大多数植物组织中,但是在不同物种不同组织中的含量相差很大[23]。在花粉中,具有生物活性的BRs鲜重比可达5~1 000 ng/g[4],在种子和果实中分别达0.30~1 600.00和0.20~3.50 ng/g[24-26]。然而,BR在营养组织中的含量较低,仅有0.12~2.00 ng/g,根中BR的含量最低,不足0.05 ng/g[23,27-28]。在植物的茎组织中,BR多分布于生长活动旺盛的区域,例如茎尖组织、幼嫩的节间等,这与BR能够促进细胞分化和细胞伸长的生物学功能相一致[23,28]。虽然BR在不同组织中的含量差别很大,但是BR并不能进行跨浓度梯度的运输。Symons等[23,29]通过对豌豆的野生型和BR合成缺陷突变体lkb植株进行的交互嫁接试验证实,在整个嫩枝和根中BR能够维持相对稳定的含量,但并不依赖由上往下或由下往上的运输;他们对豌豆体外施加同位素标记的3H-BR也未发现BR能够在豌豆中进行长距离运输。因此,虽然BR的含量在不同组织以及同一组织的不同位置相差很大,但不能像其他植物激素一样在不同组织间进行长距离运输行使作用。
4 BR的信号转导途径
在高等植物细胞中,定位在质膜上的跨膜受体蛋白激酶BRI1是BR的主要受体,另有2个BRI1-like蛋白BRL1和BRL3也能够作为BR的受体,参与信号转导过程[30-31]。BAK1是BRI1的共受体因子,是BR信号转导途径中的另一个非常重要的受体蛋白激酶,能够与BRI1形成异源二聚体并通过磷酸化作用相互激活参与BR的信号转导过程,但BAK1不影响BR和BRI1的结合[32-33]。
如图2所示,在BR缺失时,位于质膜上的负调节因子BKI1[34]与BRI1发生作用,阻止BRI1和它的共受体因子BAK1的结合,从而抑制BRI1的活性[35-36]。由BRI1开始的级联磷酸化途径被切断,在这种情况下,负调控因子BIN2被激活,并磷酸化BZR1和BES1/BZR2 2个转录因子,导致它们通过蛋白酶体介导的途径被降解或被一些14-3-3蛋白滞留在胞质[37]。有研究表明, BZR1和BES1/BZR2可以直接结合到靶基因启动子区域的BRRE(CGTGT/CG)和E-box (CANNTG)元件上,调控基因的表达[38-39]。因此,BZR1和BES1/BZR2的降解就使得基因表达受到抑制。
当BR存在时(图2),BR与受体BRI1结合,负调节因子BKI1发生磷酸化并解离到胞质中[36]。此时,BRI1与BAK1结合并通过相互磷酸化的方式互相激活,这种转磷酸作用能够激活BRI1的激酶活性,下游BR信号激酶BSK1、BSK2和BSK3则在BRI1的作用下发生磷酸化并被激活,这些信号激酶进而结合并激活蛋白磷酸酶BSU1[40]。BSU1通过去磷酸化作用抑制BIN2的活性[41],同时,BZR1和BES1/BZR2在另一个蛋白磷酸酶PP2A的作用下去磷酸化,具有活性的转录因子BZR1和BES1/BZR2就能够在核内大量聚集,调节下游基因的表达[42]。另外,解离到胞质内的BKI1能够通过拮抗14-3-3蛋白从而增强BZR1和BES1/BZR2在核内的积累,在BR存在时能够正调控BR信号转导途径[43]。
5 BR调控初生细胞壁代谢
5.1 初生细胞壁的组成 细胞壁按照不同的分类标准能够分成多种类型,然而大多数细胞壁可以分成功能性的2类:初生细胞壁和次生细胞壁。初生细胞壁是在细胞伸长的过程中合成的,典型的特点是相对较薄,容易变化并且含水较高。植物的初生细胞壁由多种高分子多聚物构成,一般包括纤维素、半纤维素、果胶、一些结构蛋白和无机盐离子[44]。纤维素是构成植物初生细胞壁的主要成分,在双子叶植物中占初生细胞壁干重的15%~30%;半纤维素的组成种类最丰富,包括木葡聚糖、木聚糖、甘露聚糖和β-葡聚糖等,水溶性差,占初生细胞壁干重的25%~30%。其中,木葡聚糖能够与纤维素微纤丝相互作用,共同构成细胞壁的主要承载结构;果胶是初生细胞壁3种主要构成成分中结构最复杂的一种,富含半乳糖醛酸,主要由同聚半乳糖醛酸(HG)、鼠李半乳糖醛酸聚糖-I(RG-I)和鼠李半乳糖醛酸聚糖-II(RG-II)构成[45],黏连分布在由纤维素和半纤维素构成的网状结构中,占细胞壁干重的20%~35%[46]。
5.2 BR调控木葡聚糖内转糖苷酶/水解酶基因的表达 植物的生长是细胞不断分化、伸长的结果,细胞的伸长需要细胞壁的不断重构。在该过程中,植物生长细胞的初生细胞壁的多糖组成和多糖之间的胶连形式随着细胞的生长而发生变化,呈现时空变异性。因此,细胞壁的构成是一个动态变化的过程,反映了细胞壁多糖成分在合成、沉积、重构和选择性的分解之间存在着一个动态平衡。纤维素微纤丝被木葡聚糖覆盖,两者之间通过氢键相互胶连,共同形成一个网状的具有可塑性的细胞壁的主要承载结构,果胶等其他物质充斥在这些网状空间内,形成了一种栓绳状的细胞壁结构模型[47-48]。在上述情况下,木葡聚糖内转糖苷酶/水解酶 (XTH)在细胞壁重构的过程中发挥着重要作用。XTH具有木葡聚糖内水解酶(XEH)和木葡聚糖内转糖苷酶(XET)2种酶活性[49]。其中,XEH能够专一地水解木葡聚糖的β-1,4 糖苷键,打断木葡聚糖长链,起到降解木葡聚糖的作用;XET能够催化木葡聚糖分子与自身的连接,从而使糖链加长[44,49]。木葡聚糖链的缩短和加长能够有效地使网状承载结构得到松散,为细胞壁的重塑伸长提供了空间。Lee等[50]研究发现,无论是在温室还是大田条件下,过表达GhXTH1基因的棉花纤维要比野生型长15%~20%,说明XTH能够调控细胞的伸长。而BR则可以通过调控XTHs的表达影响细胞的伸长。Yokoyama等[51]对拟南芥的幼苗施加1.0moL/LBL处理2h后,定量PCR结果表明XTH3、XTH4、XTH5、XTH17、XTH22和XTH23的表达量明显上调。拟南芥XTH4基因即是TCH4[49],最初作为一个触摸响应因子被发现。Xu等[52]研究表明,TCH4可以被1.0moL/LBR缓慢诱导,30min时可以看到TCH4的mRNA表达水平升高,2h后mRNA的诱导水平达到最高。上述研究结果表明了BR能够诱导XTH基因的表达。BRU1 是大豆XTH 家族中的一个成员,Zurek等[53]发现0.1moL/LBR处理大豆的上胚轴能够显著促进上胚轴的生长,而BRU1的表达也随着生长速率的加快而增加;BR处理2h后的大豆上胚轴的抗拉能力较野生型显著增强,说明BR能够通过影响XTH基因表达来促进细胞伸长,并在一定程度上改变细胞壁的机械性能。

图2 BR信号传递途径示意[36]Fig.2 BR signaling pathways model
5.3 BR调控纤维素合酶基因的表达 纤维素由定位在细胞膜上的纤维素合酶复合体合成,是初生细胞壁中最丰富的多糖物质,在双子叶植物中占初生细胞壁干重的15%~30%[46]。在很多非谷类植物中,纤维素的含量甚至可以达到植株生物干重的30%~40%[46,54]。因此,纤维素含量的多少是衡量植物生物量多少的一个重要指标。BR在植物的生长过程中起着重要作用,尤其是能够促进细胞的伸长[55]。在细胞快速伸长的过程中,新细胞壁的形成需要大量纤维素的沉积[56]。然而,很多BR生物合成途径中的关键酶基因突变体如det2、dim、dwarf4、cbb1、brd1、lka、lkb等都表现出矮化的表型,生物量减少[3,19-22,57]。Kauschmann等[22]研究表明,这些植株的矮化主要是由于组织细胞缩小而非细胞数目减少造成的,说明在这些BR合成途径突变体中纤维素的合成受到了抑制。有研究指出,在棉花胚珠培养过程中,纤维丝的形成和伸长都需要BRs的参与[58];在水稻中,BR合成途径中C-6氧化酶基因OsDwarf2/OsDwarf1表达量的降低会导致第二节间以及种子长度的减少[59];Fernandez等[60]指出,适当提高BR的含量能够促进植物的生长,提高植物的生物产量和种子产量。
随着研究的深入,纤维素合成途径受BR调控的分子机制也逐渐明确。Xie等[61]指出,拟南芥突变体det2-1及bri1-301的纤维素含量较野生型分别下降了8% 和 12%,而BRI1-GFP和35S-BES1-GFP的纤维素含量则较野生型分别提高了7%和3%,并且det2-1和bri1-301的干重明显低于野生型和2个过表达植株BRI1-GFP、35S-BES1-GFP,这与前人的研究结论相一致[62-63]。研究发现,BL处理det2-1和野生型植株2 h后,CESA1、CESA4、CESA5、CESA6、CESA7、CESA8、CESA9和CESA10的表达量在det2-1和野生型中均有1~5倍的诱导提高,而处理前CESA基因在det2-1中的表达量比在野生型中低50%左右;BR不敏感突变体在有无BL时,CESA基因均不被诱导;进一步的试验证明,受BR信号途径激活的转录因子BES1在体内能够结合在CESA基因的启动子上从而调控CESA基因的表达[61]。上述研究结果初步揭示了BR参与纤维素合成的分子机制。
5.4 WAKs相关基因通过BR途径感受细胞壁结构变化调控植株生长 在植物中,植物器官的形成和细胞伸长需要细胞壁对外界环境因素如光、机械应力、病原侵入和内部调控因子(如植物激素)等信号分子做出响应并不断地对这些影响因素进行动态调整。随着研究的深入,这些因子的响应蛋白也逐渐被发现,并能够引起细胞反应,使之维持细胞壁的完整性且对细胞壁进行重塑以协调细胞的生长。CrRLK1L基因家族中的几个类受体激酶基因如HERK1、THE1 和FER,能够在植物生长的整个过程中控制细胞的伸长[64-65]。这几个CrRLK1Ls激酶蛋白胞外结构域中的碳水化合物结合结构域的存在使这些基因能够在植物的生长周期中很好地协调细胞生长并且维持细胞壁的重塑过程。
Hématy等[66]研究发现THE1基因定位在细胞膜上,THE1基因的完全敲除以及过表达都没有影响野生型表型,但是the1突变体却能够部分恢复许多纤维素缺失突变体如prc1-1、prc1-8、sw1-10、eli1-1、pom1-2、kor1-1和bot1-1等的表型,并且当THE1存在时,这些纤维素突变体中与细胞防卫、细胞壁代谢等相关的基因表达上调。因此,THE1被认为是一个定位在细胞膜上的感受细胞壁完整性的感受器,当细胞壁受到损伤,纤维素合成受到抑制,甚至是病原菌入侵以及植物受到非生物胁迫时能够激活THE1的表达,抑制细胞伸长,对不利的环境因素做出响应。HERK1与FER也定位在细胞膜上,且HERK1和THE1具有促进细胞伸长的功能[67-68]。FER在雌配子体的助细胞中表达,能够捕获花粉管延伸的信号,从而在适当的时机抑制花粉管的伸长并促进精细胞的释放,促成其与卵细胞的结合[68],而在FER的缺失突变体中,花粉管则会不断生长,导致植物受精失败[68-69]。
Guo等[67]指出,拟南芥幼苗/成株用BL处理后,HERK1、THE1和FER3个基因的表达量能够上调20%~80%,而在bri1突变体中,这几个基因的表达下调;并且三突变体bri1-5herk1the1能够强化bri1-5的矮化表型,但是当herk1the1双突变体与bes1-D(一个功能获得型突变体,能够持续响应BR反应,促进细胞伸长[38])杂交时,能够明显抑制bes1-D细胞伸长的表型,说明这几个激酶基因的表达能够受到BL的诱导调控,并且能够参与BR信号途径对细胞伸长进行调控。然而,研究者对herk1the1与野生型进行BL处理后的基因表达模式进行研究发现,只有10%受BL调控的基因在突变体中也受到了影响,约有16%受herk1the1调控的基因也能受到BL的影响;这些受双方共同调控的基因大多是细胞壁合成/修饰基因,如XTH、PLLs和EXPs等[67]。突变体fer1、fer2的基因表达模式与herk1the1类似,说明它们在一个共同的代谢途径中。上述研究结果表明,HERK1、THE1 和FER的代谢途径在很大程度上独立于BR代谢途径,但是一些共同的目标基因的表达有可能受到来自这2条相对独立代谢途径的共同调控,这些激酶基因的调控途径与BR信号传导途径在一定程度上存在交叉。
5.5 BR调控果胶甲酯化酶基因的表达 PME是重要的细胞壁修饰酶,能通过催化HG多糖进行去甲酯化反应来改变这种果胶多糖的结构和性能,使其能够与Ca2+结合,从而改变初生细胞壁的结构组成和功能[45,70]。PME的活性又能够被PME抑制蛋白PMEI所抑制[71]。因此,PME能够通过活性的改变来调节细胞壁的组成和结构,从而影响植物的形态建成过程。有研究表明,BR能够影响PMEs基因的表达[72-73]。Qu等[74]研究指出,在寒冷胁迫作用下,PME41的活性在野生型中明显提高,而在BR信号途径突变体bri1-116中没有显著变化,说明在拟南芥中PME41活性受寒冷胁迫的诱导依赖BR信号途径,BR能够通过诱导PME41的活性提高从而参与调节植物的抗寒性。Wolf等[75]研究指出,拟南芥PME酶活性受到抑制时,植株的根、茎、果荚等器官会发生畸形,这与PMEI-OX过表达植株的表型一致。PMEI-OX过表达植株细胞壁中甲酯化程度提高,但BRI1的激酶结构域发生点突变(G944D)后能使PMEI-OX植株畸形的根、茎、果荚等表型恢复到野生型的状态,细胞壁中的甲酯化程度也有所降低。这说明PME酶能够调节细胞壁多糖甲酯化程度的变化,并且影响细胞壁的结构功能进而影响植株的表型,而这种作用与BR信号传导途径相关。进一步的研究结果表明,PME活性降低能够导致细胞壁中去甲酯化果胶成分的降低,这种变化会通过目前尚未知的反馈机制激活BRI1受体并通过BR信号转导途径上调一些包括PME在内的细胞壁相关基因的表达进行补偿[75]。植物的这种补偿途径能够使植物抵消由于果胶修饰失衡而导致的细胞壁组分不完整带来的不利影响。
6 展望
BR作为一种植物激素对调节细胞生长、促进植物的生长发育具有重要作用,但是很多其他植物激素如生长素也能够调节细胞的生长,促进植物的发育。尽管学者们对它们如何发挥作用开展了大量研究,但这些植物激素的作用机制以及交叉重叠的生理功能仍需要深入研究。初生细胞壁的形成是一个动态平衡的过程,构成初生细胞壁的多糖物质繁多且结构复杂,它们在细胞、植株生长的不同阶段有着不同的组织协调方式。目前,细胞壁多糖是如何被调控合成以适应植株细胞的不同生长阶段仍不明确,尤其是不同细胞壁多糖组分与BR之间的调控关系,在不同的组织、不同的生长阶段,以及不同的环境因子条件下,BR如何发挥作用仍需进一步的探索。
[1] CLOUSE S D.Brassinosteroid signal transduction:From receptor kinase activation to transcriptional networks regulating plant development[J].The Plant Cell,2011,23(4):1219-1230.
[2] DIVI U K,KRISHNA P.Brassinosteroid:A biotechnological target for enhancing crop yield and stress tolerance[J].New biotechnology,2009,26(3/4):131-136.
[3] VRIET C,RUSSINOVA E,REUZEAU C,et al.Boosting crop yields with plant steroids[J].The plant cell,2012,24(3):842-857.
[4] MITCHELL J W,MANDAVA N,WORLEY J F,et al.Brassins-A new family of plant hormones from rape pollen[J].Nature,1970,225(5237):1065-1066.
[5] GROVE M D,SPENCER G F,ROHWEDDER W K,et al.Brassinolide,a plant growth-promoting steroid isolated fromBrassicanapuspollen[J].Nature,1979,281(5728):216-217.
[6] YOKOTA T,ARIMA M,TAKAHASHI N,et al.Castasterone,a new phytosterol with plant-hormone potency,from chestnut insect gall[J].Tetrahedron letters,1982,23(12):1275-1278.
[7] SASSE J M.Recent progress in brassinosteroid research[J].Physiologia plantarum,1997,100(3):696-701.
[8] HIKINO H,HIKINO Y,et al.Arthropod molting hormones[J].Fortschritte der Chemie organischer naturstoffe/Progress in the chemistry of organic natural products,1970,28(3):256-312.
[9] YOKOTA T.The structure,biosynthesis and function of brassinosteroids[J].Trends in plant science,1997,2(4):137-143.
[10] MANDAVA N B.Plant growth-promoting brassinosteroids[J].Annual review of plant physiology and plant molecular biology,1988,39(1):23-52.
[11] VRIET C,RUSSINOVA E,REUZEAU C.From squalene to brassinolide:The steroid metabolic and signaling pathways across the plant kingdom[J].Molecular plant,2013,6(6):1738-1757.
[12] FUJIOKA S,INOUE T,TAKATSUTO S,et al.Identification of a new brassinosteroid,cathasterone,in cultured cells ofCatharanthusroseusas a biosynthetic precursor of teasterone[J].Bioscience,biotechnology,and biochemistry,1995,59(8):1543-1547.
[13] SUZUKI H,INOUE T,FUJIOKA S,et al.Possible involvement of 3-dehydroteasterone in the conversion of teasterone to typhasterol in cultured cells ofCatharanthusroseus[J].Bioscience,biotechnology,and biochemistry,1994,58(6):1186-1188.
[14] OHNISHI T,YOKOTA T,MIZUTANI M.Insights into the function and evolution of P450s in plant steroid metabolism[J].Phytochemistry,2009,70(17/18):1918-1929.
[15] FUJIOKA S,YOKOTA T.Biosynthesis and metabolism of brassinosteroids[J].Annual review of plant biology,2003,54(1):137-164.
[16] CHOE S,DILKES B P,FUJIOKA S,et al.TheDWF4 gene ofArabidopsisencodes a cytochrome P450 that mediates multiple 22α-hydroxylation steps in brassinosteroid biosynthesis[J].The plant cell,1998,10(2):231-243.
[17] SHIMADA Y,FUJIOKA S,MIYAUCHI N,et al.Brassinosteroid-6-oxidases fromArabidopsisand tomato catalyze multiple C-6 oxidations in brassinosteroid biosynthesis[J].Plant physiology,2001,126(2):770-779.
[18] FUJITA S,OHNISHI T,WATANABE B,et al.ArabidopsisCYP90B1 catalyses the early C-22 hydroxylation of C27,C28 and C29 sterols[J].The Plant Journal,2006,45(5):765-774.
[19] TAKAHASHI T,GASCH A,NISHIZAWA N,et al.TheDIMINUTOgene ofArabidopsisis involved in regulating cell elongation[J].Genes & development,1995,9(1):97-107.
[20] CHORY J,NAGPAL P,PETO C A.Phenotypic and genetic analysis of det2,a new mutant that affects light-regulated seedling development inArabidopsis[J].The plant cell,1991,3(5):445-459.
[21] FELDMANN K A,MARKS M D,CHRISTIANSON M L,et al.A dwarf mutant ofArabidopsisgenerated by T-DNA insertion mutagenesis[J].Science,1989,243(4896):1351-1354.
[22] KAUSCHMANN A,JESSOP A,KONCZ C,et al.Genetic evidence for an essential role of brassinosteroids in plant development[J].The plant journal,1996,9(5):701-713.
[23] SYMONS G M,REID J B.Brassinosteroids do not undergo long-distance transport in pea.Implications for the regulation of endogenous brassinosteroid levels[J].Plant physiology,2004,135(4):2196-2206.
[24] BAJGUZ A,TRETYN A.The chemical characteristic and distribution of brassinosteroids in plants[J].Phytochemistry,2003,62(7):1027-1046.
[25] MONTOYA T,NOMURA T,YOKOTA T,et al.Patterns of dwarf expression and brassinosteroid accumulation in tomato reveal the importance of brassinosteroid synthesis during fruit development[J].The plant journal,2005,42(2):262-269.
[26] SYMONS G M,DAVIES C,SHAVRUKOV Y,et al.Grapes on steroids.Brassinosteroids are involved in grape berry ripening[J].Plant physiology,2006,140(1):150-158.
[28] SHIMADA Y,GODA H,NAKAMURA A,et al.Organ-specific expression of brassinosteroid-biosynthetic genes and distribution of endogenous brassinosteroids inArabidopsis[J].Plant physiology,2003,131(1):287-297.
[29] SYMONS G M,ROSS J J,JAGER C E,et al.Brassinosteroid transport[J].Journal of experimental botany,2008,59(1):17-24.
[30] LI J M,CHORY J.A putative leucine-rich repeat receptor kinase involved in brassinosteroid signal transduction[J].Cell,1997,90(5):929-938.
[32] WANG X F,KOTA U,HE K,et al.Sequential transphosphorylation of the BRI1/BAK1 receptor kinase complex impacts early events in brassinosteroid signaling[J].Developmental cell,2008,15(2):220-235.
[33] LI J,WEN J Q,LEASE K A,et al.BAK1,anArabidopsisLRR receptor-like protein kinase,interacts with BRI1 and modulates brassinosteroid signaling[J].Cell,2002,110(2):213-222.
[34] COSGROVE D J,BEDINGER P,DURACHKO D M.Group I allergens of grass pollen as cell wall-loosening agents[J].Proc Natl Acad Sci,1997,94(12):6559-6564.
[35] WANG L,XU Y Y,MA Q B,et al.Heterotrimeric G protein α subunit is involved in rice brassinosteroid response[J].Cell research,2006,16(12):916-922.
[36] JAILLAIS Y,HOTHORN M,BELKHADIR Y,et al.Tyrosine phosphorylation controls brassinosteroid receptor activation by triggering membrane release of its kinase inhibitor[J].Genes & development,2011,25(3):232-237.
[37] GAMPALA S S,KIM T W,HE J X,et al.An essential role for 14-3-3 proteins in brassinosteroid signal transduction inArabidopsis[J].Developmental cell,2007,13(2):177-189.
[38] YIN Y H,WANG Z Y,MORA-GARCIA S,et al.BES1 accumulates in the nucleus in response to brassinosteroids to regulate gene expression and promote stem elongation[J].Cell,2002,109(2):181-191.
[39] HE J X,GENDRON J M,SUN Y,et al.BZR1 is a transcriptional repressor with dual roles in brassinosteroid homeostasis and growth responses[J].Science,2005,307(5715):1634-1638.
[40] TANG W Q,KIM T W,OSES-PRIETO J A,et al.BSKs mediate signal transduction from the receptor kinase BRI1 inArabidopsis[J].Science,2008,321(5888):557-560.
[42] TANG W Q,YUAN M,WANG R J,et al.PP2A activates brassinosteroid-responsive gene expression and plant growth by dephosphorylating BZR1[J].Nature cell biology,2011,13(2):124-131.
[43] WANG Z Y,BAI M Y,OH E,et al.Brassinosteroid signaling network and regulation of photomorphogenesis[J].Annual review of genetics,2012,46(6):701-724.
[44] COSGROVE D J.Growth of the plant cell wall[J].Nature reviews molecular cell biology,2005,6(11):850-861.
[45] WILLATS W G,MCCARTNEY L,MACKIE W,et al.Pectin:Cell biology and prospects for functional analysis[J].Plant molecular biology,2001,47(1/2):9-27.
[46] VOGEL J.Unique aspects of the grass cell wall[J].Curr Opin Plant Biol,2008,11(3):301-307.
[47] COSGROVE D J,JARVIS M C.Comparative structure and biomechanics of plant primary and secondary cell walls[J].Frontiers in plant science,2012,3(4):204.[48] HAYASHI T.Xyloglucans in the primary cell wall[J].Annual review of plant biology,1989,40(1):139-168.
[49] ROSE J K,BRAAM J,FRY S C,et al.The XTH family of enzymes involved in xyloglucan endotransglucosylation and endohydrolysis:Current perspectives and a new unifying nomenclature[J].Plant cell physiology,2002,43(12):1421-1435.
[50] LEE J,BURNS T H,LIGHT G,et al.Xyloglucan endotransglycosylase/hydrolase genes in cotton and their role in fiber elongation[J].Planta,2010,232(5):1191-1205.
[51] YOKOYAMA R,NISHITANI K.A comprehensive expression analysis of all members of a gene family encoding cell-wall enzymes allowed us to predict cis-regulatory regions involved in cell-wall construction in specific organs ofArabidopsis[J].Plant and cell physiology,2001,42(10):1025-1033.
[52] XU W,PURUGGANAN M M,POLISENSKY D H,et al.ArabidopsisTCH4,regulated by hormones and the environment,encodes a xyloglucan endotransglycosylase[J].The plant cell,1995,7(10):1555-1567.
[53] ZUREK D M,RAYLE D L,MCMORRIS T C,et al.Investigation of gene expression,growth kinetics,and wall extensibility during brassinosteroid-regulated stem elongation[J].Plant physiology,1994,104(2):505-513.
[54] PAULY M,KEEGSTRA K.Cell-wall carbohydrates and their modification as a resource for biofuels[J].The plant journal,2008,54(4):559-568.
[55] GONZALEZ N,BEEMSTER G T,INZÉ D.David and Goliath:What can the tiny weedArabidopsisteach us to improve biomass production in crops[J].Current opinion in plant biology,2009,12(2):157-164.
[56] REFR É GIER G,PELLETIER S,JAILLARD D,et al.Interaction between wall deposition and cell elongation in dark-grown hypocotyl cells inArabidopsis[J].Plant physiology,2004,135(2):959-968.
[57] AZPIROZ R,WU Y W,LOCASCIO J C,et al.AnArabidopsisbrassinosteroid-dependent mutant is blocked in cell elongation[J].The plant cell,1998,10(2):219-230.
[58] LUO M,XIAO Y H,LI X B,et al.GhDET2,a steroid 5α-reductase,plays an important role in cotton fiber cell initiation and elongation[J].The plant journal,2007,51(3):419-430.
[59] HONG Z,UEGUCHI-TANAKA M,FUJIOKA S,et al.The rice brassinosteroid-deficientdwarf2 mutant,defective in the rice homolog ofArabidopsisDIMINUTO/DWARF1,is rescued by the endogenously accumulated alternative bioactive brassinosteroid,dolichosterone[J].The plant cell,2005,17(8):2243-2254.
[60] FERNANDEZ M G S,BECRAFT P W,YIN Y,et al.From dwarves to giants? Plant height manipulation for biomass yield[J].Trends in plant science,2009,14(8):454-461.
[61] XIE L Q,YANG C J,WANG X L.Brassinosteroids can regulate cellulose
biosynthesis by controlling the expression of CESA genes inArabidopsis[J].Journal of experimental botany,2011,62(13):4495-4506.
[62] SZEKERES M,N ÉMETH K,KONCZ-KLMN Z,et al.Brassinosteroids rescue the deficiency ofCYP90,a cytochrome P450,controlling cell elongation and de-etiolation inArabidopsis[J].Cell,1996,85(2):171-182.
[63] LI J M,NAGPAL P,VITART V,et al.A role for brassinosteroids in light-dependent development ofArabidopsis[J].Science,1996,272(5260):398-401.
[64] SHIU S-H,BLEECKER A B.Expansion of the receptor-like kinase/Pelle gene family and receptor-like proteins inArabidopsis[J].Plant physiology,2003,132(2):530-543.
[65] HÉMATY K,HOFTE H.Novel receptor kinases involved in growth regulation[J].Current opinion in plant biology,2008,11(3):321-328.
[66] HÉMATY K,SADO P E,VAN TUINEN A,et al.A receptor-like kinase mediates the response ofArabidopsiscells to the inhibition of cellulose synthesis[J].Current biology,2007,17(11):922-931.
[67] GUO H Q,LI L,YE H X,et al.Three related receptor-like kinases are required for optimal cell elongation inArabidopsisthaliana[J].Proc Natl Acad Sci,2009,106(18):7648-7653.
[68] ESCOBAR-RESTREPO J M,HUCK N,KESSLER S,et al.The FERONIA receptor-like kinase mediates male-female interactions during pollen tube reception[J].Science,2007,317(5838):656-660.
[69] HUCK N,MOORE J M,FEDERER M,et al.TheArabidopsismutant feronia disrupts the female gametophytic control of pollen tube reception[J].Development,2003,130(10):2149-2159.
[70] MICHELI F.Pectin methylesterases:Cell wall enzymes with important roles in plant physiology[J].Trends in plant science,2001,6(9):414-419.
[71] CAMARDELLA L,CARRATORE V,CIARDIELLO M A,et al.Kiwi protein inhibitor of pectin methylesterase[J].European journal of biochemistry,2000,267(14):4561-4565.
[72] SUN Y,FAN X Y,CAO D M,et al.Integration of brassinosteroid signal transduction with the transcription network for plant growth regulation inArabidopsis[J].Dev Cell,2010,19(5):765-777.
[73] LI L,YE H X,GUO H Q,et al.ArabidopsisIWS1 interacts with transcription factor BES1 and is involved in plant steroid hormone brassinosteroid regulated gene expression[J].Proceedings of the national academy of sciences,2010,107(8):3918-3923.
[74] QU T,LIU R F,WANG W,et al.Brassinosteroids regulate pectin methylesterase activity and AtPME41 expression inArabidopsisunder chilling stress[J].Cryobiology,2011,63(2):111-117.
[75] WOLF S,MRAVEC J,GREINER S,et al.Plant cell wall homeostasis is mediated by brassinosteroid feedback signaling[J].Curr Biol,2012,22(18):1732-1737.
Progress in Brassinosteroids Involved in Regulation of Primary Cell Wall Metabolism
XU Zong-chang1,2,WANG Meng1,2,KONG Ying-zhen1*
(1.Tobacco Research Institute of Chinese Academy of Agricultural Sciences,Qingdao,Shandong 266101; 2.Graduate School of Chinese Academy of Agricultural Science,Beijing 100081)
The discovery,structure,distribution,synthesis and signal transduction pathways of the brassinolide were introduced; the regulation role of brassinolide in primary cell wall metabolism was expounded,and the research direction of brassinolide in future was look forward.
Brassinolide;Primary cell wall; Metabolic regulation
国家科技支撑计划项目(2015BAD15B03-05);国家自然科学基金项目(31470291,31670302)。
徐宗昌(1988- ),男,山东即墨人,博士研究生,研究方向:作物遗传育种。*通讯作者,教授,博士,博士生导师,从事细胞壁多糖合成研究。
2016-09-30
S 143.8
A
0517-6611(2016)32-0001-05

