烯酰吗啉在马铃薯和土壤中的残留动态及风险评估
梁 爽,敦亚楠,侯志广,赵晓峰,王鑫宏,逯忠斌
(吉林农业大学 资源与环境学院, 吉林 长春 130118)
烯酰吗啉在马铃薯和土壤中的残留动态及风险评估
梁 爽,敦亚楠,侯志广,赵晓峰,王鑫宏,逯忠斌
(吉林农业大学 资源与环境学院, 吉林 长春 130118)
【目的】 了解烯酰吗啉在马铃薯和土壤中的消解动态,为其防治马铃薯晚疫病时的安全合理用药提供依据。【方法】 首先建立一种用气相色谱仪测定烯酰吗啉残留量的检测方法,然后于2012和2013年在山东、吉林进行田间试验,对烯酰吗啉在马铃薯植株、块茎、土壤中的消解动态和最终残留量进行检测,并对施药后可能产生的膳食安全风险进行评估。【结果】 2012年和2013年烯酰吗啉在马铃薯植株中的半衰期分别为0.7 d(吉林)、0.6 d(山东)和2.5 d(吉林)、1.2 d(山东),在马铃薯土壤中的半衰期分别为0.7 d(吉林)、0.5 d(山东)和4.3 d(吉林)、9.6 d(山东)。烯酰吗啉施用剂量、施药次数不同,则其在马铃薯植株、块茎及土壤中的最终残留量也不同,烯酰吗啉最终残留量在马铃薯植株中均低于1.240 mg/kg,在土壤中均低于3.405 mg/kg,在马铃薯块茎中均低于或等于检测方法的最低定量限0.02 mg/kg,也低于我国制定的烯酰吗啉在马铃薯中的最大残留限量0.05 mg/kg。采收后马铃薯块茎中烯酰吗啉的估计暴露量为1.64×10-5mg/kg,风险商值为8.18×10-5(远小于1),膳食风险较低。【结论】 50%烯酰吗啉可湿性粉剂推荐施药剂量为450 g/hm2,施药次数不超过3次,施药间隔期7 d,采收安全间隔期14 d,此条件下食用收获期的马铃薯可靠安全。
烯酰吗啉;马铃薯;气相色谱;农药残留动态;农药风险评估
烯酰吗啉是一种新型内吸治疗型专用低毒杀菌剂,其作用机制是破坏病菌细胞壁膜的形成、引起孢子囊壁分解,进而使病菌死亡,对霜霉病、霜疫霉病、晚疫病、疫(霉)病、疫腐病、腐霉病、黑胫病等低等真菌性病害均具有很好的防治效果[1-3]。马铃薯晚疫病是世界性的流行性和毁灭性病害,90%以上种植马铃薯的地区都有晚疫病发生,烯酰吗啉在马铃薯上的施用非常普遍。
国内外报道烯酰吗啉残留量的检测方法有气相色谱[4-6]、液相色谱[7]、液质联用[8-10]、气质联用[11-12]等。岑江杰等[13]和Jorge Regueiro等[14]通过动物试验对烯酰吗啉的毒性进行了研究,结果表明烯酰吗啉在动物试验中未表现出病理学改变。Paola Avetta等[15]研究表明,烯酰吗啉会生成毒性更低的代谢产物。目前国内外尚无马铃薯中烯酰吗啉的检测方法及残留消解状况的研究报道。基于此,本研究建立了一种烯酰吗啉在马铃薯中的残留消解动态及最终残留量的检测方法,并对其可能产生的膳食安全风险进行了评估[16-17],以期为烯酰吗啉防治马铃薯晚疫病的安全合理用药提供重要依据,为马铃薯的农产品质量安全提供保障。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪 器 Agilent 6890N气相色谱仪配μ-ECD检测器, HP-1( 30.0 m×0.25 mm×0.25 μm) 毛细管色谱柱(美国安捷伦公司),超声波清洗器(KQ-250DE型),组织捣碎机(DS-1型),恒温水浴振荡机(SHZ-88型),旋转蒸发器(ZFQ-3型)。
1.1.2 试 剂 乙腈,HPLC级;丙酮、二氯甲烷、乙酸乙酯、氯化钠、正己烷、无水硫酸钠、中性氧化铝、活性炭均为分析纯,其中氧化铝600 ℃活化4 h,用前经130 ℃烘4 h后加5%蒸馏水减活,在干燥器中保存,无水硫酸钠用前需在650 ℃下灼烧4 h,在干燥器中保存;50%烯酰吗啉可湿性粉剂(江苏辉丰农化股份有限公司生产);烯酰吗啉标准品(纯度99.5%,美国ChemDiv公司生产)。
1.2 试验方法
1.2.1 烯酰吗啉的消解动态试验 试验地点为吉林农业大学农业科学试验站和山东省济南市历城区遥墙镇大辛村。测定烯酰吗啉在马铃薯植株中的消解动态时施药方式为茎叶喷雾,测定其在土壤中的消解动态时仅对土壤喷雾。试验设50%烯酰吗啉用量675 g/hm2和对照(清水)2个处理,每个小区面积为30 m2,3次重复,并设保护带。施药时期为马铃薯晚疫病发生初期,分别于施药后0(施药后2 h),1,3,5,7,14,20,30,40,60 d及收获期采集马铃薯植株和0~10 cm土壤样品备用。所有样品均采用对角线法五点采样。
1.2.2 烯酰吗啉最终残留量试验 试验分别设50%烯酰吗啉450 g/hm2施药3次和4次及675 g/hm2施药3次和4次共4个处理,试验小区设置同1.2.1节。于马铃薯晚疫病发生初期开始第1次施药,每间隔7 d施药1次。于最后一次施药后14 d和20 d分别采集马铃薯植株、块茎和土壤样品备用。所有样品均采用对角线法五点采样。
1.3 检测方法
1.3.1 样品的制备 将马铃薯植株和块茎样品切碎并混合均匀, 然后按四分法取500 g样品,用食品加工机打碎;土壤样品混合均匀后, 除去杂物,四分法取样500 g。所有样品均于-20 ℃保存备用。
1.3.2 样品的提取 (1)马铃薯植株和块茎。 称取样品20.0 g,加入90 mLV(乙腈)∶V(水)=8∶1的混合溶剂匀质提取2 min,滤至装有7 g氯化钠的具塞量筒中,剧烈振摇,静置1 h,取40 mL上清液减压浓缩至近干,氮气吹干后立即加入2 mL正己烷定容,待净化;其余部分弃去。
(2)土壤。称取土样50.0 g(折合风干土)放入具塞三角瓶中,加入80 mLV(丙酮)∶V(水)=8∶2的混合液,振荡提取1 h,过滤,20 mL丙酮冲洗残渣,滤液全部转移至装有20 mL 100 g/L NaCl溶液的分液漏斗中,二氯甲烷(40,30,30 mL)萃取3次,收集下层有机相减压浓缩至近干,氮气吹干后立即加入5 mL正己烷定容,待净化。
1.3.3 样品的净化 依次在层析柱(15 mm×300 mm)中装入高度为1 cm的无水硫酸钠、3.0 g中性氧化铝和0.3 g活性炭的均匀混合物及1 cm的无水硫酸钠。用50 mL乙酸乙酯预淋洗层析柱后,加入1.3.2节中的样品提取液,用60 mL乙酸乙酯分2次淋洗层析柱,收集淋洗液并减压浓缩至近干,马铃薯植株和块茎样品用正己烷定容至2 mL,土壤样品用正己烷定容至5 mL,待气相色谱分析。
1.3.4 仪器检测条件 进样口温度280 ℃,检测器温度300 ℃;柱温采用程序升温,初始温度为120 ℃,保持1 min,以25 ℃/min升至260 ℃,恒温22 min;载气为高纯氮气,流速1.0 mL/min;进样量为1 μL。烯酰吗啉2个同分异构体的保留时间在 19.693~23.566 min。
1.3.5 添加回收率和精密度测定 取对照处理的马铃薯植株20.0 g、土壤50.0 g、马铃薯块茎20.0 g,设添加烯酰吗啉 0.02,0.05和0.50 mg/kg 3个水平,重复5次,按照前述样品前处理方法及仪器检测条件,测定烯酰吗啉在马铃薯植株、块茎和土壤中的回收率,并计算相对标准偏差即精密度值。在重复性条件下获得的2次独立测试结果的绝对差值不大于这2次测定结果的算术平均值的15%,即为达到农药残留分析标准的精密度。
1.3.6 烯酰吗啉在马铃薯中的膳食风险评估 烯酰吗啉膳食风险评估结果由以下公式计算得出:
估计暴露量=(理论残留量×食物摄入量)/体质量;
(1)
风险商值=估计暴露量/每日允许摄入量。
(2)
我国60 kg体质量成人的薯类摄入量为0.049 1 kg[18],烯酰吗啉的日允许摄入量 (ADI)为0.2 mg/kg b.w.[19](b.w.指人体标准体质量),理论残留量按两年两地马铃薯块茎的最终残留量的平均值计,体质量以成人人均体质量60 kg计,按上述参数计算烯酰吗啉在马铃薯中的估计暴露量和风险商值。风险商值>1时,即表示对暴露人群存在风险;风险商值≤1时,表示风险在可接受的范围内,风险商值越小风险越小。
2 结果与分析
2.1 烯酰吗啉检测方法的建立
马铃薯淀粉含量为10%~22%[18],所以在马铃薯块茎的提取过程中,水相和有机相之间存在严重的乳化现象,使试验准确度和精确度出现明显偏差。本试验采用乙腈-水混合溶剂提取,通过盐析来破除乳化,保证了烯酰吗啉在马铃薯中的提取效率和回收率。在样品提取过程中,取40 mL上清液减压浓缩至近干,其余部分弃去,这主要是为了在不影响准确性的前提下,减少乳化作用的影响及乙腈溶液在减压浓缩过程中消耗的时间。在净化过程中本试验采用自填层析柱,对填料进行了优化,即1 cm无水硫酸钠、3.0 g中性氧化铝和0.3 g活性炭的均匀混合物及1 cm无水硫酸钠是最佳的填料配比,在最大限度地保证回收率的同时也有效地减少了基质效应的影响。
2.2 烯酰吗啉标准曲线的绘制及检测方法的准确度与精密度
用正己烷稀释烯酰吗啉标准品配得0.1,0.5,1,2,5 mg/L系列标准溶液,用建立的烯酰吗啉检测方法进行测定,得出标准曲线为y=82 850x+10 693(y表示峰面积,x表示烯酰吗啉质量浓度),相关系数r=0.999 2。烯酰吗啉在马铃薯植株、块茎和土壤中的添加试验结果见表1。
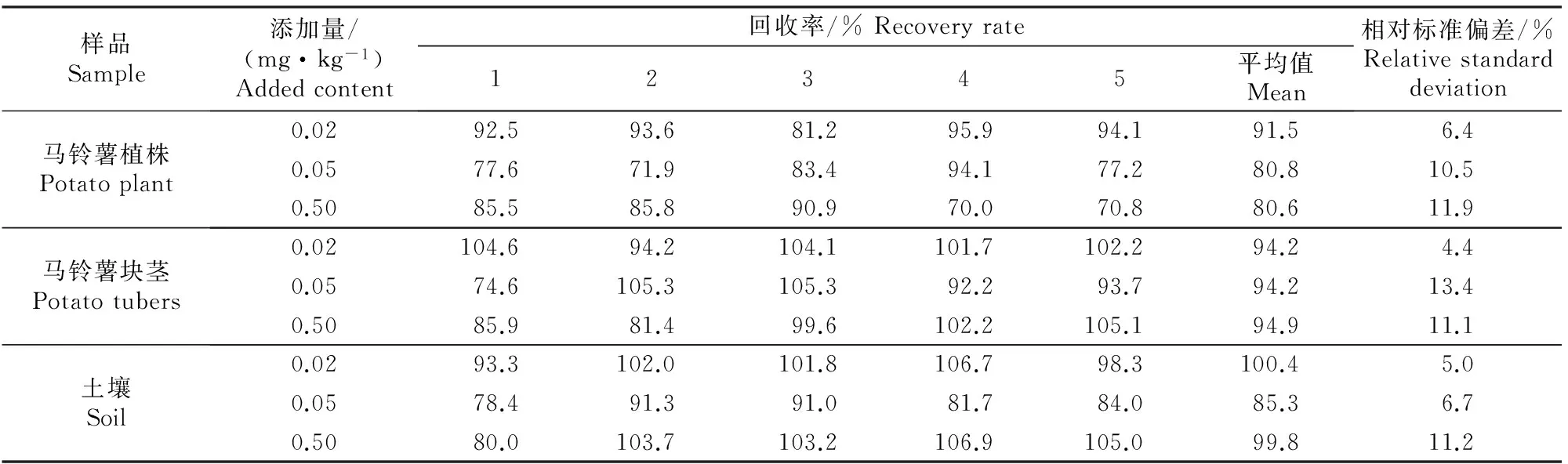
表 1 烯酰吗啉在马铃薯植株、块茎和土壤中的添加试验结果
通过添加试验测得烯酰吗啉在马铃薯植株、块茎和土壤中的平均回收率分别为80.6%~91.5%,94.2%~94.9%和85.3%~100.4%,相对标准偏差分别为6.4%~11.9%,4.4%~13.4%和5.0%~11.2%(表1)。
烯酰吗啉最小进样量峰高为仪器噪声3倍时,计算得出烯酰吗啉在马铃薯植株中的最低检出限(LOD)为0.006 mg/kg;马铃薯植株、块茎对照样品中烯酰吗啉标准品添加量为0.4 mg/kg时,检测得出最低定量限(LOQ)为0.02 mg/kg,均低于最高残留限量(MRL)值0.05 mg/kg[20]。烯酰吗啉添加量不同则试验结果不同,因此需要明确烯酰吗啉添加量。以同样方法得出烯酰吗啉在土壤中的最低检出限(LOD)为0.003 mg/kg,最低定量限(LOQ)为0.01 mg/kg。
2.3 烯酰吗啉在马铃薯植株和土壤中的消解动态
经测算,2012年烯酰吗啉在马铃薯植株中的消解曲线方程为C=5.160 2 e-0.265t(C表示残留量,t表示时间,下同)(r=0.946 8),半衰期(t1/2)=0.7 d(吉林);C=3.900 6e-0.100 6t(r=0.949 8),t1/2=0.6 d(山东)。2013年烯酰吗啉在马铃薯植株中的消解曲线方程为C=2.348 6e-0.150 6t(r=0.825 2),t1/2=2.5 d(吉林);C=4.273 2e-0.639 8t(r=0.944 5),t1/2=1.2 d(山东)。2012年烯酰吗啉在土壤中的消解曲线方程为C=0.136 7e-1.372t(r=0.990 8),t1/2=0.7 d(吉林);C=1.354 4e-0.050 7t(r=0.924 0),t1/2=0.5 d(山东)。2013年烯酰吗啉在马铃薯土壤中的消解曲线方程为C=0.365 9e-0.147 1t(r=0.949 9),t1/2=4.3 d(吉林);C=1.060 2e-0.035 8t(r=0.912 6),t1/2=9.6 d(山东)。
2.4 烯酰吗啉在马铃薯植株、块茎和土壤中的最终残留量
通过两年两地烯酰吗啉在马铃薯植株、块茎和土壤中的最终残留试验得出,烯酰吗啉剂量和施药次数不同,则其在不同施药部位的最终残留量也不同。由表2~4可以看出,马铃薯植株中烯酰吗啉最终残留量均低于1.240 mg/kg,马铃薯块茎中烯酰吗啉最终残留量均低于或等于0.020 mg/kg,土壤中烯酰吗啉最终残留量均低于3.405 mg/kg。

表 2 烯酰吗啉在马铃薯植株中的最终残留试验结果
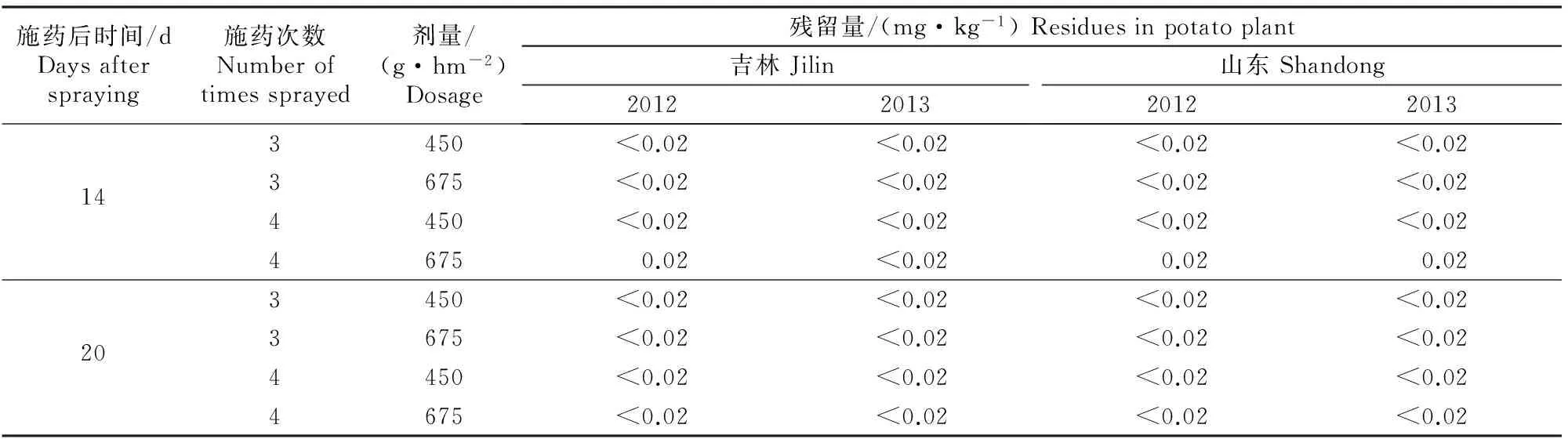
表 3 烯酰吗啉在马铃薯块茎中的最终残留试验结果
2.5 烯酰吗啉在马铃薯中的膳食风险评估
收获期后马铃薯块茎中烯酰吗啉的残留量已低于检测方法中的最低定量浓度,因此本试验以检测方法中最低定量质量浓度为最终残留量计算烯酰吗啉在采收后马铃薯块茎中的估计暴露量,其值为1.64×10-5mg/kg,风险商值为8.18×10-5(远<1)。施用50%烯酰吗啉可湿性粉剂450 g/hm2、最多施药不超过3次、施药间隔期7 d、采收安全间隔期为14 d时,烯酰吗啉在马铃薯中的膳食风险较低,消费者可安全食用。

表 4 烯酰吗啉在土壤中的最终残留试验结果
3 结 论
本研究建立了一种用气相色谱仪测定马铃薯植株、块茎及土壤中烯酰吗啉残留量的方法。该方法克服了马铃薯因基质淀粉含量高带来的前处理乳化等问题,操作简便、快捷,准确度和精密度高,完全满足检测要求。在吉林和山东连续2年的田间消解动态和最终残留量试验结果表明,烯酰吗啉在马铃薯植株和土壤中的半衰期为0.5~9.6 d(t1/2<30 d),属于易降解农药;烯酰吗啉在马铃薯块茎中的最终残留量低于检测方法的最低定量限0.02 mg/kg,也低于我国制定的烯酰吗啉在马铃薯中的最大残留限量0.05 mg/kg以及日本制定的最大残留限量0.1 mg/kg。因此,使用50%烯酰吗啉可湿性粉剂防治马铃薯晚疫病,推荐施药剂量450 g/hm2,施药次数不超过3次,施药间隔期 7 d,采收安全间隔期14 d。马铃薯中烯酰吗啉的风险商值为8.18×10-5(远小于1),膳食风险较低,食用收获期的马铃薯可靠安全。
[1] 崔淑华,王开运,钱家亮,等.烯酰吗啉在大葱中的残留消解动态 [J].农药,2010,49(1):47-49.
Cui S H,Wang K Y,Qian J L,et al.Residue decline study of dimethomorph in green onions [J].Pesticide Science,2010,49(1):47-49.
[2] 王 岩,姚威风,梁 爽,等.甘蓝和土壤中吡唑醚菌酯·烯酰吗啉残留分析 [J].农药,2011,50(1):46-47,57.
Wang Y,Yao W F,Liang S,et al.Residue analysis of dimethomorph in cabbage and soil [J].Pesticide Science,2011,50(1):46-47,57.
[3] 臧 纯,龚道新,罗 杨,等.烯酰吗啉40%可湿性粉剂在黄瓜及其土壤中的消解动态 [J].农药科学与管理,2011,32(2): 35-37.
Zang C,Gong D X,Luo Y,et al.Residue decline study of 40% dimethomorph WP in cucumber and soil [J].Pesticide Science and Management,2011,32(2):35-37.
[4] 袁 圆,龙友华,吴小毛.白菜中嘧霉胺和烯酰吗啉残留的气相色谱分析 [J].山东农业生物学报,2013,32(6):492-494.
Yuan Y,Long Y H,Wu X M.Determination of pyrimethanil and dimethomorph residue in Chinese cabbage using gas chromatography [J].Journal of Shandong Agriculture and Biology,2013,32(6):492-494.
[5] Liang H,Li W L,Li W.Dissipation and residue of dimethomorph in pepper and soil under field conditions [J].Ecotoxicology and Environmental Safety,2011,74:1331-1335.
[6] 李荣玉,谢庆艳,王 梅,等.烯酰吗啉在土壤及番茄中残留量的气相色谱分析 [J].山地农业生物学报,2013,32(6):495-498.
Li R Y,Xie Q Y,Wang M,et al.Determination of dimethomorph residue in tomato and soil using gas chromatography [J].Journal of Mountain Agriculture and Biology,2013,32(6):495-498.
[7] 吴燕华,刘吉平,谭兆海.烯酰吗啉的高效液相色谱分析 [J].广州化工,2009,36(12):152-153.
Wu Y H,Liu J P,Tan Z H.Residue analysis of dimethomorph using HPLC [J].Journal of Guangzhou Chemical Industry,2009,36(12):152-153.
[8] 王 艳,王春伟, 高 洁,等.烯酰吗啉在人参和土壤中的残留动态及膳食风险评估 [J].食品科学,2014,35(14):170-174.
Wang Y,Wang C W,Gao J,et al.Residue decline study and risk assessment of dimethomorph in ginseng and soil [J].Food Science,2014,35(14):170-174.
[9] Jadhav M,Girame R,Utture S,et al.Residue dissipation and processing factor for dimethomorph,famoxadone and cymoxanil during raisin preparation [J].Food Chemistry,2015,170:180-185.
[10] Luis A A,Carlos R B,Diego A A.Monitoring of pesticide residues in tomato marketed in Bogotá,Colombia [J].Food Control,2014,35:213-217.
[11] 徐伟松,李畅方,何 强,等.烯酰吗啉在黄瓜和土壤中的残留量及消解动态研究 [J].农药科学与管理,2008,29(3):15-18.
Xu W S,Li C F,He Q,et al.Residue decline study of dimethomorph in cucumber and soil [J].Pesticide Science and Management,2008,29(3):15-18.
[12] Julio C E A,Jairo A G D.Practical aspects in gas chromatography-mass spectrometry for the analysis of pesticide residues in exotic fruits [J].Food Chemistry,2015,182:14-22.
[13] 岑江杰,上官小来,徐永哲,等.杀菌剂烯酰吗啉的毒性研究 [J].浙江化工,2004,35(5):8-9,16.
Cen J J,Shangguan X L,Xu Y Z,et al.Toxicity research of fungicides dimethomorph [J].Journal of Zhejiang Chemical Industry,2004,35(5):8-9,16.
[14] Jorge R,Nair O,Jesussimal G,et al.Toxicity evaluation of new agricultural fungicides in primary cultured cortical neurons [J].Environmental Research,2015,140:37-44.
[15] Paola A,Giulia M,Marco M,et al.Photo transformation pathways of the fungicide dimethomorph ((E,Z) 4-[3-(4-chlorophenyl)-3-(3,4-dimethoxyphenyl)-1-oxo-2-propenyl] morpholine),relevant to sunlit surface waters [J].Science of the Total Environment,2014,501:351-360.
[16] Qu C K,Qi S H,Yang D,et al.Risk assessment and influence factors of organochlorine pesticides (OCPs) in agricultural soils of the hill region:a case study from Ningde,southeast China [J].Journal of Geochemical Exploration,2015,149:43-51.
[17] Liu C,Lu D H,Wang Y C,et al.Residue and risk assessment of pyridaben in cabbage [J].Food Chemistry,2014,149:233-236.
[18] 宿飞飞,陈伊里,石 瑛,等.不同纬度环境对马铃薯淀粉含量及淀粉品质的影响 [J].作物杂志,2009,1(4):27-31.
Su F F,Chen Y L,Shi Y,et al.Environmental effects of different latitudes on the potato starch content and starch quality [J].Crops,2009,1(4):27-31.
[19] 中国营养学会.中国居民膳食指南 [M].拉萨:西藏人民出版社,2008.
Chinese Nutrition Society.Chinese dietary guidelines [M].Lasa:Tibet People’s Publishing House,2008.
[20] 中华人民共和国农业部.GB 2763-2014 食品中农药残留最大限量 [S].北京:中华人民共和国农业部,2014:166-167.
Ministry of Agriculture in People’s Republic of China.GB 2763-2014 Maximum levels of pesticide residues in food [S].Beijing:Ministry of Agriculture in People’s Republic of China,2014:166-167.
Residual dynamics and risk assessment of dimethomorph in potato and soil
LIANG Shuang,DUN Yanan,HOU Zhiguang,ZHAO Xiaofeng,WANG Xinhong,LU Zhongbin
(CollegeofResourceandEnvironmentalScience,JilinAgriculturalUniversity,Changchun,Jilin130118,China)
【Objective】 Residual dynamics of dimethomorph in potato and soil were investigated to provide basis for safe and reasonable application of pesticide to protect and cure Potato Late Bright.【Method】 Firstly,a method was developed for analyzing dimethomorph residual based on gas chromatography.Then,field experiment was carried out in Shandong and Jilin during 2012 and 2013.Residual dynamics and final residues of dimethomorph in potato plant and soil were detected and the dietary risk was assessed.【Result】 The half-lives of dimethomrph in potato plant were 0.7 d (Jilin) and 0.6 d (Shandong) in 2012 and 2.5 d (Jilin) and 1.2 d (Shandong) in 2013.The half-lives of dimethomrph in soil were 0.7 d (Jilin) and 0.5 d (Shandong) in 2012 and 4.3 d (Jilin) and 9.6 d (Shandong) in 2013.The final residues of dimethomorph at different dosages and different sprayed times in root and plant of potato and soil were different.The final residues in potato plant were lower than 1.240 mg/kg and that in soil were lower than 3.405 mg/kg.The final residues in potato tuber were less than 0.02 mg/kg (LOQ),which is lower than the MRL of 0.05 mg/kg.The exposure level of potato root in harvest season was 1.64×10-5mg/kg and the risk quotient was 8.18×10-5(much less than 1),indicating it is in safe level.【Conclusion】 The suggested usage is 450 g/hm2for 50% dimethomorph WP,no more than three times,7 d interval,and 14 d harvest safety interval for dietary safety.
dimethomorph;potato;gas chromatography;pesticide residual dynamics;pesticide risk assessment
时间:2016-10-09 10:08
10.13207/j.cnki.jnwafu.2016.11.023
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20161009.1008.046.html
2015-04-21
农业部农药残留项目(2012H07)
梁 爽(1984-),女,吉林长春人,讲师,博士,主要从事农药残留与分析及农药环境毒理研究。
逯忠斌(1961-),男,黑龙江海伦人,教授,博士生导师,主要从事农药残留与分析及农药环境毒理研究。 E-mail:luzhong1979@aliyun.com
S482.2
A
1671-9387(2016)11-0161-05

