检测产志贺毒素大肠杆菌抗体的间接ELISA试剂盒的研制
张雪寒,张 强,张碧成,汪 伟,倪艳秀,温立斌,李 彬,周俊明,何孔旺,周 萍
(江苏省农业科学院兽医研究所 / 农业部兽用生物制品工程技术重点实验室/ 国家兽用生物制品工程技术研究中心,江苏 南京 210014)
检测产志贺毒素大肠杆菌抗体的间接ELISA试剂盒的研制
张雪寒,张 强,张碧成,汪 伟,倪艳秀,温立斌,李 彬,周俊明,何孔旺,周 萍
(江苏省农业科学院兽医研究所 / 农业部兽用生物制品工程技术重点实验室/ 国家兽用生物制品工程技术研究中心,江苏 南京 210014)
本研究旨在研制一种以紧密素为检测靶标的间接ELISA技术,检测血清中产志贺毒素大肠杆菌(Shiga toxigenicEscherichiacoli,STEC)的抗体水平。根据紧密素27个亚型的N端保守序列,体外表达390~543 aa片段制备包被抗原,通过敏感性、特异性、重复性和稳定性实验,建立检测STEC的抗体的间接 EIISA方法。经优化筛选的间接ELISA最佳反应条件:抗原包被浓度3 ng/孔,待检血清稀释比例1∶200,HRP-兔抗羊IgG、HRP-兔抗牛IgG的工作浓度均为1∶15000,5 %脱脂奶封闭l h,底物作用时间10 min,用于牛、羊疫苗抗体检测或者STEC大肠杆菌感染的监测。
致病性大肠杆菌;紧密素;间接ELISA
产志贺毒素性大肠杆菌(Shiga toxigenicEscherichiacoli,STEC)是一个多样的家族,其中的很多O∶H血清型与人类疾病密切相关。众所周知,STEC O157∶H7曾在全世界范围内引发大范围的感染发病[1],导致严重的公共卫生事件爆发。中国自1986年[2]首次报告O157∶H7感染的病例以来,已先后有江苏、山东、河南、安徽、北京等十几个省市发现O157∶H7感染的散发病例,潜在着疫情爆发流行的威胁,仅在1999年江苏省徐州局部地区短期内就报告了131例O157感染性腹泻病例,其中仅有16例治愈,115例因并发急性肾衰而死亡[3-4]。非O157∶H7引发的公共卫生事件逐渐凸显[5],2012年因美国感染STEC而发病病例231,157中,59.7 %为非O157∶H7血清型感染,40.3 %为O157∶H7感染[6]。美国1983-2002年度期间,O26、O45、O103、O111、O121和O145血清型感染导致的人群发病占非O157∶H7致病总人数的75 %[7]。
紧密素是STEC非常重要的毒力因子,功能研究最为清楚,主导菌体在宿主肠上皮细胞的定植,促进肌动蛋白聚合和基座样结构形成,造成严重的肠绒毛脱落,即attaching/effacing(A/E)损伤。Intimin编码基因eae,有27个亚型α1、α2、β1、β2、β3、ε1、ε2、ε3、ε4、η1、η2、θ、λ、μ、ν、ξ1、ξ3、ο、π、ρ、σ、τ1、τ2、б、γ1、γ2和κ,与菌株血清型和致病性关系密切[8-9]。大部分STEC O157∶H7 和O145携带有eae-γ亚型,也有少数O157∶H7携带有eae-α亚型。大部分O26和O121携带有eae-β,大部分O103主要携带有eae-ε、大部分O45 和O111主要携带eae-θ亚型[10-11]。
当前,没有国家批准和市售的STEC的抗体检测技术。快速、特异,适合批量检测的方法将为食源性致病性大肠杆菌的防控提供技术保障。随着抗生素的泛滥使用、导致菌株毒力基因更多变异,加之人类饮食结构的改变,更加重视食物营养的保留,食物被致病性大肠杆菌污染的几率增高、人类感染的机会也会随之更频繁。有效控制食物链中的动物的感染和带菌,将会大大减少对人类的危害。ELISA方法检测流程成熟、易于掌握,不需要高值仪器,更适合养殖场、疾病控制中心以及进出口检疫机构规模量样品的检测以及流行病学分析。因此,本研究旨在扩增紧密素保守区域,体外表达重组抗原,建立STEC的ELISA检测技术,组装试剂盒,便于推广和使用。
1 材料与方法
1.1 主要试剂
ExTaqDNA聚合酶(5 U/μl)、dNTPs(TaKaRa公司)、BamHI 和HindIII 限制性内切酶;Dynabeads anti-E.coliO157免疫磁珠(北京天为公司);LB培养基、麦康凯培养基、肉汤培养基、TMB显色液(南京助研生物公司);HRP-葡萄球菌A蛋白、HRP-兔抗羊IgG、HRP-兔抗牛IgG(美国KPL公司)、HRP-羊抗小鼠IgG,HRP-羊抗猪IgG和HRP-小鼠抗人IgG(武汉博士德公司)。
1.2 引物设计及合成
利用计算机软件DNAStar对STEC eae基因进行核苷酸和氨基酸序列的同源性分析。紧密素基因序列号分别为eae-α (accession no. M58154)、eae-α2 (AF530555)、 eae-β (AF453441)、eae-β2 (AJ715407)、 eae-β3 (AJ876651)、 eae-γ(Z11541)、eae-γ2 (AF025311)、 eae-δ (AJ875027)、eae-ε (AF116899)、 eae-ε2 (AF530554)、 eae-ε3 (AJ876650)、eae-ε4 (AJ876651)、 eae-ζ (AF449417)、eae-η (AJ308550)、 eae-η2 (AJ876652)、 eae-θ(AF449419)、eae-ι (AJ308551)、 eae-ι2 (AF530553)、eae-κ (U66102)、 eae-λ (AF530557)、 eae-μ (AJ705049)、eae-ν (AJ705050)、 eae-ξ (AJ705051)、 eae-ο (AJ584841, partial)、eae-π (AJ705052)、 eae-ρ (AJ748082) 和eae-σ (AJ781125)。全长27个亚型的eae基因在氨基酸和核苷酸水平的同源性分别介于68.6 %~99.9 %和77.4 %~100 %,图1。保守区域的筛选和引物的设计主要通过计算机软件DNAStar和Primer Premier 5对整个eae基因进行比对分析,N端1171~1629核苷酸保守性好,且氨基酸抗原性良好。故以1171~1629核苷酸459 nt区域设计引物eae-F和eae-R。其中eae-F的N端含有3个保护性碱基(TAA)和1个限制性酶切位点BamH I(GGATCC);eae-R的N端含有3个保护性碱基(GGG)和1个限制性酶切位点HindIII(AAGCTT)。引物序列如下:eae-F:5-TAAGGATCCtaccgtcatggtacgggt-3,eae-R:5-GGGAAGCTTctgtacattgttagagct-3。

图1 大肠杆菌eae基因氨基酸水平的同源性分析Fig.1 Identical analysis of amino acids encoded by E. coli eae gene
1.3 重组蛋白表达、纯化和Western blotting检测
常规PCR方法扩增eae目的片段459 bp,克隆到低温表达载体 pCold I质粒中,成功构建重组菌BL21(pCold I-eae)。重组菌培养物中加入IPTG(异丙基-β-D-硫代半乳糖苷)进行诱导,收集菌液,超声裂解,收集上清进行SDS-PAGE(图2)。重组蛋白经SDS-PAGE后转移至硝酸纤维素膜(NC膜)上,STEC O157∶H7血清为一抗, HRP-兔抗牛的IgG为二抗,DAB显色液显色,观察是否有预期目的条带出现。
1.4 间接ELISA方法的建立
1.4.1 重组蛋白抗原最适包被浓度及待检血清稀释浓度的确定 包被液将纯化的重组蛋白62.50、31.25、15.63、7.81、3.91和1.95 ng/mL分别包被酶标板,4 ℃过夜。用PBS将牛源大肠杆菌O157∶H7阳性血清以及阴性血清分别进行1∶50、1∶100、1∶200、1∶400倍比稀释,组成方阵。将包被好的酶标板用洗板机将包被液吸出,PBST洗涤3次,加入5 %明胶封闭液,300 μl/孔,37 ℃湿盒内孵育2 h。封闭后,同上洗涤,分别加入倍比稀释的大肠杆菌阴阳性血清,100 μl/孔,37 ℃湿盒内孵育1 h,洗涤后,按照方阵加入稀释好的HRP-兔抗牛IgG(1∶15000),100 μl/孔,洗涤后,加入底物100 μl/孔,室温显色10 min,加入2 M H2SO4终止反应,在酶标仪读出阳性血清OD450值在1.0左右,且阴性值低,P/N值高的抗原浓度和血清工作浓度,从而确定抗原最适包被浓度和血清稀释度。
1.4.2 重组抗原包被条件的确定 以最适抗原浓度包被酶标板,100 μl/孔,分成4组。I 组,37 ℃包被2 h;II 组,37 ℃包被3 h;III 组,37 ℃包被1 h加4 ℃过夜;IV 组,4 ℃过夜。将包被好的酶标板洗涤,37 ℃湿盒内封闭2 h,封闭后每孔加入最适的血清稀释度,37 ℃湿盒内作用1 h。洗涤后,每孔加入1∶15000稀释的HRP-兔抗牛IgG,100 μl /孔,37 ℃湿盒内作用1 h。洗涤后,加入底物100 μl /孔,室温显色10 min,加入2 M H2SO4终止反应,记录酶标仪的OD450值,比较阴阳性血清OD450值且阴性值低,P/N值高的抗原包被时间,以确定最佳的包被条件。
1.4.3 封闭液以及封闭时间的确定 以最适的抗原浓度和最佳抗原包被条件包被酶标板,洗涤后,分成4组。I 组,5 %脱脂奶粉;II 组,5 %小牛血清;III 组,5 % BSA(牛血清白蛋白);IV 组,5 %明胶。湿盒内封闭时间分别为1.0、1.5、2.0和2.5 h,每个组分别作3个平行孔。封闭后洗涤,加入最适浓度的阴阳性血清,100 μl /孔,37 ℃湿盒内作用1 h,洗涤后加入1∶15000稀释的HRP-兔抗牛IgG,100 μL /孔,37 ℃湿盒内作用1 h。洗涤后,加入底物100 μl /孔,室温显色10 min,加入2 M H2SO4终止反应,记录酶标仪的OD450值,以确定最佳的封闭液种类和封闭时间。
1.4.4 酶标二抗稀释倍数和作用时间的确定 以最适的抗原浓度和最佳抗原包被条件包被酶标板,洗涤后,加入5 %明胶封闭液,37 ℃湿盒内封闭2 h。封闭后,洗涤同上,加入最适阴阳性血清浓度,37 ℃湿盒内作用1 h。HRP-兔抗牛IgG按照1∶10000、1∶15000、1∶20000、1∶25000和1∶30000稀释,每个稀释度作3个平行,作用时间分别为30、60、90和120 min。洗涤后,加入底物100 μl /孔,室温显色10 min,加入2 M H2SO4终止反应,记录酶标仪的OD450值,以确定最佳的二抗稀释度和作用时间。
1.4.5 血清最佳作用时间的确定 以最适抗原浓度和最佳抗原包被条件包被酶标板,分成4组。将包被好的酶标板洗涤,37 ℃湿盒内封闭2 h,封闭后每孔加入最适的血清稀释度,37 ℃湿盒内作用30、60、90和120 min。洗涤后,1∶15000稀释的HRP-兔抗牛IgG,37 ℃湿盒内作用1 h,洗涤后每孔加入新鲜的底物溶液,室温显色10 min,加入2M H2SO4终止反应,记录酶标仪的OD450值,以确定待检血清合适的作用时间。
1.4.6 底物反应时间的确定 以最适抗原浓度和最佳抗原包被条件包被酶标板,分成4组。将包被好的酶标板洗涤,37 ℃湿盒内封闭2 h,封闭后每孔加入最适的血清稀释度,37 ℃湿盒内作用1 h。洗涤后,1∶15000稀释的HRP-兔抗牛IgG,37 ℃湿盒内作用1 h,洗涤后每孔加入底物溶液,室温条件下显色时间分别为5、10、15和20 min,加入2 M H2SO4终止反应,记录酶标仪的OD450值,以确定最佳底物显色时间。
1.4.7 不同种属酶标IgG的比较 以最适的抗原浓度和最佳抗原包被条件包被酶标板,洗涤后,加入5 %明胶封闭液,37 ℃湿盒内封闭2 h。封闭后,洗涤同上,加入相应种属阴阳性血清浓度,37 ℃湿盒内作用1 h。HRP-兔抗牛IgG、HRP-兔抗羊IgG、HRP-羊抗小鼠IgG、HRP-羊抗猪IgG和HRP-SPA按照1∶15000稀释,每个酶标抗体作2个平行,作用时间为60 min。洗涤后,加入底物100 μl /孔,室温显色10 min,加入2 M H2SO4终止反应,记录酶标仪的OD450值,以明确HRP-SPA是否可以用于检测多物种的IgG。
1.4.8 特异性交叉试验 用纯化好的重组蛋白在最适包被条件下包被酶标板,洗涤封闭后,分别将小鼠沙门氏杆菌、小鼠单增李斯特氏杆菌、小鼠弯曲杆菌、猪链球菌、猪巴氏杆菌和小鼠非致病性大肠杆菌K12的阳性血清作1∶40稀释,同时设置紧密素抗体阳性血清对照和阴性血清对照,100 μl /孔,37 ℃湿盒内作用1 h,洗涤后,加入1∶15000稀释的相应的种属二抗,37 ℃湿盒内作用1 h,洗涤后每孔加入底物显色10 min,终止液终止反应,记录酶标仪上的OD450值,进行结果判定。
1.4.9 阴阳性临界值 利用本发明建立的ELISA检测方法对28份牛阴性血清样品,方法参照文献[12]进行检测,以STEC O157∶H7抗体阳性血清为参照计算P/N值,对这些血清型数据进行统计学分析。
1.5 重复性实验
1.5.1 批内重复实验 使用同批诱导纯化制备的Intimin重组蛋白,按最佳抗原包被浓度包被酶标板,用已建立的ELISA操作方法,在不同时间分别检测8份随机选择的STEC O157∶H7抗体水平不同的血清与标准血清,用酶标仪仪在450 nm波长下测定OD值。计算各份血清S/P值,以及S/P值的平均值X,标准差SD,变异系数c.v.。
1.5.2 批间重复实验 使用不同批次诱导纯化制备的Intimin重组蛋白,按最佳抗原包被浓度包被酶标板,用已建立的ELISA操作方法,同时检测8份随机选择的ETEC抗体水平不同的血清,用酶标仪仪在450nm波长下测定OD值。计算各份血清S/P值,以及S/P值的平均值X,标准差SD,变异系数c.v.。
1.6 ELISA方法检测免疫动物的抗体滴度
1.6.1 免疫牛抗体检测 选择2月龄犊牛,颈部皮下注射 STEC O157∶H7亚单位疫苗(H7-HCP-Tir-Intimin)[13],分别于免疫前、免疫后7、14、21、28和35 d采集血清测定intimin抗体滴度。ELISA操作步骤如下:纯化的intimin包被酶标板,工作浓度为3 ng/孔,抗原包被条件为37 ℃ 包被1 h加4 ℃过夜;血清稀释度和反应时间为1∶40和1 h;使用5 %的明胶封闭,封闭时间均为2 h;HRP-兔抗牛IgG的使用浓度和反应时间为1∶15000 和1 h;常温下,底物反应时间为10 min。加入2 M H2SO4终止反应,记录酶标仪的OD450。结果显示:免疫后,P/N值大于2.1(免疫后血清OD450/免疫前血清OD450),表明intimin间接ELISA方法可以检测疫苗免疫后抗体水平的消长趋势。
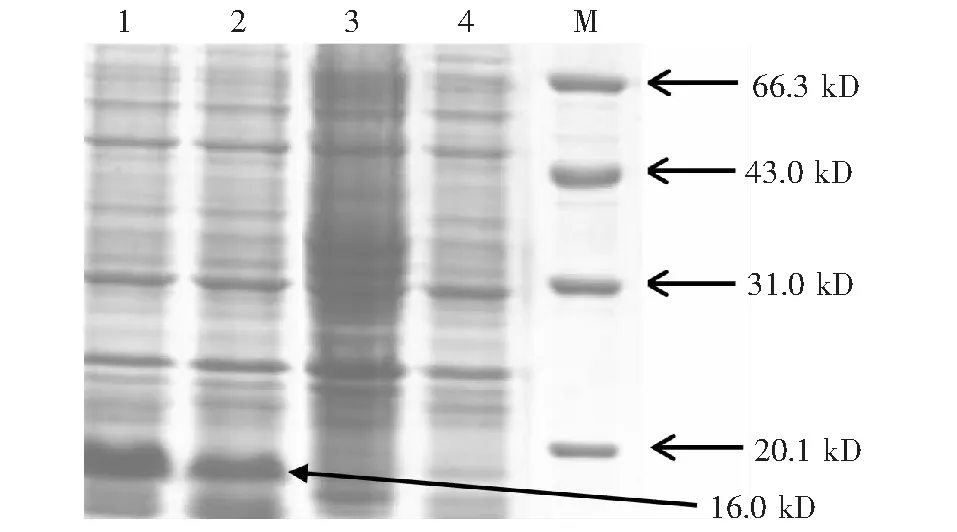
M:蛋白质标准;1~2:诱导后重组菌BL21(pCold I-eae);3~4:诱导前重组菌BL21(pCold I-eae)图2 重组蛋白的SDS-PAGE 分析Fig.2 SDS -PAGE analysis of the recombinant protein
1.6.2 山羊抗体检测 选择2月龄,劲部皮下多点注射STEC O103菌株灭活疫苗分别于免疫前、免疫后14 d、和二免后14和28 d采集血清测定intimin抗体滴度。ELISA操作步骤如下:纯化的intimin包被酶标板,工作浓度为3 ng/孔,抗原包被条件为37 ℃ 包被1 h加4 ℃过夜;血清稀释度和反应时间为1∶40和1 h;使用5 %的明胶封闭,封闭时间均为2 h;HRP-兔抗羊IgG的使用浓度和反应时间为1∶15000 和1 h;常温下,底物反应时间为10 min。加入2 M H2SO4终止反应,记录酶标仪的OD450。结果显示:免疫后,P/N值大于2.1(免疫后血清OD450/免疫前血清OD450),表明intimin间接ELISA方法可以检测疫苗免疫后抗体水平的消长趋势。
2 结果与分析
2.1 重组蛋白表达和Western blotting鉴定
重组菌BL21(pCold I-eae)经IPTG诱导,目的蛋白获得高效表达,分子量大小为16 kD(图2)。菌体超声波破碎的上清和沉淀SDS-PAGE显示,目的蛋白存在菌体破碎上清中,而重组菌诱导前则无相应的蛋白条带出现。Western blot 试验显示,重组His-intimin蛋白能够与STEC O157∶H7 全菌上清反应,呈现条带单一的反应带(图3)。

M:蛋白质标准;1:重组蛋白图3 重组蛋白的Western blot 分析Fig.3 Western blot analysis of the recombinant protein
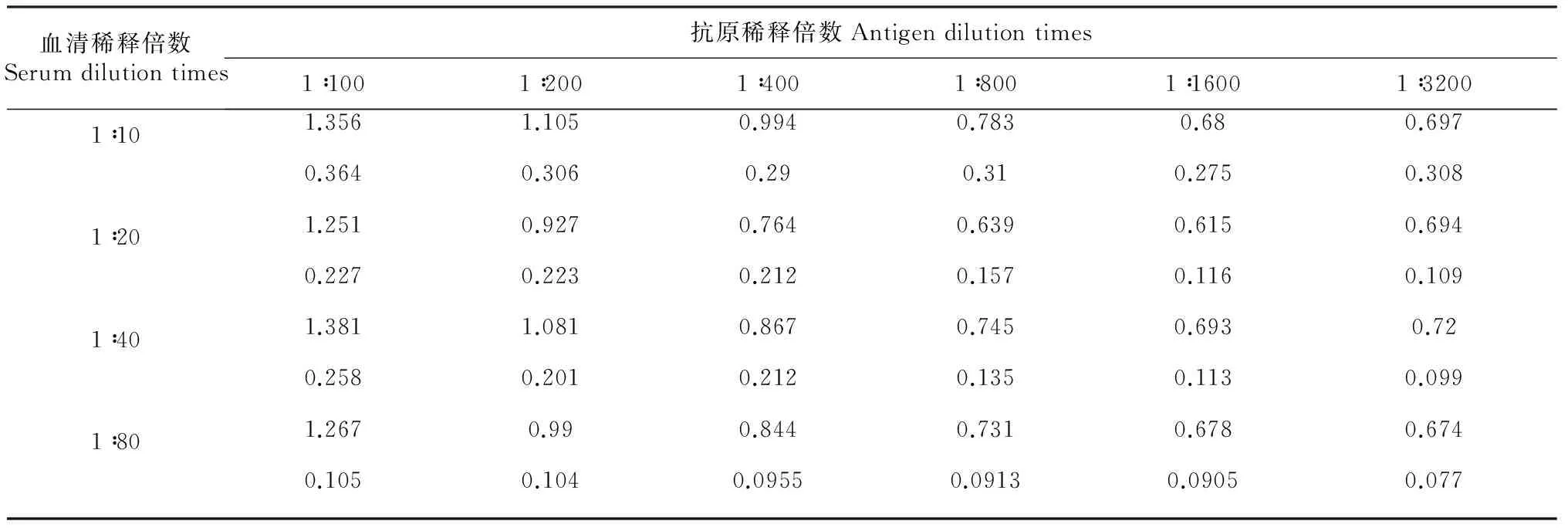
血清稀释倍数Serumdilutiontimes抗原稀释倍数Antigendilutiontimes1∶1001∶2001∶4001∶8001∶16001∶32001∶101.3561.1050.9940.7830.680.6970.3640.3060.290.310.2750.3081∶201.2510.9270.7640.6390.6150.6940.2270.2230.2120.1570.1160.1091∶401.3811.0810.8670.7450.6930.720.2580.2010.2120.1350.1130.0991∶801.2670.990.8440.7310.6780.6740.1050.1040.09550.09130.09050.077
2.2 间接ELISA 方法的建立
2.2.1 最适抗原包被浓度和血清稀释度的确定 重组蛋白包被抗原浓度为0.031 μg/mL,血清l∶40稀释时的P/N 值(5.3) 最大,阳性血清OD450nm>1,阴性血清OD450nm< 0.25。 因此,确定抗原的最适包被浓度为3 ng/孔,血清最佳稀释度为1∶40(表1)。
2.2.2 抗原包被条件、封闭条件和酶标IgG的工作条件优化 最佳抗原包被条件37 ℃包被1 h加4 ℃过夜;最佳封闭条件37 ℃ 5 %明胶封闭1 h;最佳 HRP-兔抗牛IgG最佳工作浓度1∶15000,37 ℃孵育1 h。
2.2.3 显色时间优化 比较显色5、10、15 min 后的P/N值,以底物作用10 min 时的P/N值最大,且时间长短易于控制,确定底物最佳反应时间为10 min。
2.2.4 不同种属酶标二抗的比较 HRP-SPA替代HRP-羊抗小鼠IgG和HRP-羊抗猪IgG时,OD450变化不明显,而替代HRP-兔抗牛IgG、HRP-兔抗羊IgG时,OD450差异较大。因此,HRP-SPA可以用来检测小鼠和猪血清,而牛和羊血清需要使用对应种属的酶标IgG进行检测。
2.2.5 阴阳性临界值确定 28份血清OD450平均值 (0.127)和标准差S(0.039)。根据统计学原理,OD450≥+3S=0.244时,判为阳性;OD450≤+2S=0.205时,判为阴性;介于二者之间判为可疑。
为消除每次间接ELISA 检测时,实验环境及操作的影响,每次检测时加入标准阳性血清,通过计算各份血清OD450与标准阳性血清OD450的比值S/P,来进行阴阳性判断。取52份来自江苏省多地未感染未免疫牛场的犊牛血清,按已确定的条件进行间接ELISA,测定OD450,计算血清(OD450≤0.205)与标准阳性血清OD450的比值S/P,计算S/P 值的平均值X 及标准方差SD,阴阳性临界值=X+3SD。经检测,52份中有47份血清OD450≤0.205,计算47 份血清的S/P平均值X=0.167,SD=0.051,因此ELISA 阴阳性临界值=0.157+3×0.051=0.31。因此,当样品S/P 值≥ 0.31 时为阳性,S/P 值<0.31时为阴性。根据分析结果得出本发明建立的ELISA试剂盒的判定标准。①阳性标准孔的OD450≥+3S=0.244,且P/N≥2.1,实验结果有效。否则需要进行重复试验。②如果待检样品S/P 值≥ 0.31 时,判定该样品为STEC 抗体阳性。③如果待检样品S/P 值<0.31时,判定该样品为STEC 抗体阴性。
2.2.6 特异性交叉试验 检测已知的小鼠沙门氏杆菌、牛单增李斯特氏杆菌、牛弯曲杆菌、猪链球菌、猪巴氏杆菌和小鼠非致病性大肠杆菌K12的阳性血清和阴性血清分别1∶40稀释,2个平行重复,用酶标仪在450 nm波长下测定各孔OD值,结果表明,小鼠沙门氏杆菌、牛单增李斯特氏杆菌、牛弯曲杆菌、猪链球菌、猪巴氏杆菌和小鼠非致病性大肠杆菌K12的阳性血清的OD450值介于0.01~0.33,认定与重组intimin包被抗原无明显交叉反应(表2)。
2.3 重复性检测
检测结果经过统计学分析,批内重复的8份血清OD450的变异系数在0.01~0.10(表3);批间重复的8份血清OD450的变异系数在0.01~0.06(表4),同批和不同批抗原在不同时间操作检测结果均重复性较好。
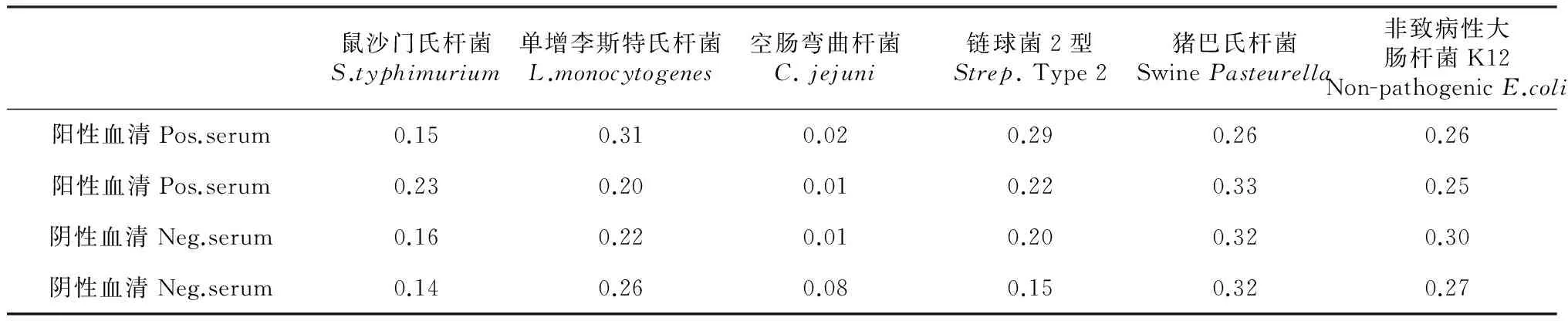
表2 间接ELISA特异性试验结果
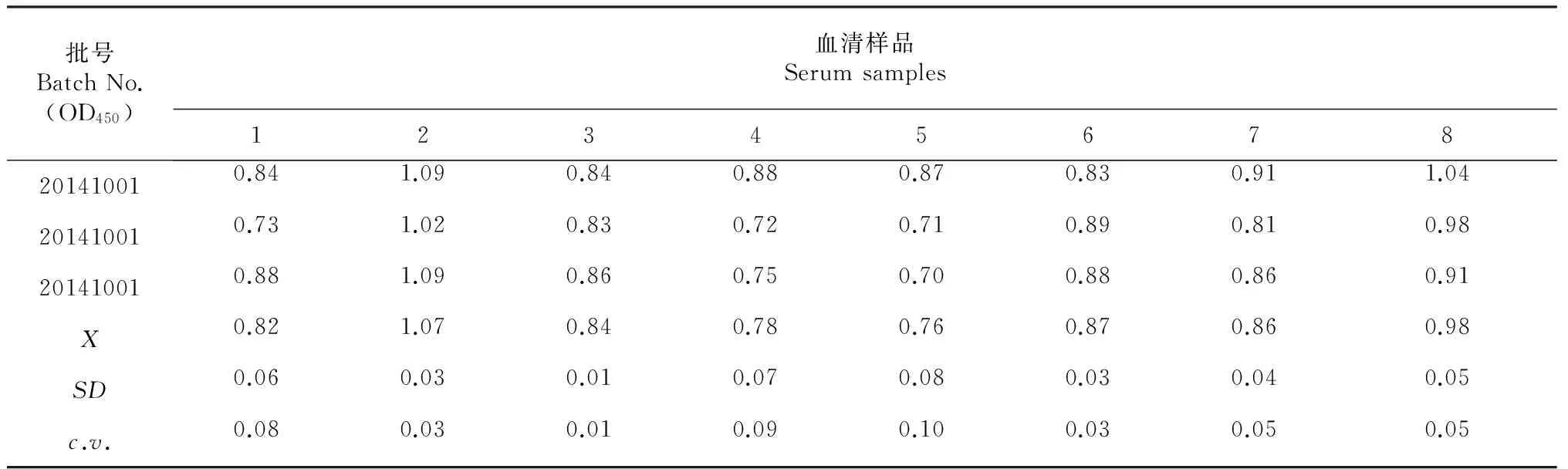
表3 批内重复性实验
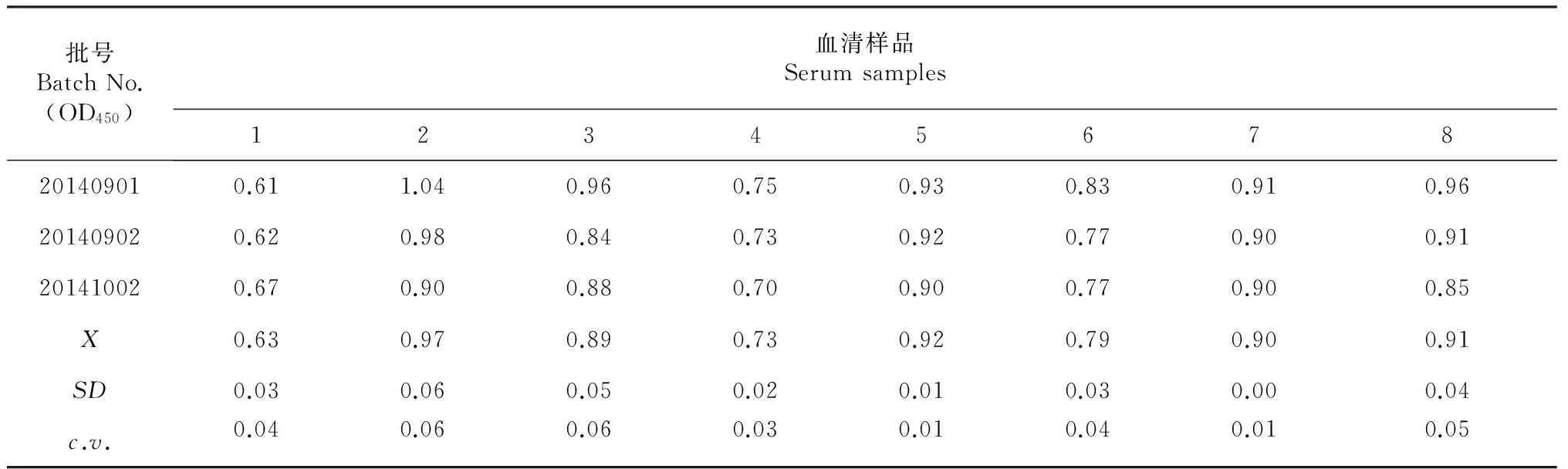
表4 批间重复性实验
2.4 ELISA试剂盒检测免疫动物的抗体
2.4.1 免疫牛抗体检测 2月龄犊牛免疫后7 d 血清OD已经转阳,OD450=0.42,标准阳性血清OD450=1.12,S/P=0.38>0.31,随着免疫天数延长,OD450逐渐升高,35 d达到峰值(图4)。
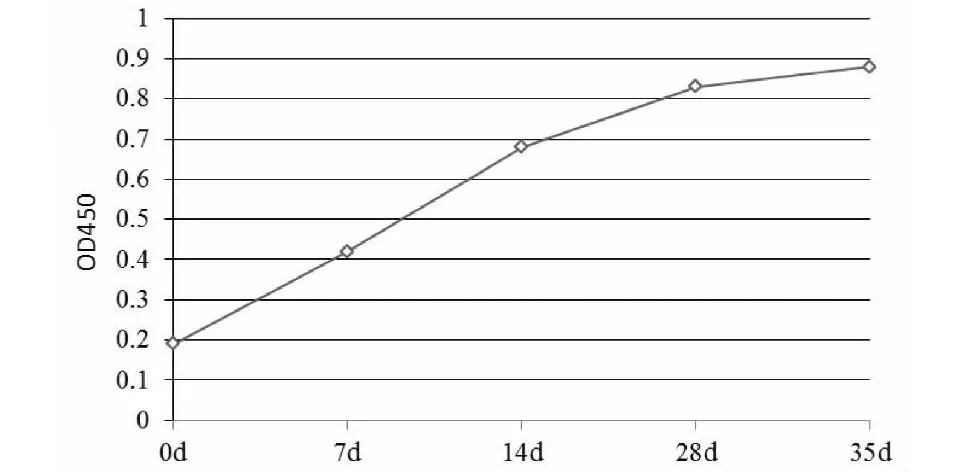
图4 免疫牛的intimin抗体检测Fig.4 Detection of intimin antibodies from the immunized bovine
2.4.2 山羊抗体检测 选择2月龄山羊,首免14 d,血清OD450=0.66,标准阳性血清OD450=1.01,S/P=0.65>0.31 ,二免14 d后OD450明显升高(图5)。
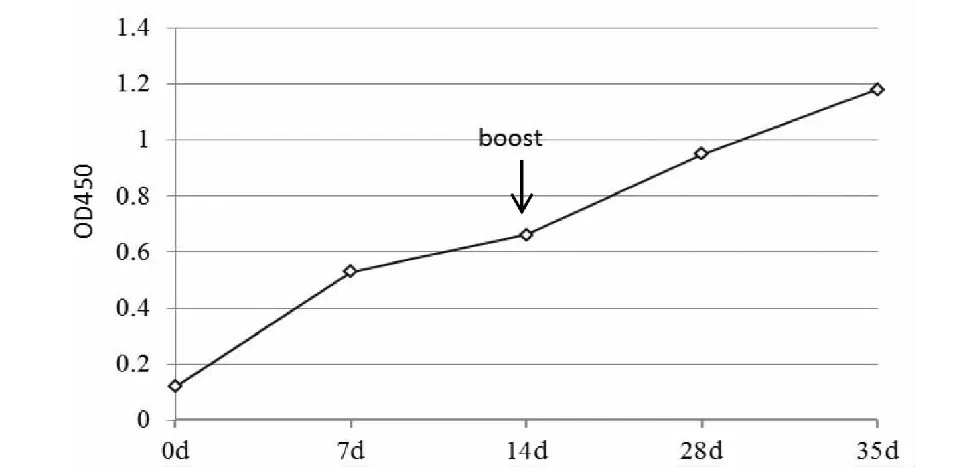
图5 免疫山羊的intimin抗体检测Fig.5 Detection of intimin antibodies from the immunized goats
3 讨 论
产志贺毒素性大肠杆菌(Shiga toxigenicEscherichiacoli,STEC)是导致人类腹泻和胃肠炎的重要食源性病原微生物,人感染后可能导致威胁生命的后遗症,如溶血性尿毒综合征(hemolytic uremic-syndrome,HUS) 和血栓性血小板减少紫癜(Thrombotic thrombocytopenic purpura,TPP)[14-15]。
志贺毒素(Shiga toxin,Stx)和LEE(locus of enterocyte effacement,LEE)毒力岛是STEC O157∶H7和非O157∶H7两个重要的毒力标志。志贺毒素由整合到病原菌基因组的溶原性噬菌体编码,分为Stx1和Stx2两种,Stx1为胞内毒素,Stx2为胞外毒素[16]。紧密素(Intimin)是LEE毒力岛编码的重要的毒力蛋白,编码基因为eae,在病原菌定植肠道上皮细胞中发挥关键性作用[17]。2005-2010年期间,纽约公共卫生实验室分离 STEC O157∶H7 132株,非O157∶H7的STEC 156株。所有STEC O157∶H7分离株,100 %菌株携带有eae基因,98 %菌株携带stx2,33 %携带有stx1。非O157∶H7 STEC 中,76 %菌株携带有eae基因,81 %携带有stx1,26 %菌株携带stx2,其中所有(100 %)O26、O103、O121和O145血清型菌株携带有eae基因,96 % O45菌株携带有eae基因,97 % O111菌株携带有eae基因[10-11]。由此可见,eae基因编码的紧密素是STEC O157∶H7和非O157∶H7菌株极为重要的毒力因子,是建立检测技术优选的检测靶标。
目前,有关STEC研究大多数都是对抗原检测方法进行研究[18-21],并且在流行病学调查中,多为根据已有的感染疫情进行抗原检测,缺乏对抗体的检测方法的研究,因而有必要建立快速、简便、特异的抗体检测方法。ELISA 检测法具有特异性强、灵敏性高和易操作性等特点,已在各种病原微生物的抗体监测中广泛应用。本研究选择紧密素为STEC抗体的检测靶标,建立ELISA技术,并组装试剂盒,检测动物血清中STEC抗体,为早期防控提供有效工具。
包被抗原特性是ELISA检测技术的关键环节。理想的包被抗原应具备以下几个特征:用于包被抗原为蛋白,且具有良好的抗原性;蛋白抗原以可溶性形式存在,避免包涵体;包被抗原具有通用性或者独特性,通用性在于能够兼顾多血清型病原的检测,独特性在于针对某些致病血清型辨别性好。本研究选择intimin的27个亚型共有的N端保守性区段153 aa,体外高效表达,成功获得可溶性重组蛋白,抗原性良好,30 ng/mL的工作浓度便能检测血清中STEC紧密素抗体,有利于提高检测方法的特异性和敏感性。罗玲等[22]体外表达STEC O157∶H7的整个intimin γ,作为包被抗原,建立了检测禽STEC的间接ELISA。完整的intimin难于在大肠杆菌表达系统中获得可溶性表达,表达为包涵体蛋白,抗原性较差,包被浓度为880 ng/mL,相比本研究中包被浓度高近30倍,将大大提升试剂盒研制的成本。另外,包涵体蛋白为变性蛋白,相比可溶性蛋白所展示的表位和抗原性有明显差异,可溶性蛋白具有与天然蛋白类似的空间表位和线性表位,而包涵体变性没有空间表位只有线性表位,并且线性表位的展示往往不充分,将影响抗体检测的特异性和敏感性。我们前期试验中,也曾选用pCold I质粒体外尝试表达了全长的intimin γ和intimin ε,重组蛋白全部以包涵体形式表达,在含有变性剂8M尿素条件下,Ni柱亲和层析获得纯化蛋白,Western blot实验显示,能够与STEC O157∶H7全菌高免血清反应,出现特异性条带(本研究未显示该数据),但清晰度明显弱于本研究所选用的片段,与罗玲的报道一致,由此推测包涵体的变性蛋白免疫原性较差,导致ELISA包被中,包被蛋白浓度高抗血清反应条带。
紧密素ELISA试剂盒可以检测牛和羊两种动物STEC抗体。反刍动物是STEC重要的储存宿主,及时、准确的检测牛羊STEC的抗体水平是保障人类健康的前提。以达到简化程序的目标,本研究尝试用HRP-葡萄球菌A蛋白代替HRP-兔抗牛IgG和HRP-兔抗羊IgG,但HRP-葡萄球菌A蛋白与这两种属IgG亲和力较差,导致OD450值明显降低,相比之下HRP-葡萄球菌A蛋白与猪、鼠的IgG亲和力好,提示可以替代HRP-羊抗猪IgG和HRP-羊抗小鼠IgG使用,研制不同种属动物共同使用的ELISA试剂盒。本研究中的ELISA试剂盒,牛和羊所用酶标二抗虽然不同,但二者的使用浓度达到了一致,在一定程度上体现出包被抗原与不同种属抗血清均具有良好的结合能力。
综上所述,本研究以27个紧密素亚型N端高度保守序列,体外成功获得可溶性蛋白的高效表达、纯化蛋白作为包被抗原,建立和组装间接ELISA试剂盒,检测牛群和羊群中STEC抗体水平,以监测动物群免疫和感染后产志贺毒素性大肠杆菌抗体消长变化,为早期防控提供有效手段和指导。
[1]Karmali M A, Gannon V, Sargeant J M. Verocytotoxin-producingEscherichiacoli(VTEC) [J]. Veterianry Microbiology, 2010,140:360-370.
[2]王 燕.大肠杆菌O157∶H7感染流行概况[J].微生物学免疫学进展,2008,36(1):51-58.
[3]徐建国,景怀奇.中国1997-1998年O157∶H7大肠杆菌检测情况分析[J].疾病监测,1999(5):19-21.
[4]张 本,刘衡川,张朝武,等.四川省大肠杆菌O157∶H7分子流行病学、耐药性及对消毒剂抗性研究[J].卫生研究,2005(5):606-610.
[5]Brooks J T, Sowers E G, Wells J G,et al. Non-O157 Shiga Toxin-ProducingEscherichiacoliInfections in the United States, 1983-2002[J]. J Infect Dis, 2005,192:1422-1429.
[6]Karmali M A, Gannon V, Sargeant J M. Verocytotoxin-producingEscherichiacoli(VTEC) [J]. Vet. Microbiol. , 2010,140: 360-370.
[7]Scallan E, Hoekstra R M, Angulo F J,et al. Foodborne illness acquired in the United States-major pathogens[J]. Emerg. Infect. Dis., 2011, 17: 7-15.
[8]Blanco M, Blanco J E, Dahbi G,et al. Typing of intimin (eae) genes from enteropathogenicEscherichiacoli(EPEC) isolated from children with diarrhoea in Montevideo, Uruguay:identification of two novel intimin variants (μB and ξR/ β2B) [J]. Journal of Medical Microbiology, 2006, 55:1165-1174.
[9]Blanco M, Blanco J E, Mora A, et al. Serotypes, virulence genes and intimin types of Shiga toxin (Verotoxin)-producingEscherichiacoliisolates from cattle in Spain:identification of a new intimin variant gene (eae-ξ) [J]. Journal of Clinical Microbiology, 2004, 42:645-651.
[10]Posse B, De Zutter L, Heyndrickx M, et al. Quantitative isolation efficiency of O26, O103,O111, O145 and O157 STEC serotypes from artificially contaminated food and cattle faeces samples using a new isolation protocol[J]. J Appl Microbiol ,2008,105: 227-235.
[11]Perelle S, Dilasser F, Grout J and Fach P. Detection by 5¢-nuclease PCR of Shiga-toxin producingEscherichiacoliO26, O55, O91, O103, O111, O113, O145 and O157∶H7, associated with the world’s most frequent clinical cases[J]. Mol Cell Probes, 2004,18: 185-192.
[12]刘 洁,夏兴霞,王永山,等.大肠杆菌O157∶H7抗体胶体金免疫层析检测试纸条的研制[J].中国预防兽医学报,2010,32(5):375-378.
[13]Zhang X, Yu Z, Zhang S, et al. Immunization with H7-HCP-Tir-Intimin significantly reduces colonization and shedding ofEscherichiacoliO157∶H7 in goats [J]. Plos One, 2014, 9(3): e91632.
[14]Gregory L A, Jill H , Morris J G. Emerging foodborne pathogens:EscherichiacoliO157∶H7 as a model of entry of a new pathogen into the food supply of the developed world [J]. Epidemiology Review, 1996,18:29-51.
[15]Iwamoto M, Huang J Y, Cronquist A B, et al. Bacterial enteric infections detected by culture-independent diagnostic tests——FoodNet, United States, 2012-2014[J]. MMWR Morb Mortal Wkly Rep., 2015,64(9):252-257.
[16]Bryan A, Youngster I, McAdam A J. Shiga Toxin ProducingEscherichiacoli[J]. Clin Lab Med. 2015,35(2):247-272.
[17]Kameyama M, Yabata J, Nomura Y, et al.Biochemical Features and Virulence Gene Profiles of Non-O157/O26 EnterohemorrhagicEscherichiacoliStrains from Humans in the Yamaguchi Prefecture, Japan[J]. Jpn J Infect Dis, 2015,68(3):216-220.
[18]Abbasi P, Kargar M, Doosti A, et al.Characterization of Shiga-toxin producingE.coli(STEC) and enteropathogenicE.coli(EPEC) using multiplex Real-Time PCR assays for stx1, stx2, eaeA [J]. Iran J Microbiol, 2014,6(3):169-174.
[19]Paoli G C, Wijey C, Uhlich G A.Genetically Marked Strains of Shiga Toxin-Producing O157∶H7 and Non-O157Escherichiacoli:Tools for Detection and Modeling [J]. J Food Prot, 2015,78(5):888-901.
[20]Qin X, Klein E J, Galanakis E, et al. Real-Time PCR Assay for Detection and Differentiation of Shiga Toxin-ProducingEscherichiacolifrom Clinical Samples [J]. J Clin Microbiol, 2015, 29(4):JCM.00115-15.
[21]张雪寒,张碧成,栾晓婷,等.遗传标志性基因 Z0372 PCR检测肠出血大肠杆菌O157∶H7 [J].西南农业学报,2015,28(1):409-413.
[22]罗 玲,苟 妙,罗青平,等.肠出血性大肠杆菌O157∶H7 eae 基因原核表达及间接ELISA 的初步建立[J].湖北农业科学,2014,53(14):3423-3426.
(责任编辑 李山云)
Development of Indirect ELISA for Detecting Specific Antibody against STEC
ZHANG Xue-han, ZHANG Qiang, ZHANG Bi-cheng, WANG Wei, NI Yan-xiu, WEN Li-bin,LI Bin, ZHOU Jun-ming, HE Kong-wang,ZHOU Ping
(Institute of Veterinary Medicine, Jiangsu Academy of Agricultural Sciences; Key Laboratory of Engineering Research of Veterinary Bio-products of Agricultural Ministry;National Center for Engineering Research of Veterinary Bio-products,Jiangsu Nanjing 210014,China)
To monitor pathogenic Shiga toxigenicEscherichiacoli(STEC) infection and evaluate vaccination efficacy in animals and human, an indirect ELISA was developed based on antigens of N-end intimin from STEC. Based on N-end conserved region, the fragment of 390-543 aa was expressed in vitro using as coated antigen to develop an indirect ELISA. The sensitivity, specificity, repeatability and stability were analyzed to optimize the indirect ELISA. The working conditions of the indirect ELISA were as follows:the concentration of coating antigen was 3 ng/well, the dilution of primary serum and HRP-labeled rabbit anti-goat IgG, HRP-labeled rabbit anti-bovine IgG were 1∶200 and 1∶15000, respectively, 5 % skimmed milk blocked for l h. and the incubation time of coloration was 10 min. This indirect ELISA established in our study has good specificity, high sensitivity, good reproducibility, stability, and it is an effective tool to examine STEC infection and vaccination in animals and human to guide vaccine immunization and new vaccine development.
Shiga toxigenicEscherichiacoli; Intimin; Indirect ELISA; Bovine; Goat
1001-4829(2016)11-2738-08
10.16213/j.cnki.scjas.2016.11.042
2015-12-12
国家自然科学基金(31201919和31572503);江苏省自主创新资金[cx(15)1060]
张雪寒(1977-),女,博士,副研究员,主要从事食源性病原微生物检测技术研究,电话:025-84390331;E-mail:liuxuehan1996@hotmail.com。
S852.61
A

