鲁北地区猪瘟流行病学调查与分析
张文通,魏凤,沈志强,
(1.山东绿都生物科技有限公司,山东滨州256600;2.山东省滨州畜牧兽医研究院,山东滨州256600)
鲁北地区猪瘟流行病学调查与分析
张文通1,魏凤2,沈志强1,2
(1.山东绿都生物科技有限公司,山东滨州256600;2.山东省滨州畜牧兽医研究院,山东滨州256600)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的,以淋巴结周边出血、脾脏边缘出血性梗死、回盲部淋巴结纽扣状肿和肾脏密集点状出血等为特征性病理变化的猪的重大传染病[1-2],被国际动物卫生组织(OIE)列为A类动物传染病,我国将其列为一类动物传染病。目前,由于猪瘟疫苗的普遍使用,猪瘟临床上主要以温和型猪瘟为主。温和型猪瘟可导致母猪繁殖障碍、仔猪先天性感染等[3-4]。为弄清楚鲁北地区猪瘟病毒感染及猪瘟疫苗免疫效果情况,对2013—2015年山东绿都生物科技有限公司收集的400份猪病料及2 400份猪血清进行检测及分析,其目的是获得该区域猪瘟野毒感染及猪瘟疫苗免疫效果情况,为防控本区域CSF提供参考。
1 材料和方法
1.1 病料检测时间与地点
病料于2016年1月6—18日在山东绿都生物技术有限公司实验室进行检测。
1.2 材料
Trizol总RNA提取试剂盒购自Omaga公司;RT-PCR试剂盒(PrimeScrip 1 Step Enzyme Mix)、UNIQ-10柱式DNA胶回收试剂盒、pMD18-T克隆载体、核酸分子量标准物,购自宝生物工程(大连)有限公司(TaKaRa);琼脂粉购自上海基因公司;其他化学试剂如异丙醇、无水乙醇等,均为国产分析纯产品;猪瘟病毒ELISA抗体检测试剂盒,购自武汉科前动物生物制品有限公司。
1.3 方法
1.3.1 病料或细胞毒DNA基因组提取病料处理:将猪病料(猪脾脏、淋巴结等)用剪刀剪碎,用无菌生理盐水以3∶1稀释组织制备组织悬液;用无菌匀浆器研磨组织悬液;将研磨好的组织悬液以4 000 r/min离心10 min,取上清液;将上清液在-20℃与37℃之间反复冻融3次。
RNA基因组提取:取反复冻融上清加Trizol后,室温放置5 min。每1 mL Trizol中加0.2 mL氯仿,用力摇晃15 s,室温静置5 min,然后于2~8℃,12 000r/min离心15min。将上层水相转入新的1.5 mL EP管中,加入0.5 mL异丙醇,混匀后室温静置10 min,然后于2~8℃,12 000 r/min离心10 min。小心吸弃上清液,留取沉淀。加现配的1 mL 75%的乙醇(预冷)振荡洗涤RNA沉淀1次。然后于2~8℃,7 500 r/min离心5 min。小心倒掉上清液,沉淀置室温干燥10 min。再在管中加20 μL的DEPC水溶解,在55~60℃下孵育10 min助溶,即得到病料总RNA基因组。
1.3.2 病料PCR鉴定参照GenBank报道的猪瘟毒株(序列号:AY382481)合成一对引物,扩增跨幅为288 bp的核苷酸,引物的合成由上海生物工程有限公司完成,引物序列如下:上游引物P1:5′-CAGGTATGCGATCTCGTCAACCA-3′;下游引物P2:5′-GGGCACAGCCCAAATCCGAAGT-3′。
RT-PCR体系成分为:PrimeScrip 1 Step Enzyme Mix 1 μL、2×1 Step Buffer 10 μL、0.5 μL P1、0.5 μL P2、4 μL RNA、4 μL灭菌水。RT-PCR反应程序为50℃30 min、94℃3 min、94℃30 s、53℃30 s、72℃45 s,30个循环,72℃延伸10 min。其RT-PCR产物采用0.8%琼脂糖凝胶电泳检测。回收PCR产物,连接pMD18-T克隆载体,送往上海生工测序。
1.3.3 血清ELISA抗体测定按照猪瘟病毒ELISA抗体检测试剂盒说明书对收集的2 400份血清进行测定。
2 结果
2.1 病料猪瘟病毒RT-PCR扩增结果
病料CSFV的RT-PCR产物经琼脂糖凝胶电泳检测,结果显示,在250 bp与500 bp之间出现特异性目的条带,大小与预期相符(图1)。回收该扩增产物,送上海生工测序。测序结果与NCBI报道CSFV序列同源性94%~99%。
2.2 病料中猪瘟病毒结果统计
为便于统计与分析,将猪场按规模分为4种类型:散养户为年出栏商品猪100头以下(含100头);小型养猪场为年出栏商品猪101~1 000头;中型养猪场为年出栏商品猪1 001~5 000头;大型养猪场为年出栏商品猪5 000头以上(不含5 000头)。表1结果显示,小型养猪场和散养户病料猪瘟病毒阳性率最高,猪场阳性率分别为43.3%和42.6%;而大型养猪场病料猪瘟病毒阳性率最低,猪场阳性率为10.5%。
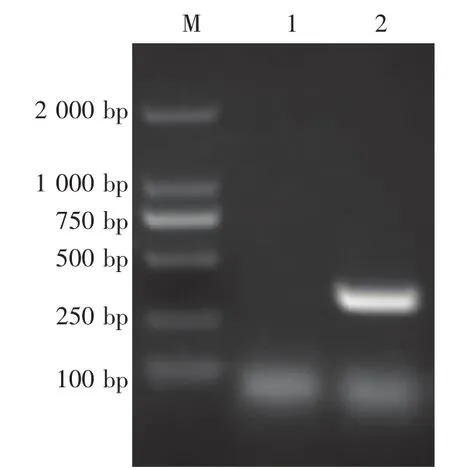
图1 病料CSFV的RT-PCR扩增结果

表1 病料猪瘟病毒阳性率
2.3 血清猪瘟病毒ELISA抗体测定结果统计
表2关于猪场规模划分与表1中划分标准一样。所采血清的猪场均来自接种CSFV疫苗的猪场。按照猪瘟病毒ELISA抗体检测试剂盒判定标准:ELISA(S/P值)大于0.17为免疫合格(血清ELISA抗体S/P值大于或等于0.17,相当于猪瘟正向间接血凝抗体大于或等于25)。表2结果显示,大型和中型养猪场血清猪瘟病毒ELISA抗体免疫合格率(猪场猪瘟病毒ELISA抗体阳性率在80%以上)较高,分别达90.0%和85.0%;而小型猪场和散养户猪瘟病毒免疫合格率较低,分别为37.5%和25.0%。
3 分析与讨论
收集的病料均采自疑似猪瘟发病猪或病死猪脾脏、淋巴结、扁桃体及肺脏等组织。血液采集猪场均为免疫猪瘟疫苗的猪场。
病料RT-PCR鉴定结果显示,小型养猪场和散养户猪瘟病毒阳性率最高,猪场阳性率分别为43.3%和42.6%;而大型养猪场猪瘟病毒阳性率最低,猪场阳性率为10.5%。这在某种程度上说明小型猪场和散养户受猪瘟病毒影响较大,需进一步重视本区域对猪瘟的防控。
血清ELISA抗体测定结果显示,大型和中型养猪场猪瘟病毒ELISA抗体免疫合格率较高,分别达90.0%和85.0%;而小型猪场和散养户猪瘟病毒免疫合格率较低,分别为37.5%和25.0%。这说明大中型养猪场猪瘟防控较好,而小型猪场与散养户猪瘟防控较差。
病料猪瘟病毒RT-PCR检测结果与血清猪瘟病毒ELISA抗体测定结果统计分析基本一致。由于本区域散养户与小型养猪场对猪瘟防控不完善、因猪瘟病毒造成损失较大,须进一步重视对猪瘟的防控;而大中型养猪场对猪瘟防控较完善,需继续维持。
[1]单虎,李明义,沈志强.现代兽医兽药大全[M].北京:中国农业大学出版社,2011:304-307.
[2]蔡宝祥.家畜传染病学[M].北京:中国农业出版社,1999:147-151.
[3]蔡奕琪,朱燕秋,王悦彬.2001—2008年猪瘟抗体和猪瘟病毒监测结果分析[J].养猪,2009(3):73-74.
[4]杨慧君.浅谈猪瘟流行新特点及防治措施[J].农业科技与信息,2009(5):50.
(编辑:富春妮)
厄搜救犬勇救七人力竭而亡
【澳大利亚《悉尼先驱晨报》网站4月27日报道】4岁的白色拉布拉多犬戴科被誉为英雄,它在厄瓜多尔地震救援行动中救出7人后力竭而亡。
厄瓜多尔伊瓦拉消防部门的搜救犬戴科于22日死亡,它在之前的几天内一直在16日厄瓜多尔7.8级地震留下的废墟中搜寻幸存者。
据伊瓦拉消防部门在其脸书网站主页上发表的一篇日志,戴科的死因是“大规模心肌梗塞和急性呼吸衰竭”。它作为搜救犬工作了3年。
伊瓦拉消防部门说:“我们很遗憾地通知大家,今天(消防部门)衰悼戴科的逝去,它参与了对佩德纳莱斯地区的搜救行动。我们四条腿的朋友因公殉职了。谢谢戴科,谢谢你在佩德纳莱斯以及在你曾参加过的其他紧急救援行动中的英勇之举。”
超过2 000人在这次地震中受伤。此次地震导致太平洋沿岸地区建筑物倒塌、道路损毁、电力中断,并造成至少654人死亡。
(转自参考消息[N],2016-04-28)
S858.282.65+9.6
A
1002-1957(2016)03-0100-02
2016-05-07
山东省农业科学院院地科技合作引导计划项目(214 YDHZ32);山东省现代农业产业技术体系生猪创新团队项目(SDAIT-06-022-15)
张文通(1979-),男,河南荥阳人,助理研究员,硕士,主要从事基因工程疫苗研究工作.E-mail:hzndzwt1@163.com

