不同磷水平对棉花内源激素的影响
陈波浪,罗 佳,蒋平安
(新疆农业大学草业与环境科学学院,新疆 乌鲁木齐 830052)
不同磷水平对棉花内源激素的影响
陈波浪,罗 佳,蒋平安
(新疆农业大学草业与环境科学学院,新疆 乌鲁木齐 830052)
为探讨棉花内源激素对不同磷水平的响应变化,提高磷素吸收利用,以中棉36 号(ZM36)和新陆早13 号(XLZ13)为试验材料,用液培方法研究了不同磷水平对棉株内源激素含量的影响。结果表明,磷营养对棉株内源激素玉米素(ZT)、赤霉酸(GA3)、生长素(IAA)和脱落酸(ABA)含量产生了明显影响,随着磷水平的提高,XLZ13棉株中ZT含量也相应提高,ZM36棉株以中磷处理(MP)最高;棉花根和茎中GA3含量以中磷处理(MP)最高,高磷处理(HP)次之;ZM36棉株IAA含量以中磷处理(MP)最高,而XLZ13根和叶IAA含量以高磷处理(HP)最高;棉株中ABA含量以中磷处理(MP)最低,其次为高磷处理(HP)。棉花内源ZT、GA3、IAA和ABA在各器官的分布在不同磷水平下呈现规律性,ZT:叶 >根 >茎,GA3:叶>茎>根,IAA:茎 >叶 >根,ABA:根 >叶 >茎。
棉花;内源激素;磷素
磷是作物生长发育所必需的三要素之一,在作物新陈代谢过程中发挥重要作用。但土壤中磷素易固定,大田作物磷肥当季利用率一般为7. 3 %~20. 1 %[1],土壤磷缺乏严重制约作物的生长和产量的提高,据报道土壤缺磷造成世界30 %以上作物生长和产量受到影响[2]。作物为了提高磷的吸收、利用和活化而形成了各种适应机制,包括根的形态和构型的变化、根系分泌物的形成和分泌、茎和花的发育变化以及生理生化和分子遗传的改变[3-7]。
植物内源激素是植物体内合成的微量有机物质,在植物生长发育和代谢起着重要的信号传导和调节作用,其合成受温度、光照、水分和养分等环境因子的诱导与调控,其中养分因子的调控备受关注[8-9]。在作物磷反应调控体系中,激素的作用也显而易见。Kuiper[10]、Martin[11]等人认为磷胁迫时,植物根系的细胞分裂素(Cytokinin,CTK)含量下降,但不影响根毛的长度和数目;Jiang[12]和Devaiah[13]等人研究发现,磷饥饿会导致活性赤霉素(Gibberellin,GA)水平降低,从而减少地上部磷素的吸收;Read、Nacry和孙海国等人的研究表明[14-16],植物生长素(Indole-3- acetic acid,IAA)的诱导机制受磷水平的调控,从而影响根系的发育;Lynch、张福锁等人[17-18]研究发现,缺磷诱导植物乙烯(Ethylene)的生成,调控根系发育,增强植株获取磷的能力。陈洁[19]等研究发现,低磷胁迫下,不同基因型玉米除玉米素(Zeatin,ZT) 含量较正常供磷水平减少外,GA3、IAA和脱落酸(Abscisic acid,ABA)含量均较正常供磷水平增加。刘辉[20]等在大麦上的研究表明,随磷水平降低,大麦叶片和根系GA3和IAA含量降低,ABA含量变化不明显。王彦平[21]等在棉花上研究发现,低磷胁迫下,棉花ZT、GA3和IAA含量在不同生育期和植株部位均表现出显著差异。上述结果表明,植物的磷素胁迫显著的影响内源激素的变化。但植物内源激素对不同磷水平的响应研究还相对较少。因此,本研究以不同基因型棉花为材料,研究在不同磷水平下棉花主要内源激素的动态变化,以探讨不同磷水平下棉花内源激素的变化规律,从而为了解棉花的吸磷机制和提高棉花磷利用效率提供理论依据。
1 材料与方法
1.1 供试材料与试验设计
选取中棉所36 号(ZM36)和新陆早13 号(XLZ13)为供试材料。采用水培试验,于2010年在新疆农业大学草业与环境科学学院的调控温室中进行,首先将种子清洗,选择饱满的种子进行发芽培育,培育温度控制在18~22 ℃左右,待芽长至2 cm左右移入石英砂进行培养。待棉苗长出2片真叶时,将棉苗定植于培养盆中,每盆定植2株棉苗,用1/2霍格兰完全营养液培养。培养盆选择避光塑料盆(直径20 cm×高24 cm),营养液体积为6 L,每天定时供氧30 min,每隔7天换1次营养液,调pH值到6.0~6.5。营养液以霍格兰营养液和阿农微量营养液为基础液,在棉花长出第4片真叶时进行3个水平的P处理:0.05×10-3mol·L-1KH2PO4(LP)、0.5×10-3mol·L-1KH2PO4(MP)和1×10-3mol·L-1KH2PO4(HP),每品种每处理培养12盆。
1.2 植物样品采集与激素测定
在棉花进行不同磷水平处理后的30 d(蕾期)和60 d(花期)取样,每品种各处理采集长势相同的10株,依根、茎、叶器官分开,用蒸馏水清洗后,用保鲜袋包裹贮存在低温(-38~-40 ℃)冰箱以用于植物激素的检测。
植物激素测定的方法参照文献方法[22],采用高效液相色谱法,流动相为CH3CN∶H2O (4∶6 V/V)混合液,其中内含0.1 %CF3COOH,pH=3.5。流速1 mL min-1,系统压力165 kg·f cm-2,检测波长254 nm,分析样品采用等度洗脱参数, 保留时间定性,外标法定量。
1.3 数据处理
所获数据用 Excel进行数据分析和图表制作,用 SPSS 15.0软件进行统计分析。
2 结果与分析
2.1 不同供磷水平对棉株ZT含量的影响
由图1可知,棉株ZT含量在不同供磷水平下存在显著差异,蕾期和花期ZM36根、茎和叶中ZT含量均表现为MP >HP >LP(P<0.05),而XLZ13表现为HP > MP>LP (P<0.05)。同一供磷水平下,2棉花品种存在差异。LP处理下,蕾期ZM36根、茎和叶中ZT含量显著高于XLZ13,而花期2品种无明显差异;MP处理下,蕾期和花期ZM36根、茎和叶中ZT含量均显著高于XLZ13;HP处理下,蕾期和花期ZM36根、茎和叶中ZT含量均显著低于XLZ13。同一供磷水平下,棉株各器官ZT含量表现为叶 >根 >茎。不同供磷条件下,花期棉株各器官ZT含量均大于蕾期。
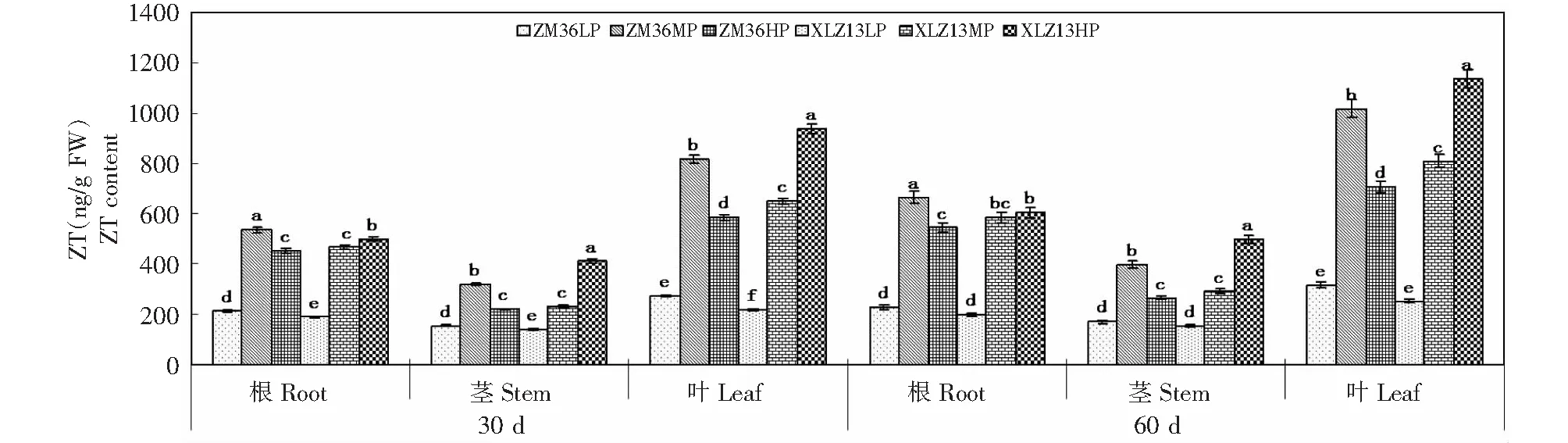
不同小写字母表示同一器官不同处理间差异显著(P<0.05),下同Different small letters meant significant difference among treatments at 0.05 level at the same organ,the same as below图1 磷营养对棉株ZR含量的影响Fig.1 The effects of P on ZR content of cotton

图2 磷营养对棉株GA3含量的影响Fig.2 The effects of P on GA3 content of cotton
2.2 不同供磷水平对棉株GA3含量的影响
图2的结果显示,棉株GA3含量在不同供磷水平下也存在显著差异,蕾期和花期2棉花品种根和茎中GA3含量均表现为MP >HP >LP(P<0.05),而叶中GA3含量ZM36表现为HP > MP>LP (P<0.05),XLZ13为MP >HP >LP (P<0.05)。LP处理下,蕾期和花期ZM36根中GA3含量显著高于XLZ13,而茎和叶中GA3含量2品种无明显差异;MP处理下,2个时期ZM36根中GA3含量显著高于XLZ13,茎中GA3含量2品种无明显差异,叶中GA3含量显著低于XLZ13;HP处理下,2个时期ZM36根中GA3含量显著高于XLZ13,茎中GA3含量显著低于XLZ13,叶中GA3含量2品种无明显差异。同一供磷水平下,棉株各器官GA3含量表现为叶>茎>根。不同供磷条件下,花期棉株各器官GA3含量均大于蕾期。
2.3 不同供磷水平对棉株IAA含量的影响
供磷水平显著影响棉株IAA含量(图3),不同品种和器官之间表现不一。蕾期和花期ZM36根、茎和叶中IAA含量均表现为MP >HP >LP,但MP处理与HP处理根中IAA含量无明显差异,XLZ13根和叶中IAA含量表现为HP > MP>LP (p<0.05),茎中IAA含量表现为MP >HP >LP,但MP处理与HP处理无明显差异。LP处理下,蕾期和花期ZM36根和叶中IAA含量显著高于XLZ13;MP处理下,蕾期和花期ZM36根、茎和叶中IAA含量均显著高于XLZ13;HP处理下,蕾期和花期ZM36根和茎中IAA含量显著高于XLZ13,而叶中IAA含量显著低于XLZ13。同一供磷水平下,棉株各器官IAA含量表现为茎 >叶 >根。不同供磷条件下,花期棉株各器官IAA含量均大于蕾期。
2.4 不同供磷水平对棉株ABA含量的影响
由图4可知,LP显著提高了棉株ABA含量,2棉花品种蕾期根、茎和叶中ABA含量以及花期根中ABA含量MP处理与HP处理无明显差异,花期茎和叶中ABA含量表现为HP > MP (P<0.05)。LP处理下,蕾期和花期ZM36根、茎和叶中ABA含量显著低于XLZ13;MP处理下,蕾期2棉花品种各器官ABA含量无明显差异,花期为XLZ13 > ZM36;HP处理下,蕾期2棉花品种根和茎中ABA含量无明显差异,ZM36蕾期叶中以及花期各器官中ABA含量显著低于XLZ13。同一供磷水平下,棉株各器官ABA含量表现为根 >叶 >茎。LP和HP处理下,花期棉株各器官ABA含量均大于蕾期,而MP处理下花期茎和叶中ABA含量小于蕾期。

图3 磷营养对棉株IAA含量的影响Fig.3 The effects of P on IAA content of cotton
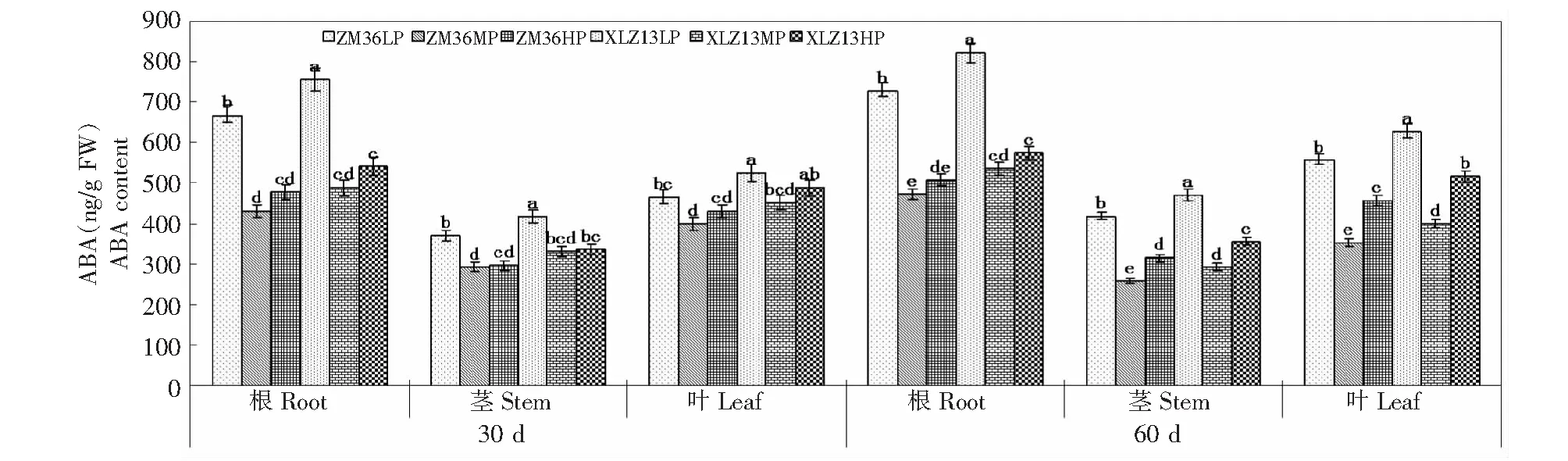
图4 磷营养对棉株ABA含量的影响Fig.4 The effects of P on ABA content of cotton
3 讨论与结论
植物激素是由植物细胞接受一定的信号诱导,在植物体内合成的微量生理活性有机物质,参与了植物细胞生长、分裂分化、果实发育等生长发育的调控过程,其自身的合成受环境因素的调控,营养调控易控且直接。大量研究表明,营养失调显著影响内源激素的合成与分配[8-10]。Kulaeva[23]和 Wagner[24]研究发现,植物CTK的减少与矿物质缺乏有关。EI- D[25]等研究表明,磷胁迫使向日葵幼苗根系和叶片中CTK 含量分别降至对照的44.5 %和38.1 %。本研究结果表明,与MP和HP相比,LP条件下,棉花各器官ZT含量均显著减少,与前人研究结果一致[11-12,19-20];在不同供磷条件下,棉花各器官ZT含量存在基因型差异,ZM36根、茎和叶中ZT含量在MP处理下最高,XLZ13随供磷水平的增加而增加,LP和MP条件下,ZM36根、茎和叶中ZT含量大于XLZ13,HP条件下,XLZ13根、茎和叶中ZT含量显著大于ZM36,这与陈洁在不同基因型玉米上的研究结果一致[19],表明棉株ZT含量可以作为棉花磷素营养效率的一个评价指标。
GA3是赤霉素中生理活性最强的一种,促进根、茎和叶等器官的发育。磷素营养供应不足会提高植物GA3的含量[13]。本研究发现,MP条件下,棉花根和茎中GA3含量最大,LP中最小,这与前人在小麦和玉米上的报道不一致[19-20],可能与作物种类和供磷强度有关;不同供磷条件下,ZM36根中GA3含量显著高于XLZ13,而茎和叶表现不明显,说明根系在不同基因型棉花对磷的生理反应较地上部敏感,这与前人的研究一致[19]。
IAA 是生理作用最重要的一种物质,在植物的生长发育中发挥重要的协调作用。Miura 等认为[26],生长素的高度积累可以促进低磷诱导拟南芥根结构的重塑,孙海国等发现[16],缺磷引起IAA含量增加,从而诱导根系生长。本研究中,LP条件下,棉花各器官IAA含量均显著减少,与前人研究结果不一致,可能与磷胁迫的浓度和时间有关;不同供磷条件下,ZM36根中IAA含量显著高于XLZ13,而茎和叶表现不明显,同样验证根系在不同基因型棉花对磷的生理反应较地上部敏感。
ABA是逆境胁迫调节的一种重要植物激素,调控光合产物运输和气孔开闭,诱导抗逆系统的启动和表达。Radin发现[27],磷胁迫时棉花叶片中积累大量的ABA,且缺磷植株对ABA的敏感性增强。本研究中,LP显著提高了棉株ABA含量,这与前人研究结果一致,蕾期棉花根、茎和叶中ABA含量MP与HP无明显差异,花期茎和叶中ABA含量表现为HP > MP (P<0.05);不同供磷条件下,ZM36根、茎和叶中ABA含量低于XLZ13,在花期达显著差异。
综合本研究中不同供磷水平下各内源激素的变化情况发现,同一供磷水平下,棉株ZT、GA3、IAA和ABA含量在器官中的动态变化分别表现为叶 >根 >茎、叶>茎>根、茎 >叶 >根和根 >叶 >茎;不同供磷条件下,棉株各器官ZT、GA3和IAA含量均表现为花期大于蕾期,棉株各器官ABA含量在LP和HP条件下花期大于蕾期,而MP条件下花期茎和叶中ABA含量小于蕾期;LP显著降低了ZT/ABA、GA3/ABA和IAA/ABA的比例(图1~4)。
[1]张福锁, 王激清, 张卫峰, 等.中国主要粮食作物肥料利用率现状与提高途径[J].土壤学报,2008,45(5): 915-924.
[2]Vance C P, Uhde-Stone C, Allan D L. Phosphorus acquisition and use:critical adaptations by plants for securing a nonrenewable resource[J].New Phytologist, 2003, 157:423-447.
[3]Lambers H Y, Shane M W, Cramer M D, et al. Root structure and functioning for efficient acquisition of phosphorus:matching morphological and physiological traits[J]. Annals Botany (Lond),2006, 98:693-713.
[4]Lynch J P.Root architecture and plant productivity[J].Plant Physiology, 1995, 109:7-13.
[5]Liao H, Rubio G, YanX, et al.Effect of phosphorus availability on basal root shallowness in common bean[J].Plant and Soil, 2001,232:69-79.
[6]Yan X, Liao H, Beebe S E, et al.QTL mapping of root hair and acid exudation traits and their relationship to phosphorus uptake in common bean[J].Plant and Soil, 2004, 265:17-29.
[7]Ochoa I E, Blair M W, Lynch J P.QTL analysis of adventitious root formation in common bean under contrasting phosphorus availability[J].Crop Science, 2006, 46:1609-1621.
[8]邱德运, 胡立勇.氮素水平对油菜功能叶内源激素含量的影响[J].华中农业大学学报, 2002, 21(3):213-216.
[9]何 萍, 金继运.氮钾营养对春玉米叶片衰老过程中激素变化与活性氧代谢的影响[J].植物营养与肥料学报,1999, 5(4):289-296.
[10]KuiPer D, KuiPer P J C, Lambers H, et al.Cytokinin concentration in relation to mineral nutrition and benryladenine treatment in plantago major sap.pleiosperma[J].Physiologia Plantarum,1989,75(4):511-517.
[11]Martin A C, del Pozo J C, Iglesias J, et al.Influence of cytokinins on the expression of phosphate starvation responsive genes in Ayabidopsis[J].Plant Journal,2000,24: 559-567.
[12]Jiang C, Gao X, Liao L, et al. Phosphate starvation root architecture and anthocyanin accumulation responses are modulated by the gibberellin-DELLA signaling pathway in Arabidopsis[J].Plant Physiol, 2007,145:1460-1470.
[13]Devaiah B N, Madhuvanthi R, Karthikeyan A S,et al. Phosphate starvation responses and gibberellic acid biosynthesis are regulated by the MYB62 transcription factor in Arabidopsis[J].Mol.Plant., 2009(2):43-58.
[14]Reed R C, Brady S R, Muday G K. Inhibition of auxin movement from the shoot into the root inhibits lateral root development in Arabidopsis[J].Plant Physiol,1998, 118:1369-1378.
[15]Nacry P, Canivenc G, Muller B, et al. A role for auxinredis tribution in the responses of the root system architecture to phosphate starvation in Arabidopsis[J]. Plant Physiology, 2005,138(4): 2061-2071.
[16]孙海国,张福锁.小麦根系生长对缺磷胁迫的反应[J].植物学报,2000,42(9):913-919.
[17]Lynch J.P.Brown K M.Ethylene and Plant responses to nutritional stress[J]. Physiol Plant, 1997, 100:613-619.
[18]张 勇,米国华,张福锁.分子生物学技术在植物营养研究中的应用[J].农业生物技术学报, 1998(4):366-370.
[19]陈 洁,张永中,张 谦,等. 低磷胁迫下不同基因型玉米内源激素的动态变化[J].玉米科学, 2013,21(5):6-12.
[20]刘 辉,王三根.低磷胁迫对大麦内源激素的影响[J].西南农业大学学报,2003,25(1):48-52.
[21]王彦平,蒋平安,陈波浪,等. 磷胁迫下不同品种棉花内源激素的动态变化[J].新疆农业科学,2008,45(3):522-525.
[22]陈波浪,郑春霞,盛建东,等.HPLC分离和测定棉花中3种植物激素[J].新疆农业大学学报, 2006,29(1):28-30.
[23]Kulaeva O N. The effect of roots on leaf metabolism in relation to the action of kinetin in leaves[J]. Soviet Plant Physiology, 1962, (9): 182-189.
[24]Wagner V H, Michael G. The influence of varied nitrogen supply on the production of cytokinins in the roots of sunflower plants[J]. Biochem Physiol Pflanzen, 1971, 162:147-158.
[25]EI-D A MS A, Salama A, Wareing P F. Effects of mineral nutrition on endogenous cytokinins in plants of sunflower(Helianthus annuus L.)[J]. J. Exp. Bot., 1979, 30: 971-981.
[26]Miura K, Lee J, Gong Q Q, et al. SIZ1 regulation of phosphate starvation-induced root architecture remodeling involves the control of auxin accumulation[J]. Plant Physiol., 2011, 155: 1000-1012.
[27]Radin J W. Stomatal responses to water stress and to abscisic acid in phosphorus-deficient cotton plants[J].Plant Physiology, 1984, 76(2):392-394.
(责任编辑 李山云)
Effects of Different Phosphorus Concentration on Endogenous Hormones of Cotton
CHEN Bo-lang, LUO Jia, JIANG Ping-an
(College of Pratacultural and Environmental Sciences,Xinjiang Agricultural University,Xinjiang Uramqi 830052,China)
In order to investigate the response of endogenous hormone to different phosphorus levels in cotton, so as to improve the absorption and utilization of phosphorus(P), by water cultivation, Zhongmian36(ZM36) and Xinluzao13(XLZ13) were used to evaluate their differences in endogenous hormone content under different P levels.The results showed that inorganic phosphorus nutrition had obvious effects on endogenous content in cotton, with P levels increasing, Zeatin(ZT) content in XLZ13 increased at different stages, ZT content in ZM36 of middle-P(MP) treatment was the highest. Gibberellin(GA3) content in root and stem of MP treatment was the highest, and higher-P(HP) treatment was the second. Indole-3- acetic acid (IAA) contents in ZM36 of MP treatment was the highest, but IAA contents in XLZ13 of HP treatment was the highest. Abscisic acid(ABA) content in cotton of MP treatment was the lowest, and higher-P(HP) treatment was the second.The ZT, GA3, IAA and ABA in various organs distribution in all kinds of P level present the regularity that the content of ZT in leaf is more than that in root which is more than that in stem, the content of GA3in leaf is more than that in stem which is more than that in root, the content of IAA in stem is more than that in leaf which is more than that in root, the content of ABA in root is more than that in leaf which is more than that in stem.
Cotton; Endogenous hormone; Phosphorus
1001-4829(2016)08-1839-05
10.16213/j.cnki.scjas.2016.08.015
2015-10-08
国家自然科学基金(31260499);新疆自治区土壤学重点学科资助
陈波浪(1979-),男,湖南汨罗人,博士,副教授,研究方向为养分资源高效利用与作物营养生理,E-mail:chenwang 200910@sina.com。
S562
A

