卵转铁蛋白和乳铁蛋白的热处理稳定性的比较研究
黎 庆,景 浩
(中国农业大学食品科学与营养工程学院,北京 100083)
卵转铁蛋白和乳铁蛋白的热处理稳定性的比较研究
黎 庆,景 浩*
(中国农业大学食品科学与营养工程学院,北京 100083)
卵转铁蛋白(Ovotransferrin,OVT)和乳铁蛋白(Lactoferrin,LF)经不同温度(50~90 ℃)处理后,通过圆二色性分析比较其二级结构的变化,紫外吸收和表面疏水性分析比较其空间构象的变化,SDS-PAGE分析比较其分子的聚集,溶解度分析比较其功能的变化。结果表明,50~60 ℃时,OVT和LF的理化特性均无明显变化。70 ℃时,OVT和LF的紫外吸光值均明显增大;80~90 ℃时,OVT的紫外吸光值不再进一步增大,而LF的进一步逐渐增大。70~90 ℃时,OVT和LF的表面疏水性指数均明显增大;LF的表面疏水性指数远大于OVT的,但OVT的增大程度较LF的更大。70~90 ℃时,OVT和LF的α-螺旋含量均明显降低,β-折叠和无规卷曲含量均明显升高,且OVT的二级结构组分的变化程度较LF的更大。70~90 ℃时,OVT和LF的SDS-PAGE图谱中的主要蛋白条带密度均明显降低;相同温度下,OVT的降低程度较LF的更大。70~90 ℃时,OVT和LF的溶解度均明显降低;相同温度下,OVT的降低程度较LF的更大。总之,OVT和LF的结构和功能在加热时均发生改变,但OVT的变化程度较LF的更大。
卵转铁蛋白,乳铁蛋白,圆二色性,紫外吸收,表面疏水性,溶解度
卵转铁蛋白(Ovotransferrin,OVT)和乳铁蛋白(Lactoferrin,LF)都为转铁蛋白家族中的一种单链糖蛋白,它们具有相似的氨基酸序列和空间结构[1-2]。OVT主要存在于鸡蛋清中,约占蛋清蛋白总量的12%~13%,包含686个氨基酸残基,分子量为78 ku[3]。LF主要存在于牛乳中,约占牛乳蛋白总量的0.3%,包含700个氨基酸残基,分子量为80 ku[4]。OVT和LF的一级结构都由单一的多肽链组成,其二级结构主要由α-螺旋和β-折叠交替排列;在二级结构的基础上进一步折叠形成的高级结构是两个极其相似且对称的球状叶,即N叶和C叶。两叶进一步分为结构相似的两个亚结构域(N1、N2、C1、C2),在两亚结构域的缝隙间都有一个铁离子结合位点;即每分子蛋白能够结合两分子的铁离子[1-2]。
OVT和LF具有多种相似的生物活性,如抑菌性、抗氧化性、抗炎活性等[1-2]。国家卫生部已于2012年将LF列为营养强化剂,并规定了婴幼儿食品、发酵乳制品(风味发酵乳)、调制乳以及乳饮料等中LF的含量不超过1.0 g/kg[5]。LF作为一种营养强化剂添加到婴儿配方奶粉中,能有效提高非母乳喂养的婴儿对铁的吸收率和免疫调节能力[6]。也有实验证明,婴儿服用含OVT的奶粉后,可防止急性肠炎,并且无异源蛋白常有的过敏等不良反应[7]。由于鸡蛋清中OVT的含量远高于牛乳中LF的含量,OVT作为功能成分在食品中的应用还有待开发[8]。
近来有报道,经不同温度(55~100 ℃,5~60 min)加热后,OVT的食物致敏性增强,抑菌性降低[9-10]。OVT生物活性的改变均与其分子结构的改变相关[11]。Marie等报道,超高压灭菌(500 MPa)可致LF变性且抑菌性丧失,而巴氏杀菌(63 ℃,30 min)则对LF的抑菌性无明显影响[12]。Celia等发现85 ℃下加热10 min,LF的抑菌性没有明显降低[13]。闫旭东等对LF进行不同热处理(63 ℃,30 min;72 ℃,15 s;85 ℃,15 s;85 ℃,10 min;95 ℃,5 min;138 ℃,4 s)后发现,随着热处理强度增加,LF的铁结合能力和抑菌性均降低等[14]。OVT和LF的氨基酸序列和空间结构极其相似,而关于热处理对它们的结构和功能影响的比较还未见报道。本研究中,OVT和LF经不同温度(50~90 ℃)处理后,通过圆二色性分析其二级结构的变化,紫外吸收和表面疏水性分析其空间构象的变化,SDS-PAGE分析其分子的聚集,溶解度分析其功能的变化,以此比较OVT和LF的热处理稳定性。
1 材料和方法
1.1 材料与仪器
OVT(Ovotransferrin,OVT,Product Code:45BG-99) 由加拿大Neova公司Alex Yousif博士馈赠(Abbotsford B C,Canada);LF(Lactoferrin,LF,纯度≥95%) 由中国农业大学食品科学与营养工程学院任发政教授馈赠;牛血清白蛋白第V组分(Bovine serum albumin fraction V,BSA,纯度≥98%,分子量67.2 ku,Cat. No. 0332) 美国Amresco公司;蛋白质染色液(Dye reagent concentrate,DRC) 美国Bio-Rad公司;低分子量标准蛋白Marker(含6种标准蛋白,低分子量从大到小依次为:兔磷酸化酶B 97.4 ku、牛血清白蛋白66.2 ku、兔肌动蛋白43 ku、牛碳酸酐酶31 ku、人生长激素22 ku,批号 201205) 中国科学院上海生命科学研究所;β-巯基乙醇(β-mercaptoethanol,β-ME)、8-苯胺基-1-萘磺酸镁盐(ANS-Mg2+) Sigma公司;其它试剂均为国产分析纯;实验用水为去离子水(dH2O,18 Ω)。
CU-420型恒温水箱 上海一恒科学仪器有限公司;XB 220A型电子天平 Precisa Gravimetrics AG公司;HJ-1型磁力搅拌器 江苏省金坛市荣华仪器制造有限公司;pHS-3C+型酸度计 成都世纪方舟科技有限公司;QL-901型漩涡震荡器 海门市其林贝尔仪器制造有限公司;680型酶标仪 美国Bio-Rad公司;DYY-8C型电泳仪 北京市六一仪器厂;DK-8AXX型电热恒温水槽 上海—恒科技有限公司;TGL-16B台式离心机 上海安亭科学仪器厂;F-7000型荧光光度计 日本Hitachi公司;UV-1200型紫外可见分光光度计 上海美谱达仪器有限公司;Pistarn-180型圆二色谱仪 英国应用光物理公司。
1.2 实验方法
1.2.1 转铁蛋白样品的热处理 将OVT和LF用磷酸盐缓冲溶液(Phosphate buffered saline,PBS;pH7.4)溶解,配制浓度为20 mg/mL的OVT和LF储备液,置于-20 ℃冰柜中保存,使用前置于37 ℃水浴解冻。将OVT和LF的储备液用PBS分别稀释成浓度为0.1、0.2、0.3、0.4、0.5、2 mg/mL的OVT和LF工作液。取3 mL浓度分别为0.1、0.2、0.3、0.4、0.5 mg/mL的OVT和LF溶液于15 mL离心管中;取1 mL浓度分别为0.2、0.5、2 mL的OVT和LF溶液于1.5 mL离心管中。将各离心管置于50~90 ℃水浴中加热5 min,然后取出立即放于冰水浴中冷却待测。
1.2.2 紫外吸收特性分析 取热处理后的OVT和LF工作液(0.5 mg/mL)1 mL,移入石英比色皿(光程10 mm)中。采用UV-1200型紫外分光光度计进行扫描,扫描的波长范围为220~320 nm,扫描速度为100 nm/min。
1.2.3 表面疏水性分析 参考董学艳等的方法[15],取热处理后的OVT和LF工作液(浓度分别为0.1、0.2、0.3、0.4、0.5 mg/mL)3 mL,加入40 μL浓度为8 mmol/L的8-苯胺基-1-萘磺酸镁盐(ANS-Mg2+)溶液(用PBS配制)作为荧光探针并于室温条件下避光放置15 min。采用F-7000型荧光分光光度计,固定380 nm处的激发波长,在450~500 nm发射波长范围内(狭缝5 nm)扫描蛋白样品的荧光强度。相同温度下,以450~500 nm发射波长范围内的最大荧光强度为纵坐标,蛋白浓度为横坐标作曲线,曲线斜率S0即为该加热温度下蛋白质的表面疏水性指数。
1.2.4 圆二色性分析 参考董学艳等的方法[15],取热处理后的OVT和LF工作液(0.2 mg/mL)0.2 mL,移入光径为1 mm的石英池中。采用Pistarn-180型圆二色谱仪在波长为190~250 nm间范围对蛋白样品进行扫描,每点扫描时间为2.5 μs,狭缝宽1 nm,室温下进行,重复扫描3次取平均值,所得的数据用平均摩尔椭圆率=[-]表示,其单位为deg·cm2/dmoL。OVT和LF的二级结构中各组分的相对含量根据系统自带软件进行计算。
1.2.5 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE) 参考刘建垒等的方法[16],依次在凝胶板中加入7 mL的12 g/100 mL的分离胶和2 mL的5 g/100 mL的浓缩胶,插入15孔的电泳梳子,凝胶厚度为1 mm。取热处理后的OVT和LF工作液(2 mg/mL)20 μL,与20 μL上样缓冲液(含2 g/100 mL SDS和2%(v/v)β-ME,40%(v/v)甘油,0.02 g/100 mL溴酚蓝的Tris-HCl缓冲溶液,pH6.8)混匀,沸水加热5 min。样品未离心,每个上样孔内加样量为9 μL。将电压设为120 V,当溴酚蓝指示剂跑到距胶底部5 mm时(约1.5 h),停止电泳。轻柔剥离胶片后,用考马斯亮蓝R-250染色液染色3 h,用脱色液脱色至条带清晰可见,用相机拍照,分析。在非还原性SDS-PAGE中的上样缓冲液中不加β-ME,其他步骤同上。
表1 不同温度所致OVT和LF的表面疏水性指数的变化
Table 1 Changes of surface hydrophobic index of OVT and LF at different temperatures

转铁蛋白表面疏水性指数255060708090(℃)OVT230±281a268±39a374±28a4800±339b5398±313bc6100±608cLF886±88a891±36a947±171a5587±463b7915±570c10146±277d
注:OVT和LF的浓度分别为0.1~0.5 mg/mL,25 ℃(室温)表示OVT和LF未经热处理,上标小写字母a~d表示同一行不同均数间差异显著(p<0.05)。
1.2.6 溶解度测定 参考刘建垒等的方法[16],取热处理后的OVT和LF工作液(2 mg/mL)1 mL,经6313×g离心10 min后,倾倒出上清液于另一1.5 mL离心管中,去除沉淀。蛋白质含量用Bradford方法测定。吸取未离心的蛋白溶液和上清液各100 μL于96孔板中,加入100 μL的DRC染色液,在室温下充分混匀,静置5 min,用酶标仪在595 nm下进行比色测定,用PBS作为空白对照。溶解度计算公式:溶解度(%)=Ps/Pt×100 Ps:离心后的上清液中可溶性蛋白的含量(Soluble protein content,Ps),Pt:原液总蛋白质含量(Total protein content,Pt)。
1.2.7 统计分析 所有实验均重复3次,数据结果以平均值±标准差(Mean±SD)表示,实验数据采用Minitab 17.1.0软件进行单因素方差分析(one way analysis of variance,one-way ANOVA),进一步用Tukey多重比较确定各组均值间的显著性差异,显著水平设为p<0.05。
2 结果与分析
2.1 不同温度所致OVT和LF的紫外吸收光谱的变化
与未经热处理的相比,OVT的吸光值在50~60 ℃时无明显变化,70 ℃时显著增大,80~90 ℃时不再进一步增大。LF的吸光值在50~60 ℃时无明显变化,70 ℃时显著增大,80~90 ℃时则进一步增大。OVT的最大紫外吸收峰值在70 ℃时出现蓝移(280 nm→274 nm),80~90 ℃时无明显变化;LF的最大紫外吸收峰值在70~90 ℃时逐渐出现蓝移(280 nm→276 nm)。总之,经较低温度(50~60 ℃)处理后,OVT和LF的吸光值均无明显变化,70 ℃时均明显增大;80~90 ℃时,OVT的不再进一步增大,而LF的则进一步逐渐增大。

图1 不同温度所致OVT和LF的紫外吸收光谱的变化Fig.1 Changes of UV spectra of OVT and LF at different temperatures 注:OVT和LF的浓度为0.5 mg/mL,25 ℃(室温)表示OVT和LF未经热处理。
蛋白质中色氨酸、酪氨酸等芳香族氨基酸残基在220~320 nm内有吸收,且其最大吸收峰在280 nm附近(芳香族氨基酸中苯环共轭双键的吸收峰)[17]。佟平等报道,OVT经70 ℃加热5 min后,其紫外吸光值也明显增大,这与本研究的结果相似[9]。OVT和LF的最大紫外吸光值明显增大,表明经热处理后,蛋白质分子结构已展开,芳香族氨基酸残基暴露在蛋白质分子表面,增大了对紫外光的吸收[9]。OVT和LF的最大紫外吸收峰值都出现蓝移,说明色氨酸和酪氨酸残基等所处微环境的极性发生了变化[9]。
2.2 不同温度所致OVT和LF的表面疏水性指数的变化
与未经热处理的相比,OVT的表面疏水性指数在50~60 ℃时无明显变化,70 ℃时显著增大,80~90 ℃时进一步显著增大,90 ℃时增大了25.5倍。LF的表面疏水性指数在50~60 ℃时无明显变化,70 ℃时也显著增大,80~90 ℃时进一步显著增大,90 ℃时增大了10.5倍。总之,经较低温度(50~60 ℃)处理后,OVT和LF的表面疏水性指数均无明显变化,70 ℃时均显著增大,80~90 ℃时均进一步显著增大。相同温度下,LF的表面疏水性指数远大于OVT的,但OVT的增大程度较LF的更大。
表2 不同温度所致OVT和LF的各二级结构百分率的变化
Table 2 Percentage changes of secondary structures of OVT and LF at different temperatures

转铁蛋白二级结构组分的相对含量(%)255060708090(℃)OVT:α-螺旋280028252875140812931252β-折叠209320782049303332023310β-转角171517091648160916171628无规则卷曲339133883436394238883818LF:α-螺旋238324722453199614081250β-折叠241123582386284334363781β-转角173517331742154514471548无规则卷曲347134383419362538183912
注:OVT和LF的浓度为0.2 mg/mL,25 ℃(室温)表示OVT和LF未经热处理。
蛋白质表面疏水性的变化能较好地反映蛋白质三级结构的变化,检测蛋白质表面疏水性最常用的方法是ANS荧光探针法。ANS通过与蛋白质的疏水区域非共价结合,其荧光强度显著增强,且其荧光强度与蛋白质表面暴露的疏水基团呈正相关[18]。刘枫等报道,OVT经65 ℃加热5 min后,其表面疏水性指数明显增大[10]。闫旭东等报道,LF经60 ℃加热30 min后,其表面疏水性指数也明显增大[14]。他们的研究结果均与本研究的结果相似。OVT和LF的表面疏水性指数都显著增大,即热处理破坏了转铁蛋白氨基酸残基之间的非共价键,导致分子内部的疏水基团暴露出来;并且随着温度升高,暴露出的疏水性基团也就越多,从而导致蛋白质的表面疏水性指数进一步增大[10]。
2.3 不同温度所致OVT和LF的二级结构的变化
与未经热处理的相比,OVT的α-螺旋含量在50~60 ℃时无明显变化,70 ℃时明显降低,80~90 ℃时进一步降低,90 ℃时降低了55.3%;OVT的β-折叠含量在50~60 ℃时无明显变化,70 ℃时明显升高,80~90 ℃时进一步升高,90 ℃时升高了58.1%;OVT的无规卷曲含量在50~60 ℃时无明显变化,70 ℃时明显升高,80~90 ℃时无明显升高,90 ℃时升高了12.6%。LF的α-螺旋含量在50~60 ℃时无明显变化,70 ℃时明显降低,80~90 ℃时进一步降低,90 ℃时降低了47.5%;LF的β-折叠含量在50~60 ℃时无明显变化,70 ℃时明显升高,80~90 ℃时进一步升高,90 ℃时升高了56.8%;LF的无规则卷曲含量在50~60 ℃时无明显变化,70 ℃时明显升高,80~90 ℃时进一步升高,90 ℃时升高了12.7%。总之,经较低温度(50~60 ℃)处理后,OVT和LF的二级结构组分的相对含量均无明显变化。70 ℃时,OVT和LF的α-螺旋含量均明显降低,β-折叠和无规卷曲含量均明显升高;80~90 ℃时,OVT和LF的二级结构组分的相对含量均进一步发生变化,且OVT的变化程度较LF的更大。
经较高温度(70~90 ℃)处理后,OVT和LF分子中α-螺旋含量逐渐降低,可能原因是热处理导致了蛋白质形成絮状物,α-螺旋逐渐展开,使其含量明显下降;同时蛋白分子中其它二级结构逐渐转变为β-折叠和无规卷曲,使其含量逐渐升高[19]。热处理导致OVT和LF分子中的α-螺旋含量降低,分子结构的有序性降低,形成了以β-折叠和无规卷曲为主的二级结构,分子结构逐步伸展而变得松散无序[8]。刘猛等报道,LF经95 ℃加热10 min后,其二级结构中α-螺旋含量降低,β-折叠含量升高,这与本研究的结果相似[8]。Kato等发现蛋白质的表面疏水性指数与分子中α-螺旋的含量呈负相关,即蛋白质分子中α-螺旋的含量降低,导致疏水区域的暴露程度增大,从而其表面疏水性指数也逐渐增大[20]。
2.4 不同温度所致OVT和LF的SDS-PAGE图谱变化
OVT主要在66.2~97.4 ku区域内出现一条倾斜的密度较高的宽大条带,在较低分子量区域(43~66.2 ku)还出现了密度较低的拖尾条带。与未经热处理的相比,OVT主要蛋白条带的密度在50~60 ℃时无明显变化;70 ℃时出现明显降低,相对应的条带有部分聚集在浓缩胶顶端;80~90 ℃时,OVT主要蛋白条带的密度进一步逐渐降低,浓缩胶顶端的条带密度逐渐增高。LF主要在66.2~97.4 ku区域内有一条密度较高的宽大条带。LF主要蛋白条带的密度在50~60 ℃时无明显变化,70 ℃时出现明显降低,相对应的条带有部分聚集在浓缩胶顶端;80~90 ℃时,LF主要蛋白条带密度进一步逐渐降低,浓缩胶顶端的条带密度也逐渐增高。总之,经较低温度(50~60 ℃)处理后,OVT和LF的主要蛋白条带的密度均无明显变化,70 ℃时均明显降低,80~90 ℃时均进一步逐渐降低;相同温度下,OVT的降低程度较LF的更大。
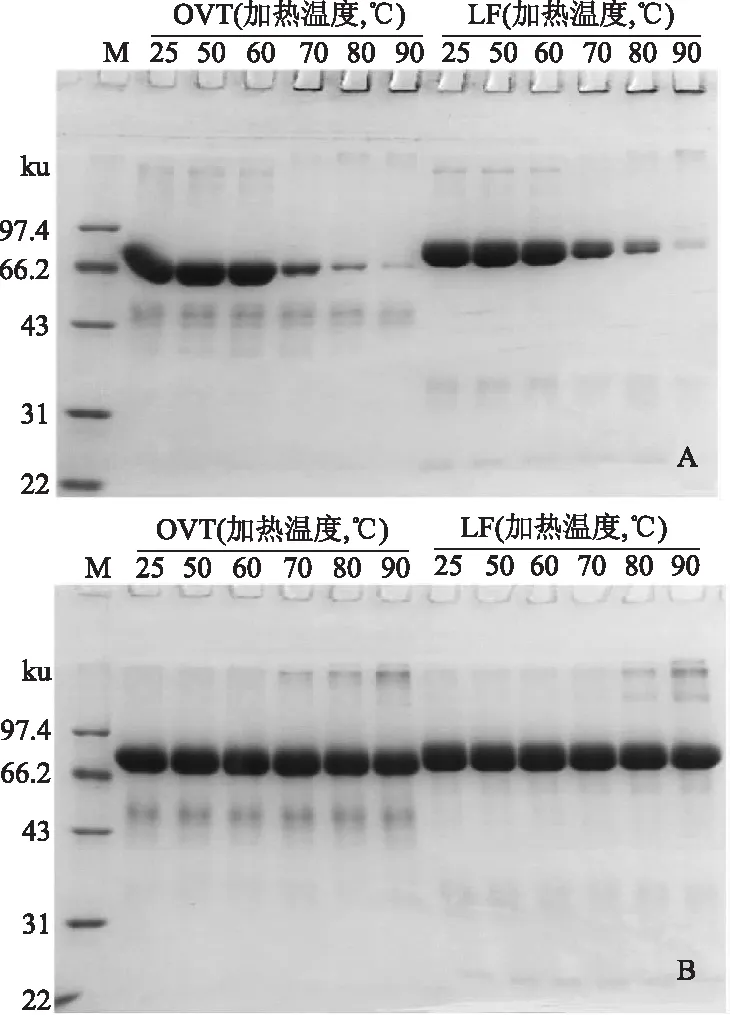
图2 不同温度所致OVT和LF的SDS-PAGE图谱的变化Fig.2 Changes of SDS-PAGE patterns of OVT and LF at different temperatures注:OVT和LF的浓度为2 mg/mL,25 ℃(室温)表示OVT和LF未经热处理。M:低分子质量标准蛋白Marker;A:-β-ME)(上样缓冲液中不添加β-ME);B:+β-ME(上样缓冲液中添加β-ME)。
未经热处理的OVT的主要蛋白条带出现倾斜,可能是标准蛋白中β-ME对未加β-ME的OVT产生了干扰。OVT在较低分子量区域出现了拖尾条带,可能是OVT中混有的低分子量杂蛋白导致条带拖尾。经较高温度(70~90 ℃)处理后,OVT和LF分子均发生交联和聚集,相对分子质量增大,且聚集体不能通过浓缩胶;但在还原性电泳图谱中,浓缩胶顶端无聚集条带,是因为加入的β-ME能将产生的交联蛋白中的二硫键还原。又因为OVT和LF都不含游离的巯基,因此OVT和LF可能通过分子间二硫键的互换形成交联或聚集[21-22]。在还原性电泳图谱中,经较高温度(80~90 ℃)处理后,OVT和LF在较高分子量区域(97.4 ku以上)都出现了新条带,表明部分OVT和LF分子也形成了不被β-ME破坏的高分子聚合物,这种聚合物可能通过非二硫键的共价键或以疏水相互作用和静电相互作用为主的非共价键作用形成[21]。
表4 不同温度所致OVT和LF的溶解度的变化
Table 4 Changes of solubility of OVT and LF at different temperatures

转铁蛋白溶解度(%)255060708090(℃)OVT980±07a974±09a956±13ab148±07c117±08d102±05dLF976±06a964±05a964±05a220±14b175±02c158±06d
注:表中数据为平均值±标准差(Mean±SD),上标小写字母a~d表示同一行不同均数间差异显著(p<0.05)。经热处理后,OVT和LF的分子间的二硫键发生重排,埋藏在疏水内核中的非极性基团暴露出来,促进了分子间的相互作用,导致分子间发生聚集[23-24]。
2.5 不同温度所致OVT和LF的浑浊度和溶解度的变化
肉眼观察可见,OVT溶液在50~60 ℃时无明显变化,70 ℃时出现絮状物但无明显浑浊,80~90 ℃时絮状物进一步增多。LF溶液在50~60 ℃无明显变化,70 ℃时出现浑浊但无明显絮状物出现,80~90 ℃时浑浊度进一步增大,同时有少量絮状物出现。总之,经较低温度(50~60 ℃)处理后,OVT和LF溶液均无明显变化;70 ℃时,OVT出现絮状物,而LF出现浑浊;80~90 ℃时,OVT和LF的浑浊度均明显增大,絮状物也明显增多。随着热处理时间的延长(由5 min到10 min),70~90 ℃时,OVT的弥漫性絮状物增多;LF的浑浊度增大,絮状物也逐渐增多。

图3 不同热处理时间和温度所致OVT和LF的浑浊度变化Fig.3 Changes of turbidity of OVT and LF at different heating times and heating temperatures注:OVT和LF的浓度为2 mg/mL,25 ℃(室温)表示OVT和LF未经热处理,加热结束后立即取出置于冰水浴中冷却。
表3 不同热处理时间和温度所致OVT和LF溶液的浑浊度的变化
Table 3 Changes of turbidity of OVT and LF at different heating times and heating temperatures

转铁蛋白浑浊度255060708090(℃)OVT:5min---+∗+++∗∗++∗∗∗10min---+∗∗++∗∗∗++∗∗∗∗LF:5min---+++∗+++∗∗10min---+++++∗∗++++∗∗∗
注:“-”表示用肉眼观察蛋白溶液呈澄清状态,“+”表示蛋白溶液的浑浊度,“*”表示蛋白溶液中出现絮状物的程度。 与未经热处理的相比,OVT的溶解度在50~60 ℃时无明显变化,70 ℃时显著降低,80 ℃时进一步显著降低,90 ℃时再无显著降低,90 ℃时降低了89.6%。LF的溶解度在50~60 ℃时无明显变化,70 ℃时显著降低,80~90 ℃时进一步显著降低,90 ℃时降低了83.8%。总之,经较低温度(50~60 ℃)处理后,OVT和LF的溶解度均无明显变化,70 ℃时均显著降低,80~90 ℃时均进一步逐渐降低;相同温度下,OVT的降低程度较LF的更大。
3 结论
经较低温度(50~60 ℃)处理后,OVT和LF的结构(紫外吸光值、表面疏水性指数、二级结构组分的相对含量、SDS-PAGE图谱)和功能(溶解度)均无明显变化。经较高温度(70~90 ℃)处理后,OVT和LF的紫外吸光值和表面疏水性指数均明显增大,且其二级结构组分的相对含量均发生明显变化;蛋白分子发生聚集并伴随溶解度的明显降低。相同温度下,OVT的变化程度均较LF的更大。总之,OVT和LF的结构和功能在加热时均发生改变,但OVT的变化程度较LF的更大。本研究结果对于评价在热加工中OVT和LF的结构和功能变化提供了一定的理论参考。
[1]Giansanti F,Leboffe L,Pitari G,et al. Physiological roles of ovotransferrin[J]. Biochimica et Biophysica Acta,2012,1820:218-225.
[2]Garcia-Montoya I A,Cendon T S,Arevalo-Gallegos S,et al. Lactoferrin a multiple bioactive protein:an overview[J]. Biochimica et Biophysica Acta,2012,1820:226-236.
[3]Wu J,Acero-Lopez A. Ovotransferrin:structure,bioactivities,and preparation[J]. Food Research International,2012,46:480-487.
[4]Gonzalez-Chavez S A,Arevalo-Gallegos S,Rascon C Q. Lactoferrin:structure,function and applications[J]. International Journal of Antimicrobial Agents,2009,33:301.e1-301.e8.
[5]中华人民共和国卫生部. GB14880-2012食品营养强化剂使用标准[S]. 北京:中国标准出版社,2012.
[6]张艳杰. 乳铁蛋白的功能特性及其在婴儿配方奶粉中的应用[J]. 中国乳品工业,2005,33(2):33-36.
[7]Corda R,Biddau P,Corrias A,et al. Conalbumin in the treatment of acute enteritis in the infant[J]. International Journal of Tissue Reactions,1983,5(1):117-123.
[8]刘猛,杜明,孔莹莹,等. 牛乳乳铁蛋白的纯化及热处理对其分子特性的影响[J]. 食品科学技术学报,2013,31(2):26-30.
[9]佟平,陈红兵. 鸡蛋卵转铁蛋白线性表位定位及热加工对其结构与过敏原性的影响[D]. 南昌:南昌大学,2011,12.
[10]刘枫,杨严峻. 卵转铁蛋白的磁法分离及热稳定性研究[D]. 无锡:江南大学,2015,6.
[11]仉旭,吴子健,吕瑜峰. 鸡卵转铁蛋白结构与功能的关系[J]. 天然产物研究与开发,2015,27:1118-1123.
[12]Marie A P,Ulla S,Kishore A R,et al. Thermal behavior of bovine lactoferrin in water and its relation to bacterial interaction and antibacterial activity[J]. Dairy Science,1993,76:3711-3720.
[13]Celia C,Carmen R G,Eduarodo C,et al. Effect of heat treatment on the antibacterial activity of bovine lactoferrin against three food borne pathogens[J]. International Journal of Dairy Technology,2010,63(2):209-215.
[14]闫旭东,王彩云,云战友. 乳铁蛋白热稳定性研究[J]. 中国乳品工业,2014,42(4):18-20.
[15]董学艳,景浩. 牛血清白蛋白与槲皮素或莱菔硫烷相互作用模式及纳米颗粒形成的比较研究[D]. 北京:中国农业大学,2014,4.
[16]刘建垒,景浩. Fenton体系的优化及其对酪蛋白的氧化作用[J]. 食品科学,2014,35(13):74-79.
[17]曹书霞,赵玉芬. 分子吸收光谱在生物大分子研究中的应用[J]. 光谱学与光谱学分析,2004,24(10):1197-1201.
[18]王守业,徐小龙,刘清亮,等. 荧光光谱在蛋白质分子构象研究中的应用[J]. 化学进展,2001,4:257-260.
[19]Ngarize S,Adams A,Howell N K. Studies on egg albumen and whey protein interactions by FT-Raman spectroscopy and rheology[J]. Food Hydrocolloids,2004,18(1):49-59.
[20]Kato A,Tsutsui N,Matsudomi N,et al. Effects of partial denaturation on surface properties of ovalbumin and lysozyme[J]. Agricultural and Biological Chemistry,1981,45(12):2755-2760.
[21]Matsudomi N,Oka H,Sonoda M. Inhibition against heat coagulation of ovotransferrin by ovalbumin in relation to its molecular structure[J]. Food Research International,2002,35:821-827.
[22]Christ D,Takeuchi P K,Cunha L R. Effect of sucrose addition and heat treatment on egg albumen protein gelation[J]. Journal of Food Science,2005,70(3):230-238.
[23]Van Der Plancken I,Van Loey A,Hendrickx M E. Kinetic study on the combined effect of high pressure and temperature on the physicochemical properties of egg white proteins[J]. Journal of Food Engineering,2007,78:206-216.
[24]Mazurier J,Metz-Boutigue M H,Jolles J,et al. Human lactotransferrin:Molecular,functional and evolutionary comparisons with human serum transferrin and hen ovotransferrin[J]. Experientia,1983,39:135-141.
Comparison of thermal stability of ovotransferrin and lactoferrin
LI Qing,JING Hao*
(College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China)
OVTandLFwereheatedatdifferenttemperaturesof50~90 ℃,andchangesoftheirsecondarystructures,spatialconformation,andsolubilitywereanalyzedbycirculardichroism(CD),UVabsorbance,surfacehydrophobicity,andturbidity/solubilitytests,respectively.ProteinaggregationwasassessedbySDS-PAGE.ResultsshowedthatnochangewasobservedforphysicochemicalpropertiesofOVTandLFat50~60 ℃.SignificantincreaseofUVabsorbancewasobservedforbothLFandOVTat70 ℃;furtherincreasewasobservedforLFbutnotforOVTat80~90 ℃.SignificantincreaseofsurfacehydrophobicityindexwasobservedforLFandOVTat70~90 ℃.ThesurfacehydrophobicityindexofLFwashigherthanthatofOVT,whiletheextentsofincreasewerehigherforOVTthanLF.Decreasedpercentagesofα-helixandincreasedpercentagesofβ-sheetandrandomcoilwereobservedforbothLFandOVTat70~90 ℃,buttheextentsofchangewerehigherforOVTthanLF.ThebanddensitiesandsolubilityofOVTandLFweredecreasedat70~90 ℃,buttheextentsofdecreasewerehigherforOVTthanLFatthesametemperatures.Inconclusion,changeswereobservedofstructuresandfunctionalcharacteristicforOVTandLFafterheatingtreatment,whiletheextentsofchangewerehigherforOVTthanLF.
ovotransferrin;lactoferrin;thermalstability;UVabsorbance;surfacehydrophobicity;solubility
2016-04-08
黎庆(1991-),女,硕士研究生,研究方向:蛋白质的结构和功能分析,E-mail:m13011824370@163.com。
*通讯作者:景浩(1957-),男,博士,教授,研究方向:蛋白质与小分子的相互作用,E-mail:haojing@cau.edu.cn。
“十二五”农村领域国家科技计划课题子课题《蛋制品加工技术研发与产业化示范》(2012BAD28B08)。
TS201.2
A
1002-0306(2016)19-0101-06
10.13386/j.issn1002-0306.2016.19.011

