响应面法优化丁酸梭菌发酵培养工艺
邢宏观,林建国,钟雪兆,王常高,杜 馨,蔡 俊
(湖北工业大学发酵工程教育部重点实验室和工业发酵湖北省协同创新中心,湖北武汉 430068)
响应面法优化丁酸梭菌发酵培养工艺
邢宏观,林建国,钟雪兆,王常高,杜 馨,蔡 俊*
(湖北工业大学发酵工程教育部重点实验室和工业发酵湖北省协同创新中心,湖北武汉 430068)
采用响应面法对丁酸梭菌生物量的发酵工艺进行优化。在单因素实验的基础上利用Plackett-Burman实验设计筛选出影响菌体数的显著性因素。在此基础上,运用最陡爬坡实验找出CCD实验的中心点,并确定非显著因素最低添加量来降低生产成本。最后通过响应面法分析获得最佳发酵培养基组成成份。结果表明:酵母浸粉、FeSO4和K2HPO4为影响菌体量的3个显著性因素;可溶性淀粉2%、酵母浸粉6%、FeSO41.74%、K2HPO40.37%、NaCl 0.2%、MgSO40.024%为最佳培养基组合;优化后的菌体数可达1.01×109个/mL,与优化前(2.3×108个/mL)相比,提高至4.39倍。
丁酸梭菌,生物量,响应面法,发酵工艺
丁酸梭菌(Clostridiumbutyricumm)即丁酸梭状芽孢杆菌,又名酪酸菌、宫入菌[1]。根据2001年联合国粮农组织和世界卫生组织的专家们对益生菌的定义,C.butyricum符合益生菌标准,其最早于1944年在日本投入临床应用,至今已经开发出多种相关的微生态制剂[2]。在临床应用上,丁酸梭菌主要治疗各种原因(肠道感染、外科手术等)所致的肠道菌群紊乱、急慢性腹泻、肠易激综合症、非溃疡性消化不良等疾病[3-6]。除了能调节机体肠道菌落平衡,提高免疫力外,也有报道称丁酸梭菌对肝脏损伤有治疗和预防的效果[9]。最新研究表明丁酸梭菌对治疗癌症也有一定功效[10-11]。
目前制约微生态制剂大规模生产的主要因素是在生物菌剂的制备过程中存在菌体生物量偏低的问题。响应面法(Response Surface Method),也称响应曲面法,是通过对响应曲面及等高线的分析寻求最优工艺参数,采用多元二次回归方程来拟合响应值与因素之间函数关系的一种优化统计方法,其优点是在实验条件优化过程中可以连续地对实验因素的各个水平进行分析,克服了正交实验[12-13]只能对一个个孤立的实验点进行分析和不能给出直观图形的缺陷,所以它被广泛应用于微生物发酵条件的优化和模型建立中[14-15]。徐莹等[16]利用响应面法优化丁酸梭菌清液发酵工艺,使生物量由6.96×107cfu/mL提升到3×108cfu/mL;孔青等[17]利用CCD复合实验优化丁酸梭菌淀粉培养基,最终生物量达到2.55×108个/mL;李雯静等[18]通过PB实验设计和响应面法优化丁酸梭菌发酵培养基,其芽孢数最终为1.478×108cfu/mL,是优化前的2.7倍。
本实验采用单因素实验设计方法,对影响丁酸梭菌生物量发酵液的相关组分进行初步优化,最后通过响应面法设计进一步优化其发酵配方,确定了最优培养条件,以期为丁酸梭菌大规模工业化生产提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
丁酸梭菌(Clostridiumbutyricumm),本实验室自行筛选获得。种子培养基:葡萄糖10 g/L,胰蛋白胨10 g/L,蛋白胨10 g/L,大豆蛋白胨5.0 g/L,酵母浸粉3.0 g/L,NaCl 3.0 g/L,K2HPO42.5 g/L,硫代乙醇酸钠0.30 g/L,半胱氨酸盐酸盐0.30 g/L,pH7.0;初始发酵培养基:葡萄糖10 g/L,胰蛋白胨10 g/L,蛋白胨10 g/L,大豆蛋白胨5.0 g/L,酵母浸粉3.0 g/L,NaCl 3.0 g/L,K2HPO42.5 g/L,pH7.0;以上试剂均为分析纯。
表2 中心复合设计实验因素与水平
Table 2 The factors and levels of variables of CCD

因素编码值与水平-1682-1011682A:酵母浸粉(g/L)466505560634B:FeSO4(g/L)14641618202136C:K2HPO4(g/L)28963134373904
PHS-25 pH计 上海雷磁;DNP-9052电热恒温培养箱 上海精宏实验设备有限公司;血球计数板 上海求精生化试剂仪器有限公司。
1.2 实验方法
1.2.1 种子活化 取-20 ℃甘油管保藏的菌种200 μL接种于装有9 mL种子培养基的厌氧管中,37 ℃条件下静态厌氧活化24 h。
1.2.2 发酵培养 采用液体深层静置培养:250 mL三角瓶装液量100 mL,于37 ℃恒温培养箱中静置培养。
1.2.3 菌体浓度测定 血球计数板法[19]。
1.2.4 单因素实验设计
1.2.4.1 最佳除氧剂的筛选实验 酸梭菌属于严格厌氧菌,对培养液中溶解氧的浓度有严格要求,添加合适除氧剂可以降低培养液中的溶解氧浓度,利于菌体的生长。故选择了Fe粉、FeSO4、抗坏血酸、半胱氨酸盐酸盐、硫代乙醇酸钠和亚硫酸钠作为除氧剂,初始添加量均为0.1%(注:文中所出现的添加量“%”均为“v/w”)。
1.2.4.2 碳源的优选实验 共选择了葡萄糖、麦芽糖、果糖、可溶性淀粉、乳糖、甘油、蔗糖等7种碳源,初始添加量均为1%。
1.2.4.3 氮源的优选实验 共选择了蛋白胨、酵母浸膏、酵母浸粉、牛肉膏、大豆蛋白胨、胰蛋白胨、玉米粉、大豆粉8种氮源,起始添加量均为1%。
1.2.4.4 金属离子优选实验 选择了Mg2+、Zn2+、Ca2+、Mn2+、Cu2+5种金属离子,起始浓度均为5 mmol/L。
1.2.4.5 CaCO3添加量优选实验 丁酸梭菌在代谢过程中会产生大量有机酸抑制菌体生长,添加一定量CaCO3有助于解除酸抑制。
1.2.5 Plackett-Burman设计 PB设计是一种2水平的实验设计方法,是以最少量实验次数挑选出对丁酸梭菌有显著性影响的因素的实验方法[20-21],对于N次实验至多可研究(N-1)个因素。本实验选取单因素优化实验中对菌体生物量影响较大的培养基的5个组分以及初始培养基中的2种无机盐共7个因素来进行PB实验,每个因素取高(“+”)、低(“-”)2个水平,以菌体生物量为响应值Y,共进行12次实验选取可信度大于95%以上的因素作为影响菌体生物量的主要因素。Plackett-Burman实验设计的各因素和水平见表1。
表1 Plackett-Burman实验因素与水平
Table 1 The factors and levels of Plackett-Burman design

实验因素水平(g/L)-1+1A可溶性淀粉10003000B酵母浸粉20006000CFeSO46001800DNaCl200400EK2HPO415035FMgSO4012036GCaCO3050150
1.2.6 最陡爬坡实验 依据PB实验所得到的显著性因素,根据其正负效应设定各因素的步长及变化方向进行实验,从而逼近最大响应区域,找到最大拐点值,确定下一步中心复合实验的中心点。
1.2.7 最低添加量实验 在Plackett-Burman实验设计得出的不显著因素基础上,以培养基最节省为目的研究不显著因素的最低添加量。根据各因素效应合理设计变化步长,通过单因素实验确定培养基成分最优最小的用量。
1.2.8 中心组合(CCD)实验设计 CCD实验可利用有限的实验次数,评价各个因素的影响,并分析各个因素之间的相互作用,分析过程中对实验结果采用二阶经验模型对数据进行拟合。根据PB设计及最陡爬坡实验的结果,通过软件(Design-Experment 8.0.6)设计3因素5水平的实验来确定丁酸梭菌的最适培养基成份,见表2。
2 结果与分析
2.1 单因素实验结果
2.1.1 最佳除氧剂的筛选实验分析 从图1可以看出FeSO4的除氧效果最佳,菌体数可达2.69×108个/mL,故选择FeSO4作为除氧剂;从图2可以看出当FeSO4添加量为1.2%时效果最佳,菌体数达到4.55×108个/mL,较之空白对照有显著提高。

图1 除氧剂对丁酸梭菌的影响Fig.1 The effect of deoxidant on the growth of C. butyricumm

图2 FeSO4添加量对丁酸梭菌的影响Fig.2 The effect of addition amount of FeSO4 on the growth of C. butyricumm
2.1.2 碳源的优选实验分析 从图3中可以看出,可溶性淀粉效果最佳,菌体量可达5.73×108个/mL,故选择可溶性淀粉作为最佳碳源;从图4可以看出当添加量为2%时,菌体数达到最大为6.26×108个/mL,继续增加其添加量菌体浓度开始下降,故选择2%作为最适氮源添加量。

图3 不同碳源对丁酸梭菌的影响Fig.3 The effect of carbon source on the growth of C. Butyricumm

图4 可溶性淀粉添加量对丁酸梭菌的影响Fig.4 The effect of addition amount of soluble starch on the growth of C. butyricumm
2.1.3 氮源的优选实验分析 从图5可看出酵母浸粉效果明显优于其它,菌体数可达4.10×108个/mL,玉米粉和大豆粉效果最差,故选酵母浸粉为最佳氮源;从图6可以看出菌体数随着酵母浸粉添加量的增加而升高,当添加量为4%时达到最高,为6.86×108个/mL,故选择4%作为最适氮源添加量。

图6 酵母浸粉添加量对丁酸梭菌的影响Fig.6 The effect of addition amount of Yeast extract powder on the growth of C. butyricumm

图7 不同金属离子对丁酸梭菌的影响Fig.7 The effect of ions on the growth of C. butyricumm
2.1.4 金属离子优选实验分析 从图7可看出Mg2+对丁酸梭菌生长有促进作用,Zn2+、Ca2+、Mn2+则对其有抑制作用,Cu2+完全抑制其生长,故选Mg2+作为最佳金属离子;其添加量由图8可以看出为2 mmol/L时最佳,菌体数可达8.01×108个/mL。
表4 Plackett-Burman实验设计的回归分析
Table 4 Regression analysis for the Plackett-Burman design

项效应系数系数标准差Tp常量674580196034410000∗可溶性淀粉-02483-0124201960-0630561酵母浸粉1365006825019603480025∗FeSO41831709158019604670010∗NaCl0368301842019600940401K2HPO41195005975019603050038∗MgSO40475002375019601210292CaCO30135000675019600340748
注:模型在5%水平时差异显著,“*”代表显著因素;表4与表8同。
表5 Plackett-Burman实验设计方差分析表
Table 5 Analysis of variable(ANOVA)for Plackett-Burman design

来源自由度SeqSSAdjSSAdjMSFp主效应72126221262303756590044∗残差误差41844184404611合计1123107R2=9202%R2Adj=7805%

图8 Mg2+浓度对丁酸梭菌的影响Fig.8 The effect of concentration of Mg2+ on the growth of C. Butyricumm
2.1.5 CaCO3添加量优选实验分析 从图9中可以看出,CaCO3添加量为0.1%时效果最佳,菌体数达到8.45×108个/mL。

图9 CaCO3添加量对丁酸梭菌的影响Fig.9 The effect of addition amount of CaCO3 on the growth of C. Butyricumm
2.2 PB实验结果与分析
PB实验设计结果见表3。对表3中的实验结果进行方差分析和回归分析,分析结果见表4和表5。
表3 Plackett-Burman实验设计与结果
Table 3 The Plackett-Burman experiment design and results

实验号ABCDEFG菌体数(×108个/mL)111-111-117032-1-1111-118253-11-1-1-11161641-1-1-1111566511-11-1-1-15646111-111-194271-111-11-16568-1-1-1-1-1-1-147591-11-1-1-1154210-111-11-1-179611-1-1-1111-157412-1111-111836
由表4可看出,该回归模型的p值(prob>F)为<0.0001,为高度显著,表明该模型在所得回归区域拟合很好。且酵母浸粉、FeSO4和K2HPO4的p分别为0.025、0.010和0.038,均小于0.05,表明酵母浸粉、FeSO4和K2HPO4在95%的置信区间内显著,是影响丁酸梭菌菌体量的三个主要因素,且全为正效应;其余因素的p值均大于0.05,表明在95%的置信区间内是不显著,对菌体量影响不大,可以通过后面的最低添加量实验来确定这些非显著因素的添加量,以降低成本。由表5看出,该回归模型的p值在95%的置信区间内是显著的,其决定系数R2=92.02%,表示模型中92.02%的数据都能用此模型来解释。
2.3 最陡爬坡实验结果分析
根据PB实验的回归分析和方差分析,按照各因素的正负效应来设定最陡爬坡实验:酵母浸粉、FeSO4、K2HPO4均为正效应,步长分别设为5、2、0.3 g/L,详见表6。
表6 最陡爬坡实验设计与结果
Table 6 Experiment design and results of the steepest ascent design

项目酵母浸粉(g/L)(+)FeSO4(g/L)(+)K2HPO4(g/L)(+)菌体数(×108个/mL)原点401225步长5203实验运行140122578524514288333501631876455183490356020378136652240795
由表6可知,随着实验序的进行,第4组丁酸梭菌的菌体数最高,即酵母浸粉、FeSO4和K2HPO4的用量分别为55、18 g/L和3.4 g/L时,菌体数为9.03×108个/mL,随着运行序的进一步增加,丁酸梭菌的菌体数逐渐降低。故选酵母浸粉、FeSO4和K2HPO4的添加量分别为55、18 g/L和3.4 g/L作为中心复合设计的中心点。

图10 最低添加量的实验设计与结果Fig.10 The design and result of minimum amount
2.4 最低添加量实验
由PB实验得到的4个不显著因素可溶性淀粉、NaCl、MgSO4和CaCO3做最低添加量实验,以期达到培养基成分最优最小的用量。
由图10a可知,随着可溶性淀粉添加量的增加,丁酸梭菌菌体密度逐渐增加,当添加量为20 g/L时,菌体数达到最大值9.03×108个/mL;由图10b可知,NaCl的添加量为2 g/L时,丁酸梭菌菌体密度达到最大值9.01×108个/mL,而继续增加NaCl用量后菌体数开始下降,故选择NaCl的添加量为2 g/L;由图10c可知,随着MgSO4添加量的逐渐增加,其菌体数也随着升高,在0.24 g/L时达到最大;由图10d可知,随着CaCO3含量的增加,丁酸梭菌菌体密度基本趋于平衡,为节省成本,故选择CaCO3添加量为0 g/L。故最终确定可溶性淀粉、NaCl、MgSO4、CaCO3的添加量分别为20、2、0.24、0 g/L。
2.5 中心复合实验设计
根据最陡爬坡实验得到中心复合实验的中心点:选酵母浸粉55 g/L、FeSO418 g/L、K2HPO43.4 g/L。以此为中心点,以丁酸梭菌菌体数为响应值进行3因素5水平的中心复合设计实验。其设计及结果见表7。
表7 中心复合实验设计与结果
Table 7 Design and result of Central composite design
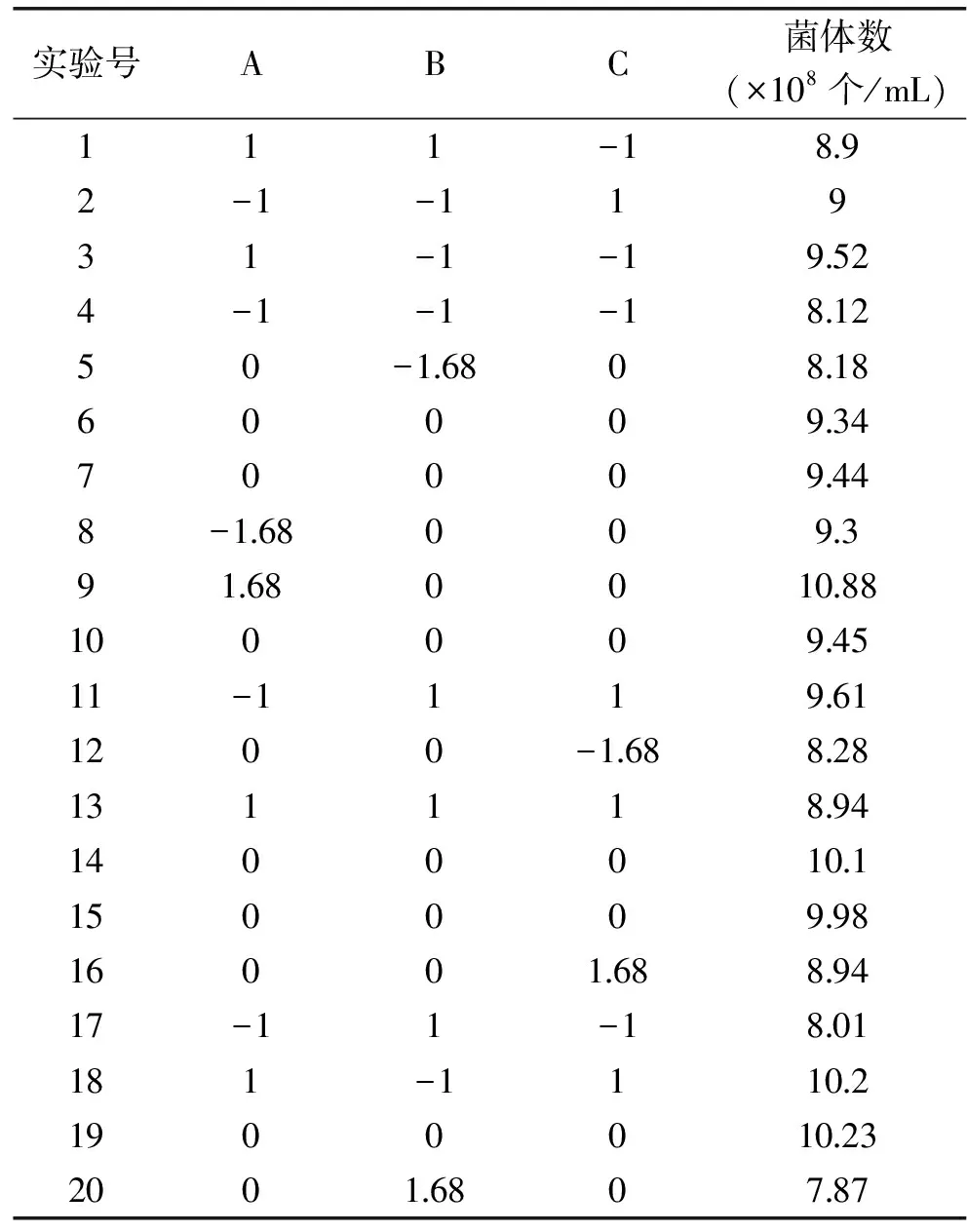
实验号ABC菌体数(×108个/mL)111-1892-1-11931-1-19524-1-1-181250-1680818600093470009448-168009391680010881000094511-1119611200-168828131118941400010115000998160016889417-11-1801181-111021900010232001680787
响应面分析中对CCD实验结果进行拟合二次模型方差分析如表8,模型的p值(prob>F)小于0.05,说明模型具有显著性,该二次模型多元相关系数R2=90.17%,表明该模型能解释90.17%的菌体密度变化;失拟项p值为0.6415大于0.05,表明失拟项不显著,没有失拟现象。A、C、B2、C2的p值均小于0.05表明对菌体密度的影响呈显著性,AB之间的交互影响显著。
根据软件分析,以Y为菌体数,A为酵母浸粉,B为FeSO4,C为K2HPO4,用多项式回归技术对此实验数据拟合所得二次多项式回归方程为:Y(×108)=9.75+0.40A-0.14B+0.32C-0.30AB-0.22AC+0.010BC+0.16A2-0.57B2-0.37C2,该二次多项式方程的三维响应面图见图11~图13。
由图11可知,当FeSO4添加量不变时,随着K2HPO4含量的增加,菌体数出现了先增大后减小的趋势。同样,当K2HPO4含量不变时,随着FeSO4添加量的增加,菌体数也出现了先增大后减小的趋势。由图12可知,当酵母浸粉添加量不变时,FeSO4添加量对菌体数存在二次效应,其曲面呈现抛物面。由图13可以看出K2HPO4和酵母浸粉之间的交互作用不是很明显。
表8 响应面二次式模型的方差分析表
Table 8 ANOVA Table of response surface quadratic model

项目平方和自由度均方F值p值显著性Model11929132101900006显著A酵母浸粉2212216900021∗BFeSO402610262040184Ck2HPO41361136104700089∗AB071107154500418∗AC03910392980115BC800E-041800E-04616E-030939A203510352701315B24751475365500001∗C21941194149600031∗残差1310013失拟项054501107106415非显著纯误差0765015总离差132219R2=9017% R2Adj=8132%
对图11~图13分析可知,菌体数达到最大时,三个因素的编码值分别为1.00(A)、-0.38(B)、0.13(C),即酵母浸粉6%、FeSO41.74%、K2HPO40.34%,得到此模型的一个最大响应值为1.04×109个/mL,为了验证此模型预测的准确性,在优化后的培养基进行了验证,共进行了三次实验,其平均值为1.01×109个/mL,实测值与回归方程预测值相对误差很小。由此可见,用该回归模型优化丁酸梭菌发酵工艺进行的分析和预测是可行的,且具有实用价值。最终优化后丁酸梭菌发酵培养基为:可溶性淀粉2%,酵母浸粉6%,FeSO41.74%,K2HPO40.34%,NaCl 0.2%。

图11 磷酸氢二钾和硫酸亚铁的交互作用对菌体数影响的响应面图Fig.11 Response surface for interaction effects of K2HPO4 and FeSO4 on cells

图12 硫酸亚铁和酵母浸粉的交互作用对菌体数影响的响应面图Fig.12 Response surface for interaction effects of FeSO4 and Yeast extract powder on cells

图13 磷酸氢二钾和酵母浸粉的交互作用对菌体数影响的响应面图Fig.13 Response surface for interaction effects of K2HPO4 and Yeast extract powder on cells
3 结论
本研究首先采用单因素实验对丁酸梭菌培养基及培养条件进行了优化,确定了最佳培养基组份:可溶性淀粉2%,酵母浸粉4%,FeSO41.2%,NaCl 0.3%,K2HPO40.25%,MgSO40.024%,CaCO30.1%,在此基础上利用PB实验设计筛选出了影响丁酸梭菌生长的3个显著性因素即:酵母浸粉、FeSO4、K2HPO4,随后进行最陡爬坡实验找出CCD实验的中心点,最后利用响应面法分析确定丁酸梭菌最佳培养成份为:可溶性淀粉2%,酵母浸粉6%,FeSO41.74%,K2HPO40.34%,NaCl 0.2%,MgSO40.024%,菌体数达到1.01×109个/mL,较之初始发酵培养基提高了4.39倍,为工业上丁酸梭菌微生态制剂大规模生产提供了有价值的参考。
[1]张善亭,史燕,张淑丽,等. 丁酸梭菌的研究应用进展[J]. 生物技术通报,2013(9):27-33.
[2]于莲,马丽娜,杜妍,等. 微生态制剂研究进展[J]. 中国微生态学杂志,2012,24(1):84-86.
[3]Feiyue L I U T Z S D,Caimei C A O G C A Y. Effects of Glutamine and Clostridium butyricum on Growth Performance,Immune Function,Small Intestinal Morphology and Microflora in Weanling Piglets[J]. Chinese Journal of Animal Nutrition,2011,6:16.
[4]赵熙,冉陆,杨宝兰,等. 丁酸梭菌活菌制剂对肠道菌群影响的研究[J]. 中国微生态学杂志,1999,11(6):332-333.
[5]Ouwehand A,Isolauri E,Salminen S. The role of the intestinal microflora for the development of the immune system in early childhood[J]. European journal of nutrition,2002,41(1):i32-i37.
[6]Kanai T,Mikami Y,Hayashi A. A breakthrough in probiotics:Clostridium butyricum regulates gut homeostasis and anti-inflammatory response in inflammatory bowel disease[J]. Journal of Gastroenterology,2015,50(9):1-12.
[7]傅思武,陆俭,肖在滢,等. 酪酸梭菌-婴儿型双歧杆菌二联活菌制剂的研究[J]. 中国微生态学杂志,2000,12(1):11-14.
[8]李朝友,石微娜,黄会芝,等. 酪酸梭菌二联活菌制剂治疗儿科不同类型腹泻的疗效观察[J]. 中国微生态学杂志,2011,23(10):918-920.
[9]田口信洋. 具有预防及治疗肝脏损害功能的丁酸梭菌,以及由其培养物制成的肝保护剂、食品和饲料. 日本专利,CN1246144.2000-03-01.
[10]吕建平,徐秀丽,付孟莉. 酪酸梭菌的药理作用及临床应用[J]. 临床合理用药杂志,2010,3(20):159-160.
[11]Masahide S,Mano H,Takashi Y,et al. Clostridium butyricum MIYAIRI 588 shows antitumor effects by enhancing the release of TRAIL from neutrophils through MMP-8.[J]. International Journal of Oncology,2013,42(3):903-911.
[12]Wang H K. Determination of an economical medium for growth of Clostridium butyricum TK2 using orthogonal test[J]. African Journal of Microbiology Research,2011,5(14):1773-1777.
[13]戚薇,何玉慧,李安东,等. 酪酸梭状芽孢杆菌发酵培养基的优化[J]. 天津科技大学学报,2010,25(2):18-21.
[14]Chun-Hui Z,Yu-Jiu M,Fang-Xiao Y,et al. Optimization of medium composition for butyric acid production by Clostridium thermobutyricum using response surface methodology.[J]. Bioresource Technology,2009,100(18):4284-4288.
[15]Kong Q,Guoqing H E,Chen Q,et al. Optimization of Medium Composition for Cultivating Clostridium butyricum with Response Surface Methodology[J]. Journal of Food Science,2004,69(7):163-168.
[16]徐莹. 丁酸梭菌清液发酵工艺的研究[D]. 武汉:华中农业大学,2009.
[17]孔青,陈琳,周雯,等. 丁酸梭菌淀粉培养基的优化研究[J]. 食品工业科技,2009(12):197-199.
[18]李雯静,李则静,田中元,等. 羊源丁酸梭菌HDRyYB1发酵工艺的优化[J]. 微生物学通报,2016(3).
[19]诸葛健,王正祥.工业微生物实验手册[M].北京:中国轻工业出版社,1994;88-90.
[20]Plackett R L,Burman J P. The design of optimum multifactorial experiments[J]. Biometrika,1946:305-325.
[21]Ahuja S K,Ferreira G M,Moreira A R. Application of Plackett-Burman design and response surface methodology to achieve exponential growth for aggregated shipworm bacterium[J]. Biotechnology & Bioengineering,2004,85(6):666-675.
Optimization of fermentation process forClostridiumbutyricumusing response surface methodology
XING Hong-guan,LIN Jian-guo,ZHONG Xue-zhao,WANG Chang-gao,DU Xin,CAI Jun*
(Key Laboratory of Fermentation Engineering(Ministry of Education),Hubei Provincial Cooperative Innovation Center of Industrial Fermentation,Hubei University of Technology,Wuhan 430068,China)
Responsesurfacemethodology(RSM)wasemployedtooptimizefermentationprocessforimprovingthebiomassofClostridium butyricumm.Onthebasisofsinglefactorexperiment,factorswhichinfluencedthebiomassofClostridium butyricummsignificantlywerescreenedbyPlackett-Burmandesign.Onthisbasis,thesteepestascentexperimentwasappliedtofindoutthecenterpointofcentralcompositedesignandtheminimumamountexperimentwasusedtoreducethecostofnon-significantfactors.Finally,themaximumresponsevaluewasidentifiedbyCCD.Theresultsshowedthat:Yeastextractpowder,FeSO4andK2HPO4werethethreefactorsinfluencingthebiomassofC. Butyricummsignificantly,solublestarch2%,yeastextractpowder6%,FeSO41.74%,K2HPO40.37%,NaCl0.2%andMgSO40.024%werethebestcombinationofmediumcomponent,thebiomassofClostridium butyricumreached1.01×109cells/mLwhichwas4.39timesthatofthebiomassbeforeoptimization.
Clostridium butyricumm;biomass;RSM;fermentationprocess
2016-03-14
邢宏观(1989-),男,硕士,研究方向:发酵过程优化与放大,E-mail:759211628@qq.com。
*通讯作者:蔡俊(1968-),男,博士,教授,研究方向:发酵过程优化与放大,E-mail:hgcaijun@126.com。
TS201.3
B
1002-0306(2016)19-0237-07
10.13386/j.issn1002-0306.2016.19.038

