傅里叶变换衰减全反射红外光谱技术对稻谷中常见有害霉菌的快速鉴别
刘凌平,和肖营,都立辉,沈 飞,袁 建,鞠兴荣
(南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,江苏南京 210046)
傅里叶变换衰减全反射红外光谱技术对稻谷中常见有害霉菌的快速鉴别
刘凌平,和肖营,都立辉*,沈 飞,袁 建,鞠兴荣
(南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,江苏南京 210046)
本研究利用傅里叶变换衰减全反射红外光谱技术(ATR-FTIR)结合化学计量学方法,对稻谷中7种常见有害霉菌(尖孢镰刀菌Pr、尖孢镰刀菌Po、尖孢镰刀菌M23、黄灰青霉Pe、扩展青霉3.7898、灰绿曲霉3.3975和亮白曲霉)进行了快速鉴定。结果显示,运用主成分分析法(PCA)能够有效区分七种不同类别的菌株样品。建立的线性判别分析(LDA)和偏最小二乘判别分析(PLS-DA)模型,对7种不同类别菌株的留一交互验证整体正确率分别达到87.1%和87.3%。说明运用ATR-FTIR技术对稻谷侵染霉菌的种类实现快速鉴别具有一定可行性。
ATR-FTIR,稻谷,霉菌,快速鉴别
Nanjing University of Finance and Economics,Nanjing 210023,China)
粮食在高温高湿条件下极易发霉变质,不仅造成经济损失,且多数产毒霉菌的次级代谢产物严重威胁人畜健康[1]。目前,粮食中霉菌种类的检测方法主要包括:平板菌落计数法[2]、高效液相色谱法[3-4,10]、气相色谱与质谱联用法[5-6]、PCR和免疫法[7-9]等,然而,上述方法存在操作繁琐、灵敏性低,或成本高、耗时长等不足之处,难以实时监测霉菌的生长状况。因此,急需发展一种能够快速识别粮食中产毒霉菌的检测方法。
傅里叶变换衰减全反射红外光谱(ATR-FTIR)法具有制样简单、无损和检测灵敏度高等特点[11-12],是一种有效的微生物识别及鉴定手段[13]。Naumann等[14]研究表明,傅里叶变换红外光谱(FTIR)技术可用于微生物的区分、归类和识别。目前,基于FTIR技术用于微生物特性的研究备受研究者青睐。柴阿丽等[13]运用ATR-FTIR技术结合聚类分析法对来自14个属的17株真菌进行鉴别,达到理想效果。Volha Shapaval等[15]运用FTIR法分析5种菌属的11种真菌,结果表明,曲霉、毛霉、拟青霉可依据脂肪酸、脂质和碳水化合物的变化将其区分开来,且基于脂蛋白的差异可以区分交链孢霉和茎点霉。A.Lecellier等[16]通过由486种真菌的红外光谱信息构成的数据库进行匹配,达到快速鉴别霉菌的目的。然而,目前多数研究仅限于霉菌种类的区分,缺乏对粮食中霉菌的鉴别分析。
综上,本研究将采用ATR-FTIR法对稻谷中七种常见有害霉菌进行检测,结合主成分分析(PCA)、线性判别分析(LDA)和偏最小二乘判别分析(PLS-DA)建立7种霉菌的快速判别模型[17],为ATR-FTIR法实现谷物中霉菌的快速检测及早期预警提供理论参考。
1 材料与方法
1.1 材料与仪器
七种稻谷中常见有害霉菌 灰绿曲霉3.3975、亮白曲霉、黄灰青霉菌Pe、扩展青霉3.7898、尖孢镰刀菌Po、尖孢镰刀菌Pr、尖孢镰刀菌M23,七种霉菌均为稻谷中分出并经过基因鉴定;马铃薯葡萄糖琼脂培养基(PDA) 北京陆桥技术有限责任公司;甘油 北京索莱宝科技有限公司。
傅立叶变换红外光谱仪 德国布鲁克公司;血球计数板 上海求精生化试剂仪器有限公司;EX30生物显微镜 宁波舜宇仪器有限公司;载玻片 盐城市飞舟玻塑有限公司;单人双面超净工作台 上海三发科学仪器有限公司;冰箱 青岛海尔股份有限公司;WH-2微型旋涡混合仪 上海沪西分析仪器厂有限公司;隔水式恒温培养箱 南京晓晓仪器设备有限公司。
1.2 实验方法
1.2.1 霉菌的培养 采用马铃薯葡萄糖琼脂培养基培养。500 mL三角瓶装入400 mL马铃薯葡萄糖琼脂培养基,经121 ℃灭菌20 min后,待培养基冷却到55 ℃左右时,将培养基倒入到灭菌过的一次性的培养皿中,待培养皿中的培养基凝固后,将七种霉菌分别接种到培养基上,在培养箱中培养,培养温度为28 ℃。
1.2.2 孢子悬浮液的收获与处理 将培养5 d后的霉菌取出,取4 mL灭菌的甘油-水(%v/v,1∶10)溶液于培养基表面,轻微震荡后,移取培养基表面的孢子悬浮液于EP管中,置于-20 ℃保藏备用。
1.2.3 霉菌孢子的计数 将孢子悬浮液置于微型旋涡混合仪上震荡10 s,取50 μL孢子悬浮液于血球计数板上,在EX 30生物显微镜下观察并计数,为验证ATR-FTIR对霉菌光谱的特异性以及不同孢子悬浮液浓度的影响,分别对以上样品稀释10倍和20倍,共计得到62份样品,进行检测分析。
1.2.4 ATR-FTIR光谱采集 利用德国布鲁克公司的FTIR仪,结合ATR附件(Pike公司,美国)采集不同浓度的7种霉菌孢子悬浮液的光谱信息。先扫描背景(空气),然后,移取4 μL的样品于ZnSe晶体上进行检测,扫描32次,分辨率为4 cm-1,测量范围4000~800 cm-1,每个样品检测3次,取平均光谱建模。不同样品间需用无水乙醇擦拭平台以避免交叉污染。
1.3 数据分析方法
采用SPSS 16.0软件,TQ analyst 6.0和Matlab 7.0 软件对样品光谱数据进行分析。运用主成分分析法(PCA)对样品聚类趋势进行分析,线性判别分析(LDA)和偏最小二乘判别分析(PLS-DA),并运用留一交互验证法对模型性能进行验证。
2 结果与讨论
2.1 霉菌孢子计数结果
显微镜计数结果显示,七种霉菌悬浮液样品的浓度分别为:扩展青霉3.7898:5.5×106个/mL,黄灰青霉Pe:5.4×106个/mL,尖孢镰刀菌Pr:1.9×107个/mL,尖孢镰刀菌Po:1.425×107个/mL,尖孢镰刀菌M23:6.9375×106个/mL,灰绿曲霉3.4.5×106个/mL,亮白曲霉:1.02×107个/mL,七种霉菌孢子悬浮液的孢子数均在一个数量级或在相近的数量级,即它们的孢子浓度相近。
2.2 ATR-FTIR光谱图
图1为7种霉菌孢子悬浮液在4000~800 cm-1的红外光谱图。由于7种霉菌孢子悬浮液的化学成分相似,导致样品红外光谱图的整体趋势及出峰位置一致,难以直观判别不同样品。对光谱图分析可知,在3700~2996 cm-1处与O-H、N-H伸缩振动有关的吸收[18],1800~1450 cm-1处关于蛋白质酰胺Ⅰ带和酰胺Ⅱ带的吸收[19],1185~900 cm-1处为C-O-C和C-O-P的伸缩振动带[20-21]。仔细观察可知,不同霉菌样品的光谱曲线在1000~900 cm-1区域存在明显差异,表明其内部成分存在细微差异。鉴于不同霉菌样品悬浮液的红外光谱图无明显差异,下一步需对光谱信息进一步分析。
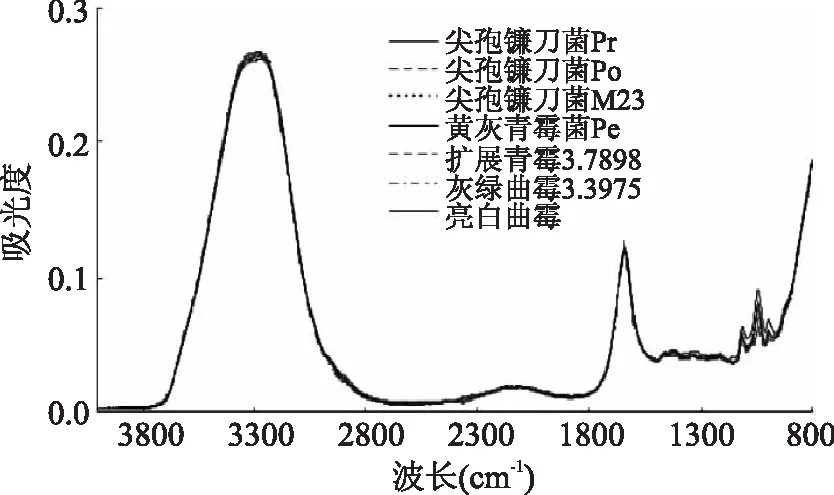
图1 7种霉菌孢子悬浮液样品的ATR-FTIR光谱图Fig.1 ATR-FTIR spectra of spore suspensions from seven kinds of fungal strains
2.3 PCA结果
图2为7种不同浓度的霉菌孢子悬浮液光谱信息的主成分得分图。由图2可知,从菌属来看,尖孢镰刀菌属、青霉属和曲霉属3种菌属样品有大致分离趋势,说明三种菌属样品之间的差异较为明显,曲霉类样品可完全区分于其他2类。除了个别来自青霉菌属的样品与其他类别混在一起之外,大部分样品能够被很好的区分。进一步观察7类霉菌样品的聚类趋势可知,除了3种尖孢镰刀菌样品及黄灰青霉Pe样品间存在部分重叠之外,其余3种霉菌可区分良好。结果表明,不同霉菌样品悬浮液的红外光谱吸收强度存在区别,PCA可以提取不同样品间的差异信息,采用ATR-FTIR法识别稻谷中的不同霉菌具有可行性。下一步将利用从光谱中提取的前10个主成分建立不同菌属的判别分析模型。
表1 7种霉菌孢子悬浮液样品的LDA模型留一交互验证结果
Table 1 Discrimination results of cross-validation LDA of spore suspensions from seven kinds of fungal strains

类别预测类别尖孢镰刀菌Pr尖孢镰刀菌Po尖孢镰刀菌M23黄灰青霉Pe扩展青霉37898灰绿曲霉33975亮白曲霉正确率(%)尖孢镰刀菌Pr100000001000尖孢镰刀菌Po2800000800尖孢镰刀菌M233060000667黄灰青霉Pe00090001000扩展青霉378980001500833灰绿曲霉339750000081889亮白曲霉0000018889总计871
表2 7类霉菌样品的留一交互验证PLS-DA模型判别结果
Table 2 Discrimination results of cross-validation PLS-DA of seven fungal species

项目尖孢镰刀菌Pr尖孢镰刀菌Po尖孢镰刀菌M23黄灰青霉Pe扩展青霉37898灰绿曲霉33975亮白曲霉样品量(个)101099699正确率(%)991894792888796955796敏感性(%)100827904887981982925特异性(%)981788885887925911925

图2 7种霉菌孢子悬浮液样品的PCA得分图Fig.2 PCA scores plot of spore suspensions from seven kinds of fungal strains
2.4 LDA结果
7种霉菌孢子红外光谱信息的LDA函数得分图如图3所示。结果显示,不同类别霉菌样品在水平方向的位置相距较远,差异明显,除青霉菌属间和曲霉菌属间出现部分重叠外,其余样品均能被完全区分,其结果优于PCA。留一交互验证结果如表1所示,整体判别正确率为87.1%,其中仅尖孢镰刀菌M23的判别正确率偏低,3个样误判为尖孢镰刀菌Pr,其余结果均大于或等于80%。尖孢镰刀菌Pr和黄灰青霉Pe的判别正确率最高,均为100%。另外,仔细观察发现,误判均发生在不同菌属内,3类菌属间的判别正确率同为100%。

图3 7种霉菌孢子悬浮液样品红外光谱信息的LDA得分图Fig.3 LDA score map of the infrared spectra of spore suspensions from seven kinds of fungal strains
2.5 PLS-DA结果
为比较不同化学计量学方法对模型精度的影响,进一步运用主成分得分建立PLS-DA判别分析模型[22],结果如表2所示。结果显示,模型对尖孢镰刀菌Pr和灰绿曲霉3.3975类样品的判别精度最佳,对尖孢镰刀菌M23、扩展青霉3.7898和亮白曲霉的精度稍差。7类样品的判别正确率为79.2%~99.1%之间,整体平均判别正确率为87.3%,与LDA方法所得整体判别正确率值类似。表明ATR-FTIR技术,结合化学计量学方法,在霉菌菌属鉴别上取得了良好的效果。进一步的研究,应该扩大样本量,运用多种特征提取方法,以进一步提高模型的精度、适用性和稳健性。
3 结论
本文利用ATR-FTIR技术对稻谷中7种常见有害霉菌进行了快速检测分析。PCA结果显示不同类别的霉菌样品可被良好区分,且样品孢子悬浮液浓度对结果影响不明显,建立的LDA和PLS-DA模型对7种霉菌的留一交互验证结果的整体判别正确率分别为87.1%和87.3%,且尖孢镰刀菌属、青霉菌属和曲霉菌属间的判别正确率高达100%。结果表明,ATR-FTIR技术可用于谷物中霉菌不同属间的快速鉴别,尤其对不同菌属的霉菌具有良好的判别效果。
[1]周玉庭,任佳丽,张紫莺.粮食中霉菌污染检测方法现状及发展趋势[J].食品安全质量检测学报,2016,7(1):244-250.
[2]张燕燕,蔡静平,蒋澎.储粮微生物危害检测技术研究进展[J].食品与机械,2013,29(6):267-270.
[3]彭志兵,章烜,蒋建云.液液萃取-高效液相色谱法测定粮食中黄曲霉毒素的研究[J].粮食科技与经济,2013,38(1):26-29.
[4]C Soderstrom,H Boren,C Krantz-Rulcker. Use of an electronic tongue and HPLC with electrochemical detection to differentiate molds in culture media[J]. International Journal of Food Microbiology,2005,97:247-257.
[5]Norbert Stoppacher,Bernhard Kluger,Susanne Zeilinger,et al. Identification and profiling of volatile metabolites of the biocontrol fungus Trichoderma atroviride by HS-SPME-GC-MS[J]. Journal of Microbiological Methods,2010,81:187-193.
[6]J Olsson,T Borjesson,T Lundstedt,et al. Detection and quantification of ochratoxin A and deoxynivalenol in barley grains by GC-MS and electronic nose[J]. International Journal of Food Microbiology,2002,72:202-214.
[7]遇晓杰.食品中5种致病菌多重PCR快速检测技术的建立与应用[J].中国食品卫生杂志,2009,21(5):398-401.
[8]张臻,陆利霞,熊晓辉. 食品中霉菌毒素检测技术研究新进展[J].安徽农业科学,2012,40(6):3597-3599.
[9]窦玉平. 薄层层析法测定粮食中的黄曲霉毒素B1[J]. 吉林农业,2011,(1):23.
[10]孙娟,李为喜,张妍,等.用超高效液相色谱串联质谱法同时测定谷物中12种真菌毒素[J]. 作物学报,2014,40(4):691-701.
[11]黄红英,尹齐和.傅里叶变换衰减全反射红外光谱法
(ATR-FTIR)的原理与应用进展[J].中山大学研究生学报,2011,32(1):20-31.
[12]王若男,岳田利,袁亚宏,等.基于傅里叶变换近红外光谱的脂环酸芽孢杆菌种间分类鉴定[J].光谱学与光谱分析,2015,35(11):3073-3077.
[13]柴阿丽,李金萍,石延霞,等.基于傅里叶变换红外光谱和聚类分析的真菌鉴别[J].光谱学与光谱分析,2010,30(1):2941-2944.
[14]L.Mariey,J P.Signolle,C Amiel,et al. Discrimination,classification,identification of microorganisms using FTIR spectroscopy and chemometrics[J]. Vibrational Spectroscopy,2001,26:151-159.
[15]Volha Shapaval,Trond Moretro,Henri-Pierre Suso,et al. A high-throughput microcultivation protocol for FTIR spectroscopic characterization and identification of fungi[J].Journal of Biophotonics,2010,3(8-9):512-521.
[16]A Lecellier,V Gaydou,J Mounier,et al. Implementation of an FTIR spectral library of 486 filamentous fungi strains for rapid identification of molds[J].Food Microbilogy,2015,45:126-134.
[17]A Salman,I Lapidot,A Pomerantz,et al. Detection of Fusarium oxysporum Fungal Isolates Using ATR Spectroscopy[J]. Spectroscopy,2012,27:551-556.
[18]Hande Kaya-Celiker,P Kumar Mallikarjunan,David Schmale III,et al. Discrimination of moldy peanuts with reference to aflatoxin using FTIR-ATR system[J].Food Control,2014,44:64-71.
[19]Vitaly Erukhimovitch,Valentina Pavlov,Marina Talyshinsky,et al. FTIR microscopy as a method for identification of bacterial and fungal infections[J]. Journal of Pharmaceutical and Biomedical Analysis,2005,37:1105-1108.
[20]聂明,罗江兰,包衎,等.镰刀菌的傅里叶变换红外光谱鉴别[J].光谱学与光谱分析,2007,27(8):1519-1522.
[21]A Salman,L Tsror,A Pomerantz,et al. FTIR spectroscopy for detection and identification of fungal phytopathogenes[J]. Spectroscopy,2010,27(3-4):261-267.
[22]A Lecellier,J Mounier,V Gaydou,et al. Differentiation and identification of filamentous fungi by high-throughput FTIR spectroscopic analysis of mycelia[J]. International Journal of Food Microbiology,2014,168-169:32-41.
Application of attenuated total reflection-fourier transform infrared spectroscopy for rapid identification of fungi strains on grain
LIU Ling-ping,HE Xiao-ying,DU Li-hui*,SHEN Fei,YUAN Jian,JU Xing-rong
(College of Food Science and Engineering/Collaborative Innovation Center for Modern Grain Circulation and Safety/Key Laboratory of Grains and Oils Quality Control and Processing,
Attenuatedtotalreflection-Fouriertransforminfraredspectroscopy(ATR-FTIR)wasusedincombinationwithchemomoetricsinthisstudyforrapididentificationofsevenstrainsoffungithatusuallycauseseriouslyeconomicdamagetopaddyrice(Fusarium oxysporumPr,Fusarium oxysporumPo,Fusarium oxysporumM23,Penicillium aurantiogriseumPe,Penicillim expansum 3.7898,Aspergillus glaucus 3.3975andAspergillus candidus).Theresultsindicatedthat,principalcomponentanalysis(PCA)couldeffectivelydistinguishthesevenfungistrains.Theoverallcorrectclassificationinleaves-one-outcross-validationfordifferentkindsofstrainsobtainedbylineardiscriminantanalysis(LDA)andpartialleast-squaresdiscriminantanalysis(PLS-DA)modelwas87.1%and87.3%,respectively.TheresultsverifiedthattheuseofATR-FTIRtechnologymightbefeasibleforrapididentificationofthespeciesoffungicontaminationonpaddyrice.
ATR-FTIR;grain;fungi;strains;rapididentification
2016-03-21
刘凌平(1989-),女,硕士研究生,研究方向:粮食储藏过程中的霉菌预警及其控制,E-mail:1091624063@qq.com。
*通讯作者:都立辉(1981-),男,博士生,副教授,研究方向:粮食储藏过程中的霉菌预警及其控制,E-mail:ddabc_2000@163.com。
粮食公益性行业科研专项经费资助(201313002-01)以及江苏高校优势学科建设工程资助项目(PAPD)。
TS207.3
A
1002-0306(2016)19-0298-04
10.13386/j.issn1002-0306.2016.19.049

