萝卜硫素制备及纯化工艺研究进展
吴元锋,徐维亮,申雨珂,肖功年,毛建卫,*,黄 俊,尤玉如
(1.浙江科技学院生化学院/轻工学院,浙江杭州 310023; 2.浙江省农产品化学与生物加工技术重点实验室,浙江杭州 310023; 3.浙江省农业生物资源生化制造协同创新中心(2011协同创新中心),浙江杭州 310023)
萝卜硫素制备及纯化工艺研究进展
吴元锋1,2,3,徐维亮1,2,3,申雨珂1,2,3,肖功年1,2,3,毛建卫1,2,3,*,黄 俊1,2,3,尤玉如1,2,3
(1.浙江科技学院生化学院/轻工学院,浙江杭州 310023; 2.浙江省农产品化学与生物加工技术重点实验室,浙江杭州 310023; 3.浙江省农业生物资源生化制造协同创新中心(2011协同创新中心),浙江杭州 310023)
本论文主要对萝卜硫素的制备和纯化方法等方面进行了综述。主要采用的萝卜硫素制备方法有化学合成法、酶法、半合成法等,纯化方法主要有大孔树脂吸附法、硅胶柱色谱法、制备液相色谱法和高速逆流色谱法等。最后,论文对萝卜硫素制备及纯化等方面的研究前景做了探讨。
萝卜硫素,制备,纯化,进展
萝卜硫素(sulforaphane,1-异硫氰酸酯(4R)-(甲基亚磺酰基)丁烷)又称莱菔硫烷,是西兰花等芸薹属植物中的萝卜硫苷(4-甲基亚磺酰基丁烯基硫代葡萄糖苷,Glucoraphanin)经黑芥子酶水解产生的异硫氰酸酯类化合物[1]。大量的研究表明萝卜硫苷没有生物活性[2],然而水解生成的萝卜硫素却具有多种生理活性,如抑制癌细胞增殖、诱导细胞周期阻滞和凋亡、抑制肿瘤转移、抗氧化、免疫调节、抗炎等[3-4]。萝卜硫素具有这些生理活性是因为其具有抑制阶段I药物代谢酶、激活阶段Ⅱ药物代谢酶、诱导NF-E2相关因子(Nrf2)、抑制核转录因子κB(NFκB)、抑制组蛋白去乙酰化酶等多种活性[5-7]。作者团队的研究结果表明,萝卜硫素抑制了小鼠B16黑色素瘤细胞的组蛋白去乙酰化酶活性,使Bax和p21表达上调,从而诱导B16细胞凋亡和周期阻滞[8]。因此萝卜硫素是一种很有潜力的生物活性物质,已经成为当前研究的热点之一。本论文对萝卜硫素的制备及纯化方法等方面的研究进展做一综述,并对这些方面的研究前景做了展望。
1 萝卜硫素的制备方法
萝卜硫素的制备方法有化学合成法、酶法、半合成法等。
1.1 化学合成法

图1 萝卜硫素的化学合成路线Fig.1 Synthesis of sulforaphane
一种萝卜硫素化学合成法是以邻苯二甲酰亚胺钾盐为原料,与1,4-二溴丁烷反应生成N-烷基邻苯二甲酰亚胺,通过肼解反应得到烷基胺,再与硫光气反应生成萝卜硫素,总收率约为16%[9]。最近Vo等[10]提出了一种新的方法,即以四氢噻吩、甲基碘与NaBF4为原料合成S-甲基四氢噻吩鎓四氟硼酸盐,后者与NaN3在60 ℃下反应16 h得到1-叠氮-(4-甲基磺酰基)丁烷,再通过施陶丁格反应生成erucin,随后erucin被H2O2氧化得到萝卜硫素,整个反应仅需4步,收率达到41%,且产物无需通过色谱法纯化(图1)。Whitesell等人[11]则提出了一种手性合成方法,以手性辅助剂反式-2-苯基环己醇为原料,经过多步反应得到R-萝卜硫素。化学合成法反应过程容易控制,易大量生产,但是一般使用有毒试剂为原料,易造成环境污染,且合成产物是外消旋体,而手性合成方法则步骤多,工艺复杂,收率低。

图2 萝卜硫苷的酶促水解途径Fig.2 Enzymatic hydrolysis of glucoraphanin
1.2 酶法
酶法是以西兰花、甘蓝等芸薹属植物为原料提取萝卜硫苷,再经内源性黑芥子酶水解生成萝卜硫素。西兰花、甘蓝的苗、花、茎、种子都含有萝卜硫苷,含量最高的是西兰花种子或8~10 d的西兰花苗,因此,萝卜硫苷或萝卜硫素的制备一般都以西兰花种子或苗为原料[12-14]。值得注意的是,萝卜水解液不含萝卜硫素,而是Glucoraphenin(1-异硫氰酸酯(4R)-(甲基亚磺酰基)-3-丁烯)[15]。
以种子为原料的制备过程一般包括脱脂、酶解、提取三步。由于西兰花种子含有大量的油脂,因此在酶解之前,首先要用石油醚、正己烷等有机溶剂对种子进行脱脂处理[16]。以苗或蔬菜为原料提取时,则只需酶解、提取两步。酶解步骤中,萝卜硫苷经黑芥子酶水解得到萝卜硫素。考虑到成本、得率等因素,一般采用内源性黑芥子酶[16],但是当内源酶活力较低或失活时,可通过添加外源黑芥子酶提高萝卜硫素得率[17]。萝卜硫苷经黑芥子酶水解后,首先生成不稳定的中间体(thiohydroxamate-O-sulfonate),然后经洛森型重排(Lossen-type rearrangement)生成萝卜硫素、萝卜硫腈以及硫氰酸酯等,其中萝卜硫素是主要的转化产物。但在酶解体系pH较低、酶解体系中存在Fe2+或上皮硫特异蛋白(Epithiospecifier protein,ESP)等情况下,萝卜硫腈的产量会显著提高(图2),生成萝卜硫腈的量与ESP活性呈正比例关系[18-19]。通过抑制ESP活性则可提高萝卜硫素得率,如Matusheski等[20]发现降低西兰花中ESP活性可增加萝卜硫素得率,即西兰花在60 ℃条件下加热5 min后,萝卜硫素的得率增加,而萝卜硫腈的得率则降低,这是由于ESP的热稳定性比黑芥子酶要差,受热易失活,从而可以增加萝卜硫素的得率,并且减少萝卜硫腈的产生。
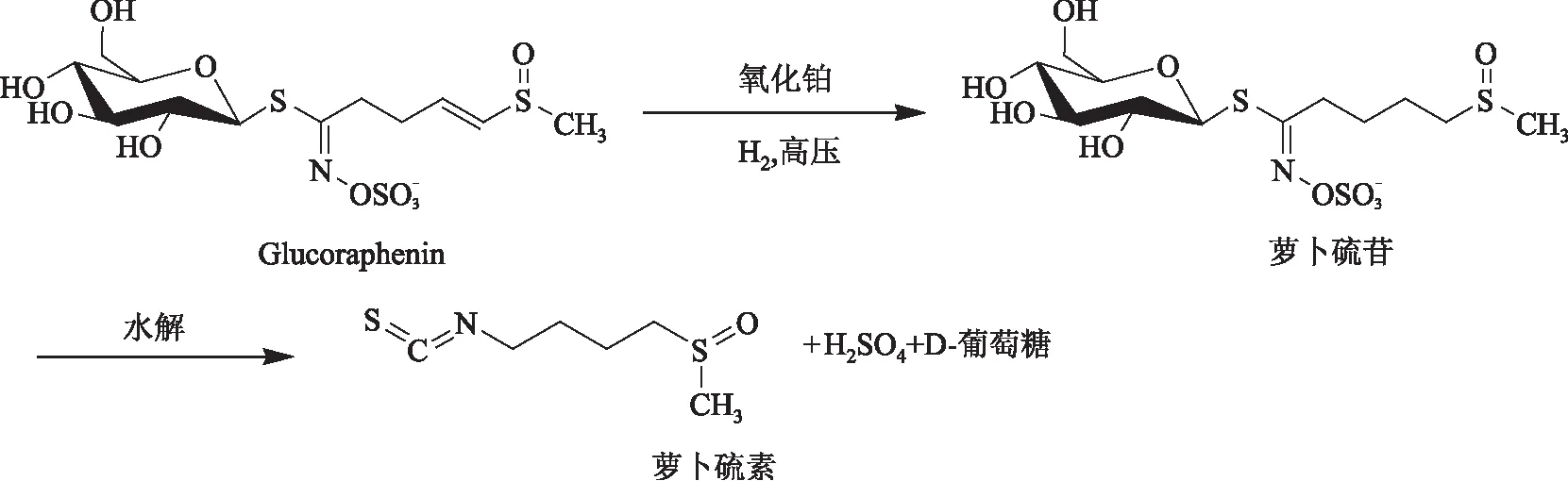
图3 催化加氢法制备萝卜硫素的工艺路线Fig.3 Preparation of sulforaphane by catalytic hydrogenation
萝卜硫苷酶解后,一般用水、丙酮、乙酸乙酯、二氯甲烷[21-22]等提取萝卜硫素。萝卜硫素易溶于水,但是用水提取时,会把蛋白质、多糖等其它成分也提取出来。萝卜硫素也易溶于二氯甲烷和乙酸乙酯,考虑到二氯甲烷具有毒性,乙酸乙酯是比较理想的提取溶剂。
由于萝卜硫苷酶解过程复杂,影响因素很多,因此萝卜硫素的酶解及提取工艺优化也是一个重要的研究内容。在对酶解-提取条件优化的报道中,所采用的优化手段多是在单因素基础上采用正交或者响应面实验考察固液比、水解pH等的交互作用[23-26]。这些研究报道的工艺参数相差都很大,反映了萝卜硫素的酶解-提取是一个复杂的过程,影响因素非常多。作者课题组分析了各种芸薹属植物种子中异硫氰酸酯的种类和含量,其中西兰花种子中萝卜硫素含量最高[27];以西兰花种子为原料,通过单因素实验,得到萝卜硫素的提取工艺条件,发现酶解-提取同步进行时,具有更高的提取效率[22];进一步通过响应面法对萝卜硫素的酶解、提取工艺进行了优化,根据Plackett-Burman设计,从11个变量中筛选出提取得率影响最大的3个因素为提取料液比、水解时间和水解料液比;在此基础上,用最陡爬坡路径逼近最大产萝卜硫素区域,最后通过中心组合实验及响应面分析得出优化工艺为:水解时间13 min,水解料液比2.9∶1 (mL/g),萃取料液比17.5∶1 (mL/g),在此条件下,萝卜硫素的得率最高,达14.8 mg/g[28]。
近年来,超声和微波辅助萃取法在植物活性成分的提取中得到了广泛的应用。与传统的溶剂萃取法相比,超声辅助萃取法溶剂用量较少,萃取时间较短,而微波具有穿透力强、选择性高、加热效率高等特点。Tanongkankit等[29]以甘蓝为原料,研究了不同溶剂、微波功率、萃取时间对萝卜硫素得率的影响,优化了提取工艺。他们还比较了溶剂萃取法和微波辅助萃取法对萝卜硫素得率的影响,表明微波辅助萃取法是一种非常有效的方法,具有得率高、萃取时间短等优点,Pongmalai等[30]的研究也表明,微波萃取萝卜硫素具有更高的能源效率。Briones-Labarca等[31]以智利木瓜(Vasconcellea pubescens)种子为原料萃取萝卜硫素,对高压萃取法、超声波辅助萃取法和传统萃取法进行了比较,结果表明高压萃取法具有最高的萃取效率,其次是超声波辅助萃取法,传统萃取法的提取率最低。唐斌等[32]的实验则表明,超声萃取法提高了提取效率。与其他生物活性物提取过程不同的是,萝卜硫素的制备包括酶解和提取过程,在使用辅助萃取时,需要注意的是在酶解阶段,超声或微波处理会影响酶的效率,因此辅助萃取仅用于提取阶段,而且在超声或微波辅助萃取时产生的高温及自由基等对萝卜硫素的影响也是一个值得注意的问题。
1.3 半合成法
半合成法是以萝卜硫苷的结构类似物,如glucoraphenin、glucoerucin等为原料,通过生物或化学转化法得到萝卜硫苷,再水解得到萝卜硫素。萝卜种子中富含的glucoraphenin比萝卜硫苷多一个双键,因此以glucoraphenin为原料,在高温高压下,以氧化铂、碳钯等为催化剂进行催化加氢得到萝卜硫苷,再水解得到萝卜硫素,工艺路线如图3所示[33-34]。但是该方法的转化率较低。
上述催化加氢步骤也可以通过微生物来完成。袁其朋等[35]以glucoraphenin为底物,利用白地霉、白僵霉、黑曲霉等微生物进行还原反应,得到萝卜硫苷,最高转化率可达91.9%。
Iori等[36]设计了以glucoerucin为原料制备萝卜硫素的工艺路线,即以glucoerucin为原料,通过双氧水氧化得到萝卜硫苷,再经水解生成萝卜硫素,如图4所示。
半合成法的优点是原料便宜,萝卜种子富含glucoraphenin,芝麻菜种子则富含glucoerucin,这些种子都比较廉价易得。因此,如能提高转化效率,该方法有望具有较好的应用前景。但该方法的缺点是在提取硫代葡萄糖苷前要经过灭酶处理,生成的萝卜硫苷还需要加入外源硫代葡萄糖苷酶水解得到萝卜硫素。
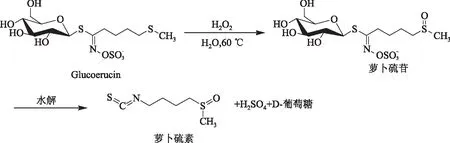
图4 氧化法制备萝卜硫素的工艺路线Fig.4 Preparation of sulforaphane by oxidation
2 萝卜硫素的纯化
萝卜硫素纯化方法有大孔树脂吸附法、硅胶柱色谱法、反向高效制备液相色谱法和高速逆流色谱法等。
萝卜硫素在大孔树脂上具有良好的吸附性能,因此大孔树脂吸附法是较理想的萝卜硫素纯化方法。Li[37]和刘锡建[38-39]等都报道了大孔吸附树脂法纯化萝卜硫素,通过SP850树脂吸附,乙醇溶液洗脱,可得到纯度为85%以上的萝卜硫素。作者团队[40]通过吸附平衡实验、吸附热力学及吸附动力学方法,研究了水相中SP850大孔吸附树脂对萝卜硫素的吸附性能,吸附平衡实验表明,Langmuir和Freundlic方程都较好地描述了SP850树脂吸附萝卜硫素的平衡机制;计算了萝卜硫素吸附热力学函数,ΔG<0,ΔS<0,ΔH<0,表明SP850吸附萝卜硫素是一个放热过程,随着温度升高,ΔG不断增加,表明在研究温度范围内降低温度有利于萝卜硫素吸附;吸附动力学实验表明,吸附过程可以用拟二阶模型拟合;颗粒内扩散模型分析表明,SP850吸附萝卜硫素过程受内扩散控制,萝卜硫素在SP850上吸附平衡时间小于30 min,液膜扩散是吸附初期的主要速率控制步骤。
表1 萝卜硫素纯化方法的比较
Table 1 Comparison of different purification methods of sulforaphane
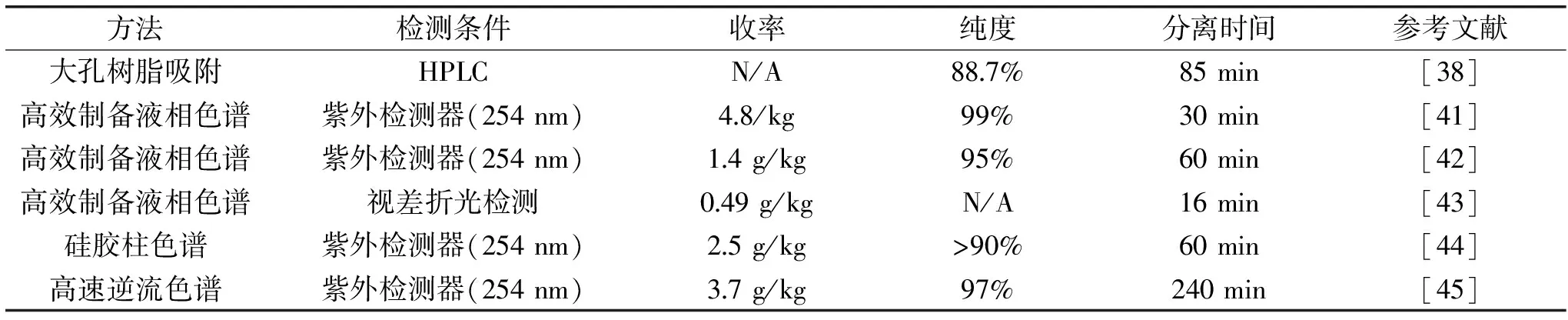
方法检测条件收率纯度分离时间参考文献大孔树脂吸附HPLCN/A887%85min[38]高效制备液相色谱紫外检测器(254nm)48/kg99%30min[41]高效制备液相色谱紫外检测器(254nm)14g/kg95%60min[42]高效制备液相色谱视差折光检测049g/kgN/A16min[43]硅胶柱色谱紫外检测器(254nm)25g/kg>90%60min[44]高速逆流色谱紫外检测器(254nm)37g/kg97%240min[45]
注:N/A:未显示。
在柱色谱法中,反向高效制备液相色谱法可以得到较高纯度的萝卜硫素。西兰花种子脱脂、酶解、提取后,可以通过反相制备色谱柱分离纯化萝卜硫素,流动相有乙腈/水[41]、甲醇/水[42]或丙酮/水[43]等。正向硅胶柱色谱法也可以用于纯化萝卜硫素,Liang等[44]以硅胶为固定相,三氯甲烷/甲醇(95∶5)为流动相,可得到90%以上纯度的萝卜硫素,Liang等认为该方法具有操作压力低,成本相对较低等优点。
另外,Liang等[45]还报道了用高速逆流色谱法(HSCCC)分离纯化萝卜硫素,通过正己烷/乙酸乙酯/甲醇/水(1∶5∶1∶5,v/v/v/v)的体系,得到纯度为97%的萝卜硫素。作者团队[46]以西兰花种子水解液为原料,通过HSCCC法分离纯化萝卜硫素,得出与Liang等相似的结论,得到色谱图如图5所示,其中第3个峰是萝卜硫素,纯度为89%。

图5 西兰花种子提取物的高速逆流色谱图Fig.5 HSCCC chromatogram of the crude extract of broccoli seed meal
在上述方法中,大孔树脂吸附法成本低,处理量大,容易放大,从作者团队的吸附动力学结果可知,萝卜硫素在大孔树脂上的吸附是一个快吸附过程,因而吸附分离的时间较短,但是萝卜硫素纯度稍低。HSCCC法不耗费色谱填料,收率高,样品无需预处理,但是放大困难。反向高效制备液相色谱法的优点是萝卜硫素的纯度较高,但耗费大量溶剂,生产成本较高。因此在萝卜硫素纯度要求不高时,可通过大孔树脂吸附法制备;纯度要求较高时,可先通过大孔树脂法初步纯化,再通过反向高效制备液相色谱法制备。各种纯化工艺的方法、检测条件、收率、纯度、分离时间等见表1。
另外一种萝卜硫素纯化方法是先纯化萝卜硫苷,再酶解得到萝卜硫素。如De Nicola等[47]以150 g羽衣甘蓝种子为原料,通过离子交换树脂和凝胶排阻层析制备得到纯度为95%的萝卜硫苷,再通过两相体系酶解制备得到1.09 g萝卜硫素。由于萝卜硫苷的化学性质稳定,因此本方法收率较高,但是在预处理中先需要高温灭酶,水解过程中需要加入外源黑芥子酶,这是本方法的一个缺点。
3 总结与展望
萝卜硫素具有抑制癌细胞增殖、诱导细胞周期阻滞和凋亡、抑制肿瘤转移、抗氧化、免疫调节、抗炎等多种作用,引起了国内和国外学者对萝卜硫素的广泛关注。萝卜硫素的制备、纯化工艺已经有较多的文献报道,但仍然有许多方面值得我们进一步深入研究:
深入研究ESP活性的抑制条件。如前所述,抑制ESP活性可以显著提高萝卜硫素的得率。尽管已有文献通过加热法抑制了ESP活性,然而加热也会使黑芥子酶失去活性。课题组已有的实验数据显示,不同品种西兰花中ESP的活性和热稳定性也有一定的差异,因此有必要对这两种酶的活性、结构和稳定性之间的构效关系以及抑制条件等进行深入的研究。
廉价萝卜硫素制备和纯化工艺研究。萝卜硫素的提取通常都用乙酸乙酯、二氯甲烷等为溶剂,然而萝卜硫素也易溶于水或乙醇,因此今后的研究可以考虑以水、乙醇等为溶剂萃取萝卜硫素,从而减少生产成本及废物的排放,并通过大孔树脂吸附等方法除去多糖和蛋白质等成分。
新兴纯化工艺的应用。例如分子蒸馏法作为一种不断发展的特殊蒸馏分离技术已得到广泛应用,该技术特别适用于高沸点、热敏性及易氧化物质的分离。萝卜硫素在分离纯化中易氧化降解,且其沸点较高,若将此技术应用到萝卜硫素的分离纯化中,不仅可提高产品收率,在一定程度上还可保障产品的质量。
[1]Latté K P,Appel K E,Lampen A. Health benefits and possible risks of broccoli-an overview[J]. Food and Chemical Toxicology,2011,49(12):3287-3309.
[2]Angelino D,Jeffery E. Glucosinolate hydrolysis and bioavailability of resulting isothiocyanates:Focus on glucoraphanin[J]. Journal of Functional Foods,2014,7:67-76.
[3]Guerrero-Beltrán C E,Calderón-Oliver M,Pedraza-Chaverri J,et al. Protective effect of sulforaphane against oxidative stress:recent advances[J]. Experimental and Toxicologic Pathology,2012,64(5):503-508.
[4]任杰,蒋何菲,赵娟,等. 萝卜硫素及其衍生物BSFN通过激活PI3K/Akt途径诱导SH-SY5Y细胞凋亡[J]. 中国药学杂志,2014,20:1813-1819.
[5]Cheung K L,Kong A N. Molecular targets of dietary phenethyl isothiocyanate and sulforaphane for cancer chemoprevention[J]. AAPS J,2010,12(1):87-97.
[6]Rajendran P,Kidane A I,Yu T W,et al. HDAC turnover,CtIP acetylation and dysregulated DNA damage signaling in colon cancer cells treated with sulforaphane and related dietary isothiocyanates[J]. Epigenetics,2013,8(6):612-623.
[7]Liang H,Yuan Q. Natural sulforaphane as a functional chemopreventive agent:including a review of isolation,purification and analysis methods[J]. Critical Reviews in Biotechnology,2012,32(3):218-234.
[8]Wu Y F,Xiao G N,Mao J W,et al. Dietary sulforaphane inhibits histone deacetylase activity in B16 melanoma cells[J]. Journal of Functional Foods,2015,18:182-189.
[9]Vermeulen M,Zwanenburg B,Chittenden G J F,et al. Synthesis of isothiocyanate-derived mercapturic acids[J]. European Journal of Medicinal Chemistry,2003,38(7):729-737.
[10]Vo D V,Truong V D,Tran T D,et al. A new and effective approach to the synthesis of sulforaphane[J]. Letters in Organic Chemistry,2016,13(1):7-10.
[11]Whitesell J K,Wong M S. Asymmetric synthesis of chiral sulfinate esters and sulfoxides. Synthesis of sulforaphane[J]. The Journal of Organic Chemistry,1994,59(3):597-601.
[12]López-Cervantes J,Tirado-Noriega L G,Sánchez-Machado D I,et al. Biochemical composition of broccoli seeds and sprouts at different stages of seedling development[J]. International Journal of Food Science & Technology,2013,48(11):2267-2275.
[13]Deng Q,Zinoviadou K G,Galanakis C M,et al. The effects of conventional and non-conventional processing on glucosinolates and its derived forms,isothiocyanates:extraction,degradation,and applications[J]. Food Engineering Reviews,2015,7(3):357-381.
[14]West L G,Meyer K A,Balch B A,et al. Glucoraphanin and 4-hydroxyglucobrassicin contents in seeds of 59 cultivars of broccoli,raab,kohlrabi,radish,cauliflower,brussels sprouts,kale,and cabbage[J]. Journal of Agricultural and Food Chemistry,2004,52(4):916-926.
[15]Tian G,Tang P,Xie R,et al. The stability and degradation mechanism of sulforaphene in solvents[J]. Food Chemistry,2016,199:301-306.
[16]Vaughn S F,Berhow M A. Glucosinolate hydrolysis products from various plant sources:pH effects,isolation,and purification[J]. Industrial Crops and Products,2005,21(2):193-202.
[17]Ghawi S K,Methven L,Niranjan K. The potential to intensify sulforaphane formation in cooked broccoli(Brassica oleracea var. italica)using mustard seeds(Sinapis alba)[J]. Food Chemistry,2013,138(2):1734-1741.
[18]Guo L,Yang R,Zhou Y,et al. Heat and hypoxia stresses enhance the accumulation of aliphatic glucosinolates and sulforaphane in broccoli sprouts[J]. European Food Research and Technology,2016,242(1):107-116.
[19]Lekcharoenkul P,Tanongkankit Y,Chiewchan N,et al. Enhancement of sulforaphane content in cabbage outer leaves using hybrid drying technique and stepwise change of drying temperature[J]. Journal of Food Engineering,2014,122:56-61.
[20]Matusheski N V,Juvik J A,Jeffery E H. Heating decreases epithiospecifier protein activity and increases sulforaphane formation in broccoli[J]. Phytochemistry,2004,65(9):1273-1281.
[21]沈莲清,苏光耀,王奎武. 西兰花种子中硫苷酶解产物萝卜硫素的提纯与抗肿瘤的体外实验研究[J]. 中国食品学报,2008,8(5):15-21.
[22]吴元锋,沈莲清,毛建卫,等. 芸苔属植物种子中萝卜硫素的提取工艺研究[J]. 食品与生物技术学报,2009,28(5):647-651.
[23]吴华彰,赵云利. 西兰花种子提取萝卜硫素的酶解体系[J]. 光谱实验室,2012,29(1):431-434.
[24]胡翠珍,李胜,马绍英,等. 响应面优化西兰花中萝卜硫素复合提取工艺[J]. 食品工业科技,2016,37(4):271-277.
[25]杨海荣,马绍英,赵利敏,等. 响应面分析法优化西兰花离体细胞系萝卜硫素提取工艺[J]. 食品工业科技,2012,33(15):206-209.
[26]林毅,张金娟,李晓露,等. 西兰花种子中萝卜硫素的提取工艺研究[J]. 化学与生物工程,2014,31(12):48-50.
[27]吴元锋,毛建卫,袁海娜,等. 气质联用分析芸苔属种子水解液中的异硫氰酸盐[J]. 分析实验室,2008,27(9):53-56.
[28]Wu Y F,Mao J W,Mei L H,et al. Studies on statistical optimization of sulforaphane production from broccoli seed[J]. Electronic Journal of Biotechnology,2013,16(6):
[29]Tanongkankit Y,Sablani S S,Chiewchan N,et al. Microwave-assisted extraction of sulforaphane from white cabbages:Effects of extraction condition,solvent and sample pretreatment[J]. Journal of Food Engineering,2013,117(1):151-157.
[30]Pongmalai P,Devahastin S,Chiewchan N,et al. Enhancement of microwave-assisted extraction of bioactive compounds from cabbage outer leaves via the application of ultrasonic pretreatment[J]. Separation and Purification Technology,2015,144:37-45.
[31]Briones-Labarca V,Plaza-Morales M,Giovagnoli-Vicuna C,et al. High hydrostatic pressure and ultrasound extractions of antioxidant compounds,sulforaphane and fatty acids from Chilean papaya(Vasconcellea pubescens)seeds:Effects of extraction conditions and methods[J]. LWT-Food Science and Technology,2015,60(1):525-534.
[32]唐斌,马绍英,李胜,等. 响应面优化西兰花中萝卜硫素的超声辅助提取工艺[J]. 甘肃农业大学学报,2015,50(3):171-177.
[33]胡晔. 中药中硫代葡萄糖苷及其降解产物的分析和中药莱菔子中Glucoraphenin的提取纯化与催化加氢工艺研究[D]. 北京:北京化工大学,2009.
[34]West L G,Kim N,Haas G W,et al. Method of enriching glucoraphanin in radish seed preparations:U.S. Patent 7,371,419[P]. 2008-05-13.
[35]袁其朋,李利光,梁浩,等. 生物转化制备4-甲基亚硫酰基丁基硫代葡萄糖苷的方法:中国,ZL201010159808.6[P]. 2010-09-15.
[36]Iori R,Bernardi R,Gueyrard D,et al. Formation of glucoraphanin by chemoselective oxidation of natural glucoerucin:a chemoenzymatic route to sulforaphane[J]. Bioorganic & Medicinal Chemistry Letters,1999,9(7):1047-1048.
[37]Li C,Liang H,Yuan Q,et al. Optimization of sulforaphane separation from broccoli seeds by macroporous resins[J]. Separation Science and Technology,2008,43(3):609-623.
[38]刘锡建,肖稳发,曹俭,等. SP850树脂分离萝卜硫素[J]. 食品与发酵工业,2011,37(7):197-200.
[39]刘锡建,王明强,徐一麟,等. SP850树脂对萝卜硫素吸附特性的研究[J]. 离子交换与吸附,2013,29(6):561-568.
[40]Wu Y F,Zhang L,Mao J W,et al. Kinetic and thermodynamic studies of sulforaphane adsorption on macroporous resin[J]. Journal of Chromatography B,2016,1028:231-236.
[41]Matusheski N V,Wallig M A,Juvik J A,et al. Preparative HPLC method for the purification of sulforaphane and sulforaphane nitrile from Brassica oleracea[J]. Journal of Agricultural and Food Chemistry,2001,49(4):1867-1872.
[42]Liang H,Li C,Yuan Q,et al. Separation and purification of sulforaphane from broccoli seeds by solid phase extraction and preparative high-performance liquid chromatography[J]. Journal of Agricultural and Food Chemistry,2007,55(20):8047-8053.
[43]Kore A M,Spencer G F,Wallig M A. Purification of the omega-(methylsulfinyl)alkyl glucosinolate hydrolysis products:1-isothiocyanato-3-(methylsulfinyl)propane,1-isothiocyanato-4-(methylsulfinyl)butane,4-(methylsulfinyl)butanenitrile,and 5-(methylsulfinyl)pentanenitrile from broccoli and Lesquerella fendleri[J]. Journal of Agricultural and Food Chemistry 1993,41(1):89-95.
[44]Liang H,Yuan Q,Xiao Q. Purification of sulforaphane from Brassica oleracea seed meal using low-pressure column chromatography[J]. Journal of Chromatography B,2005,828(1):91-96.
[45]Liang H,Li C,Yuan Q,et al. Application of high-speed countercurrent chromatography for the isolation of sulforaphane from broccoli seed meal[J]. Journal of Agricultural and Food Chemistry,2008,56(17):7746-7749.
[46]Wu Y F,Mao J W,Mei L H,et al. Kinetic studies of the thermal degradation of sulforaphane and its hydroxypropyl-β-cyclodextrin inclusion complex[J]. Food Research International,2013,53:529-533.
[47]De Nicola G R,Rollin P,Mazzon E,et al. Novel gram-scale production of enantiopure R-sulforaphane from Tuscan black kale seeds[J]. Molecules,2014,19(6):6975-6986.
Preparation and purification of sulforaphane-an overview
WU Yuan-feng1,2,3,XU Wei-liang1,2,3,SHEN Yu-ke1,2,3,XIAO Gong-nian1,2,3, MAO Jian-wei1,2,3,*,HUANG Jun1,2,3,YOU Yu-ru1,2,3
(1.School of Biological and Chemical Engineering/School of Light Industry,Zhejiang University of Science and Technology,Hangzhou 310023,China; 2.Zhejiang Provincial Key Lab for Chem & Bio Processing Technology of Farm Produces,Hangzhou 310023,China; 3.Zhejiang Provincial Collaborative Innovation Center of Agricultural Biological Resources Biochemical Manufacturing,Hangzhou 310023,China)
Inthisreview,differentproductionandpurificationmethodsengagedinsulforaphaneresearchweresummarizedandcompared.Thepreparationmethodsforsulforaphaneincludechemicalsynthetic,semisyntheticandenzymaticmethods,andpurificationmethodsincludemacroporousresinadsorption,silicagelcolumnchromatography,preparativeHPLCchromatographyandhighspeedcountercurrentchromatography.Thentheprospectofsulforaphanepreparationandpurificationwerealsodiscussed.
Sulforaphane;preparation;purification;researchprogress
2016-03-21
吴元锋(1976-),男,博士,副教授,研究方向:天然活性物研究与开发,E-mail:wyfhz@126.com。
*通讯作者:毛建卫(1964-),男,硕士,教授,研究方向:农产品加工,E-mail:zjhzmjw@163.com。
浙江省自然科学基金(LY16C200005);杭州市科技计划项目(20140432B108)。
TS201.1
A
1002-0306(2016)19-0381-06
10.13386/j.issn1002-0306.2016.19.066

