Cr(Ⅵ) /亚硫酸钠体系快速氧化活性蓝4的动力学研究
范文娟,董红钰,关小红
(同济大学污染控制与资源化研究国家重点实验室,上海 200092)
· 试验研究 ·
Cr(Ⅵ) /亚硫酸钠体系快速氧化活性蓝4的动力学研究
范文娟,董红钰,关小红
(同济大学污染控制与资源化研究国家重点实验室,上海 200092)
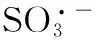
Cr(Ⅵ);亚硫酸钠;氧化还原;自由基
铬是一种多价态的过渡金属元素,其毒性与价态密切相关。六价铬(Cr(Ⅵ))的毒性高出三价铬(Cr(Ⅲ))数十倍甚至百倍,对环境有持久危险性,是美国环保局(USEPA)认定的环境优先污染物。环境中的Cr(Ⅵ)主要来源于铬矿的开采和冶炼、电镀、鞣革、颜料、油漆、合金、印染、胶版印刷等行业[1~4]。大量的Cr(Ⅵ)通过这些行业的工业废水排放或事故排放和泄露等方式进入到天然水体、土壤和地下水中,使得Cr(Ⅵ)成为最常见的环境污染物之一。鉴于Cr(Ⅵ)污染的广泛性及其危害性,我国《生活饮用水卫生标准》(GB5749-2006)、《钢铁工业水污染物排放标准》(GB13456-2012)等标准中均对总铬与Cr(Ⅵ)的最高允许排放浓度做出了规定。目前,含Cr(Ⅵ)废水的治理成为国内外重金属污染领域优先控制的项目之一[5]。因此,发展高效、经济的Cr(Ⅵ)废水处理工艺已成为研究的热点。
目前去除水中Cr(Ⅵ)的方法包括还原法、吸附法、电化学法、离子交换法、膜分离法等[5~7]。当Cr(Ⅵ)被还原成Cr(Ⅲ)后,其毒性大大降低,而且Cr(Ⅲ)比较容易形成Cr(OH)3沉淀而从水中分离出去,因此把Cr(Ⅵ)还原成Cr(Ⅲ)并沉淀是处理含Cr(Ⅵ) 废水的首选方法之一[8]。采用此法时,使用的还原剂主要为具有还原性的低价态硫和铁,常用的还原剂有亚铁、零价铁、硫化氢、硫铁矿、焦亚硫酸钠、亚硫酸氢钠、亚硫酸钠等[9-10]。但用铁类物质作为还原剂时,沉淀中氢氧化铬和氢氧化铁共存,污泥量大且难以回收铬资源[9]。 而亚硫酸钠作为一种比较典型的还原剂,被广泛应用于含Cr(Ⅵ)废水处理及Cr(Ⅵ) 污染的应急处理[10-11]。亚硫酸钠法处理含Cr(Ⅵ)废水具有反应速度快、投药量较少、污泥产生量少、操作简便、处理费用较低等优点[12]。
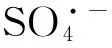
为了系统地分析Cr(Ⅵ)/亚硫酸钠体系对RB4的氧化效果,本文在不同亚硫酸钠浓度、不同pH条件下探究了该体系对RB4的降解动力学。通过对动力学数据的拟合分析,可以定量地得出该体系氧化RB4的较优条件。同时借助电子顺磁共振仪及甲醇的淬灭实验分析了体系中的中间态活性氧化剂。
1 材料与方法
1.1 材料和仪器
1.1.1 主要材料
重铬酸钾、无水亚硫酸钠、硝酸铬、磷酸氢二钾、盐酸、硫酸均为分析纯,购于国药集团上海化学试剂有限公司。无水甲醇、乙二胺四乙酸二钠、磷酸二氢钠、氢氧化钠均为分析纯,购于江苏强盛功能化学股份有限公司。活性蓝4,染料含量40%,购于百灵威科技有限公司。5,5’-二硫代双(2-硝基苯甲酸)即DTNB,分析纯,购于上海阿拉丁生化科技股份有限公司。二苯碳酰二肼为分析纯,购于上海强顺化学试剂有限公司。实验中所有溶液均用Milli-Q去离子水进行配制。
1.1.2 主要仪器
pHS-3C型pH计(上海精密科学仪器有限公司); TU-1901型紫外分光光度计(北京普析公司);停流光谱仪(英国应用光物理公司);电子顺磁共振波谱仪(德国布鲁克仪器公司)。
1.2 实验方法
1.2.1 RB4的动力学实验
RB4的动力学实验使用停留光谱仪完成。实验操作如下:配置含有一定浓度的重铬酸钾溶液以及一定浓度的亚硫酸钠和RB4的混合液,利用NaOH和HCl将两种溶液的pH调到所需要的值,然后通过自动进样的方式将两种溶液分别加入光谱仪的两个通道里,之后将双通道的两种溶液同时注入光谱仪的反应池内迅速混合,紫外检测器检测RB4在反应过程中的变化。
1.2.2 Cr(Ⅵ)和亚硫酸根的动力学实验
Cr(Ⅵ)和亚硫酸根浓度变化的实验均在广口瓶内进行:先配制250 mL含有亚硫酸钠或者亚硫酸钠和RB4的混合溶液,将上述溶液加入250 mL广口瓶中,广口瓶置于20 ℃的低温恒温水浴槽中,采用磁力搅拌,用HCl和NaOH溶液调节溶液至所需pH值,将一定浓度的Cr(Ⅵ)溶液加入广口瓶中,同时开始计时,定时取样分析Cr(Ⅵ)和亚硫酸根的浓度。实验均设有平行实验以保证数据的可靠性。
1.3 分析方法
1.3.1 RB4的测量方法
RB4在595 nm处有紫外特征吸收峰,且其它物质在此波长处没有紫外吸收,所以在595 nm处采用停留光谱仪的紫外检测器检测RB4的吸光度随时间的变化。
1.3.2 Cr(Ⅵ)的测量方法
采用《水和废水监测分析方法》[18]中二苯碳酰二肼分光光度法测定Cr(Ⅵ)。使用硫酸调节溶液酸性,二苯碳酰二肼作为显色剂,显色5~10 min,用紫外分光光度计在波长540 nm下测量。
1.3.3 亚硫酸根的测量方法
按照改进的检测亚硫酸根浓度的方法[19],使用磷酸二氢钠和磷酸氢二钾的混合溶液作为缓冲溶液,乙二胺四乙酸二钠溶液排除金属离子的干扰,采用5,5’-二硫代双(2-硝基苯甲酸)作为显色剂,显色5~10 min,用紫外分光光度计在波长412 nm下测量。
2 结果与讨论
2.1 Cr(Ⅵ)/亚硫酸钠体系对RB4的快速氧化
图1中的A、B两图表示在初始pH为4.0时不同实验条件下染料RB4的降解动力学。由图A可以看出,在Cr(Ⅵ)/亚硫酸钠体系中,随着时间的变化,RB4的浓度快速降低,并在反应时间为3.5 min时,RB4几乎全被去除。图B中单独的Cr(Ⅲ)和Cr(Ⅵ)以及Cr(Ⅲ)/亚硫酸钠体系在2h内均不能氧化RB4,而Cr(Ⅵ)和亚硫酸钠共存时可以在3.5 min内完成对RB4的降解。 因此,推测是Cr(Ⅵ)和亚硫酸钠之间相互作用,产生了高活性的中间物种,进而实现了对RB4的快速降解。

图1 不同实验条件下RB4的降解动力学
另外,考察了在RB4是否存在的条件下,体系中Cr(Ⅵ)和亚硫酸根浓度变化,其结果如图2所示。当体系中没有加入RB4时(B图),15 min时Cr(Ⅵ)剩余浓度为20.94 μmol/L,对应的亚硫酸根的消耗量为926 μmol/L,消耗的亚硫酸根和还原去除的Cr(Ⅵ)的摩尔浓度比值为11.71。而在有RB4存在时(A图),反应时间15 min 时Cr(Ⅵ)的剩余浓度仅为8.57 μmol/L即0.45 mg/L(反应过程中RB4的存在影响Cr(Ⅵ)在540 nm处的检测,所以只检测了初始时刻和15 min时的Cr(Ⅵ)浓度),该浓度低于《钢铁工业水污染物排放标准》(GB13456-2012)中对Cr(Ⅵ)的最高排放标准0.5 mg/L的要求。此时亚硫酸根的消耗量为673 μmol/L,对应的消耗的亚硫酸根和还原去除的Cr(Ⅵ)的摩尔浓度比值为7.36,小于没有RB4存在时的比值,即在Cr(Ⅵ)/亚硫酸钠体系中加入有机物之后,还原相同量的Cr(Ⅵ)所消耗的亚硫酸钠减少了,提高了Cr(Ⅵ)的去除效率,同时有机物也能够得到去除,可以节约一定的Cr(Ⅵ)处理费用。
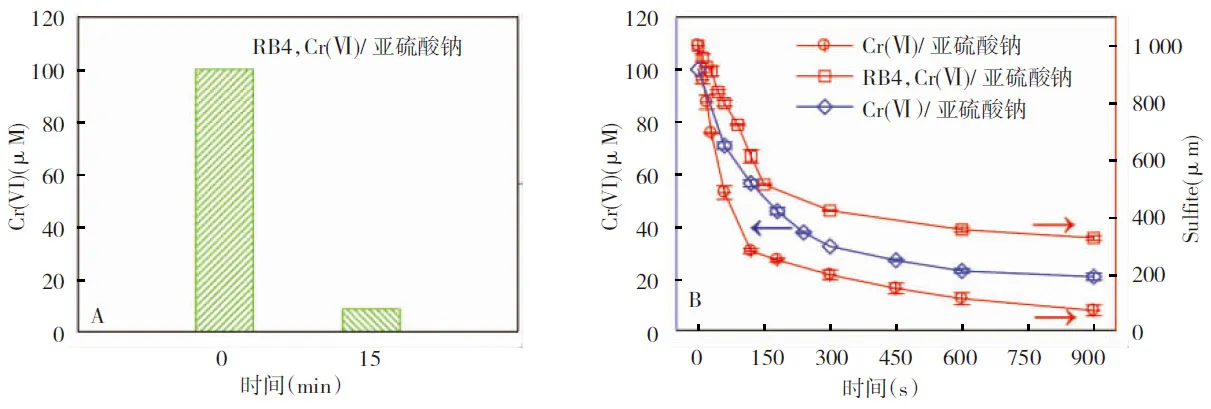
图2 不同体系中Cr(Ⅵ)和亚硫酸根浓度的变化
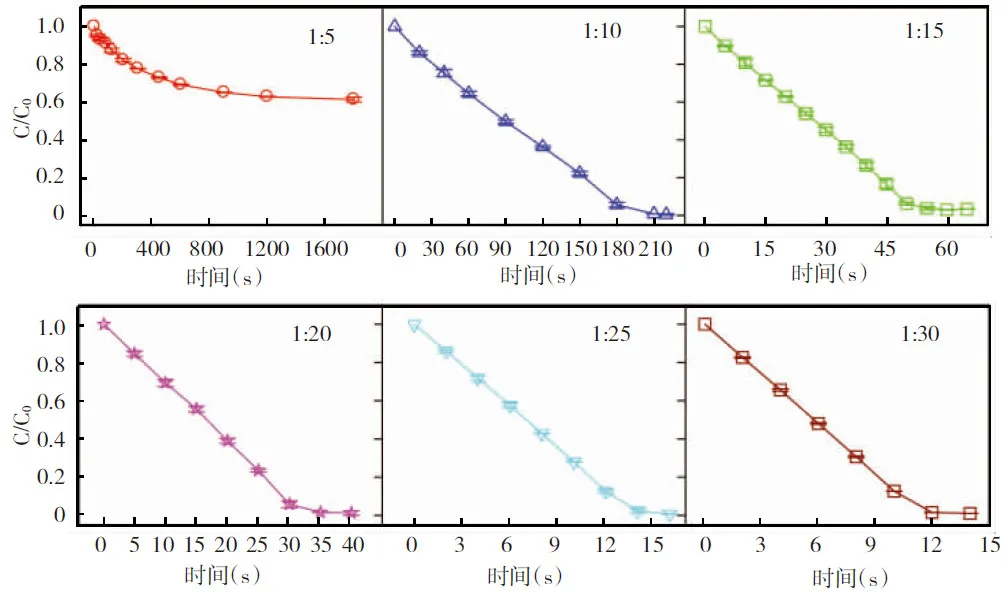
图3 不同Cr(Ⅵ)/亚硫酸钠摩尔比时RB4的降解动力学
2.2 不同初始亚硫酸钠浓度对氧化RB4的影响
为了系统考查Cr(Ⅵ)/亚硫酸钠体系降解RB4的效果,固定Cr(Ⅵ)的浓度,改变亚硫酸钠的浓度,探究在不同Cr(Ⅵ)/亚硫酸钠摩尔比条件下RB4的降解情况,其结果如图3所示。当亚硫酸钠浓度为500 μmol/L时,RB4不能被完全氧化,进一步提高亚硫酸钠的浓度, RB4的氧化速率增大。当亚硫酸钠的浓度为3 mmol/L时,20 μmol/L的RB4在12 s内即可被氧化完全。这是由于随着亚硫酸钠浓度的提高,Cr(Ⅵ)和亚硫酸钠之间的反应速率加大[10],产生高活性中间物种的速率随之提高,最终RB4的氧化速率得到了增加。继续提高亚硫酸钠的浓度,氧化完RB4所需的时间更少,但考虑到亚硫酸钠的实际投加量及药剂费用,本研究在亚硫酸钠浓度为1 mmol/L时进行了一系列的实验探究。
2.3 pH对Cr(Ⅵ)/亚硫酸钠体系氧化RB4的影响
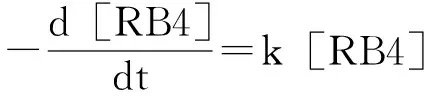
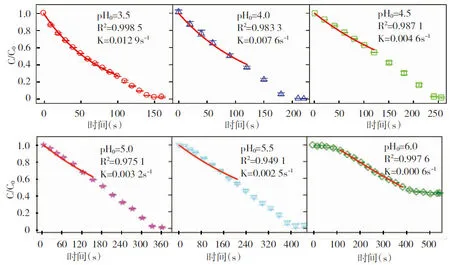
图4 不同初始pH下Cr(Ⅵ)/亚硫酸钠体系降解活性蓝4的动力学
2.4 Cr(Ⅵ)/亚硫酸钠体系氧化RB4的中间活性氧化剂
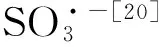

表 Cr(Ⅵ)/亚硫酸钠体系中的反应方程式Tab. Reaction equations in the Cr(Ⅵ)/sulfite system
图5 A:Cr(Ⅵ)/亚硫酸钠体系的电子顺磁共振波谱图

图6 甲醇对Cr(Ⅵ)/亚硫酸钠体系降解RB4的影响
3 结 论
3.1 在使用亚硫酸钠还原去除Cr(Ⅵ)时,可以实现共存活性染料活性蓝4的氧化,此方法可用于含Cr(Ⅵ)废水和染料废水的综合处理。与单独的Cr(Ⅵ)/亚硫酸钠体系相比,Cr(Ⅵ)/亚硫酸钠/活性蓝4体系中单位亚硫酸钠还原去除的Cr(Ⅵ)更多,可节约一定的药剂,降低废水的处理费用。
3.2 Cr(Ⅵ)/亚硫酸钠体系降解活性蓝4的效果随着亚硫酸钠和Cr(Ⅵ)摩尔比的升高而增强,且在pH较低的条件下活性蓝4的降解速率更快。初始pH为4.0时,100 μmol/L Cr(Ⅵ)与1 mmol/L亚硫酸钠可在3.5min内迅速氧化20 μmol/L活性蓝4。提高亚硫酸钠浓度至3 mmol/L时,活性蓝4在12s内被完全氧化。氧化活性蓝4的假一级反应速率常数随pH降低而升高,当pH低至3.5时,速率常数高达0.012 9 s-1。主要是由于较高浓度的亚硫酸钠和较低的pH 值使得Cr(Ⅵ)和亚硫酸钠之间的氧化还原速率提高,单位时间内产生了更多高活性的中间活性氧化剂。借助动力学研究结果,得到了较优的反应条件,可以从降低pH和提高亚硫酸钠浓度两方面来提高反应的效率,为含Cr(Ⅵ)废水和染料废水的综合处理提供了依据。
3.3 Cr(Ⅵ)和过量的亚硫酸钠反应时产生了亚硫酸根自由基,在氧气的参与下,亚硫酸根自由基被氧化为过一硫酸根自由基,继而产生了硫酸根自由基和羟基自由基,两种自由基作为体系中高活性的中间态氧化剂,实现了对活性蓝4的氧化。
[1] Raji C, Anirudhan T. Chromium (Ⅵ) adsorption by sawdust carbon: Kinetics and equilibrium[J]. Indian Journal of Chemical Technology, 1997, 5(4): 228-236.
[2] Parga J R, Cocke D L, Valverde V, et al. Characterization of electrocoagulation for removal of chromium and arsenic[J]. Chemical Engineering & Technology,2005, 28(5):605-612.
[3] Zazo J A, Paull J S, Jaffe P R. Influence of plants on the reduction of hexavalent chromium in wetland sediments[J]. Environmental Pollution,2008, 156(1): 29-35.
[4] Chiha M, Samar M H, Hamdaoui O. Extraction of chromium (Ⅵ) from sulphuric acid aqueous solutions by a liquid surfactant membrane (LSM)[J]. Desalination,2006, 194(1): 69-80.
[5] 任滨侨, 王艳丽, 赵路阳, 等. 含铬废水处理研究现状及发展趋势[J]. 黑龙江科学,2013, 12(9): 67-69.
[6] 王建刚, 张伟东, 崔怡亭, 等. 含铬废水高效膜处理新技术的应用[J]. 资源节约与环保, 2015, (2): 56-56.
[7] Alvarado L, Torres I R, Chen A. Integration of ion exchange and electrodeionization as a new approach for the continuous treatment of hexavalent chromium wastewater[J]. Separation and Purification Technology,2013, 5(105): 55-62.
[8] 孙玉凤, 赵春英, 赵 平. 还原法处理含铬电镀废水的工艺研究[J]. 电镀与精饰, 2012, 34(5): 43-46.
[9] Fu F, Dionysiou D D, Liu H. The use of zero-valent iron for groundwater remediation and wastewater treatment: A review[J]. Journal of hazardous materials, 2014, 28(267): 194-205.
[10] Beukes J, Pienaar J, Lachmann G, et al. The reduction of hexavalent chromium by sulphite in wastewater[J]. Water SA, 1999, 25(3): 363-370.
[11] Pettine M, Tonnina D, Millero F J. Chromium (Ⅵ) reduction by sulphur (IV) in aqueous solutions[J]. Marine chemistry, 2006, 99(1): 31-41.
[12] 佘志强, 毛迪山. 亚硫酸钠法处理含铬废水的探讨[J]. 白云科技, 1990, (1): 9-13.
[13] Gözmen B, Kayan B, Gizir A M, et al. Oxidative degradations of reactive blue 4 dye by different advanced oxidation methods[J]. Journal of Hazardous materials, 2009, 168(1): 129-136.
[14] Aspland J R. Textile dyeing and coloration[M]. AATCC: 1997.
[15] Bokare A D, Choi W. Chromate-induced activation of hydrogen peroxide for oxidative degradation of aqueous organic pollutants[J]. Environmental science & technology, 2010, 44(19):7232-7237.
[16] Wang Z, Bush R T, Sullivan L A, et al. Simultaneous redox conversion of chromium(Ⅵ) and arsenic(Ⅲ) under acidic conditions[J]. Environmental science & technology, 2013, 47(12):6486-6492.
[17] Jiang B, Liu Y, Zheng J, et al. Synergetic transformations of multiple pollutants driven by Cr(Ⅵ)-sulfite reactions[J]. Environmental science & technology,2015, 49(20): 12363-12371.
[18] 复 盛.水和废水监测分析方法[M]. 北京:中国环境科学出版社, 2002.346-349.
[19] Humphrey R E, Ward M H, Hinze W. Spectrophotometric determination of sulfite with 4, 4'-dithio-dipyridine and 5, 5'-dithiobis (2-nitrobenzoic acid)[J]. Analytical Chemistry, 1970, 42(7):698-702.
[20] Haight Jr G, Perchonock E, Emmenegger F, et al. The Mechanism of the Oxidation of Sulfur (IV) by Chromium (Ⅵ) in Acid Solution[J]. Journal of the American Chemical Society, 1965, 87(17): 3835-3840.
[21] Brandt C, Elding L I. Role of chromium and vanadium in the atmospheric oxidation of sulfur (IV)[J]. Atmospheric Environment, 1998, 32(4):797-800.
[22] Neta P, Huie R E, Ross A B. Rate constants for reactions of inorganic radicals in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17(3):1027-1284.
[23] Buxton G V, Greenstock C L, Helman W P, et al. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O-in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17(2): 513-886.
Rapid Oxidation of Reactive Blue 4 by the Cr(VI)/Sulfite System: Kinetics and Mechanisms
FAN Wen-juan, DONG Hong-yu, GUAN Xiao-hong
(StateKeyLaboratoryofPollutionControl&ResourcesReuse,Shanghai200092,China)
Cr(Ⅵ); sodium sulfite; redox; free radical
2016-01-23
国家自然科学基金水污染控制铁锰化学(21522704)。
范文娟(1990-),女,山东枣庄人,同济大学市政工程专业2014级在读硕士研究生,主要研究方向为饮用水深度处理技术。
关小红,guanxh@tongji.edu.cn。
X703.1
A
1001-3644(2016)03-0001-07

