桉树无性系叶片蛋白质组双向电泳体系优化
马松亚 ,蒋维昕 ,2,屈林丰 ,曹雪宁 ,谭 玲 ,杨 梅 ,2
(1. 广西大学 林学院 ,广西 南宁 530004;2. 广西林业科学与工程高校重点实验室,广西 南宁 530004)
桉树无性系叶片蛋白质组双向电泳体系优化
马松亚1,蒋维昕1,2,屈林丰1,曹雪宁1,谭 玲1,杨 梅1,2
(1. 广西大学 林学院 ,广西 南宁 530004;2. 广西林业科学与工程高校重点实验室,广西 南宁 530004)
为了建立适用于桉树叶片蛋白质组研究的双向电泳体系,以尾叶桉Eucalyptus urophyllas广林4号无性系作为试验材料,对蛋白质样品获取方法、双向电泳等电聚焦胶条pH范围、蛋白质上样量、胶条平衡条件以及染色方法进行了优化。结果表明:提取液+酚抽提法最适合桉树叶蛋白质的提取,电泳图谱可检测到850个蛋白质点。7 mol/L尿素+2 mol/L硫脲+4% Chaps+60 mmol DTT 10 µL的蛋白质干粉裂解液,裂解效果较好;使用50 mg蛋白质干粉和600 µL裂解液所获得的蛋白质浓度较高,为3.97 µg/µL。使用 pH4~7、24 cm IPG胶条,蛋白质上样量为1 200 µg,并加入375 mg碘乙酰胺,采用考马斯亮蓝染色,获得的蛋白点清晰,没有拖尾现象,条纹极少,分布较均匀。
桉树;叶片;蛋白质组;无性系;双向电泳
蛋白质组学研究的目的是为了弄清某一生物体中基因编码的所有蛋白质,建立蛋白质组学数据库,并着重于寻找和筛选任何有意义的两个材料之间的差异蛋白质谱,揭示细胞生理和病理状态的进程与本质、对外界环境刺激的反应途径以及细胞调控机制,同时对某些关键蛋白进行定性和功能分析[1]。在植物的生存环境中,会受到非生物因子胁迫,这些胁迫可以引起大量的蛋白质在种类和表达量上的变化。蛋白质组学可以检测逆境胁迫下植物体内差异表达的蛋白质,再通过差异蛋白质组学研究,可以使我们更好地了解胁迫的伤害机制以及植物对非生物环境的适应机制[2]。目前针对特定林木的研究大多关注于基因的克隆鉴定和表达[3-5],而针对林木在低温、干旱等胁迫下的差异蛋白鉴定中的应用相对有限。
桉树Eucalyptus是热带亚热带地区,尤其是我国广西地区极为重要的造林树种[6]。然而,为了追求速生、丰产,经营效益最大化,大面积单基因型桉树人工纯林的营造以及集约化经营管理模式的推广,造成林分结构、树种组成单一化,林地生态环境趋同,导致桉树林生态系统生态环境恶化,抗逆能力降低,各种桉树病害频繁暴发、种类不断增加、面积显著扩大[7-8]。
本试验以尾叶桉Eucalyptus urophyllas广林4号无性系为研究对象,对桉树叶片蛋白质双向电泳技术中的影响因素进行探讨,同时对电泳体系进行条件优化,以获得纯度高、分离效果好,清晰度高的桉树叶蛋白双向电泳图谱,为深入研究桉树在逆境下的适应机制,从蛋白质组水平上探索其蛋白质及基因的表达差异的研究奠定基础,并为其他水平上的深入研究提供参考。
1 试验材料与方法
1.1 试验材料
试验材料为广西林科院提供的尾叶桉4号2月生苗木。铝处理浓度分别为0 mg/L和120 mg/L Al3+,每个处理设3个重复,每个重复6株苗木,共36株。在Hoagland营养液预培养40 d,转入55.5 mg/L CaCl2中培养1 d,以55.5 mg/L CaCl2为基本营养液,铝以分析纯AlCl3·6H2O为供源加入,处理24 h。
1.2 试验方法
1.2.1 叶蛋白质干粉制备方法
方法1:直接提取法
分次称取桉树叶片3.0 g左右,加入液氮充分研磨后的粉末快速转移至2 mL离心管中,加入4倍于叶片粉末体积的提取液(7 mol/L尿素,2 mol/L硫脲,2%CHAPS,1%PMSF,1%蛋白酶抑制剂),置于冰上震荡3 h后,在4℃下14 000 r/min的条件下离心25 min,吸取上清液至另一2 mL离心管中,加入4倍体积-20℃预冷丙酮(含0.07%巯基乙醇),-20℃过夜后,在4 000 r/min离心25 min,用无水乙醇洗涤蛋白沉淀2次,80%丙酮洗涤沉淀1次,然后将蛋白沉淀置于-20℃至丙酮挥发干净。
方法2:改良的TCA丙酮法
取样及样品前处理与方法一相同。样品在-20℃过夜、离心后,向上清液中加入6倍于沉淀体积的-20℃预冷的丙酮溶液(含0.07%巯基乙醇),用枪头将沉淀捣碎,上下晃动充分混匀,放在-20℃冰箱中沉淀3 h,以充分沉淀蛋白,在4℃下14 000 r/min离心25 min,弃上清。将上一步骤重复两次直至上清液呈现无色,然后将蛋白沉淀置于-20℃至丙酮挥发干净。
方法3:提取液+酚抽提法
此方法采用Saravanan[9]的方法进行改良。
分次称取桉树叶片3.0 g左右,放入预冷的研钵中,加入液氮充分研磨,然后加入2 mL提取液(含有2%PVP和2%巯基乙醇)继续充分研磨成匀浆状态。再加入4 mL Tris-饱和酚,在冰上进行充分研磨,最后加入3 mL预冷提取液继续充分研磨,将匀浆快速转移到冰上的2 mL离心管中,震荡平衡大约2 h。在4℃,14 000 r/min离心30 min。然后取酚层转移至新的离心管中,重复上一步骤一次。加入五倍于酚层体积的醋酸铵甲醇溶液,置于-20℃冰箱过夜。在4℃,14 000 r/min的条件下,离心15 min,弃上清,用-20℃预冷甲醇(使用前加入0.07%巯基乙醇)洗涤沉淀,之后4℃,14 000 r/min离心,弃上清,所得沉淀即为桉树叶的蛋白质粗提样品。
1.2.2 裂解液成份
裂解液甲加9 mol/L 尿素,裂解液乙加7 mol/L尿素、2 mol/L硫脲。两者均加入4%(W/V)CHAPS,用超纯水定容,DTT在使用前加入。两种裂解液在使用之前都分别加入浓度为0 mmoL、20 mmoL、40 mmoL、60 mmoL、80 mmoL、100 mmoL DTT溶液。
称取50 mg蛋白质干粉,分别加入400 µL、600 µL、800 µL 以及 1000 µL 裂解液乙,对蛋白浓度进行测定。
1.2.3 胶条pH的选择
本研究选择非线性胶条pH3~10、24 cm和pH4~7、24 cm两种规格。
1.2.4 蛋白质上样量的比较
本研究选用 600 µg、900 µg、1 200 μg/24 cm 3个不同浓度梯度的IPG胶条进行双向电泳。
1.2.5 碘乙酰胺用量的确定
本研究对胶条进行了两次平衡,时间均设置为15 min。第一次平衡液体积为15 mL并加入150 mg DTT;第二次平衡液体积为15 mL,分别加入碘乙酰胺375 mg和150 mg,对不同碘乙酰胺用量的平衡效果进行比较。
1.2.6 染色方法的比较
本研究对硝酸银染色法与考马斯亮蓝染色法的效果进行对比。
2 蛋白质双向电泳方法
2.1 第一向等电聚焦
IEF使用IPG非线性胶条,按照Bio-Rad双向电泳操作手册操作。定量后计算出的样品含量,吸取一定体积的样品溶液,加入IEF上样缓冲液进行等电聚焦。
2.2 第二向SDS-PAGE电泳
等电聚焦结束后,立即进行胶条平衡,平衡分两步,每次 15 min。平衡结束后,立即进行第二向电泳。起始时使用220 v,10 µA/根胶条的电流,待蛋白样品完全进入凝胶之后使用360 v,15 µA/根胶条的电流。电泳结束后, 进行染色。
3 结果与分析
3.1 适合桉树叶蛋白质双向电泳的蛋白质干粉制备方法
直接沉淀法得到双向电泳二维图谱见图1A,在图谱上几乎没有看到蛋白质点,在胶条的酸性端横向和纵向条纹较严重,并且凝胶背景色很深。这说明直接沉淀法提取桉树叶片蛋白质的效率较低,并且去除干扰物质的效果较差,提取蛋白中杂质含量较多。改良的TCA丙酮法得到双向电泳二维图谱见图1B,蛋白点数量相对于丙酮沉淀法有所增多,但是横向和纵向条纹仍然存在,蛋白拖尾严重。提取液+酚抽提法得到双向电泳二维图谱见图1C,横向和纵向条纹较少,蛋白质点的数目明显增加,呈现圆形或者椭圆形,分布均匀并且几乎没有拖尾现象,分离效果较好,背景清晰,适合进行双向电泳。
3.2 适合桉树叶蛋白质干粉的裂解液成份
分别在裂解液甲和裂解液乙中加入0 mmol、20 mmol、40 mmol、60 mmol、80 mmol、100 mmol浓度的DTT。
从图2可以看出,裂解液乙较裂解液甲对蛋白质干粉的溶解度明显较大。DTT浓度的变化对裂解液甲裂解蛋白质的效果不明显,但是在不同DTT浓度下裂解液乙裂对蛋白质干粉的溶解度呈现出明显的变化趋势,伴随着DTT浓度的上升呈现出先上升后下降的趋势,在DTT浓度达到60 mmol时蛋白溶解度达到最大值,裂解效果最好。
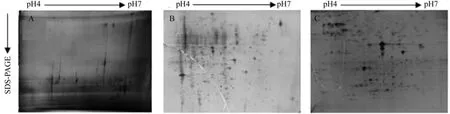
图1 不同提取方法的双向电泳凝胶图谱Fig. 1 2-DE protein pro fi les obtained with different protein extraction methods
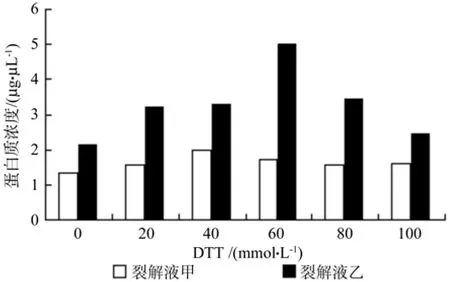
图2 不同裂解液对蛋白裂解的影响Fig. 2 Effect of different lysis buffers on protein lysis
3.3 裂解液剂量对蛋白质干粉溶解效果的影响
50 mg 蛋白质干粉分别加入 400 µL,600 µL,800 µL以及1 000 µL裂解液乙(使用前加入10 µL 60 mmol DTT),所获得的蛋白浓度分别为2.89µg/µL、3.97 µg/µL、2.23 µg/µL 和 2.04 µg/µL。结果表明,使用600 µL裂解液进行裂解时所获得的蛋白浓度较高。结果见图3。
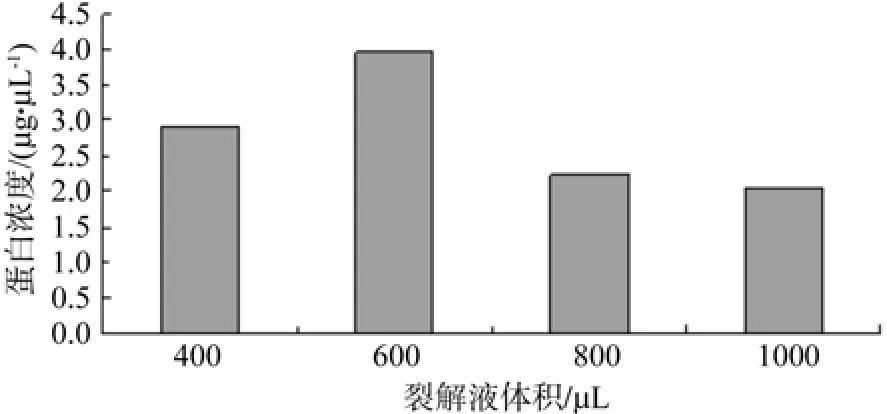
图3 裂解液剂量对蛋白质浓度的影响Fig. 3 Effect of dosages of lysis buffer on protein concentration
3.4 等电聚焦胶条pH范围的选择
采用pH3~10、24 cm的IPG线性胶条,上样量为1200 µg时,蛋白质点在胶条酸性端分布较多,而在碱性端几乎没有被检出。采用pH4~7的胶条分离的蛋白质点分布均匀,并且清晰,可用于桉树叶蛋白的双向电泳图谱分析。双向电泳图谱可见图4。
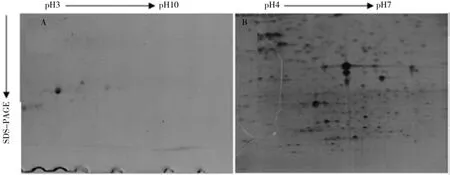
图4 不同胶条pH的双向电泳图谱Fig. 4 2-DE protein pro fi les of different pH
3.5 适合双向电泳的蛋白质上样量
在图5A中,上样量为 600 µg 时,双向电泳凝胶图谱并不理想,蛋白点不但分布极不均匀,而且总数较少并且蛋白点亮度和清晰度不够,尤其是在胶条的碱性端,几乎没有检测到蛋白质点。在图5B中,上样量为 900 µg 时,凝胶图谱比上样量为600 µg蛋白质点总数有所上升,但是碱性端的蛋白质点数量仍然较少,蛋白质点圆度、亮度和清晰度不够,分布不均。在图5C中,上样量为1 200 µg时,蛋白点总数明显上升并且多数蛋白质点较大较圆,分布较均匀,没有出现明显拖尾和条纹等现象,整张图谱适合进行双向电泳图谱分析以及质谱鉴定。因此,上样量为1 200 µg较为合适。

图5 不同上样量的双向电泳凝胶图谱Fig. 5 2-DE protein pro fi les obtained with different sample volumes
3.6 提高IPG胶条平衡效果的碘乙酰胺用量
平衡结果分别如图6A和6B所示,第二次平衡过程中使用15 mL平衡液加375 mg碘乙酰胺的平衡效果较好,条纹较少并且蛋白点较圆,适合双向电泳图谱分析。
3.7 适合蛋白质双向电泳的凝胶染色方法
本研究采用了硝酸银染色和考马斯亮蓝染色两种方法,硝酸银染色与考马斯亮蓝染色结果分别如图7A和7B所示。硝酸银染色背景颜色深、蛋白质点被掩盖,无法进行凝胶图谱分析。考马斯亮蓝染色蛋白点清晰、均匀并且没有出现拖尾和条纹等现象,是比较适合桉树叶蛋白质双向电泳凝胶染色的方法。
4 结论与讨论
蛋白质双向电泳分析中的一个关键步骤是蛋白质样品制备,蛋白质样品制备主要包括蛋白质干粉的提取和裂解两个方面。在直接提取法、改良TCA丙酮法和提取液+酚抽提法等3种方法中,提取液+酚抽提法所获得的蛋白质适合进行桉树叶蛋白质双向电泳,提取蛋白质点清晰、条纹少、数量多。增加蛋白质在裂解液中的溶解度和解聚状态,避免蛋白质在裂解过程中的降解和丢失是利用双向电泳技术分析植物蛋白质的核心所在。裂解液的组成中主要包括离液剂、还原剂及各种去污剂等[10]。DTT在蛋白裂解中作为还原剂起到变性作用,硫脲的存在大大提高了桉树叶蛋白质裂解的效果,这是由于硫脲的高效增溶性从很大程度上增加了蛋白质的溶解性,较适合于植物蛋白质的裂解,Chaps作为两性电解质可以较好的提高蛋白的溶解效果,目前已在其他试验研究中应用[11]。
不同长度的 IPG 胶条所需的上样量也不同,蛋白质样品上样量过大或者过小都会影响到双向电泳图谱的效果[12],本研究通过对三种不同上样量所得结果进行对比,认为上样量为1 200 µg 时使用pH4~7的24 cm IPG胶条,所获得的蛋白质点总数明显上升并且蛋白质点较大较圆,分布比较均匀,没有出现明显拖尾和条纹等影响双向电泳图谱分析的现象,整张图谱适合进行双向电泳图谱分析以及质谱鉴定。
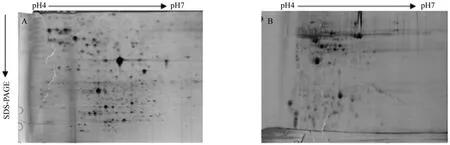
图6 碘乙酰胺用量对平衡效果的影响Fig. 6 Effect of dosages of iodoacetamide on equilibrium

图7 不同染色方法的双向电泳凝胶图谱Fig. 7 2-DE protein pro fi les obtained with different staining methods
目前对双向电泳蛋白质检测的常用染色方法主要有银染法和考马斯亮兰染色法。考马斯亮兰操作容易,药品毒性较低,成本低,更为重要的是与质谱的兼容性较高[13],而且操作简便。硝酸银染的优点是其灵敏度较高,检测限为 0.1 ng[14]有利于低丰度蛋白的检出,上样所需的蛋白质量较少。与银染方法相比,考马斯亮兰染色后,电泳图谱背景较容易去除,蛋白点清晰,分布均匀,并且没有出现拖尾和条纹等现象,是比较适合桉树叶蛋白质双向电泳的凝胶染色方法。
通过对桉树无性系叶片双向电泳体系的优化,提取液+酚抽提法较适合桉树叶蛋白质干粉的提取;使用7M尿素,2M硫脲以及4%Chaps,在使用前加入60 mmol的DTT10 µL可以提高蛋白质干粉的裂解效果;含有50 mg蛋白质干粉的600 µL裂解液进行裂解时所获得的蛋白浓度较高;使用pH4~7的24 cm IPG胶条、上样量为1 200 µg时,对桉树叶蛋白的分离效果较好,第二次平衡加入375 mg碘乙酰胺平衡效果较好,考马斯亮蓝染色是较适合桉树无性系叶双向电泳凝胶的染色方法,适合软件分析和质谱鉴定。该优化体系为后续的桉树叶蛋白质组学及进一步探讨桉树抗逆性的分子响应机制提供了试验基础。
[1]何大澄, 肖雪媛. 差异蛋白质组学及其应用[J]. 北京师范大学学报, 2002, 38(4): 558-562.
[2]杨 梅. 邻轻基苯甲酸胁迫对不同杉木无性系化感效应及差异蛋白质组分析[D]. 福州:福建农林大学, 2007.
[3]梁楠松, 周 姗, 李蕾蕾, 等. 小黑杨 bHLH 转因子基因和启动子的克隆与分析[J]. 经济林研究, 2013, 31(4): 58-66 .
[4]王 淋, 叶生晶. 杜仲 EuHMGRS 基因家族的鉴定及生物信息学分析[J]. 经济林研究, 2013, 31(4): 16-24.
[5]刘慧敏, 王 淋, 许靖诗, 等. 杜仲 MEP 途径系列基因表达差异的研究[J]. 中南林业科技大学学报, 2014, 34(2): 26-33.
[6]潘 昕, 谢德新, 邱 权, 等 . 干旱胁迫对两种速生树种苗木生理指标的影响[J]. 中南林业科技大学学报, 2013, 33(10):84-88.
[7]陈全助. 福建桉树焦枯病菌鉴定及其诱导下桉树转录组和蛋白组学研究[D]. 福州: 福建农林大学, 2013.
[8]王缉健, 杨秀好, 罗基同, 等. 桉扁蛾生物学研究[J]. 中国森林昆虫, 2015, 34(1): 9-13.
[9]Saravanan R S, Rose J K C. A critical evaluation of sample extraction techniques for enhanced proteomic analysis of recalcitrant plant tissues[J]. Proteom Clin App, 2004, 4(9): 2522-2532.
[10]钱小红, 贺福初. 蛋白质组学: 理论与方法[M]. 北京: 科学出版社, 2003.
[11]林文芳, 陈林姣, 彭 浩, 等. 不同生态型芦苇叶片蛋白质双向电泳系统的筛选和优化[J]. 生物化学与生物物理进展,2008, 35(10): 1209-1214.
[12]李德华, 贺立源, 刘武定. 耐铝的和对铝敏感的玉米自交系根系的有机酸分泌[J]. 植物生理与分子生物学学报, 2003,29(2): 114-120.
[13]Blackstock W P, Weir M P. Proteomics: Quantitative and physical mapping of cellular proteins[J]. Trend in Biot, 1999, 17(3): 121-127.
[14]Gharahdaghi F, Weinberg C R, Meagher D A,et al. Mass spedrometric identification of proteins from silver-stained polyacrylamide gel: A method for the removal of silver ions to enhance sensitivity[J]. Electrophoresis, 1999, 20(3): 601-605.
Optimization of two-dimensional electrophoresis for proteome of Eucalyptus clones leaves
MA Song-ya1, JIANG Wei-xin1,2, QU Lin-feng1, CAO Xue-ning1, TAN Ling1, YANG Mei1,2
(1. College of Forestry, Guangxi University, Nanning 530004, Guangxi, China;2. Key Laboratory of Forestry Science and Technology in Guangxi, Nanning 530004, Guangxi, China)
A suitable two-dimensional electrophoresis(2-DE) system for proteomic of Eucalyptus leaves was established ,by selecting the extraction methods, pH gradient of IPG strips and optimizing sample loading, equilibrium and straining methods. The results showed that phenol extraction was suitable forEucalyptusleaves protein extraction by 850 detected protein spots. Using the lysis buffer contained 7M urea, 2M thiourea , 4% Chaps and adding 60 mmol DTT 10 µL may obtain the better lytic effect. When using 600 µL lysis buffer with 50 mg protein powder, protein concentration was up to 3.97µg/µL that met the demand of 2-DE. By loading 1 200 μg proteins on the 24 cm IPG strip with pH4~7 and 375mg iodacetamide for equilibrium, the clear and round protein spots were detected with uniform distribution and less steak on the gel when using blue-silver staining method.
Eucalyptus; leaves; Proteome; clones; two-dimensional gel electrophoresis
S792.39
A
1673-923X(2016)04-0045-06
10.14067/j.cnki.1673-923x.2016.04.009
http: //qks.csuft.edu.cn
2015-04-10
国家自然科学基金:铝诱导不同耐铝型速生桉无性系根有机酸分泌特征及调控机理(31070560)
马松亚,硕士研究生
杨 梅,教授,博士;E-mail:fjyangmei@126.com
马松亚,蒋维昕,屈林丰,等. 桉树无性系叶片蛋白质组双向电泳体系优化[J].中南林业科技大学学报, 2016,36(4):45-50.
[本文编校:吴 彬]

