2-氨基吡啶和炔酸酯的环化反应研究*
陈正旺,温月璐,陈 海,丁 浩,曾祥贞,王青豪
(赣南师范大学 化学化工学院,江西 赣州 341000)
·有机药物化学·
2-氨基吡啶和炔酸酯的环化反应研究*
陈正旺,温月璐,陈 海,丁 浩,曾祥贞,王青豪†
(赣南师范大学 化学化工学院,江西 赣州 341000)
本论文以2-氨基吡啶和炔酸酯为原料,三氟醋酸银为催化剂,水为溶剂合成了一系列的吡啶并嘧啶酮类化合物;当催化剂为三氟醋酸钾时,氯苯为溶剂,相同原料得到咪唑并吡啶产物.考察了不同反应条件,并拓展了反应的底物.
氨基吡啶;炔酸酯;吡啶并嘧啶酮;咪唑并吡啶
稠杂环化合物尤其含氮稠杂环是目前有机化学和药物化学的研究热点[1].嘧啶酮在医药化学里是很重要的分子.例如,利培酮和帕潘立酮已经作为人类精神病的口服治疗药物.吡啶并[1,2-a]嘧啶-4-酮是其中很重要的一类化合物,具有广泛的生物活性[2].最近发展了一些过渡金属催化的方法来合成吡啶并[1,2-a]嘧啶-4-酮化合物.如曾伟课题组报道了钯催化亚胺的羰基化的合成方法[3];Guchhait课题组报道了钯催化吡啶并嘧啶-2,4-二酮与芳基硼酸的偶联的合成方法[4];Hermecz课题组报道了钯催化的卤代的吡啶并嘧啶酮与芳基硼酸的Suzuki偶联来构建这类分子[5].除了金属催化,2-氨基吡啶和β-酮酸酯的缩合也可以用来合成该类型的化合物[6].以前报道在有机溶剂中合成吡啶并嘧啶酮,本论文以水为溶剂的催化体系更加符合绿色化学的要求.
另一方面,咪唑并吡啶类化合物是另一类重要的含氮稠杂环化合物,因其特定的生理活性以及和吲哚、氮杂吲哚等在结构上的类似性,成为有机化学家和药物化学家的研究热点[7-8].作为其中一类重要的结构,2,3-二芳基咪唑并[1,2-α]吡啶类化合物同样具有重要的生物活性.最近报道了一些合成方法合成这类型的化合物,如通过缩合反应[9-10]、多组分反应[11]和金属催化碳氢官能团化的方法[12-13].最近我们小组也报道了碱促进的通过碳碳键断裂的方式构建2,3-二芳基咪唑并[1,2-α]吡啶的方法,但用三乙胺作为溶剂不符合绿色化学的要求[14].这里我们报道了以2-氨基吡啶和炔酸酯为原料,通过调控催化剂合成吡啶并嘧啶酮和咪唑并吡啶的方法(图1).
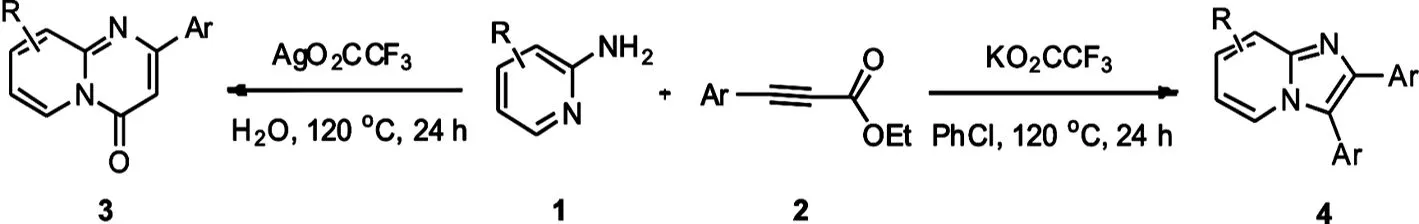
图1 吡啶并嘧啶酮和咪唑并吡啶的合成
1 实验部分
1.1 仪器与试剂
Bruker AM-400 FT-NMR核磁共振仪(TMS为内标,CDCl3为溶剂);岛津GCMS-QP5050A 质谱仪;反应试剂均为国产市售分析纯.
1.2 AgO2CCF3催化合成吡啶并嘧啶酮的实验操作
于25 mL螺旋刻度试管中分别加入0.1 mmol 2-氨基吡啶1、0.1 mol炔酸酯2、 三氟醋酸银(30 mol %)和1 mL水,120 ℃反应24 h.反应结束后,加入10 mL水,乙酸乙酯(3×5 mL)萃取,合并有机层并用无水硫酸镁进行干燥.浓缩,去溶剂.所得余留物经柱色谱分离,得到相应的吡啶并嘧啶酮化合物3.
1.3 KO2CCF3催化合成咪唑并吡啶的实验操作
于25 mL螺旋刻度试管中分别加入0.2 mmol 2-氨基吡啶1、0.2 mol炔酸酯2、三氟醋酸钾(30 mol %)和1 mL氯苯,120 ℃反应24 h.反应结束后,加入10 mL水,乙酸乙酯(3×5 mL)萃取,合并有机层并用无水硫酸镁进行干燥.浓缩,去溶剂.所得余留物经柱色谱分离,得到相应的酮化合物4.
1.4 产物结构分析
2-苯基-4H-吡啶并[1,2-a]嘧啶-4-酮 (3a):1H NMR(400 MHz,CDCl3):δ=9.07(d,J=6.8 Hz,1H),8.07-8.09(m,2H),7.75(d,J=3.6 Hz,2H),7.48-7.50(m,3H),7.11-7.15(m,1H),6.91(s,1H).13C NMR(100 MHz,CDCl3):δ=162.0,158.6,151.0,137.2,136.1,130.6,128.8,127.4,127.2,126.7,115.2,100.1.
9-甲基-2-苯基-4H-吡啶并[1,2-a]嘧啶-4-酮(3b):1H NMR(400 MHz,CDCl3):δ=8.96(d,J=6.8 Hz,1H),8.14-8.17(m,2H),7.58(d,J=6.8 Hz,1H),7.47-7.51(m,3H),7.02(t,J=6.8Hz,1H),6.93(s,1H),2.68(s,3H).13C NMR(100 MHz,CDCl3):δ=160.5,159.2,150.4,137.4,135.3,134.7,130.5,128.7,127.4,125.3,114.6,99.5,18.2.MS(EI)m/z:236,208,180,152,131,104,92,77,65,39,28.
7-碘-2-苯基-4H-吡啶并[1,2-a]嘧啶-4-酮(3c):1H NMR(400 MHz,CDCl3):δ=9.28(d,J=1.6 Hz,1H),8.04-8.07(m,2H),7.84-7.87(m,1H),7.46-7.50(m,4H),6.92(s,1H).13C NMR(100 MHz,CDCl3):δ=161.9,157.3,149.4,143.9,136.7,132.4,130.9,128.8,127.6,127.4,100.6,78.8.MS(EI)m/z:348,320,294,204,166,139,116,102,77,63,51,28.
2-(4-叔丁基苯基)-4H-吡啶并[1,2-a]嘧啶-4-酮(3d):1H NMR(400 MHz,CDCl3):δ=8.02-8.05(m,2H),7.67-7.70(m,2H),7.61-7.64(m,2H),7.45-7.49(m,2H),7.38-7.42(m,1H),2.64(s,3H).13C NMR(100MHz,CDCl3):δ=197.8,145.7,139.8,135.8,128.9,128.9,128.2,127.2,127.2,26.6.MS(EI)m/z:196,181,152,76,43.
2-(4-氯苯基)-4H-吡啶并[1,2-a]嘧啶-4-酮(3e):1H NMR(400 MHz,CDCl3):δ=9.07(d,J=7.2 Hz,1H),8.02-8.06(m,2H),7.76-7.78(m,2H),7.45-7.49(m,2H),7.14-7.17(m,1H),6.87(s,1H).13C NMR(100 MHz,CDCl3):δ=160.7,158.5,151.0,136.9,136.3,135.6,129.0,128.7,127.3,126.7,115.3,99.8.MS(EI)m/z:256,228,192,166,136,114,96,78,51,39,28.
2-(4-乙酰苯基)-7-甲基-4H-吡啶并[1,2-a]嘧啶-4-酮(3f):1H NMR(400 MHz,CDCl3):δ=8.89(s,1H),8.17(d,J=8.4 Hz,2H),8.06(d,J=8.4 Hz,2H),7.63-7.71(m,2H),6.92(s,1H),2.65(s,3H),2.45(s,3H).13C NMR(100 MHz,CDCl3):δ=197.6,160.2,158.4,150.0,141.6,139.4,138.3,128.6,127.5,126.2,125.9,124.8,100.5,26.7,18.3.MS(EI)m/z:278,255,221,183,152,133,107,77,65,51,28.
2,3-二苯基咪唑并[1,2-a]吡啶(4a):1H NMR(400 MHz,CDCl3):δ=7.95(d,J=5.6 Hz,1H),7.68-7.66(m,3H),7.53-7.50(m,2H),7.48-7.44(m,3H),7.29-7.22(m,3H),7.20-7.17(m,1H),6.73-6.70(m,1H).13C NMR(100 MHz,CDCl3):δ=144.8,142.4,134.2,130.7,129.9,129.5,128.8,128.2,128.1,127.4,124.6,123.2,121.0,117.5,112.2.MS(EI)m/z:270,241,207,190,165,134,121,78,28.
6-甲基-2,3-二苯基咪唑并[1,2-a]吡啶(4b):1H NMR(400 MHz,CDCl3):δ=7.71(s,1H),7.66-7.64(m,2H),7.58(d,J=9.2 Hz,1H),7.55-7.48(m,3H),7.46-7.44(m,2H),7.29-7.20(m,3H),7.06-7.04(m,1H),2.26(s,3H).13C NMR(100 MHz,CDCl3):δ=143.8,142.2,134.3,130.7,130.1,129.5,128.7,128.2,127.9,127.8,127.3,121.9,120.8,120.8,116.8,18.3.MS(EI)m/z:284,268,220,207,165,142,91,77,28.
7-氯-2,3-二苯基咪唑并[1,2-a]吡啶(4c):1H NMR(400 MHz,CDCl3):δ=7.86(d,J=7.2 Hz,1H),7.68-7.62(m,3H),7.56-7.49(m,3H),7.44-7.42(m,2H),7.30-7.23(m,3H),6.73-6.71(m,1H).13C NMR(100 MHz,CDCl3):δ=144.4,143.1,133.6,131.1,130.6,129.6,129.2,129.1,128.3,128.0,127.7,123.6,121.2,116.2,113.8.MS(EI)m/z:304,281,268,207,165,152,133,91,43,28.
2,3-二间甲基咪唑并[1,2-a]吡啶(4d):1H NMR(400 MHz,CDCl3):δ=7.93(d,J=6.8 Hz,1H),7.67(d,J=9.2 Hz,2H),7.40(t,J=7.6 Hz,1H),7.33-7.23(m,4H),7.20-7.16(m,1H),7.11(t,J=7.6 Hz,1H),7.05(d,J=7.6 Hz,1H),6.71(t,J=6.4 Hz,1H),2.40(s,3H),2.32(s,3H).13C NMR(100 MHz,CDCl3):δ=144.6,142.2,139.2,137.9,134.0,131.1,129.8,129.6,129.3,128.7,128.2,128.0,127.8,125.0,124.5,123.3,121.2,117.4,112.1,21.4,21.4.MS(EI)m/z:298,282,207,190,178,141,128,91,28.
2,3-二(4-溴苯基)咪唑并[1,2-a]吡啶(4e):1H NMR(400 MHz,CDCl3):δ=7.93(d,J=6.9 Hz,1H),7.72-7.67(m,3H),7.51(d,J=8.4 Hz,2H),7.43(d,J=8.4 Hz,2H),7.32(d,J=8.4 Hz,2H),7.28-7.24(m,1H),6.80(t,J=6.7 Hz,1H).13C NMR(100 MHz,CDCl3):δ=144.9,141.5,133.0,132.7,132.2,131.5,129.6,128.4,125.3,123.4,123.0,121.9,119.9,117.6,112.8.MS(EI)m/z:425,347,268,207,190,134,121,78,28.
6-甲基-2,3-二(噻吩-3-基)咪唑并[1,2-a]吡啶(4f):1H NMR(400 MHz,CDCl3):δ=7.66-7.63(m,2H),7.54(d,J=9.2 Hz,1H),7.30-7.26(m,2H),7.23(d,J=5.2 Hz,1H),7.18(d,J=3.6 Hz,1H),7.07-7.05(m,1H),6.96-6.94(m,1H),2.26(s,3H).13C NMR(100 MHz,CDCl3):δ=144.3,139.8,137.3,131.1,129.5,129.0,128.5,128.2,127.4,125.4,124.7,122.4,121.5,116.4,111.6,18.2.MS(EI)m/z:296,281,251,207,177,147,126,69,28.
2 结果与讨论
2.1 反应条件的筛选
我们以0.1 mmol 2-氨基吡啶和0.1 mmol苯丙炔酸乙酯为反应原料,加入1 mL溶剂,120 ℃反应24 h为模型反应,进行了条件的优化.如表1所示,我们首先以水为反应溶剂,尝试了不同银盐(30 mol%).Ag2O作为催化剂得不到任何的产物.其它的银盐作为催化剂可以选择性的得到吡啶并嘧啶酮产物3a, 而AgO2CCF3能有效催化该反应的进行,得到80%的分离收率.在这些转化里面,没有得到对应的咪唑并吡啶4a产物.反应体系中不加入催化剂不能得到任何的产物.进一步的控制实验证实,当加入AgO2CCF3的阴离子部分即KO2CCF3,意外发现反应得到21%收率的咪唑并吡啶4a产物.我们发现氯苯作为溶剂能够有效提高反应的收率,得到86%的分离收率.我们以氯苯为溶剂,考察了不同的添加剂,主要包括常用的无机碱和有机碱.发现各种碱对反应收率影响比较大,但没有金属银,得到的产物都是咪唑并吡啶4a产物.因此,综合以上因素,该反应的最佳条件为:AgO2CCF3为催化剂,水为溶剂,120 ℃反应24 h,得到吡啶并嘧啶酮3a产物;KO2CCF3为催化剂,氯苯为溶剂,120 ℃反应24 h,得到咪唑并吡啶4a产物.
表1 反应条件的优化

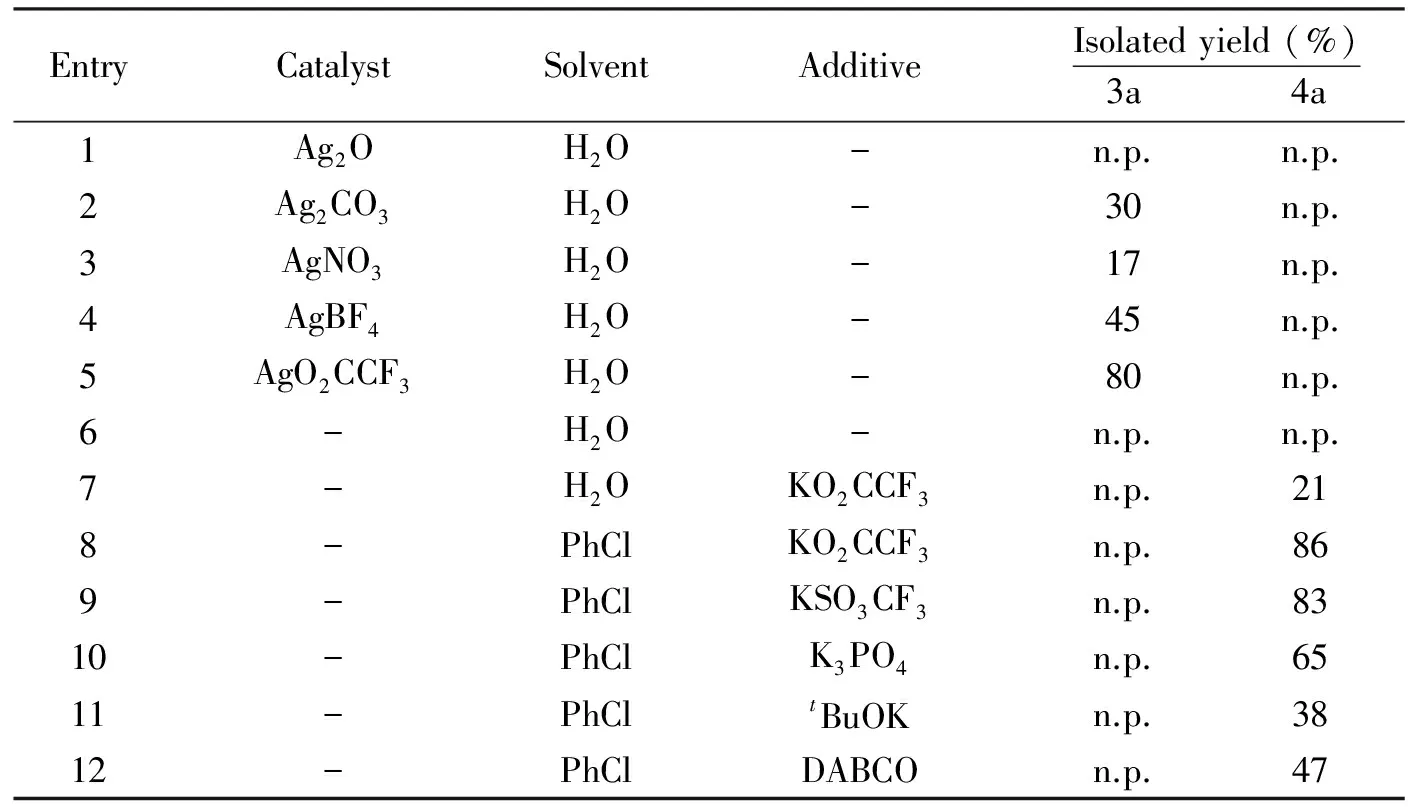
EntryCatalystSolventAdditiveIsolatedyield(%)3a 4a1Ag2OH2O-n.p.n.p.2Ag2CO3H2O-30n.p.3AgNO3H2O-17n.p.4AgBF4H2O-45n.p.5AgO2CCF3H2O-80n.p.6-H2O-n.p.n.p.7-H2OKO2CCF3n.p.218-PhClKO2CCF3n.p.869-PhClKSO3CF3n.p.8310-PhClK3PO4n.p.6511-PhCltBuOKn.p.3812-PhClDABCOn.p.47
2.2 吡啶并嘧啶酮类产物的合成
在最优化的反应条件下,我们对合成吡啶并嘧啶酮类产物的反应底物进行了拓展.如表2所示,首先选取了有代表性的2-氨基吡啶进行了测试.总体而言,当吡啶环上连有给电子基团和吸电子基团的底物都能得到对应的产物,但给电子基团更有利于反应的进行,这可能是由于当吡啶环上有给电子基团时,更有利于吡啶环外氮原子与炔烃三键进行Michael加成反应.值得注意的是含有卤素碘原子的底物能兼容该反应体系,这些产物能够在过渡金属的催化下,方便的实现进一步的转化.紧接着我们考察了含有取代基的苯丙炔酸乙酯对反应收率的影响,如供电子的叔丁基和吸电子的氯.反应都能顺利的进行,得到中等收率的产物.最后当2-氨基吡啶环上和苯丙炔酸酯的苯环上都有取代基团时,也能得到中等收率的产物.
表2 银催化合成吡啶并嘧啶酮的底物拓展

表3 碱催化合成咪唑并吡啶的底物拓展

2.3 咪唑并吡啶类产物的合成
在最佳反应条件下,我们也考察了合成咪唑并吡啶类产物的原料的适用性.如表3所示,总体而言,当2-氨基吡啶环上和苯丙炔酸酯的苯环上有给电子基团或者吸电子基团都能得到对应的产物.吡啶环上的取代基对反应收率影响较大,如有氯原子时,仅能得到中等收率.除了苯基取代的炔酸酯,杂环芳基取代的炔酸酯也能得到对应的产物.
3 结论
本文介绍了以2-氨基吡啶和炔酸酯合成吡啶并嘧啶酮和咪唑并吡啶的方法.该反应体系主要通过银盐和碱来调控生成产物的类型.在银盐的作用下,通过分子间的胺化和Michael加成串联反应合成了吡啶并嘧啶酮.与之前的方法相比,以水作为反应溶剂更加符合绿色化学的要求.在碱的作用下,该反应通过了分子间的环化和碳碳键断裂来构建咪唑并吡啶.新的方法用氯苯为溶剂取代了之前的三乙胺,有利于该反应的推广应用.此外该反应具有较好的官能团兼容性,得到较好的收率.本催化体系的实际应用和机理探讨还在继续研究中.
[1] Pires M J D, Poeira D L, Marques M M B. Metal-catalyzed cross-coupling reactions of aminopyridines[J].Eur. J. Org. Chem. 2015,7197-7234.
[2] Peng L, Gao X, Duan L, et al. Identification of pyrido[1,2-a]pyrimidine-4-ones as new molecules improving the transcriptional functions of estrogen-related receptor[J].J. Med. Chem. 2011,54:7729-7733.
[3] Xie Y, Chen T, Fu S, et al. Pd-catalzyed carbonylative cycloamidation of ketoimines for synthesis of pyrido[1,2-a]pyrimidin-4-ones[J].Chem. Commun. 2015,51:9377-9380.
[4] Guchhait S K, Priyadarshani G. Synthesis of 2-arylpyridopyrimidinones, 6-aryluracils, and tri- and tetrasubstituted conjugated alkenes via Pd-catalyzed enolic C-O bond activation-arylation[J].J. Org. Chem. 2015,80:6342-6349.
[5] Molnar A, Kapros A, Parkanyi L, et al. Suzuki-Miyaura cross-coupling reactions of halo derivatives of 4H-pyrido[1,2-a]pyrimidin-4-ones[J].Org. Biomol. Chem. 2011,9:6559-6565.
[6] Basahel S N, Ahmed N S, Narasimharao K, et al. Simple and efficient protocol for synthesis of pyrido[1,2-a]pyrimidin-4-one derivatives over solid heteropolyacid catalysts[J].RSC Adv. 2016,6:11921-11932.
[7] Bagdi A K, Santra S, Monir K, et al. Synthesis of imidazo[1,2-a]pyridines: a decade update[J].Chem. Commun. 2015,51:1555-1575.
[8] Pericherla K, Kaswan P, Pandey K, et al. Recent development in the synthesis of imidazo[1,2-a]pyridines[J].Synthesis, 2015,47:887-912.
[9] Hiebel M-A, Fall Y, Scherrmann M-C, et al. Straightforward synthesis of various 2,3-diarylimidazo[1,2-a]pyridines in PEG400medium through one-pot condensation and C-H arylation[J].Eur. J. Org. Chem. 2014,4643-4650.
[10] Patel H S, Linn J A, Drewry D H, et al. New synthetic approaches to estrogen receptor modulators: imidazo[1,2-a]pyridines[J].Tetrahedron Lett. 2003,44:4077-4080.
[11] Wang Y, Frett B, Li H, et al. Efficient access to 2,3-diarylimidazo[1,2-a]pyridines via a one-pot ligand-free, palladium-catalzyed three-component reaction under microwave irradiation[J].Org. Lett. 2014,16:3016-3019.
[12] Cao H, Zhan H, Lin Y, et al. Direct arylation of imidazo[1,2-a]pyridine at C-3 with aryl iodides, bromides, and triflates via copper-catalzyed C-H bond functionalization[J].Org. Lett. 2012,14:1688-1691.
[13] Huang H, Ji, X, Tang X, et al. Conversion of pyridine to imidazo[1,2-a]pyridines by copper-catalyzed aerobic dehydrogenative cyclization with oxime esters[J].Org. Lett. 2013,15:6254-6257.
[14] Chen Z, Wen Y, Luo G, et al. Transition-metal-free C-C bond cleavage and formation: efficient synthesis of 2,3-diarylimidazo[1,2-a]pyridines from 2-aminopyridines and alkynoates[J].RSC Adv. 2016,6:86464-86467.
The Study of the Cyclization Reaction of 2-Aminopyridines and Alkynoates
CHEN Zhengwang, WEN Yuelu, CHEN Hai,DING Hao, ZENG Xiangzhen, WANG Qinghao
(SchoolofChemistryandChemicalEngineering,GannanNormalUniversity,Ganzhou341000,China)
An efficient AgO2CCF3-catalyzed 2-aminopyridines with alkynoates in water to synthesis of pyridopyrimidinones has been developed. Imidazopyridines were afforded when KO2CCF3was used as catalyst and chlorobenzene was solvent from the same raw materials. We also optimized the reaction conditions, and examined the scope of the substrates.
aminopyridine; alkynoate; pyridopyrimidinone; imidazopyridine
2016-10-24
10.13698/j.cnki.cn36-1346/c.2016.06.013
江西省教育厅科技项目(GJJ151005);国家级大学生创新创业项目(CX161002)
陈正旺(1981-),男,湖北罗田人,赣南师范大学化学化工学院副教授,研究方向:药物合成及有机合成方法学.
† 通讯作者:王青豪(1963-),男,江西永新人,赣南师范大学化学化工学院教授,研究方向:药物合成.
http://www.cnki.net/kcms/detail/36.1037.C.20161209.1515.028.html
O62
A
1004-8332(2016)06-0057-05

