鼓粒期叶施烯效唑和激动素对绿豆叶片碳代谢及籽粒产量的影响
刘 洋,郑殿峰*,冯乃杰,张红梅,张盼盼,陈文浩,刘 涛,龚 屾
(1.黑龙江八一农垦大学农学院化控实验室,黑龙江 大庆 163319;2.黑龙江八一农垦大学生命科学技术学院,分子生物学实验室,黑龙江 大庆 163319;3.中国农业大学农学与生物技术学院,北京 100193)
鼓粒期叶施烯效唑和激动素对绿豆叶片碳代谢及籽粒产量的影响
刘 洋1,郑殿峰1*,冯乃杰1,张红梅2,张盼盼1,陈文浩3,刘 涛1,龚 屾1
(1.黑龙江八一农垦大学农学院化控实验室,黑龙江 大庆 163319;2.黑龙江八一农垦大学生命科学技术学院,分子生物学实验室,黑龙江 大庆 163319;3.中国农业大学农学与生物技术学院,北京 100193)
研究了鼓粒期叶施烯效唑和激动素对绿豆叶片光合特性、糖分积累、保护性酶及籽粒产量的影响。结果表明:与对照相比,两处理不同程度提高了绿豆鼓粒期至成熟期叶片叶绿素、糖分含量及SOD、POD和CAT活性并且降低了MDA含量;2013年烯效唑和激动素分别较对照产量提高了22.84 %、3.63 %;2014年烯效唑和激动素分别较对照产量提高了26.19 %、44.26 %。综上所述,烯效唑和激动素能有效提高绿豆籽粒产量。
绿豆;烯效唑;激动素;碳代谢;籽粒产量
绿豆[Vignaradiata(Linn.) Wilczek.]是中国的传统豆科植物,具有两千年种植历史。与大豆和菜豆相比,绿豆拥有更丰富的维生素和矿物质[1]。绿豆适应性强,耐旱、耐瘠,生育期短,并有固氮养地作用,在农业种植结构调整和高产、优质、高效农业发展中具有重要作用[2]。
烯效唑(Uniconazole,S3307)是20世纪90年代开发应用的一种新型植物生长延缓剂,具有生物活性高、使用安全等特点,具有壮苗、抗逆、提高品质和产量等作用,常用在作物生长、发育、抗逆、产量等方面的调控[3]。生理机制在于它影响贝壳杉烯氧酶活性,减少GA的前体原料的形成,阻抑内源GA的合成,降低内源GA水平,并可降低内源IAA的水平。Sekimoto[4]研究发现对小麦喷施烯效唑,会使其根系发育健壮,形态和生理指标均优于对照。激动素(Kinetin,KT)是一种非天然的细胞分裂素,属于生长促进剂。国外研究表明[5-6]激动素处理可以降低绿豆叶绿素含量和豆科植物的糖含量并对豆科根系也有一定的促进增长的作用。

表1 0~20 cm耕层土壤基础养分状况
为了探索烯效唑和激动素对绿豆生理代谢和籽粒产量的调控效应,研究其对绿豆光合生理、糖分积累、保护性酶及籽粒产量的影响,探讨绿豆内部生理结构,以及生育后期叶片光合表现,为绿豆高产优质栽培提供理论依据。
1 材料与方法
1.1 试验材料与试验区概况
试验选用东北主栽品种小明绿,植物生长调节剂为烯效唑和激动素(浓度均为30 mg·L-1),试验于 2013年5月至2014年9月进行。大田试验地点设在黑龙江省大庆市林甸县宏伟乡吉祥村黑龙江八一农垦大学试验基地,土壤类型为草甸黑钙土,0~20 cm耕层土壤基础养分状况见表1。
1.2 试验设计与田间管理
采用随机区组试验设计,2013年5月16日播种,9月10日收获;2014年5月22日播种,9月13日收获,密度均为179 910株/hm2,行距为0.65 m,小区为9行区,4次重复,双行精量点播,真叶期人工定苗,播种、施肥、除草等田间管理措施与常规生产一致。
1.3 取样项目及测定方法
从喷药后第7天开始取样,每隔5 d取1次,每次取样10株,各部位分别装入封口袋装入液氮中速冻30 min后置于-40 ℃超低温冰箱保存待测。生理指标可溶性糖、蔗糖、果糖和淀粉含量的测定采用张志良[7]的方法,SOD活性采用Ginnopolitis等[8]NBT光化还原法、POD活性采用Sigma法[9]测定、CAT活性采用Beers和Sizers改进法[9]测定和MDA含量采用Heath等[10]的硫代巴比妥酸TBA法测定,叶绿素含量测定采用美国OPTI-sciences CCM-200 PLUS叶绿素测定仪,光合指标的测定采用ECA-PB0401便携式光合测定仪进行测定,于晴天上午9: 00-11: 00在每处理中选择受光方向和生长状况一致的倒三功能叶片。产量测定在收获期每小区取10株进行考种,测定株高、茎粗、节数、单株荚数、有效荚数、百粒重。
1.4 数据处理与统计分析方法
数据处理和绘图运用Office Excel 2003,采用SPSS 19.0进行方差分析。
2 结果与分析
2.1 鼓粒期叶施烯效唑和激动素对绿豆叶片光合生理的影响
2.1.1 鼓粒期叶施烯效唑和激动素对绿豆叶片光合特性的影响 如表2所示,渍涝胁迫下鼓粒后期叶施烯效唑和激动素处理的光合速率高于CK,且差异显著(P<0.05)。说明鼓粒期叶施烯效唑和激动素可以有效调控绿豆叶片的光合速率;烯效唑处理蒸腾速率高于激动素和对照,激动素处理的蒸腾速率未达到显著水平;烯效唑处理水分利用效率也高于激动素和对照,烯效唑处理在鼓粒后期提高绿豆叶片水分利用效率,促进了绿豆植株体内的物质运输,利于籽粒内含物质的充实和积累。
2.1.2 鼓粒期叶施烯效唑和激动素对绿豆叶绿素含量的影响 如图1所示,喷药后7~17 d,烯效唑处理叶绿素含量先上升后下降趋势,而对照处理叶绿素含量缓慢下降;喷药后第17天,各个处理叶绿素含量基本一致。喷药后17~27 d,激动素处理叶绿素含量缓慢下降,对照处理叶绿素含量上升后下降;相反烯效唑处理先下降后上升,延缓型调节剂烯效唑在生育后期促进绿豆叶绿素含量迅速升高,说明烯效唑处理对绿豆叶绿素含量有一定的促进作用。

表2 鼓粒期叶施烯效唑和激动素对绿豆R6期叶片光合速率、蒸腾速率和水分利用效率的影响
注:同一列中不同大小写字母分别表示差异达1 %和5 %显著水平。 Note:Values followed by a different lowercase or capital within each column are significantly different at 0.05 and 0.01 probability levels, respectively.

图1 S3307和KT对绿豆叶绿素含量的影响Fig.1 Effects of S3307 and KT on chlorophyll content of mung bean leaves
2.2 鼓粒期叶施烯效唑和激动素对绿豆叶片糖分积累的影响
2.2.1 鼓粒期叶施烯效唑和激动素对绿豆叶片可溶性糖和蔗糖含量的影响 如图2所示,喷药后激动素处理整个取样时间内可溶性糖的含量都高于烯效唑处理和对照,其可溶性糖含量变化呈单峰曲线,峰值出现在第17天,然后缓慢下降,成熟期降到最低值,比烯效唑和对照可溶性糖含量增加了231.53 %和277.98 %;烯效唑处理在喷药7 d后可溶性糖含量与对照持平,12 d达到峰值,12~17 d迅速下降,第17天降到对照的17.74 %,其变化趋势和对照基本一致。总体看,调节剂能够有效的调控绿豆叶片可溶性糖含量,促进型调节剂激动素处理可以提高叶片可溶性糖的含量并推迟峰期;延缓型调节剂烯效唑变化趋势和对照基本一致,但可溶性糖含量高于对照。
如图3所示,激动素处理和对照叶片蔗糖变化趋势均为单峰曲线,喷药后12 d烯效唑处理出现峰值,而喷药后12~17 d呈下降趋势,喷药后17~22 d烯效唑和激动素处理与对照下降趋势线基本一致,且激动素处理一直高于对照,其峰值比烯效唑处理和对照的蔗糖含量增加了45.42 %和10.80 %。总体来看,促进型调节剂激动素可以提高叶片蔗糖含量且变化趋势与对照一致,延缓型调节剂烯效唑前期蔗糖含量高,峰值出现早,而后期低于促进型调节剂激动素和对照。
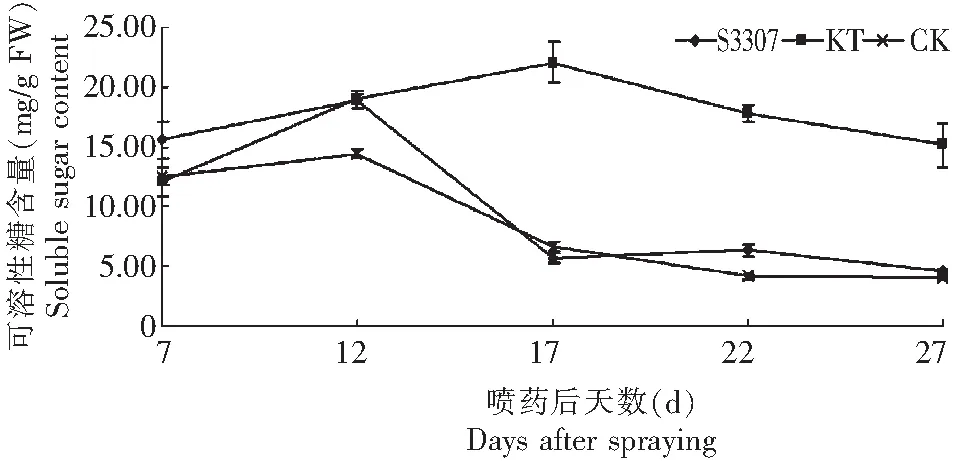
图2 S3307和KT对绿豆叶片可溶性糖糖含量的影响Fig.2 Effects of S3307 and KT on soluble sugar content of mung bean leaves
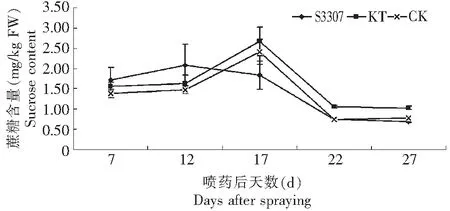
图3 S3307和KT对绿豆叶片蔗糖含量的影响Fig.3 Effects of S3307 and KT on sucrose content of mung bean leaves
2.2.2 鼓粒期叶施烯效唑和激动素对绿豆叶片果糖和淀粉含量的影响 图4所示,烯效唑处理果糖含量变化呈单峰曲线,喷药后7~17 d,缓慢上升,峰值出现在喷药后17 d,然后缓慢下降,成熟期达到最低值;喷药后7~27 d,激动素和对照处理趋势线基本一致,峰值均出现在喷药后第17天,然后均缓慢下降,成熟期达到最低值,对照处理果糖含量最高,高于烯效唑和激动素处理果糖含量15.93 %和21.15 %。总体看,调节剂能够有效的调控绿豆叶片果糖含量。 图5为烯效唑和激动素处理对绿豆叶片淀粉含量的影响,烯效唑处理趋势线呈双峰曲线,峰在第12天,第17天为烯效唑处理淀粉含量最低值;喷药后7~27 d,激动素处理趋势线呈“下降-上升-下降”趋势;喷药后7~22 d,对照处理趋势线持平,22~27 d,对照处理淀粉含量缓慢下降,第27天,对照高于烯效唑和激动素处理淀粉含量12.70 %和61.97 %,烯效唑处理更有利叶片淀粉淀粉含量的输出,激动素处理次之。

图4 S3307和KT对绿豆叶片果糖含量的影响Fig.4 Effect of S3307 and KT on fructose content of mung bean leaves

图5 S3307和KT对绿豆叶片淀粉含量的影响Fig.5 Effect of S3307 and KT on starch content of mung bean leaves

表3 鼓粒期叶施烯效唑和激动素对绿豆叶片SOD和POD活性的影响
注:同一列中不同大小写字母分别表示差异达1 %和5 %显著水平。 Note:Values followed by a different lowercase or capital within each column are significantly different at 0.05 and 0.01 probability levels respectively.
2.3 鼓粒期叶施烯效唑和KT对绿豆叶片保护性酶的影响
2.3.1 鼓粒期叶施烯效唑和激动素对绿豆叶片超氧化物歧化酶和过氧化物酶活性的影响 如表3所示,喷药后7~12 d,烯效唑处理SOD活性降低,喷药后12~22 d,烯效唑处理SOD活性迅速升高,喷药后22 d活性达到最高值,高于激动素和对照处理SOD活性含量51.42 %和9.91 %。喷药后17~22 d,激动素和对照处理SOD活性也迅速升高但均低于烯效唑。喷药后22~27 d,三处理SOD活性均降低,且对照为最低值。总体来看,烯效唑和激动素均能提高绿豆叶片SOD活性,使活性氧的清除能力增强,可以保护细胞膜免受损伤,进而延缓叶片衰老,有利于剩余后期叶片光合作用的进行。
喷药后7~17 d,烯效唑处理POD活性先升高后下降,激动素处理POD活性缓慢升高,而对照呈先下降后上升趋势;而喷药后22~27 d左右,烯效唑和激动素处理POD活性均升高,烯效唑处理POD活性最高,分别比激动素和对照增加60.45 %和22.68 %。
2.3.2 鼓粒期叶施烯效唑和激动素对绿豆叶片过氧化氢酶活性的影响 图6所示,喷药后7~17 d,激动素处理CAT活性先下降后上升,烯效唑处理CAT活性高于CK,喷药后17~22 d,两处理和对照处理CAT活性趋势线基本一致,喷药后22~27 d左右,烯效唑处理活性显著高于激动素和CK。综合分析可以看出,烯效唑对绿豆叶片CAT活性调控效果较好,越到生育后期越显著,其次是激动素。调节剂处理能有效调控绿豆叶片CAT活性,有利于叶片中各种代谢反应的进行。

图6 S3307和KT对绿豆叶片CAT活性的影响Fig.6 Effect of S3307 and KT on CAT activity in mung bean leaves
2.3.3 鼓粒期叶施烯效唑和激动素对绿豆叶片丙二醛含量的影响 如图7所示,喷施后第7~12天,激动素处理MDA含量上升,随着生育期推进,激动素处理MDA含量缓慢下降,表明调节剂处理后细胞的膜质过氧化程度减轻。烯效唑和对照趋势线基本一致,在整个取样时间段,表现均为先缓慢上升后平滑下降趋势。鼓粒期至收获期,绿豆处于生长发育后期,伴随着籽粒的成熟,叶片已经开始慢慢衰老,MDA含量下降可以延缓绿豆叶片的衰老,防止叶片早衰,这对生育后期光合产物的形成具有重要的意义。
2.4 鼓粒期叶施烯效唑和激动素对绿豆产量及其构成因素的影响
如表4可知,鼓粒期叶面喷施烯效唑和激动素处理均不同程度的提高了绿豆产量。2013年烯效唑和激动素处理降低了株高,而2014年两处理均提高了株高,但都未到达差异显著水平。2013年,烯效唑处理增加了绿豆单株荚数和百粒重,其中茎粗与对照达显著水平(P<0.05)和极显著水平(P<0.01),烯效唑和激动素处理分别较对照产量提高了16.19 %、2.61 %,且烯效唑处理达到显著水平(P<0.05)和极显著水平(P<0.01);2014年,与对照相比,两处理均增加了绿豆株高、单株荚数、单株粒数和百粒重,烯效唑和激动素分别较对照产量提高了26.43 %、13.05 %。连续2年调节剂处理均比对照高产,说明烯效唑和激动素对绿豆高产有一定的调控作用。
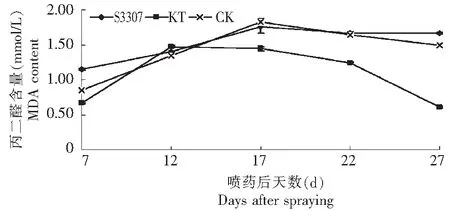
图7 S3307和KT对绿豆叶片MDA含量的影响Fig.7 Effect of S3307 and KT on MDA content in mung bean leaves

表4 鼓粒期叶施烯效唑和KT对绿豆产量及其构成因素的影响
注:同一列中不同大小写字母分别表示差异达1 %和5 %显著水平。 Note:Values followed by a different lowercase or capital within each column are significantly different at 0.05 and 0.01 probability levels, respectively.
3 讨论与结论
叶片是进行光合作用场所,叶片衰老会导致光合作用的下降,所以绿豆叶片在鼓粒期衰老快慢会影响绿豆结荚率和产量。植物生长调节剂在调控植物的光合作用、碳水化合物的运输与分配等方面都有一定的调控作用[11-12]。郑殿峰认为植物生长调节剂可以提高大豆叶片的光合速率和水分利用效率,对生育后期叶片水分利用效率的促进作用较大[13]。本研究在阴雨天气条件下,导致绿豆叶片气孔关闭,烯效唑对绿豆叶片光合速率、蒸腾速率以及水分利用效率均有不同程度的提高,激动素除蒸腾速率和水分利用效率外,光合速率较对照升高了80.69 %,且达到差异显著(P<0.05)和极显著水平(P<0.01)。
糖分含量反映了作物体内作为有效态营养物的碳水化合物和能量水平,绿豆叶片糖分含量高低,反映了叶片合成光合产物的能力。前人研究表明植物生长调节剂可以增加大豆叶片中蔗糖、淀粉和可溶性糖含量,为高产奠定了良好的物质基础[14]。本研究中激动素增加了绿豆可溶性糖和蔗糖含量,而激动素处理果糖和淀粉含量均低于对照,这可能与取样时阴雨天气有关,影响了绿豆内部生理代谢结构;而烯效唑可溶性糖和蔗糖含量在喷药后第17天达到了峰值,两个糖分指标分别比激动素处理高出了323.08 %和36.36 %,由此可以看出,烯效唑要比激动素处理在糖分积累方面表现得更为显著。
植物体内的SOD和POD在抵御活性氧伤害中扮演着重要的角色。有研究证实,植物体内的SOD和POD会表现出升高和降低两种不同的变化趋势。本研究发现,SOD和POD活性的变化趋势表现出明显的一致性和同步性。在喷药后7~12 d,烯效唑和激动素均表现趋于稳定,而在喷药后12~22 d,烯效唑和激动素处理开始迅速上升,烯效唑比对照SOD活性高,激动素处理SOD活性一直低于对照。到了成熟期,三处理SOD活性才开始缓慢下降。
国外学者研究发现随着烟草叶片的衰老,膜透性与脂质过氧化产物MDA含量增加,SOD和CAT活性降低,丼认为叶片衰老可能是膜脂过氧化所致[28]。本研究发现,在第17天开始,对照的MDA含量开始显著增加且高于烯效唑和激动素,造成这一差异可能是由于供试材料不同所致。
绿豆产量由鼓粒期决定,鼓粒期叶施烯效唑和激动素能增加绿豆单株粒数和百粒重,连续两年的大田试验中,烯效唑和激动素处理均不同程度提高绿豆产量,2013年烯效唑和激动素分别较对照产量提高了22.84 %、3.63 %;2014年烯效唑和激动素分别较对照产量提高了26.19 %、44.26 %,总体来看烯效唑和激动素能有效提高绿豆产量及其影响因素。
本研究连续两年试验均赶上绿豆生育期偏涝年型,绿豆的生育期约120d,本研究有1/3以上的时间绿豆生长在渍涝环境下,会造成产量降低。然而目前中国绿豆的防涝水平还停留在20世纪80年代水平,主要通过抽水和覆土等措施来降低渍涝的损失,其技术措施繁重而且效率低下。而烯效唑和激动素能够有效地影响和控制作物的生长发育,不但操作方便,且效率较高,能起到很好的预防渍涝灾害,从而确保绿豆高产。而关于正常年份下烯效唑和激动素对绿豆生育和产量的影响,有待进一步深入研究。
前人研究植物生长调节剂基本都在大豆、玉米、小麦和水稻上,而杂粮——绿豆大田生产中运用植物生长调节剂却少有报道,本研究发现烯效唑和激动素可以有效调控了绿豆生殖生长的光合特性、糖分积累及叶片内保护性酶活性的影响,从而提高了籽粒产量,为绿豆高产、优质、高效生产中的植物生长调节剂施用技术提供理论依据。
[1]A.E. Mubarak. Food Chemistry[M]. 2005: 489-495.
[2]Izumi K. Studies of sites of action of a new plant growth retardant(E)-1-(4-chlorophenyl)-4, 4-dimenethyl-2-(1,2,4-triazol-l-yl)-1-penten-3-ol and comparative effects of its stereoisomers in a cell-free system from Cucurbita maxima[J]. Plant Cell Physiology,1985(1):821-827.
[3]Shakeel Ahmad Aunjum. Exogenous application of some potential growth regulators for improving drought tolerance in maize and soybean[D]. Southwestern University,2011.
[4]Sekimoto H, Nishikawa. Effects of gibbrellin biosynthesis inhibitor and ammonium nitrogen on elongation of rice second leaf[J]. Japanese Journal of Soil Science and Plant Nutritions, 1994(2):190-193.
[5]G. H. Rabie. Influence of arbuscular mycorrhizal fungi and kinetin on the response of mung bean plants to irrigation with seawater[J]. Mycorrhiza, 2005(3):225-230.
[6]Nemat-Alla M, Younis M, El-Shihaby O, El-Bastawisy Z Kinetin regulation of growth and secondary metabolism in water logging and salinity treated Vigna sinensis and Zea mays[J]. Acta Physiol Plant, 2002:19-27.
[7]张志良,翟伟菁.植物生理学实验指导[M].北京:高等教育出版社,2008: 128-133.
[8]Giannopolitis C N, Ries S K. Superoxide dismutases: I. Occurrence in higher plants[J]. Plant Physiol, 1977(3):309-314.
[9]Qian J Y. Method for determination of enzyme[M]. Beijing: China Light Industry Press, 1992:186-194.
[10]Heath R L, Packer L. Photoper oxidation in isolated chloroplasts:1.Kinetics and stoichiometry of fatty acid peroxidation[J]. Arch Biochemistry and Biophysics,1968(5):189-198.
[11]Flore J A, Lakso A N. Environmental and physiological regulation of photosynthesis in fruit crops[J]. Horticultural Reviews, 1989(6): 111-146.
[12]Ookawa T, Naruoka Y, Sayama A, et al. Cytokinin effects on ribulose-1, 5-bisphosphate carboxylase oxygenase and nitrogen partitioning in rice during ripening[J].Crop Science,2004(6): 2107-2115.
[13]郑殿峰,赵玖香,赵黎明.植物生长调节剂对大豆光合作用和同化物分配的影响[J].西南农业学报,2008,21(5):1265-1269.
[14]Dhindsa R S,Plumb-Dhindsa P L,Thorpe T A. Leaf Senescence correlated with increared levels of membrane permeability and lipid peroxidation and decreased levels of superoxide desmutase and catalase[J]. Exp Bot, 1981(4):93-101.
(责任编辑 李 洁)
Effects of Spraying Uniconazole and Kinetin in Leaves of Carbon Metabolism and Grain Yield on Mung Bean in R6
LIU Yang1, ZHENG Dian-feng1*, FENG Nai-jie1, ZHANG Hong-mei2, ZHANG Pan-pan1, CHEN Wen-hao3, LIU Tao1, GONG Shen1
(1.Chemical Control Room College of Agronomy, Heilongjiang Bayi Agricultural University, Heilongjiang Daqing 163319, China; 2.Molecular Biology Lab, Heilongjiang Bayi Agricultural University, Heilongjiang Daqing 163319, China; 3.College of Agriculture and Biotechnology, China Agricultural University, Beijing 100193, China)
Field experiments were conducted in 2013 and 2014 for two consecutive years in Heilongjiang province DAQING city LINDIAN country HONGWEI citytown JIXIANG village Heilongjiang Bayi Agricultural University test site. The effect of spraying uniconazole and kinetin in leaves of the photosynthetic characteristics, sugar accumulation, protective enzyme and grain yield on mung bean in R6 was researched. Two different processing degree improves the mung bean drum grain period to mature leaf chlorophyll, sugar content and SOD, POD and CAT activity and reduce MDA content. Uniconazole and kinetin than control grain yield increased by 22.84 % and 3.63 % respectively in 2013, uniconazole and kinetin than control grain yield increased by 26.19 % and 44.26 % respectively in 2014. From discussed above, uniconazole and kinetin can improve mung bean grain yield effectively.
Mung bean; Uniconazole; Kinetin; Carbon metabolism; Grain yield
1001-4829(2016)07-1584-06
10.16213/j.cnki.scjas.2016.07.015
2015-06-17
国家科技支撑计划课题(2014BAD07B05);国家杂粮工程技术研究中心组建项目(2011FU125X07);黑龙江农垦总局科技攻关项目;国家科技支撑计划项目子课题(2014BAD07B05-H07);黑龙江省教育厅科学技术研究项目(12541599);黑龙江八一农垦大学研究生创新科研项目(YJSCX2015-Y03)
刘 洋(1989-),女,哈尔滨人,硕士,主要从事作物栽培生理生化研究,E-mail: xiaofeixiabidepan@126.com,*为通讯作者。
S522
A

