局部给予去铁敏对卵巢切除大鼠骨量减少的抑制作用*
李长英 赵 强
(济宁市第一人民医院,山东 济宁 272000)
局部给予去铁敏对卵巢切除大鼠骨量减少的抑制作用*
李长英 赵 强
(济宁市第一人民医院,山东 济宁 272000)
目的 探讨骨组织局部给予促血管形成药物去铁敏对卵巢切除大鼠骨量减少的抑制作用。方法 30只3月龄SD雌性大鼠随机分为假手术组(Sham组)、卵巢切除组(OVX组)、卵巢切除后股骨局部给予去铁敏治疗组,4周后取大鼠右股骨进行Micro-CT检测大鼠股骨远端骨量变化。结果 大鼠卵巢切除后4周体重较假手术组增加明显(P<0.05),而卵巢显著萎缩(P<0.01)。大鼠卵巢切除后4周,股骨远侧干骺端小梁骨骨密度较Sham组大鼠下降18.8%(P<0.01),而局部给予去铁敏组大鼠股骨远侧干骺端小梁骨骨密度较Sham组大鼠相比无显著性差异(P>0.05)。OVX组大鼠股骨远侧干骺端小梁骨较Sham组BV/TV下降24.4%(P<0.01),DFO组大鼠股骨远侧干骺端小梁骨BV/TV较Sham组大鼠相比无显著性差异(P>0.05)。结论 大鼠卵巢切除后股骨局部给予促血管形成药物去铁敏可以抑制局部骨量的减少。
绝经后骨质疏松;骨量丢失;去铁敏
骨髓腔内窦状隙和动脉毛细血管数量的减少是骨质疏松症的一个典型特点[1],另外,在骨质疏松的骨组织中,骨的血流量亦明显下降[2],这表明血管和骨之间存在着密切的偶联关系,血管因素可能在骨质疏松症的发病机理中起重要的作用。另外,前期实验表明,通过条件性基因敲除增加小鼠骨内血管数量可以显著抑制卵巢切除引起的骨量下降[3]。本实验通过局部给予促进血管形成药物去铁敏(DFO)探讨对卵巢切除大鼠局部骨量的影响,从而为绝经后骨质疏松症的预防和治疗探讨新的思路和方法。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级3月龄雌性Sprague-Dawley大鼠50只,体重217.34±15.12 g,购于上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2003-0003)。
1.1.2 药物 去铁敏(Sigma,美国)。
1.1.3 实验仪器与试剂 Micro-CT(Lotus SP,美国), 4%多聚甲醛(Sigma,美国)。
1.2 方法
1.2.1 动物分组 将3月龄SD大鼠随机分为假手术组(Sham组,10只)、卵巢切除组(OVX组,10只)、卵巢切除后局部给予去铁敏40 μM治疗组(DFO 40 μM组,10只)、卵巢切除后局部给予去铁敏200 μM治疗组(DFO 200 μM组,10只)、卵巢切除后局部给予去铁敏1000 μM治疗组(DFO 1000 μM组,10只)。
1.2.2 模型制作 OVX组及DFO组大鼠切除双侧卵巢,Sham组大鼠只切除卵巢周围部分脂肪组织,不切除卵巢。3组大鼠均于右侧股骨下端关节面上方9 mm处外侧做一直径1 mm骨孔,骨孔内放置PE-50管,并使用氰基丙烯酸盐粘合剂将PE-50管一端固定于骨孔,另一端通过皮下露出于背部皮肤并夹闭管腔。
1.2.3 给药方法 术后第2 d开始,DFO组分别通过PE-50管注入大鼠右股骨远端20 μL 40 μM 、200 μM、1000 μM DFO ,Sham组和OVX组注入生理盐水20 μL。隔日一次,共5次。
1.2.4 取材方法与检测指标 术后4周取各组大鼠右侧股骨,标本用生理盐水纱布包裹,-20 ℃储存。使用Micro-CT对各时间点各组大鼠股骨做逐层扫描并分别测量分析大鼠股骨远侧干骺端小梁骨密度(BMD)和小梁骨的静态微观结构参数,包括小梁骨厚度(Tb.Th.)、小梁骨数量(Tb.N.)以及小梁骨间距(Tb.Sp.)。
1.3 统计学分析
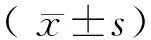
2 结 果
2.1 各组大鼠体重的变化
手术前各组大鼠体重无明显差别,卵巢切除后大鼠体重较假手术组显著增加(P<0.05)。
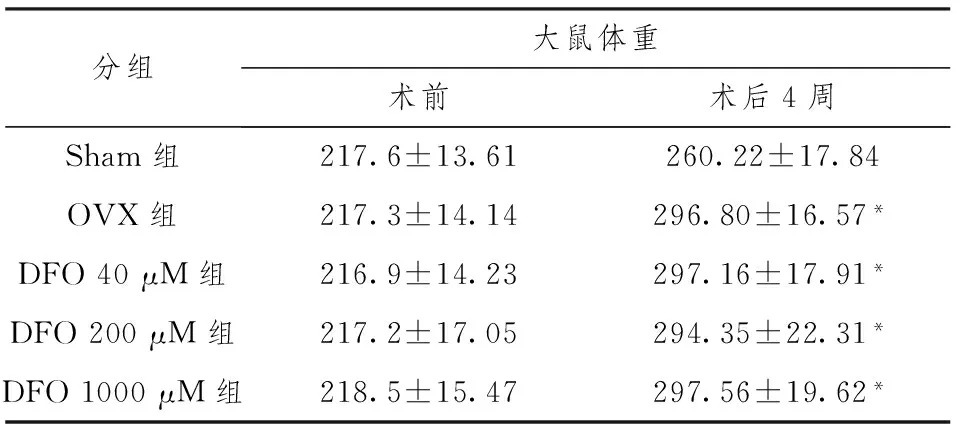
表1 各组大鼠体重(g)
2.2 各组大鼠子宫重量
卵巢切除4周后,OVX组及DFO组大鼠子宫较Sham组萎缩明显,子宫重量显著下降(与Sham组相比,P<0.01)。

表2 各组大鼠子宫重量(g)
*与Sham组相比,P<0.01
2.3 各组大鼠股骨远端骨量分析
卵巢切除大鼠给药4周后,OVX组大鼠股骨远侧干骺端小梁骨骨密度较Sham组大鼠下降18.8%,而DFO 200 μM组大鼠股骨远侧干骺端小梁骨骨密度较Sham组大鼠相比无显著性差异。OVX组大鼠股骨远侧干骺端小梁骨较Sham组BV/TV下降24.4%,DFO 200 μM组大鼠股骨远侧干骺端小梁骨BV/TV与Sham组大鼠相比无显著性差异(表3)。
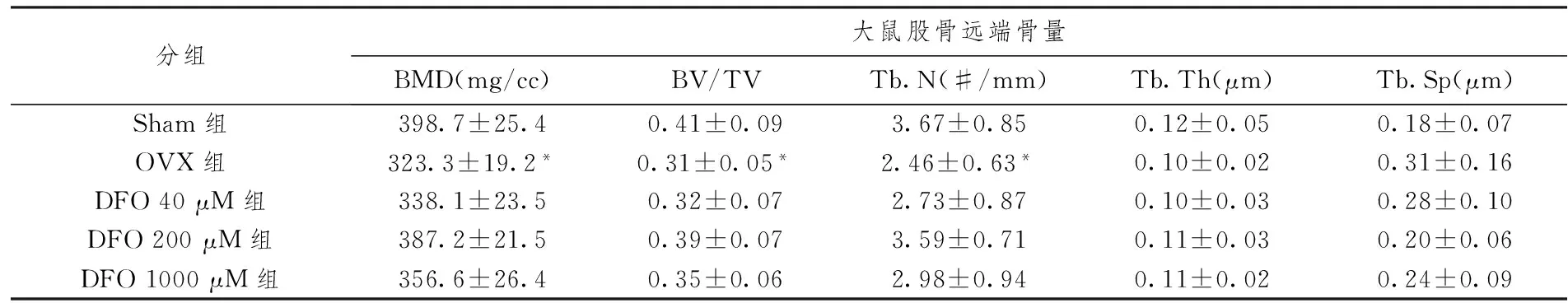
表3 各组大鼠股骨远端骨量分析(g)
3 讨 论
骨质疏松症是一种以低骨量和骨微观结构的退变为特征,由此引起骨的脆性增加并易于发生骨折的骨骼系统疾病。女性绝经后体内雌激素缺乏是引起骨质疏松症最为常见的原因。绝经后妇女由于体内雌激素缺乏,破骨细胞生存期延长而成骨细胞生存期降低[4],从而引起骨转化率明显增加,导致骨形成和骨吸收间的平衡被打破,骨吸收大于骨形成,结果引起骨量的净丢失和骨微观结构的退变。本次实验,大鼠卵巢切除后4周子宫重量显著下降,且股骨远端小梁骨BMD下降,表明骨质疏松模型造模成功。骨的塑形过程与血管形成是紧密偶联的。血管可以将循环的成骨细胞[5]和破骨细胞前体细胞[6]运送到骨的改建部位,此外,血管内皮细胞可以有效地诱导骨髓间充质干细胞向成骨细胞谱系分化[7]。另一方面,血管形成相关因子如血管内皮细胞生长因子(VEGF)可以调控前成骨细胞的募集、增殖和向成骨细胞的分化以及成骨细胞和破骨细胞的活性,在骨代谢中起到重要作用[8-9]。这表明血管可能在骨形成过程中起极其重要的作用。
去铁敏(DFO)可以通过低氧诱导因子途径增加局部血管内皮生长因子表达并促进局部血管生长[10]。本次实验证实,大鼠卵巢切除后4周,股骨远端小梁骨BMD显著下降,在小梁骨的结构参数中,卵巢切除大鼠股骨远侧干骺部小梁骨数量明显减少,而小梁骨厚度下降相对不明显,说明在OVX导致的小梁骨BMD下降中,小梁骨数量的减少可能起到主要作用。本次实验中使用40 μM、200 μM及1000 μM三种浓度DFO局部给药,虽均能在一定程度上抑制卵巢切除大鼠股骨远端骨量丢失,但200 μM组效果最为显著,表明200 μM浓度可能更有利于抑制卵巢切除大鼠骨量的丢失。局部给予DFO治疗可阻止卵巢切除引起的骨量丢失,并维持了小梁骨的数量和小梁骨厚度,证明DFO在防治卵巢切除大鼠骨量丢失、小梁骨微观结构退变等方面具有十分有效的作用,进一步证实了血管在骨质疏松的发病中可能起重要作用。我们推测,通过增加骨内血管数量可有效减少体内雌激素缺乏引起的骨量丢失和骨质疏松症,从而为绝经后骨质疏松症的预防和治疗提供了新的思路和方法。
[1] Burkhardt R, Kettner G, Bohm W.Changes in trabecular bone, hematopoiesis and bone marrow vessels in aplastic anemia, primary osteoporosis, and old age: a comparative histomorphometric study[J].Bone,1987,8(3):157-164.
[2] Griffith JF, Wang YX, Zhou H.Reduced Bone Perfusion in Osteoporosis: Likely Causes in an Ovariectomy Rat Model[J].Radiology,2010,254(3):739-46.
[3] Zhao Q, Shen X, Zhang W.Mice with increased angiogenesis and osteogenesis due to conditional activation of HIF pathway in osteoblasts are protected from ovariectomy induced bone loss[J].Bone,2012,50(3):763-770.
[4] Westerlind KC, Wronski TJ, Ritman EL.Estrogen regulates the rate of bone turnover but bone balance in ovariectomized rats is modulated by prevailing mechanical strain[J].Proc Natl Acad Sci USA,1997,94(8):4199-4204.
[5] Eghbali-Fatourechi GZ, Lamsam J, Fraser D.Circulating osteoblast-lineage cells in humans[J].N Engl J Med,2005,352:1959-1966.
[6] Kassem M, Risteli L, Mosekilde L.Formation of osteoblast-like cells from human mononuclear bone marrow cultures[J].APMIS,1991,99:269-274.
[7] Kaigler D, Krebsbach PH, Polverini PJ.Role of vascular endothelial growth factor in bone marrow stromal cell modulation of endothelial cells[J].Tissue Eng,2003,9:95-103.
[8] Brandi ML, Collin-Osdoby P.Vascular biology and the skeleton[J].J Bone Miner Res,2006,21:183-192.
[9] Sagsoz H, Liman N, Alan E.Expression of vascular endothelial growth factor receptors and their ligands in rat uterus during the postpartum involution period[J].Biotech Histochem,2015,90(5):361-364.
[10] Xing Shen,Chao Wan,Girish Ramaswamy.Proly Hydroxylase inhibitors cncrease neoangiogenesis and callus formation following femur fracture in mice[J].Journal of orthopaedic research,2009,10:1298-1305.
Effect of desferrioxamine applied locally on preventing bone loss in ovariectomized rats
LI Chang-ying ZHAO Qiang
(Jining NO.1 People's Hospital,Jining 272000,China)
Objective: To investigate the effect of Desferrioxamine(DFO) on preventing bone loss in ovariectomized rats.Methods: 3-month-old female SD rats were randomized into the following three groups, sham-operated control(Sham), ovariectomized group(OVX), OVX+ Desferrioxamine(DFO).The animals' femur were administered locally respectively with vehicle , or Desferrioxamine.4w later, the quality of femur was analyzed to evaluate the effects of Desferrioxamine on estrogen deficiency-induced bone loss.Results: Ovariectomy resulted in a pronounced deterioration of bone mass.DFO could inhibit bone loss after OVX.Conclusion: Local application of DFO was effective to inhibit bone loss of OVX rats.
postmenopausal osteoporosis;bone Loss;DFO
李长英(1976—),女,山东济宁人,本科,主要从事脊柱外科工作。
赵强,济宁市第一人民医院急诊创伤外科,副主任医师,博士,E-Mail:fengyujc@126.com。
R681
A
1004-7115(2016)10-1109-03
10.3969/j.issn.1004-7115.2016.10.009
2016-07-20)

