洞庭湖浮游藻类功能群的组成特征及其影响因素研究
汪 星,李利强,郑丙辉*,刘 琰,田 琪,王丽婧(1.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012;2.中国环境科学研究院,国家环境保护饮用水水源地保护重点实验室,北京100012;3.国家环境保护洞庭湖科学观测研究站,湖南 岳阳 1000;.洞庭湖生态环境监测中心,湖南 岳阳1000)
洞庭湖浮游藻类功能群的组成特征及其影响因素研究
汪 星1,2,3,李利强4,郑丙辉1,2,3*,刘 琰1,2,田 琪4,王丽婧1,2,3(1.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012;2.中国环境科学研究院,国家环境保护饮用水水源地保护重点实验室,北京100012;3.国家环境保护洞庭湖科学观测研究站,湖南 岳阳 414000;4.洞庭湖生态环境监测中心,湖南 岳阳414000)
2013年3月、6月、9月及12月采集了洞庭湖11个断面的浮游藻类,并对所采集的藻类进行了功能群划分,结果显示,洞庭湖的浮游藻类可以分为24个功能群:A、B、C、D、E、F、G、H1、J、LO、LM、M、MP、N、P、S1、SN、T、W1、W2、X1、X2、X3、Y,所反映的生境特征主要表现为对分层敏感、频繁扰动且混合程度较高的浑浊型中-富营养型水体.不同时期调查的藻类优势功能群存在明显差异,其中,B(中营养水体、对分层敏感)、D(较浑浊的浅水水体)、J(混合型高富营养浅水水体)、MP(扰动频繁的浑浊型浅水水体)、P(混合程度较高中富营养浅水水体)、Y(广适性)在四次调查中的优势度均>0.02,成为洞庭湖的绝对优势功能群,洞庭湖藻类优势功能群不同时期的演替规律为:3月MP+P+D+B经6月MP+J+P+D+B与9月MP+J+P+D+B+LO+Y转变成12月MP+J+D+Y.CCA分析结果显示,洞庭湖藻类功能群分布受水环境因子影响较为明显.整体上,T、pH值、DO、CODCr、NH3-N及TP是影响洞庭湖藻类功能群分布格局的主要因素.
洞庭湖;藻类功能群;优势度;环境因子
同一类群中的不同种类可能具备相似的生态属性,因此,生态学家们将具备相似生态属性的生物体进行归类,以此来简化复杂的生态系统,并将该简化后的生态群落定义为功能群[1].浮游藻类是一类极其多样、多源的光合自养型原生动物或蓝细菌,是食物链和生物地球化学循环过程的初级生产者[2],20世纪 70年代以来,功能群分类法在浮游藻类中的应用越来越广泛,且不断被更新.截至目前,浮游藻类功能群的分类标准包含尺寸、形状、生长策略、生态功能及生境特征等5个 方 面 .BSS(Biomass size spectrum)/NBS (Normalised Biomass Sizespectrum)、 TTSS (Traditional Taxonomic Size spectrum)以及PGS (Phytoplankton Geometric Shapes)法均以生物体的尺寸和形状作为分类依据,这三种方法的优点在于不需要专业的分类学基础且错误归类的风险极低,缺点则是不能反映生物样本的生态属性以及所处生境的特征等[3-6].CSR(Competitive, Stress-tolerant and Ruderal strategists)法是 r/k (rete of increase/carrying capacity)法的衍生,主要反映藻类的生长属性及策略,优点也是对分类学基础要求不高,且错误归类的风险较低,受到研究者们的广泛关注并一直沿用至今[7].随着研究的不断深入,FG(Functional Groups)法的提出具有划时代的意义,该方法能反映藻类的栖息地属性、对环境的耐受能力以及水体的营养等级等各个方面[8-10],近年来也成为我国湖泊研究者们使用最为广泛的方法[11-16].
洞庭湖位于湖南省北部(28°30′N~30°20′N、111°40′E~113°40′E),长江中游南岸,西南有湘、资、沅、澧“四水”入湖,北有长江的藕池、松滋、太平“三口”流入,湖水经北部的城陵矶与长江相通,是我国第二大淡水湖泊、国内最大淡水湿地以及国际重要湿地和珍稀候鸟越冬栖息地,亦是长江洄游和半洄游鱼类的产卵场、索饵场,具有调蓄、滞洪、维持长江中游水域生态平衡及下游水资源战略安全等多项生态服务功能.因长年的泥沙淤积和围垦,洞庭湖被分割为东洞庭湖、南洞庭湖和西洞庭湖.现有天然湖面2 691km2,洪道1 307km2.在自然和人类活动的双重作用下,100多年来,湖泊迅速萎缩,生物多样性显著下降,部分水域出现蓝藻水华,水情和生态环境日益恶化.在以往的研究中曾提出溶解氧和氮是影响洞庭湖藻类分布格局的主要因素[17-18],但浮游藻类的生长繁殖及水华的产生也与生境、水文、水动力等条件有着潜在的联系[15],因此,对洞庭湖浮游藻类生长、形态及生态功能等的演替规律及其影响因素的研究显得尤为重要.本研究采用 FG法对洞庭湖浮游藻类功能群特征进行分析,并通过典范对应分析(CCA)明确影响浮游藻类功能群演替的主要环境因子,以期为洞庭湖的生态与水质监管提供理论依据和技术支撑.
1 材料与方法
1.1 采样位点设置与采样方法
本研究共设置11个采样断面,如图1所示,监测时间为2013年3、6、9和12月.藻类样品的采集使用国际标准的25号筛绢制成的小型浮游生物网,于水体自下向上垂直托取定量样品,用 5%的甲醛溶液固定保存.另取表层水样 2L,摇匀,一部分原水样直接分装于250ml磨口瓶,用于测定总磷、总氮、氨氮、生化需氧量等常规水质指标.
1.2 水样测试方法
水样的生化需氧量(BOD)、高锰酸盐指数(CODMn)、化学需氧量(CODCr)、总氮(TN)、总磷(TP)、氨氮(NH3-N)以及粪大肠菌群(E.coli)的测定方法参照《水和废水监测分析方法》[19].其中,稀释与接种法测定 BOD,酸性高锰酸钾法测定CODMn;重铬酸盐法测定 CODCr;碱性过硫酸钾-紫外分光光度法测定 TN;钼酸铵分光光度法测定TP;纳氏试剂分光光度法测定NH3-N;多管发酵法测定E.coli.pH值、水温(T)、溶解氧(DO)的测定采用便携式 pH 计和水质多参数测定仪(YSI)现场直接测定(水面下0.5m);参照《中国淡水藻志》[20]对采集的样品进行分类、鉴定,藻细胞生物量计算等采用显微镜法[21].
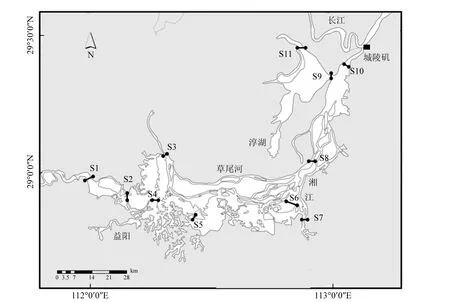
图1 洞庭湖采样断面示意Fig.1 Sampling sections of Dongting Lake
1.3 数据分析
1.3.1 浮游藻类功能群分类及生物量计算 参照2002年Reynolds等[9]和2009年Padisák等[10]以浮游植物生理生长特征及其环境适应性机制为基础,在浮游植物生长的C-R-S策略分类基础上,对具有相同适应性特征、易于在相同生境条件下共存的浮游植物种类进行功能分组.浮游藻类功能群生物量指的是功能群的代表性藻种(属)的细胞生物量之和,通过各代表性藻种(属)的生物量相加得出.比如洞庭湖藻类功能群B的代表性藻种(属)包括小环藻和冠盘藻,那么该功能群生物量则为小环藻和冠盘藻细胞生物量之和.
1.3.2 浮游藻类功能群优势度分析 优势度根据藻类功能群的出现频率及丰度来确定,用优势度来表示[22]:y=fi·Pi.式中:y为优势度,fi为第i功能群的出现频率,Pi为第 i功能群丰度占总藻类丰度的比例,当 y>0.02时,定为优势功能群[23].选择优势度>0.02的浮游藻类功能群进行典范对应(CCA)分析.
1.3.3 环境因子主成分分析(PCA) 采用主成分分析(PCA)中的因子分析法[24],将各采样断面的环境数据进行标准化处理(其中溶解氧为逆指标,故将其先进行倒数变换,然后在 SPSS13.0中完成数据标准化),为了使每个主成分的意义更加明确,采用 Varimax最大方差法对因子进行旋转,按照特征值λ大于1的原则提取出3个主成分,选择主成分的因子载荷量>0.7的环境因子进行CCA分析.所有的数据分析均在SPSS 13.0软件下进行.
1.3.4 典范对应分析(CCA) 采用 Canoco for Windows 4.5 软件对功能群数据和环境数据进行CCA分析.浮游藻类功能群矩阵经过 lg(x+1)转换,环境因子数据除 pH值外全部进行lg(x+1)转换[25].CCA分析结果用功能群—环境因子关系的双序图表示,图中环境因子用带有箭头的线段表示,向量长短表示其在主轴中的作用,线段所处象限代表环境因子与排序轴间的正负关系.分析时,做出某一功能群与环境因子连线的垂直线,垂直线与环境因子连线相交点离箭头越近,表示该种与该类生境因子的正相关性越大,处于另一端的则表示与该类环境因子具有的负相关性越大.
2 结果分析
2.1 浮游藻类丰度变化及功能群划分
从不同时期藻类生物量的分布来看(图 2),3月藻类的生物量变化范围为 0.08~2.59mg/L,最大值出现在大小西湖(S11),而万子湖(S5)的生物量最小,整体来看,浮游藻类生物量从大到小依次为东洞庭湖、西洞庭湖、南洞庭湖;6月、9月和12月浮游藻类的生物量变化范围分别为0.05~0.89,0.07~1.76,0.02~2.41mg/L,最大值均出现在大小西湖(S11),而坡头(S1)的生物量最小,整体来看,浮游藻类生物量从大到小依次为东洞庭湖、南洞庭湖、西洞庭湖.
对所检出的浮游藻类进行功能分类,如表 1所示,洞庭湖的浮游藻类可以分为 24个功能群:A、B、C、D、E、F、G、H1、J、LO、LM、M、MP、N、P、S1、SN、T、W1、W2、X1、X2、X3、Y.
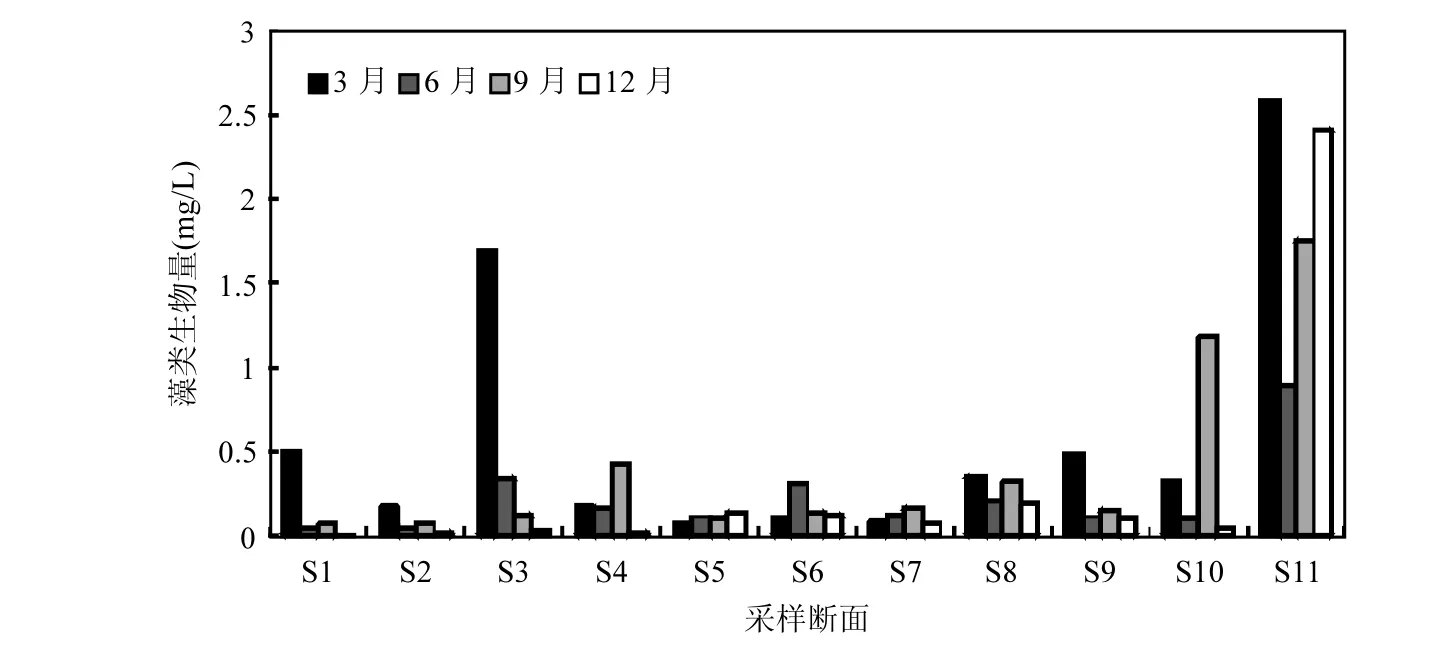
图2 洞庭湖2013年浮游藻类生物量的时空变化Fig.2 Temporal and spatial variation of phytoplankton of Dongting Lake in 2013

表1 洞庭湖浮游藻类功能群划分Table 1 Algal function groups division in Dongting Lake
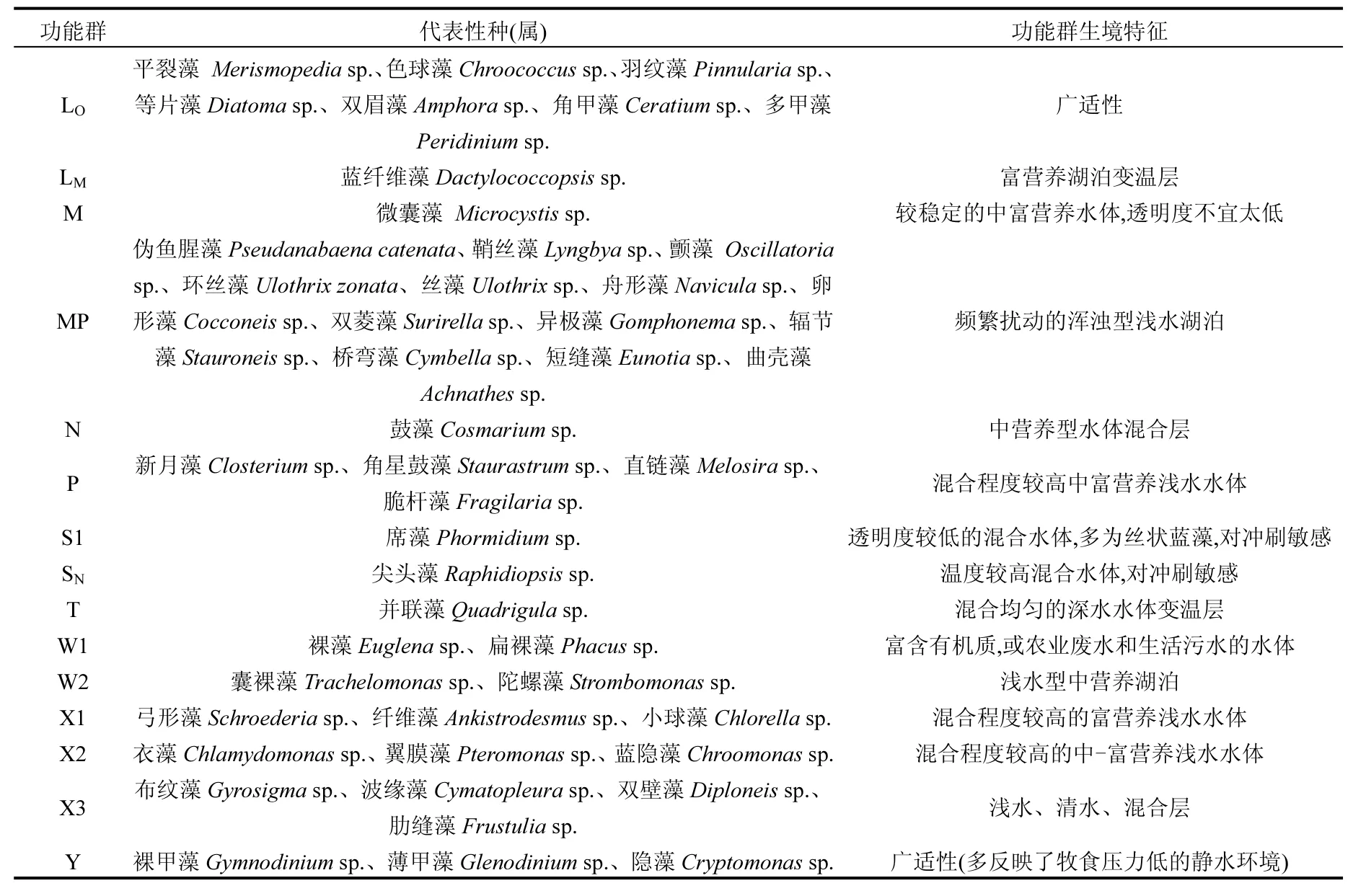
续表1
2.2 浮游藻类优势功能群及其分布特征
从不同时期藻类功能群的优势度来看(图3),3月浮游藻类的优势功能群为D、B、MP、P、J、Y、X1,6月为J、MP、B、Y、D、P,9月为J、Y、P、MP、LO、D、B、X2,12月为Y、D、J、MP、X2、B 、P、X1,其中,B、D、J、MP、P、Y在4次调查中的优势度均>0.02,成为洞庭湖的绝对优势功能群.本研究中浮游藻类功能群的时空分布特征及其影响因子分析均在上述优势功能群中展开.
从不同时期藻的功能群组成来看(图4),3月藻类功能群 MP、P、B、D在各采样断面均有分布,其中,B在南嘴(S3)、鹿角(S8)和洞庭湖出口(S10)均占据绝对优势,D在大小西湖(S11)占据绝对优势,整体来看,MP、P自西洞庭湖至东洞庭湖湖呈现逐渐下降的趋势,而B、D则呈现逐渐升高的趋势(除 S3外),值得注意的是,万子湖(S4)以Y占据优势,而MP、P、B、D等优势类群所占比例较小.6月各采样断面的主要功能群由3月的MP+P+D+B转变成MP+J+P+D+B,优势功能类型较3月明显增多,其中,MP、J分别在东洞庭湖(S9)和大小西湖(S11)占据绝对优势,整体来看,西洞庭湖与南洞庭湖的藻类优势功能群组成均衡度较高,而东洞庭湖则以MP、J成为绝对优势群落.9月各采样断面的主要功能群由 6月的MP+J+P+D+B转变成MP+J+P+D+B+LO+Y,其中,J、Y分别在大小西湖(S11)和洞庭湖出口(S10)占据绝对优势,整体来看,MP、LO自西洞庭湖至东洞庭湖湖呈现逐渐下降的趋势,J、Y则呈现逐渐上升的趋势,P、D、B在各采样断面所占比例相对均衡.12月洞庭湖整体以Y占据绝对优势,各采样断面的主要功能群由 9月的MP+J+P+D+ B+LO+Y转变成MP+J+D+Y,整体来看,MP自西洞庭湖至东洞庭湖湖呈现逐渐下降的趋势,而J则呈现相反的趋势;D在南洞庭湖所占比例明显高于西洞庭湖和东洞庭湖,而Y在西洞庭湖和东洞庭湖所占比例则明显高于南洞庭湖.
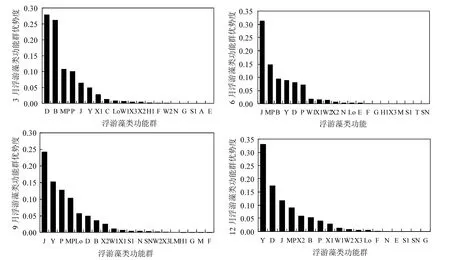
图3 洞庭湖不同季节浮游藻类功能群优势度Fig.3 Dominance of algal function groups in different seasons in Dongting Lake
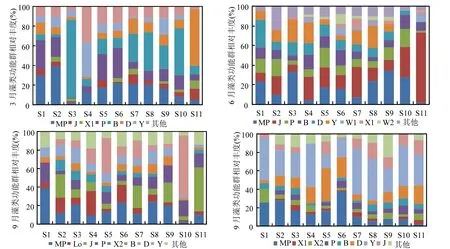
图4 洞庭湖不同季节浮游藻类功能群组成Fig.4 Algal function groups composition in different seasons in Dongting Lake
2.3 环境因子的主成分分析
为了使每个主成分的意义更加明确,采用Varimax最大方差法对因子进行旋转,按照特征值λ大于1的原则提取出3个主成分,如表2所示,3月、6月、9月和12月的主成分累计贡献率分别达到81%、94.5%、78.5%及92.8%.该主成分分析所得指标的载荷超过 0.7的即为主要影响因子,3月的主要环境因子为T、pH值、DO、CODMn、CODCr、BOD、NH3-N、TP、E.coli,6月的主要环境因子为T、pH值、DO、CODMn、CODCr、BOD、NH3-N、TN、E.coli,9月的主要环境因子为T、pH值、DO、SD、CODMn、CODCr、NH3-N、TN、E.coli,12月的主要环境因子为 T、pH值、DO、CODMn、CODCr、BOD、NH3-N、TN、TP、E.coli.

表2 Varimax转轴后的因子载荷量Table 2 Rotated component matrix
2.4 浮游藻类优势功能群与环境因子的相关 (CCA)分析

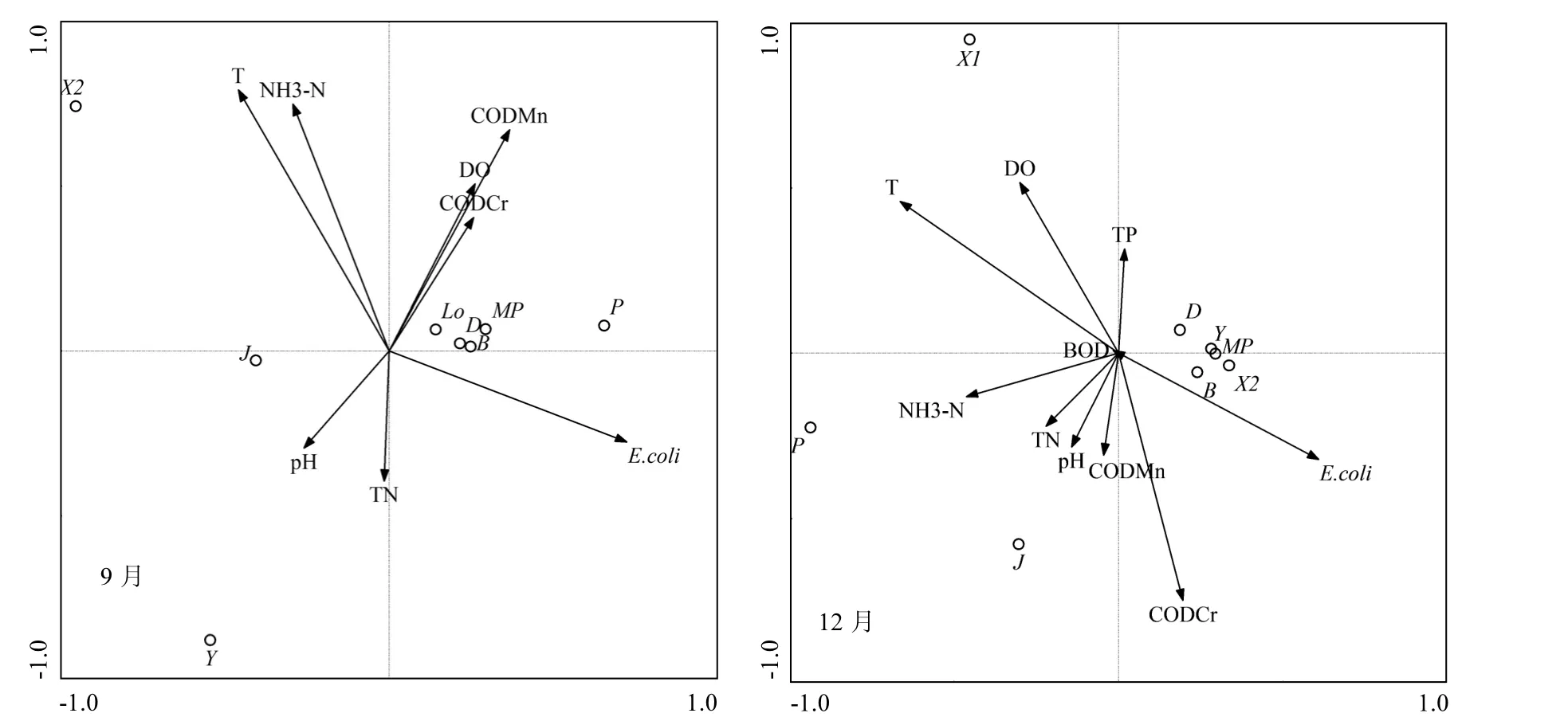
图5 洞庭湖不同季节浮游藻类优势功能群与主要环境因子的CCA分析Fig.5 CCA analysis of algal dominant function groups and principal environment factors in different seasons in Dongting Lake
选取藻类优势功能群与主要环境因子进行CCA分析,如图5所示,环境因子第一、二轴间的相关系数为 0,表明分析结果可信[26].3月的分析结果显示,Y与DO呈现强正相关; J与pH值呈现强正相关;整体来看,DO、pH是影响3月藻类功能群分布的主要环境因子.6月的分析结果显示,W2、X1与T正相关性显著;J、B、P、MP、D与DO、CODCr均呈现强正相关;整体来看,T、DO及CODCr是影响6月藻类功能群分布的主要环境因子.9月的分析结果显示,J与pH呈现强正相关;P与 CODCr、DO呈现强正相关;整体来看,pH、CODCr及DO是影响9月藻类功能群分布的主要环境因子.12月的分析结果显示,P、X1均与 T呈现强正相关;J与 NH3-N呈现强正相关;D、Y、MP、X2均与TP呈现较强的正相关;整体来看,T、NH3-N、TP是影响12月藻类功能群分布的主要环境因子.
3 讨论
3.1 浮游藻类丰度变化及功能群划分
通过对洞庭湖不同时期浮游藻类的调查显示,该流域内藻类功能群存在明显的时空差异.从优势功能群的代表性种类来看,3月浮游藻类以硅藻占绝对优势,其次是绿藻和蓝藻,6月以绿藻与硅藻占绝对优势,其次是蓝藻和隐藻,9月为以绿藻占绝对优势,其次是甲藻、隐藻,硅藻所占比例显著减少,12月则转变为甲藻和隐藻占优,其次是硅藻和绿藻.1999年李利强等[27]、2012年汪星等[17]的调查结果均显示,洞庭湖以绿藻门与硅藻门占优,蓝藻门次之,陈格君等[28]对另一长江的典型通江行湖泊鄱阳湖的调查结果也显示,浮游藻类的组成以绿藻门占优,硅藻和蓝藻门次之,均与本研究的结果保持一致.可见,近年来,尽管土地利用、水产养殖及种植业等人类活动的不断增多,洞庭湖藻类功能群的组成并未发生明显改变.
从优势功能群的生境特征来看,3月西洞庭湖以B和MP占绝对优势,特别地,南嘴(S3)的B所占比例超过80%,B与MP功能群的生境特征均为频繁扰动浑浊型浅水水体,这与西洞庭湖的几个采样断面实际情况相符,S1、S3分别属于沅水和澧水的入湖监测断面,上游的开江春水夹带大量泥沙且流速较大,导致水体较为浑浊,同样地,S2、S4也受益阳资水的来水影响,水体混合度较高;南洞庭湖的万子湖(S5)与横岭湖(S6)断面受入湖河流扰动较小,水体流动速率相对较缓,适宜生境为混合程度较高的中-富营养型水体的 P型藻类生长,这也与洞庭湖水体属于中-轻度富营养状态的报道一致[29-30].S7-S8、S9-S11分别受湘江与长江回水的作用,水体重回浑浊,适宜B、D及MP等功能群的生长.6月以MP和J在各采样断面的优势较为明显,受上游来水的影响,MP在坡头、南嘴、鹿角、东洞庭湖及洞庭湖出口的比例仍占据优势; J的适宜生境为混合型高富营养水体,其比例则呈现自西洞庭湖到东洞庭湖逐渐增加的趋势,并在大小西湖达到最大;钟振宇等[29]、周泓等[31]、王丽婧等[32]、Wang等[33]的研究结果均表明,洞庭湖的水体富营养化状态依次为西洞庭湖<南洞庭湖<东洞庭湖,且大小西湖水体的富营养化最为恶劣,这些均与本研究中藻类功能群的分布状况相符.9月MP与J的分布状况与6月的基本一致,但J的比例有所下降,而Y的比例则随之增加,Y属于广适性中营养功能群且在万子湖和洞庭湖出口占据绝对优势,究其原因,可能是9月属于丰水期,湖区上游来水量增大,对水体有一定的稀释作用,导致整体营养状态有所下降,广适性功能群比例增加,值得注意的是,大小西湖仍以 J占据绝对优势,其富营养化状态不容小视.12月MP在东洞庭湖的比例明显小于西洞庭湖和南洞庭湖,东洞庭湖在该时期受长江回水影响明显减少;Y在各采样断面占据优势明显,可见该时期洞庭湖水体营养状况良好,究其原因,可能是枯水期上游来水减少,进入湖区的污染物总量降低,加之湖区的自净作用,湖区适应中营养和广适性的藻类生长;另外,该时期J的变化趋势仍与其他时期的保持一致,三个湖区的水体营养状态高低次序保持不变.
3.2 浮游藻类功能群与环境因子的相关性
研究表明,pH、水温、溶解氧、总氮、透明度、总磷、氨氮、生化需氧量以及化学需氧量均能成为影响浮游藻类群落分布的主要环境因子
[34-40],本研究结果显示,水温、pH、DO、CODCr、NH3-N及TP是影响洞庭湖藻类功能群分布的主要环境因子,其中,水温成为P、W2、X1等多个功能群分布的主要影响因素,虽然洞庭湖属于北亚热带季风湿润气候,但其在不同季节以及昼夜的水温仍存在明显差异,因此,水温必然成为该区域藻类生长的限制因子,对寒区安邦河湿地[13]、北方的乌梁素海[15]、深水型金盆水库[41]、贵州高原的阿哈水库[14]与三板溪水库[42]等湖库的研究亦表明,水温是该区域藻类功能群结构变化的最主要影响因素,可见水温对湖泊藻类生长及结构演替的重要性.藻类适宜在偏碱性的水体中生长,可见 pH对藻类生长的重要性,本研究中,pH则成为适宜富营养水体生长的 J功能群的限制因子.藻类的生长除了光合作用,同时也需要氧气来完成呼吸作用,因此,DO成为B、D、J、MP、P、Y分布的主要限制因素,已有研究表明,DO与藻类生长呈显著正相关[43],作为典型的通江湖泊,镜泊湖的浮游藻类也受到 DO的限制[34].CODCr通常作为反映点源污染的常规检测指标,NH3-N、TP则是反映面源污染的两项重要监测指标.南屏水库、竹仙洞水库[44]、北京海子水库[45]的研究表明, 磷是浮游藻类功能群演替的主要驱动因子,本研究中,J、B、P、MP、D均受CODCr的限制,可见有机污染物对藻类生长的影响之深,同时,NH3-N、TP两项营养盐指标也分别与适应富营养水体生长的 J、X2呈现强的正相关;研究表明[18],洞庭湖浮游藻类的生长主要受到氮(尤其是氨态氮)的限制,添加氨氮能明显促进浮游藻类生物量的增加.洞庭湖作为长江中下游通江型调蓄湖泊,承接“四水”和“三口”,受上游来水影响显著,同时,湖区周边的人为活动也对洞庭湖的水质状况带来了深远的影响,整体来看,洞庭湖的污染主要来自于上游的工业废水和生活污水、湖区周边造纸厂废水、农业用肥以及湖区内渔民的生活污水与垃圾渗滤液等,其中工业废水则是CODCr的主要来源,生活污水及农用肥料则是NH3-N与TP的主要贡献者,故CODCr、NH3-N、TP能成为洞庭湖藻类功能群分布的主要限制因子.当然,随着社会经济的继续稳步发展,人类活动会更加频繁,洞庭湖的生态环境质量问题应引起有关部门重视.
4 结论
4.1 2013年对洞庭湖 11个采样断面所采集的浮游藻类的分类结果显示,洞庭湖的浮游藻类可以分为24个功能群:A、B、C、D、E、F、G、H1、J、LO、LM、M、MP、N、P、S1、SN、T、W1、W2、X1、X2、X3、Y.
4.2 洞庭湖不同时期的藻类优势功能群存在明显差异,其中,B、D、J、MP、P、Y在4次调查中的优势度均>0.02,成为洞庭湖的绝对优势功能群;洞庭湖藻类优势功能群不同季节的演替规律为:3月MP+P+D+B经6月MP+J+P+D+B与9月 MP+J+P+D+B+LO+Y 转 变 成 12 月MP+J+D+Y.
4.3 CCA分析结果显示,洞庭湖藻类功能群分布受水环境因子影响较为明显.整体上,T、pH值、DO、CODCr、NH3-N及TP是影响洞庭湖藻类功能群分布格局的主要因素.
[1] Solbrig O T. Plant traits and adaptive strategies: their role in ecosystem function [M]//: Biodiversity and Ecosystem Function (Eds E.D. Schulze & H.A. Mooney), 1993:97-116. Ecological Studies. Springer-Verlag, Berlin.
[2] Rousseaux C S, Gregg W W. Interannual variation in phytoplankton primary production at a global scale [J]. Remote Sensing, 2013,6(1):1-19.
[3] Platt T, Denman K. The structure of pelagic marine ecosystems [J]. Rapports et Proces Verbaux des Reunions, 1978,173:60-65.
[4] Kamenir Y, Dubinsky Z, Zohary T. Phytoplankton size structure stability in a meso-eutrophic subtropical lake [J]. Hydrobiologia, 2004,520(1-3):89-104.
[5] Kamenir Y, Dubinsky Z, Zohary T. The long-term patterns of phytoplankton taxonomic size-structure and their sensitivity to perturbation: A Lake Kinneret case study [J]. Aquatic Sciences, 2006,68(4):490-501.
[6] Stanca E, Cellamare M, Basset A. Geometric shape as a trait to study phytoplankton distributions in aquatic ecosystems [J]. Hydrobiologia, 2013,701:99-116.
[7] Stanca E, Cellamare M, Basset A. Geometric shape as a trait to study phytoplankton distributions in aquatic ecosystems [J]. Hydrobiologia, 2013,701(1):99-116.
[8] Reynolds C S. Phytoplankton assemblages and their periodicity in stratifying lake systems [J]. Holarctic Ecology, 1980,3(3):141-159.
[9] Reynolds C S, Huszar V, Kruk C, et al. Towards a functional classification of the freshwater phytoplankton [J]. Journal of Plankton Research, 2002,24(5):417-428.
[10] Padisak J, Crossetti L O, Naselli-Flores L. Use and misuse in the application of the phytoplankton functional classification: a critical review with updates [J]. Hydrobiologia, 2009,621(1): 1-19.
[11] 董 静,李根保,宋立荣.抚仙湖,洱海,滇池浮游藻类功能群1960s以来演变特征 [J]. 湖泊科学, 2014,26(5):735-742.
[12] 陈晓江,杨 劼,杜桂森,等.海子水库浮游植物功能群季节演替及其驱动因子 [J]. 水资源保护, 2015,31(6):122-127.
[13] 武安泉,郭 宁,覃雪波.寒区典型湿地浮游植物功能群季节变化及其与环境因子关系 [J]. 环境科学学报, 2015,35(5):1341-1349.
[14] 李 磊,李秋华,焦树林,等.阿哈水库浮游植物功能群时空分布特征及其影响因子分析 [J]. 环境科学学报, 2015,35(11):3604-3611.
[15] 李 兴,李建茹,徐效清,等.乌梁素海浮游植物功能群季节演替规律及影响因子 [J]. 生态环境学报, 2015,24(10):1668-1675.
[16] Liu X, Qian K, Chen Y. Effects of water level fluctuations on phytoplankton in a Changjiang River floodplain lake (Poyang Lake): Implications for dam operations [J]. Journal of Great Lakes Research, 2015,41(3):770-779.
[17] 汪 星,郑丙辉,刘录三,等.洞庭湖典型断面藻类组成及其与环境因子典范对应分析 [J]. 农业环境科学学报, 2012,31(5):995-1002.
[18] 李利强,黄代中,熊 剑,等.洞庭湖浮游植物增长的限制性营养元素研究 [J]. 生态环境学报, 2014,23(2):283-288.
[19] 国家环保总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版.北京:中国环境出版社, 2002.
[20] 齐雨藻,李家英.中国淡水藻志 [M]. 北京:科学出版社, 2004.
[21] 徐金森,郑天凌,郭清华,等.两种海洋细菌对赤潮藻的细胞生物量的影响研究 [J]. 海洋科学, 2002,26(12):57-60,67.
[22] Aksnes D L, Wassmann P. Modeling the significance of zooplankton grazing for export production [J]. Limnology and Oceanography, 1993,38(5):978-985.
[23] Lampitt R S, Wishner K F, Turley C M, et al. Marine snow studies in the Northeast Atlantic Ocean: distribution, composition and role as a food source for migrating plankton [J]. Marine Biology, 1993,116(4):689-702.
[24] 刘 潇,薛 莹,纪毓鹏,等.基于主成分分析法的黄河口及其邻近水域水质评价 [J]. 中国环境科学, 2015,35(10):3187-3192.
[25] 王 华,杨树平,房晟忠,等.滇池浮游植物群落特征及与环境因子的典范对应分析 [J]. 中国环境科学, 2016,36(2):544-552.
[26] Kent M. Vegetation description and data analysis: a practical approach [M]. John Wiley & Sons, 2011.
[27] 李利强,张建波.洞庭湖浮游植物调查与水质评价 [J]. 江苏环境科技, 1999,12(4):14-16.
[28] 陈格君,周文斌,胡春华.鄱阳湖五河入湖口浮游藻类及营养现状评价 [J]. 湖北农业科学, 2013,52(9):2048-2052.
[29] 钟振宇,陈 灿.洞庭湖水质及富营养状态评价 [J]. 环境科学与管理, 2011,36(7):169-173.
[30] 黄代中,万 群,李利强,等.洞庭湖近20年水质与富营养化状态变化 [J]. 环境科学研究, 2013,26(1):27-33.
[31] 周 泓,欧伏平,刘 妍.“十一五”期间洞庭湖水环境质量状况及变化趋势分析 [J]. 湖南理工学院学报(自然科学版), 2011, 24(2):88-90.
[32] 王丽婧,汪 星,刘录三,等.洞庭湖水质因子的多元分析 [J]. 环境科学研究, 2013,26(1):1-7.
[33] Wang X, Zheng B, Liu L, et al. Development and evaluation of the Lake Multi-biotic Integrity Index for Dongting Lake, China [J]. Journal of Limnology, 2015,74(3):594-605.
[34] 汪 星,刘录三,李 黎,等.镜泊湖浮游藻类组成及其与环境因子的相关分析 [J]. 中国环境科学, 2015,35(11):3403-3413.
[35] 沈会涛,刘存歧.白洋淀浮游植物群落及其与环境因子的典范对应分析 [J]. 湖泊科学, 2008,20(1):773-779.
[36] 刘鸿雁,徐云麟.镜泊湖藻类生长和湖泊富营养化预测初探 [J].生态学报, 1996,16(2):195-201.
[37] Jiang Y J, He W, Liu W X, et al. The seasonal and spatial variations of phytoplankton community and their correlation with environmental factors in a large eutrophic chinese lake (Lake Chaohu) [J]. Ecological Indicators, 2014,40:58-67.
[38] 潘继征,熊 飞,李文朝,等.云南抚仙湖透明度的时空变化及影响因子分析 [J]. 湖泊科学, 2008,20(5):681-686.
[39] Arhonditsis G B, Winder M, Brett M T et al. Patterns and mechanisms of phytoplankton variability in Lake Washington (USA). Water Research, 2004,38:4013-4027.
[40] 杨丽标,韩小勇,孙 璞,等.巢湖藻类组成与环境因子典范对应分析 [J]. 农业环境科学学报, 2011,30(5):952-958.
[41] 卢金锁,张 颖,胡亚潘.深水型水库中藻类功能群组演替及其与环境因子的关系 [J]. 环境工程学报, 2014,(11):4605-4611.
[42] 黄国佳,李秋华,陈 椽,等.贵州高原三板溪水库浮游植物功能群时空分布特征 [J]. 环境科学学报, 2015,35(2):418-428.
[43] 游 亮,崔莉凤,刘载文,等.藻类生长过程中 DO、pH与叶绿素相关性分析 [J]. 环境科学与技术, 2007,30(9):42-45.
[44] 张 怡,胡 韧,肖利娟,等.南亚热带两座不同水文动态的水库浮游植物的功能类群演替比较 [J]. 生态环境学报, 2012,21(1): 107-117.
[45] 陈晓江,杨 劼,杜桂森,等.海子水库浮游植物功能群季节演替及其驱动因子 [J]. 水资源保护, 2015,31(6):122-127.
Composition and influential factors of algal function groups in Dongting Lake.
WANG Xing1,2,3, LI Li-qiang4, ZHENG Bing-hui1,2,3*, LIU Yan1,2, TIAN Qi4, WANG Li-jing1,2,3(1.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;2.State Environmental Protection Key Laboratory of Drink Water Resource Protection, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;3.State Environmental Protection Scientific Observation and Research Station for Lake Dongtinghu, Yueyang 414000, China;4.Dongting Lake Eco-Environment Monitoring Centre, Yueyang 414000, China). China Environmental Science, 2016,36(12):3766~3776
This research was performed at March, June, September and December in 2013 at 11sections of Dongting Lake, aiming to investigate the algal function groups. A total of 24 kinds of algal function groups were identified: A、B、C、D、E、F、G、H1、J、LO、LM、M、MP、N、P、S1、SN、T、W1、W2、X1、X2、X3、Y, which reflected the habitat characteristics with species sensitive to the onset of stratification, and which are adapt to frequently stirred up, inorganically turbid, and mesotrophic to eutrophic shallow lakes. The algal function groups was dominated by B (mesotrophic waters in small-and mediumsized lakes with species sensitive to the onset of stratification), D (shallow turbid waters), J (well-mixed, enriched shallow lakes), MP (frequently stirred up, inorganically turbid shallow lakes), P (well-mixed, mesotrophic to eutrophic shallow lakes) and Y (refers to a wide range of habitats) based on the dominant degree (>0.02) and significant differences which were found on algal function groups across 11sampling sections in the four investigations. The successional law of algal function groups in different seasons could be summarized as follow: MP+P+D+B in March, MP+J+P+D+B in June, MP+J+P+D+B+LO+Y in September, MP+J+D+Y in December. PCA (principal component analysis) was applied to choose the major potential stressors which influenced the habitat of algae by SPSS 13.0, and CCA (canonical correspondence analysis) was used to explore the relationship between algal function groups and major environmental parameters. It is indicated from the results that water temperature (T), pH, dissolvedoxygen (DO), Chemical Oxygen Demand (CODCr), ammonia nitrogen (NH3-N) and total phosphorus (TP) were the most important factors influencing the distribution of algal function groups across the 11sampling sections.
Dongting Lake;algal function groups;dominance;environmental factors
X826
A
1000-6923(2016)12-3766-11
汪 星(1983-),男,湖北荆州人,副研究员,博士,主要从事水生生物评价的研究.发表论文30余篇.
2016-06-02
“十二五”国家科技支撑计划课题(2014BAC09B02);“973”项目(2012CB417004);洞庭湖江湖生态监测重点站项目(JJ2013-023)
* 责任作者, 研究员, zhengbinghui@craes.org.cn

