肌酐水解酶基因工程菌的构建及功能研究
, , , ,,,云生
(1.南华大学附属第一医院肾内科,湖南 衡阳 421001,2.长沙医学院临床系;3.湖南省衡阳市第八中学生物教研室;4.湘雅二医院肾内科)
·基础医学·
肌酐水解酶基因工程菌的构建及功能研究
杨波1,蒋芬1,朱艳1,杨成2,向铁勇3,段绍斌4,蒋云生4
(1.南华大学附属第一医院肾内科,湖南 衡阳 421001,2.长沙医学院临床系;3.湖南省衡阳市第八中学生物教研室;4.湘雅二医院肾内科)
目的构建肌酐水解酶的重组质粒转染至大肠杆菌中,研究其蛋白的表达及活性。方法根据Genbank上肌酐水解酶基因序列(D45424.1),进行生物合成,得到肌酐水解酶基因片段C,聚合酶链反应(PCR)扩增后,与质粒GV296连接,构建成重组质粒GV296-C,转染至大肠杆菌BL21(DE3),构建成基因工程菌GV296-C/BL21(DE3)。进行十二烷基硫酸钠—聚丙烯酰胺(SDS-PAGE)分析后,测定培养液肌酐浓度变化。结果成功构建重组质粒GV296-C,电泳显示目的片段约为0.783Kb,测序结果与D45424.1基因序列一致。重组质粒GV296-C转染至E.coli BL21(DE3)感受态细胞中,经SDS-PAGE分析酶蛋白的分子量约为29KD。结论成功构建工程菌GV296-C/BL21(DE3),诱导后高效表达肌酐水解酶,具有水解肌酐活性。
肌酐水解酶; 基因工程菌; 肌酐; 慢性肾功能衰竭
慢性肾功能衰竭是各种肾脏疾病的最终结局。除原发症状外,其主要表现均有代谢产物蓄积,水及电解质酸碱平衡紊乱。慢性肾衰竭一旦发生后,患者肾功能的恶化与原有基础疾病活动有关。但有时即便原发病停止活动,肾功能仍会继续进行下降。其主要原因是尿毒素不仅使肾功能损伤加剧,而且引起全身各个器官都会受损。血中过高浓度的毒素渗入胃肠道,从而引起肠道内微生态的改变,出现细菌数量及菌种的改变[1]。大量增殖的肠道细菌对尿毒素(如肌酐、尿素)进行分解代谢,作为细菌生长的能量来源。肌酐在肠道细菌作用下,可降解成多种产物。在细菌肌酐水解酶催化下生成肌酸,后者在肌酸水解酶催化下,水解为肌氨酸。把以上两种酶的基因融合转入肠道益生菌细菌中,再将这含有这两种酶的基因菌种制成生物制剂,注入肾衰患者的消化道内,使渗入肠道中的肌酐降解为肌氨酸,肌氨酸不但无毒,而且是营养物质,从而达到降低慢性肾衰患者血肌酐,同时改善患者营养。
本研究组已经成功将肌酸水解酶转入大肠杆菌,并且获得高效表达[2]。现拟构建肌酐水解酶基因表达工程菌,以大肠杆菌为宿主菌,使其能产生肌酐水解酶,降解肌酐为肌酸,为后期进一步建立将肌酐降解成为肌氨酸的肌酐水解酶及肌酸酶融合表达的枯草芽孢杆菌基因工程菌打下基础。通过将转入以上两种酶的基因工程菌注入慢性肾衰患者肠道,在患者肠道内发挥肌酐降解作用及改善营养,为延缓肾功能衰竭治疗提供新的思路及治疗手段。
1 材料与方法
1.1实验材料大肠杆菌E.coliBL21(DE3) 、DH5a(E.coliDH5a)均由南华大学微生物实验室提供。质粒PET28a(+)(GV296),购于上海吉凯生物有限公司。Thermo购于T4 DNA Ligase;DNA限制性内切酶购于BioLabs; 2×Taq MasterMix购于康为世纪;高纯度质粒小提试剂盒,和DNA凝胶回收试剂盒均为天根产品。上海生工生物股份有限公司合成引物。
1.2实验方法
1.2.1 构建肌酐水解酶目的基因片段 按照GenBank数据库提供的肌酐水解酶(恶臭假单胞菌1978)D45424.1基因序列,交上海吉凯生物有限公司生物合成,得到肌酐水解酶基因模板C。
1.2.2 聚合酶链式反应(Polymerase Chain Reaction PCR)扩增 按照肌酐水解酶(D45424.1)的基因序列设计引物,在上游引物中加入酶切位点BamHI,在下游引物中加入酶切位点XhoI。以下是设计的引物:
上游:AGCAAATGGGTCGCGGATCCATGAGCAAGAGTGTTTTTG
下游:TGGTGGTGGTGGTGCTCGAGTCAGGTGGGCGGGAACTCC
反应体系(25 μL):模板a,1 μL;上游引物,0.5 μL;下游引物,0.5 μL;2×Taq MasterMix,12.5 μL;dd H2O,10.5 μL;总体积为25 μL。PCR反应参数为:94 ℃,5 min;94 ℃,30 s;53 ℃,30 s;72 ℃,60 s;30个循环,72 ℃,5 min。反应结束后,4 ℃保存。
1.2.3 肌酐水解酶基因重组质粒GV296-C的构建
用BamHI、XhoI对PCR产物和质粒GV296进行双酶切。DNA凝胶回收试剂盒回收DNA片段。回收纯化的GV296酶切片段、肌酐水解酶DNA片段C,按照5∶1加样。进行连接反应。T4连接酶反应体系(20 μL):肌酐水解酶DNA片段5 μL;质粒GV296酶切回收产物1 μL;T4连接酶1 μL,10×连接Buffer2 μL; dd H2O11 μL。22 ℃反应10 min;65 ℃灭活10 min。重组质粒GV296-C转化DH5a感受态细胞。
1.2.4 重组质粒的挑选及鉴定 使用菌落PCR、双酶切、DNA测序等方法,对重组质粒GV296-C转化子进行筛选阳性克隆菌。初步用菌落PCR筛选阳性克隆,重组质粒抽提后,进行双酶切及DNA测序进一步确定。挑取单菌落,分别挑取1个单菌落于1 mL卡那霉素抗性LB培养基离心管×8管,37 ℃,220 rpm 振荡2 h。PCR及测序引物以通用引物T7 Promoter Primer。以下是设计的引物:
T7正向引物:TAATACGACTCACTATAGGG
T7反向引物:TGCTAGTTATTGCTCAGCGG
反应体系(12.5 μL):菌液1.5 μL;T7正向引物、T7反向引物均为0.25 μL;dd H2O,4.25 μL;2×Taq MasterMix,6.25 μL;总容积为12.5 μL。反应参数如下:94 ℃,10 min;94 ℃,30 s;53 ℃,30 s;72 ℃,60 s;30个循环,72 ℃,5 min。反应完后,4 ℃保存。将PCR产物进行1.2%琼脂糖凝胶电泳,以初步筛选阳性克隆。
取PCR阳性克隆菌液10 μL,接种于卡那霉素抗性LB培养基。37 ℃,220 rmp振荡培养过夜(约12 h)。抽提质粒后,进行双酶切。将菌落PCR、酶切均显示为阳性的重组质粒GV296-C转化子的菌液,送至上海生工生物有限公司进行测序。
1.2.5 重组质粒GV296-C的鉴定和诱导表达 测序正确的阳性转化子GV296-C,转入大肠杆菌BL21(DE3),进行转化及菌液PCR,构建表达工程菌GV296-C/BL21(DE3)。根据测序比对正确的肌酐水解酶的序列设计引物,在上下游引物中分别添加HindIII、 XbaI酶切位点。引物如下:
上游:GCTCTAGA-cggaagtccgtctggc
下游:CCCAAGCTT-gaattcgacatagctgaaacttcc
PCR反应完成后,产物1.2%琼脂糖凝胶电泳,以筛选阳性克隆菌。对PCR鉴定阳性的表达工程菌GV296-C/BL21(DE3),使用IPTG诱导其蛋白的表达。超声波粉碎细菌后,采用非连续变性电泳。
1.2.6 表达工程菌分解肌酐的体外实验 挑取重组菌GV296-C/BL21(DE3)的单菌落,接种于2 mL卡那霉素抗性LB培养基,温度37 ℃,220 rpm 揺菌培养;次日按1∶100转种于5 mL卡那霉素抗性LB培养基,温度30 ℃,220 rpm培养2 h;在无菌条件下加入IPTG至终浓度1 mM,继续培养4 h后,收集菌体,生理盐水洗涤后,再用生理盐水重悬菌体,用麦氏比浊法调整悬菌液约1.5×108cfu/mL;取悬菌液200 μL加入含肌酐的800 μL LB培养基中。取大肠杆菌DE3(菌浓度同上)悬菌液200 μL,加入含肌酐的LB培养基800 μL,设为对照组。温度37 ℃,220 rpm培养24小时,13 000 rpm,离心2 min,取上清液,送生化分析仪检测肌酐浓度。取生理盐水200 μL加入上述培养基中,设为阴对照组,培养24小时后,同上离心取上清液测肌酐浓度。设5个样本每组。
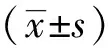
2 结 果
2.1 PCR扩增的肌酐水解酶目的基因按照肌酐水解酶D45424.1的基因序列进行生物合成,得到模板C,进行PCR扩增,得到约823bp的DNA片段,大小与预期一致,见图1。

图1 肌酐水解酶基因PCR产物电泳图 1:PCR扩增产物,2:Maker
2.2 PCR鉴定重组质粒重组质粒GV296-C转染入a感受态大肠杆菌DH5,挑取转化子1~8号,进行菌液PCR,产物进行1.2%琼脂糖凝胶电泳。5~12泳道为1~8号转化子经PCR鉴定,得到约1 068 bp的DNA片段,与肌酐水解酶的基因大小相符,具体见图2。将PCR鉴定阳性的产物送测序,显示肌酐水解酶的基因片段与D45424.1的基因序列一致,测序结果见图3。

图2 重组质粒GV296-C的菌落PCR鉴定
2.3工程菌GV296-C/BL21(DE3)表达的SDS-PAGE分析表达工程菌GV296-C/BL21(DE3)经IPTG诱导后,用于SDS-PAGE上样,凝胶成像照相。分析泳道3、5,可见有目的蛋白表达,分子量约为29 KD,大小与预期相一致,见图4。

图4 重组肌酐水解酶及其纯化产物的SDS-PAGE分析
2.4工程菌肌酐水解酶活性测定结果取经IPTG诱导后的表达工程菌GV296-C/BL21(DE3),菌液与肌酐溶液作用24小时后,与对阴性照组相比,表达工程菌组上清液肌酐浓度显著下降(P<0.01),有统计学意义,DE3组与阴对照组比较,P>0.05无显著性差异;见表1。
表1各种细菌对肌酐的作用比较(n=5)

分组阴性对照组大肠杆菌DE3组表达工程菌组肌酐(μmol/L)1019.73±47.98952.64±51.48b512.35±43.95a
F=176.92,a:与阴对照组、DH5a组比较,P<0.01;b:与阴对照组比较,P>0.05

图3 肌酐水解酶基因片段的测序图
3 讨 论
慢性肾衰当人体血肌酐浓度达到530.46~ 707.28 μmol/L时,肌酐渗入肠腔的量显著增加,为肠道细菌提供了充足的能源。导致肠道内微生态发生改变,细菌过度生长。肌酐被细菌降解为多种产物,如尿酸、甲基胍等。动物实验显示注射甲基胍的鼠肾小球滤过率、肾血流量均显著下降。给慢性肾衰的狗腹腔内注射甲基胍,可导致代谢增高、贫血、血小板减少,中央和周围神经病变、心律不齐、心肌变性、痛痒症,呕吐、食欲下降、流涎增多和腹泻。甲基胍肾毒性机制目前认为是甲基胍在氧作用下产生氧自由基,激活体内(特别是肾细胞)的氧化应激。实验显示肌酐降解为甲基胍后,其毒性进一步增强。
实验显示在高浓度肌酐诱导下,细菌能产生更多的肌酐降解酶。烟草节杆菌发酵产肌酐酶,诱导后,酶活性显著增加[3]。多种细菌具有肌酐降解酶[4,5]。Seifter JL发现尿道感染细菌中也肌酐水解酶,并且降解肌酐[6]。肌酐在肠道细菌作用下降解成多种产物,其中1-甲脲乙醇酸酐、甲基胍等其毒性进一步增强[7]。Ranganathan[8]提出慢性肾衰肠道细菌疗法,其方法是将能分解尿毒素的细菌(对人体低毒的)摄入消化道内,分解渗入肠道内的尿毒素,以降低血中尿毒素浓度,减轻尿毒症症状。
肌酐在肌酐水解酶的作用下,水解成肌酸;肌酸在肌酸水解酶催化下进一步降解为肌氨酸和尿素。目前对肌酐水解酶研究较多,主要是把该酶用于酶法检验肌酐[9]。本实验室以前已经成功构肌酸水解酶基因重组工程菌,本次实验构建含肌酐水解酶的基因大肠杆菌,表达肌酐水解酶,旨在下一步将这两种酶的基因融合,转入肠道益生菌,使肌酐降解肌酸后,进一步降解为肌氨酸。
目前研究较为系统的是能产肌酐水解酶的恶臭假单胞菌,其基因序列中含有一个780 bp的开放阅读框、由259个氨基酸残基组成、分子量为28 437 Da,根据Genbank中恶臭假单胞菌PS-7(D45424.1)基因序列构建肌酐水解酶目的基因模板,PCR扩增得到肌酐水解酶目的基因片段,测序鉴定扩增片段的基因与D45424.1基因序列完全一致。通过测序比对得到肌酐水解酶的基因片段,经酶切后也证实与肌酐水解酶的基因片段一致。显示目的基因克隆成功。在表达实验结果中,显示工程菌能产生肌酐水解酶,并且能分解酐,具有酶活性。
肠道细菌疗法其关键是选择高效低毒菌,通常选择肠道益生菌。因为外来菌进入消化道后,可能导致宿主肠道微生态紊乱,产生新的菌群失调;同时还可能携带了某些耐抗菌素的载体质粒,这些质粒可能会转化到其他肠道菌种中,导致产生新的耐抗生素菌群,有可能导致原本免疫力低下的尿毒症患者出现严重的感染性疾病。因此考虑下一步采用益生菌做为基因工程菌的宿主菌,如乳酸杆菌、枯草芽孢杆菌,有望为慢性肾衰肠道细菌治疗解决安全性问题。枯草芽孢杆菌比乳酸杆菌有更强的生存能力,在孢子状态下稳定性好,耐挤压,能耐氧化;60 ℃高温下能长期生存,在120 ℃温度下可存活20分钟;在胃酸环境中能保持活性,可以耐唾液和胆汁的碱性环境,具有良好的耐酸碱特性,活菌可100%直达大小肠。枯草芽孢杆菌以孢子状态进入消化道后,由休眠状态迅速复苏,在短期内繁殖成含菌量高的优势种群,大量消耗掉肠道内氧气,并产生细菌素、过氧化氢,建立新的微生态平衡,促进肠道益生菌的繁殖,抑制有害微生物(大肠杆菌、沙门氏杆菌)的生长,从而预防腹泻、痢疾等肠胃道疾病。在快速增殖过程中,产生大量多种维生素、氨基酸、有机酸、蛋白酶(特别是碱性蛋白酶)、脂肪酶、糖化酶、淀粉酶[10-11]。近二十年以来,人们逐渐致力研究枯草芽孢杆菌的生物学和基因组学特性,并且运用基因工程的方法,对其遗传物质进行改造,构建了一系列基因表达载体[12-13]。程新等把肌酐水解酶基因转入乳酸杆菌[14]。枯草芽孢杆菌可能比乳酸杆菌更有优势。本实验成功构建肌酐水解酶的重组质粒菌,将为下一阶段构建含有肌酐水解酶的枯草芽孢杆菌基因工程菌奠定基础,基因菌摄入慢性肾衰患者肠道后,在肠道内发挥生化作用。使作为毒素的肌酐,在降解为肌酸后,进一步转化可作为为营养物质的肌氨酸,为慢性肾功能衰竭的治疗,延缓病情的进展提供新的治疗方法及思路。
[1] 樊均明,马欣,文集.肠道菌群的微生态改变与慢性肾脏疾病[J].中国中西医结合肾病杂志,2013,12(14):1035-1037.
[2] 杨波,王滚,蒋芬,等.产肌酸水解酶基因工程菌的构建[J].中国现代医学杂志,2015,29(25):12-17.
[3] 梁剑光,贾佳红,吴俊伟,等.烟草节杆菌肌酐酶发酵培养基优化[J].中国生物工程杂志,2015,35( 8):90-95.
[4] 胡白瑛,蒋云生.尿毒症患者与正常人肠道细菌利用肌酐的研究[J].中国医师杂志,2004,6(2):160 -162.
[5] 赵更峰,王兰,顿玉慧,等.产肌酐水解酶菌株的分离、鉴定及产酶条件研究[J].河南师范大学学报:自然科学版,2005,33(1):111-114.
[6] Seifter JL.Urinary creatinine-splitting bacteria after ileal-loop diversion causing underestimate of glomerular filtration rate[J].Am J Med,2014,127(12):11-12.
[7] Yang B,Liu D,Li CZ,et al.1-Methylhydantoin cytotoxicity on renal proximal tubular cells in vitro[J].Renal Failure,2007,29:1025-1029.
[8] N Ranganathan,BG Patel,P Ranganathan,et al.In vitro and in vivo assessment of intraintestinal bacteriotherapy in chronic kidney disease.Amercian society of artificial[J].Internal Organs,2006,52(1):70 -79.
[9] Yadav S,Devi R,Bhar P, et al.Immobilization of creatininase,creatinase and sarcosine oxidase on iron oxide nanoparticles/chitosan-g-polyaniline modified Pt electrode for detection of creatinine[J].Enzyme Microb Technol, 2012,50(4):247-254.
[10] 吴逸飞,孙宏,姚晓红,等.芽孢杆菌在动物肠道内的作用机制及其动物生产应用[J].饲料工业,2013,34(13):29 -31.
[11] 王晓阁.枯草芽孢杆菌研究进展与展望[J].中山大学研究生学刊:自然科学与医学版,2012,33(3):14-23.
[12] 余小霞,田健,刘晓青,等.枯草芽孢杆菌表达系统及其启动子研究进展[J].生物技术通报,2015,31(2):35-44.
[13] Guan C,Cui W,Cheng J,et al.Construction of a highly active secretory expression system via an engineered dual promoter and a highly efficient signal peptide in Bacillus subtilis[J].N Biotechnol,2016,33(3):372-379.
[14] 程新,张彦新,周桂凤,等.产肌酐水解酶基因工程菌的构建[J].生物医学工程研究,2009,28(4):299-230.
TheConstructionoftheCreatininaseGeneEngineeringBacteriaandFunctionStudy
YANG Bo,JIANG Fen,ZHU Yan,et al
(DepartmentofNephrology,theFirstAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo construct recombinant plasmids of Creatininase,cloning into E.coli,and study its expression and enzyme activity.MethodsAccording to the gene sequence of creatininase in Genbank(D45424.1),it was biosynthesized to get the gene fragment of creatininase C,after the PCR amplified,and then was connected with GV296 to construct the recombinant plasmid GV296-C,and transformed to E.coli BL21(DE3) to construct gene engineering strain GV296-C/BL21 (DE3).After SDS-PAGE,the concentration of creatinine in the culture fluid was determined.ResultsThe recombinant plasmid GV296-C was constructed successfully,enzyme fragment was about 0.783Kb as electrophoresed shown.The sequencing result was consistent with gene order(D45424.1).The reconstructed plasmid GV296-C were transformed into E.col BL21(DE3) competent cells.The protein of molecular weight was approximately 29KD by SDS-PAGE.ConclusionsThe engineering strain GV296-C/BL21 (DE3) is constructed successfully,and the expression of the creatininase is induced to be efficient,which has the enzymes activity.
creatininase; gene engineering bacteria; creatinine; chronic renal failure
10.15972/j.cnki.43-1509/r.2016.05.004
2016-04-25;
2016-06-29
湖南省自然科学基金项目(No:13JJ3082).
R692.5
A
秦旭平)

