水相大豆分离蛋白对油包水乳液稳定性的影响
易建华 孙艺飞 朱振宝 董文宾 李静娟
(陕西科技大学食品与生物工程学院1,西安 710021)(焦作市疾病预防控制中心2,焦作 454003)
水相大豆分离蛋白对油包水乳液稳定性的影响
易建华1孙艺飞1朱振宝1董文宾1李静娟2
(陕西科技大学食品与生物工程学院1,西安 710021)(焦作市疾病预防控制中心2,焦作 454003)
以富含多不饱和脂肪酸的核桃油为油相,于水相添加大豆分离蛋白(SPI),采用超高压微射流均质机制备油包水(W/O)乳液,乳液于45 ℃避光保存,每隔1 d测定乳液的平均粒径及粒径分布等物理特性,同时检测乳液初级及其次级氧化产物—脂质氢过氧化物与己醛,探究SPI对W/O乳液稳定性影响。结果表明,SPI应用于W/O乳液,乳液水滴粒径降低,乳液物理稳定性增大,SPI同时具有抗氧化活性。0.1%~0.4% SPI,蛋白质用量的增大对乳液物理稳定性无显著性影响;SPI用量增大(0.1%~0.2%)延长了脂质氢过氧化物与己醛形成延迟期,而用量进一步增大(0.4%)乳液脂质氧化稳定性影响不显著。乳液水相pH对SPI抗氧化活性有显著影响,水相pH 7.0,SPI抗氧化活性高于水相pH 3.0。研究同时表明,水相钙离子强度0~200 mmol/L CaCl2,钙离子引入提高了乳液物理稳定性;乳液水相钙离子强度较低时(≤10 mmol/L CaCl2),离子强度的增大降低了SPI抗氧化活性,较高离子强度(100~200 mmol/L CaCl2)加速了乳液脂质氧化。
大豆分离蛋白 油包水乳液 油脂氧化 钙离子强度
核桃油含70%多不饱和脂肪酸(PUFA)。据研究报道,核桃油具有调节血脂、预防和改善心血管疾病、促进神经传导、健脑益智、促进脂肪代谢等功能[1]。然而,PUFA极易氧化,促使含油食品产生不良风味,降低其品质,甚至产生有毒物质,影响食品安全,因此提高油脂氧化稳定性有助于提高食品的品质[2]。
油脂一般以纯油(Bulk oil)、水包油(O/W)乳液或油包水(W/O)乳液的形式存在于食品体系,其中O/W是油脂在食品中存在的主要形式[3]。研究表明,大豆分离蛋白(SPI)是一种两亲性分子,作为乳化剂广泛的应用于食品O/W乳液。SPI可以吸附在油水界面并且降低界面张力,为乳液液滴间提供空间和静电排斥作用,因而可以形成较稳定的乳液[4]。研究同时显示,分布于油水界面脂质氢过氧化物与水相过渡金属离子相互作用加速脂质氧化,因此,O/W乳液脂质氧化稳定性与油滴界面物化特性高度相关。通过控制油水界面化学成分、界面厚度以及电荷属性,可以有效控制油脂氧化[3]。研究证实,水相pH低于SPI等电点(pI 4.8),大豆蛋白通过吸附至油滴表面,使油水界面具有正电特性,从而提高了乳液氧化稳定性[5]。另外,研究显示,大豆蛋白抗氧化性可能源于脯氨酸、苯丙氨酸、酪氨酸等对自由基清除作用以及有限的过渡金属螯合作用[3,6]。
研究表明,在O/W体系中,大豆蛋白具有抗氧化作用。W/O乳液(如黄油、人造奶油)是油脂存在于食品的重要形式。关于在W/O体系中SPI抗氧化活性,目前研究报道有限。基于此,本课题将SPI应用于W/O体系,研究其对W/O体系氧化稳定性影响,为该蛋白在相关食品中的应用提供参考。
1 材料与方法
1.1 原料与试剂
核桃油:自制。大豆分离蛋白(SPI),购买于美国Protein Technologies International (St. Louis, MO,USA),蛋白经过透析脱盐处理,SPI蛋白质含量为90%,水分6.0%,脂肪1.5%。
异丙苯过氧化氢,十六烷,氯化钡,氯化钠,磷酸氢二钠、磷酸二氢钠,正己烷,甲醇,正丁醇:西格玛化学试剂有限公司;聚甘油聚蓖麻油酸酯(PGPR,4175):由美国Palsgaard馈赠。所有试剂为分析纯。
1.2 设备与仪器
M133/1281-0便携式均质搅拌器:美国Biospec Products有限公司;ECLIPSE80i光学显微镜:尼康机械有限公司;粒径动态激光散射仪:美国马尔文机械有限公司;高压微射流均质机:美国Microfluidics公司;ICE 3500型原子吸收仪:美国Thermo(热电)公司;GC-17A气相色谱:日本Shimadzu公司。
1. 3 试验方法
1.3.1 乳液的制备和储存条件
以PGPR为乳化剂,用量为乳液质量分数5.0%,将PGPR与核桃油混合均匀,制备油相;将SPI溶解于20 mmol/L磷酸盐缓冲液,制备水相,含水量为乳液质量分数20.0%。将水相逐渐滴加于油相,由便携式均质搅拌器以2000 r/min搅拌2min,获得粗乳液,随后用高压微射流均质机以12 kbar压力均质3次。制备的乳液样品转移至10 mL的GC小瓶,用聚四氟乙烯/硅氧烷为垫片,采用铝盖密封,并存储于45 ℃温室避光保存。每天取不同处理3瓶样品,检测脂质氢过氧化物和己醛的形成。在研究蛋白质浓度对W/O乳液脂质氧化稳定性影响的试验中,SPI(分别为乳液质量分数0、0.1%、0.2%、0.4%)溶于pH 7.0 20 mmol/L磷酸盐缓冲液,并依照上述方法制备W/O乳液;在研究水相pH对蛋白质抗氧化性影响时,将0.2% SPI溶解于20 mmol/L磷酸盐缓冲液,用0.1和/或1 mol/L NaOH、HCl将水相pH分别调节至pH 3.0、pH 7.0;在研究离子强度对含蛋白质W/O乳液氧化稳定性影响时,CaCl2(浓度分别为乳液水相的0、10、100、200 mmol/L)溶于pH 7.0 20 mmol/L磷酸盐缓冲液,制备水相,水相蛋白质分数为0.2% ;所有乳液的制备参照上述方法。
1.3.2 乳液物理性质的测定
分析前轻轻搅拌乳液,以确保乳液体系中水滴均匀分散。滴加乳液于载玻片,加盖盖玻片。利用光学显微镜观察乳液结构,该显微镜连接数字图像处理软件CCD照相机,可动态获取乳液液滴分布的图像资料。采用粒径动态激光散射仪于25 ℃测定水滴粒径,测定方法参照Choi等[7]试验方法,具体如下:乳液样品用十六烷稀释到4倍,(十六烷折射率1.434,黏度为3.13 mPa·s),混合均匀,并立即转移至3 mL激光散射玻璃皿,测定乳液液滴粒径的大小。微滴大小为散射强度加权平均直径,以z-average表示。每处理重复3次,在室温下测定样品。
1.3.3 脂质氧化物的测定
1.3.3.1 脂质氢过氧化物的测定
脂质氧化初级产物以脂质氢过氧化物含量表示。依据Panya等[8]测定脂质氢过氧化物的方法,并做一些改进:20 μL乳状液称重,并添加于2.8 mL甲醇/正丁醇混合液中(甲醇/正丁醇=2∶1,V/V),然后将15 μL 3.94 mol/L硫氰酸铵和15 μL亚铁溶液(由0.132 mol/L氯化钡和0.144 mol/L硫酸亚铁配制)加入其中。混合液旋涡混合,置于室温下反应20 min后,用分光光度计于510 nm处测定吸光度。以过氧化枯烯(异丙苯过氧化氢)为标准品绘制标准曲线,并计算出氢过氧化物的含量。
1.3.3.2 己醛测定
脂质氧化次级产物以顶隙己醛含量表示。根据Shantha等[9]的方法,采用GC-17A气相色谱测定己醛浓度:将以聚四氟乙烯/硅氧烷为密封垫并用铝盖加盖的玻璃瓶中的1 mL样品加热到55 ℃保持8 min。气相色谱分析条件固相:50/30 μmol/L DVB/Carboxen/PDMS;色谱柱:Supelco DB-1柱,30 m×0.32 mm。载气为氦气,流速为15 mL/min。纤维针注入小瓶,吸取挥发物2 min,然后转移到喷油器端口(250 ℃),注射3 min。注射端口是按照分流模式操作,分流比为1∶7。检测器:火焰电离检测器,检测温度250 ℃。以己醛标准品绘制标准曲线,采用峰面积计算己醛含量。
1.3.4 蛋白质螯合能力测定
采用改进的Chen等[10]测定蛋白质螯合铁离子的方法。具体方法如下:透析袋(截留相对分子质量为8 ku置于2%碳酸氢钠和1 μmol/L EDTA溶液,于80 ℃加热30min,清洗2次,然后用去离子水彻底冲洗,并置于0.1%叠氮化钠溶液中,于5 ℃保存,备用。用20 mmol/L pH3.0和pH7.0的磷酸盐缓冲液配制质量分数2% SPI溶液。分别用1 mol/L NaOH和1 mol/L HCl调整SPI溶液pH值。两等分10 mL pH 3.0和7.0 SPI溶液,分别加入透析袋,透析袋置于89 mL pH分别为3.0和7.0 20 mmol/L磷酸盐缓冲溶液,于室温搅拌,平衡30 min。然后向平衡液中加入80 μg/mL Fe2+溶液(由FeSO4配制),平衡12 h后,依据GB/T 5009.90—2003,采用原子吸收测定透析袋外溶液铁离子的浓度。在研究离子强度对蛋白质螯合能力影响的试验中,用20 mmol/L pH7.0磷酸盐缓冲液配制离子强度分别为0、10、100、200 mmol/L CaCl2溶液,再用该溶液配制2.0% SPI溶液。分别移取10 mL SPI溶液于透析袋,透析袋置于89mL离子强度分别为0、10、100、200 mmol/L CaCl2溶液,于室温搅拌,平衡30min。
原子吸附测定条件:铁波长:248.3 nm,灯电流:6 mA,光谱通带:0.2 nm,乙炔流量:0.9 L/min。
1.3.5 统计分析方法
所有处理重复3次。每个样品重复测定3次,取平均值,数据结果以均值 ± 标准差(x±S.D.)表示,采用Microsoft excel软件绘图,并运用Duncan’s多重比较进行显著性检验(P<0.05)。脂质氧化滞后期或延迟期定义为第一个数据点显著大于0 d氧化指标值。
2 结果与分析
2.1 乳液物理稳定性及影响因素
乳液制备后立即测定乳液液滴粒径,并在储藏过程中每24 h测定1次。空白样(未加蛋白质以及盐)的平均粒径(z-average)的范围在(3 464.3±71.3) nm,试验中发现蛋白质浓度、离子强度对乳液液滴粒径分布和平均粒径有明显影响外,其他处理(如水相pH)对乳液粒径没有显著性影响。此外,W/O乳液粒径分布和平均粒径在试验期间没有明显的变化(数据未显示)。视觉观察试验也表明,乳液在存储过程中,所有处理没有相分离现象(数据未显示)。这说明在该试验条件下,乳液液滴尚未发生聚结、沉积而失稳。
2.1.1 用量影响
本研究发现,蛋白质用量影响乳液粒径分布和平均粒径。结果如图1以及表1所示。表1显示,W/O乳液中SPI引入显著降低了乳液水滴粒径。图1同样显示:SPI的应用使乳液水滴粒径由双峰分布转变为单峰分布。大量研究表明,SPI具表面活性,由于有较高的亲水性和较低的亲油性,可用于O/W乳液的制备,但不能用于制备W/O乳液。尽管如此,该研究说明,在W/O体系中,SPI能促进水油界面的形成以及乳液粒径均一微细化分布。该性能有利于提高乳液的物理稳定性。但由表1和图1看出,SPI浓度提高对乳液平均粒径与粒径分布没有明显影响。

图1 含SPI W/O乳液粒径分布

处理用量/%平均粒径/nmSPI0.1226.9±37.3b0.2246.2±50.1b0.4197.3±40.1b空白对照03464.3±71.3a
注:不同字母表示差异性显著(P<0.05)。
2.1.2 离子强度影响
离子强度对含SPI乳液液滴粒径分布及平均粒径影响如表2及图2所示。由图2看出,离子强度对含SPI乳液水滴粒径分布影响具有以下显著特征:对于未加CaCl2含0.2% SPI乳液,其粒径呈现单峰分布,该研究结果与上述研究相一致;离子强度的引入显著降低了乳液水滴粒径,表明在W/O体系中离子强度能提高乳液的稳定性。该研究结论与O/W体系完全相反。以往研究显示,在O/W体系,由SPI稳定的乳液中含有较高浓度的盐离子将导致乳液液滴发生聚集,使乳液稳定性降低[11]。可见,SPI存在不同体系,水相离子强度对其影响有所不同。图2同时表明,随乳液离子强度的增大,分布峰左移,说明平均粒径减小;离子强度的增大使粒径分布峰肩变窄,表明液滴粒径分布范围变小,粒径趋于集中;由图2和表2可以看出,该离子强度范围对乳液平均粒径大小影响不显著(P>0.05)。
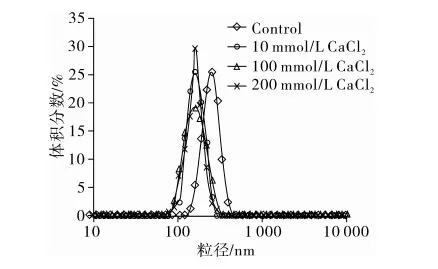
图2 离子强度对含SPI W/O乳液粒径分布影响
表2 离子强度对W/O乳液液滴平均粒径的影响

处理离子强度/mmol/LCaCl2平均粒径/nmSPI0252.6.±18.1a10167.8±20.5b100166..9±10.6b200162.8±21.1b
注:不同字母表示差异性显著(P<0.05)。
2.2 SPI用量对W/O乳液脂质氧化稳定性影响
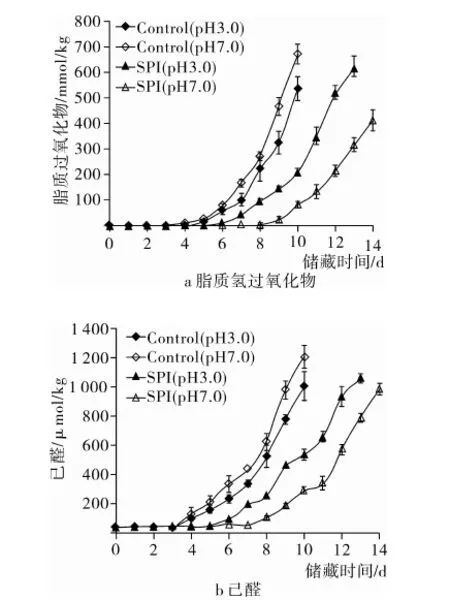
图3显示,SPI用量增加可在一定程度上延缓W/O乳液脂质氧化产物的形成。例如,当SPI用量由0.1%提高到0.2%,脂质过氧化物形成的延迟期由6 d 延长至8 d;己醛形成的延迟期由6 d延长至9 d。这表明适当提高SPI浓度有助于增大W/O乳液脂质氧化稳定性。SPI浓度继续增大对脂质氧化产物延迟期没有显著性影响(SPI浓度为0.4 mg/100 mL,乳液脂质氢过氧化物与己醛形成的延迟期分别为8、9 d)。该研究结果有别于Hu等[5]研究,他们发现在O/W体系中SPI的抗氧化性与其浓度正相关。可见,在不同的乳液中蛋白质抗氧化性存在差异。

注:水相pH 7.0,乳液于45 ℃,避光贮存14 d。
2.3 水相pH对含SPI W/O乳液脂质氧化稳定性影响
有研究表明,对促氧化剂—过渡金属离子螯合作用与蛋白质的抗氧化性密切相关,而pH影响蛋白质带电状态,从而有可能影响其抗氧化活性。因此本研究进一步研究了水相pH对SPI抗氧化性影响,结果如图4所示。由图4看出,pH影响空白对照样氧化稳定性:水相pH较低时(如pH 3.0),乳液脂质稳定性较高,而水相pH升高(如pH 7.0)导致乳液脂质稳定性降低。该结果与以前研究相一致[12]。水相pH同时影响SPI抗氧化活性,总体表现为,蛋白质的抗氧化性随pH增大而提升,这与空白对照样氧化稳定性趋势相反,也与Mei等[13]、Donnelly等[14]的研究结论相反。研究发现,由蛋白质稳定的O/W乳状液,水相pH较低时(
注:乳液于45 ℃ 避光贮存14 d。
图4 水相pH对含SPI W/O乳状液脂质氧化稳定性的影响

注:体系含0.2 g SPI,8 mg/mL Fe2+。
2.4 钙离子强度对含SPI W/O乳液脂质氧化稳定性影响
含蛋白质的食品体系,其离子强度影响蛋白质的电离状态以及蛋白质空间结构,这种影响有可能导致其抗氧化活性的改变,因此,该研究考察了钙离子强度(0~200 mmol/L CaCl2)对含蛋白质W/O乳液脂质氧化稳定性的影响,结果如图6所示。图6表明,含有SPI但未加钙盐的乳液,脂质氢过氧化物和己醛的形成缓慢,表明SPI在W/O乳液具有抗氧化活性,与以上研究一致。离子强度的增大导致乳液氧化稳定性降低,表明在该离子强度范围,SPI抗氧化性受到抑制。有研究表明,水相pH 7.0,高浓度盐使蛋白质所带负电荷减少[13],因此,离子强度的增加可能会屏蔽蛋白质表面的负离子,从而降低蛋白质螯合过渡金属的能力,导致抗氧化活性的降低。CaCl2的进一步增加(例如,100 mmol/LCaCl2)完全抵消SPI抗氧化活性,甚至促进W/O乳液脂质氧化,具体表现为:空白对照样(未加SPI与CaCl2)的脂质氢过氧化物和己醛形成的延迟期都为4 d,而含SPI及100 mmol/L CaCl2的乳液,其脂质氢过氧化物和己醛形成的延迟期被缩短至2 d。离子强度进一步提高到200 mmol/L CaCl2,乳液脂质氧化速率进一步提升,初级与次级氧化产物形成的延迟期都为1 d。钙盐加速油脂氧化可能与以下因素有关:氯离子被研究证明具有催化过渡金属铁离子参与的脂质氧化反应的作用[13]。体系中钙盐浓度的增大,促使Ca2+与Fe2+竞争蛋白质螯合位点,降低了SPI螯合内源促氧化剂—过渡金属离子的能力,从而增大了过渡金属铁离子与液滴界面脂质接触的机会。为此,试验测定了钙离子浓度对SPI螯合能力的影响(图7),图7证实,钙离子浓度增大明显降低了SPI螯合Fe2+螯合能力。另外,离子强度的引入降低了W/O乳液的液滴粒径,增大了油水界面面积,从而加速脂质氧化速率[15]。

注:水相pH 7.0,乳液于45 ℃避光贮存14 d。
图6 离子强度对含0.2% SPI W/O乳状液脂质氧化稳定性的影响

注:体系pH 7.0,含0.2 g SPI,8 mg/mL Fe2+。
图7 钙离子强度对SPI螯合Fe2+能力影响
3 结论
SPI应用于W/O乳液降低乳液液滴粒径,提高乳液物理稳定性;SPI引入同时提高乳液氧化稳定性;水相pH影响SPI抗氧化活性,其中水相pH 7.0时,SPI抗氧化活性高于水相pH 3.0;含SPI乳液,钙盐的引入提高了乳液的物理稳定性,但乳液氧化稳定性随离子强度的增大而降低。
[1]王文琼,包怡红,蔡秋红,等. 超声波辅助法提取山核桃油的研究[J]. 中国粮油学报,2012,27(12):47-52
Wang W Q, Bao Y H, Cai Q H, et al. Study on extracting technics of walnut oil assisted by ultrasonic wave[J]. Journal of the Chinese Cereals and Oils Association, 2012,27(12):47-52
[2]Yi J H, Zhu Z. B, Dong W B, et al. Influence of free fatty acids on oxidative stability in water-in-walnut oil emulsions [J]. European Journal of Lipid Science and Technology, 2013, 115: 1013-1020
[3]McClements D J, Decker E A. Lipid oxidation in oil-in-water emulsions: impact of molecular environment on chemical reactions in heterogeneous food systems [J]. Journal of Food Science, 2000, 65: 1270-1282
[4]蓝亭,杨晓泉,张晋博.高温短时干热法制备 SPI-麦芽糊精糖基化产物及其乳化性的研究[J].中国粮油学报,2012,29(5):23-28
Nan T, Yang X Q, Zhang JB. Soy protein isolate-maltodextrin conjugates synthesized by high-temperature,short-time dry-heating maillard reaction:preparation and emulsifying properties[J]. Journal of the Chinese Cereals and Oils Association, 2012, 29 (5):23-28
[5]Hu M., McClements D J, Decker E A. Lipid oxidation in corn oil-in-water emulsions stabilized by casein, whey protein isolate, and soy protein isolate [J]. Journal of Agricultural and Food Chemistry, 2002, 51: 1696-1700
[6]王璇,田少君,张君旗. 大豆肽生理活性研究进展[J].农业机械,2011(1):75-78
Wang X, Tian S J, Zhang J Q. Research progress on physiological activity of soybean peptide[J]. Agricultural Machinery, 2011(1): 75-78
[7]Choi S J, Decker E A, McClements D J. Impact of iron encapsulation within the interior aqueous phase of water-in-oil-in-water emulsions on lipid oxidation [J]. Food Chemistry, 2009, 116: 271-276
[8]Panya A, Laguerre M, Lecomte J, et al. Effects of chitosan and rosmarinate esters on the physical and oxidative stability of liposomes [J]. Journal of Agricultural and Food Chemistry, 2010, 58(9): 5679-5684
[9]Shantha N, Decker E A. Rapid, sensitive, iron-based spectrophotometric methods for determination of peroxide values of food lipids [J]. Journal Association of Ofcial Analytical Chemists, 1994, 77: 412-424
[10]Chen B C, McClements D J, Decker E A. Role of continuous phase anionic polysaccharides on the oxidative stability of menhaden oil-in-water emulsions [J]. Journal of Agricultural and Food Chemistry, 2010, 58: 3779-3784
[11]Diftis N, Kiosseoglou V. Stability against heat-induced aggregation of emulsions prepared with a dry-heated soy protein isolate-dextran mixture [J].Food Hydrocolloids, 2006, 20(6): 787-792
[12]Yi J H, Zhu Z B, McClements D J, et al. Inuence of aqueous phase emulsiers on lipid oxidation in water-in-walnut oil emulsions [J]. Journal of Agricultural and Food Chemistry, 2014, 62: 2104-2011
[13]Mei L Y, McClements D J, Wu J N, et al. Iron-catalyze lipid oxidation in emulsions as affected by surfactant, pH and NaCl [J]. Food Chemistry, 1998, 61: 307-312
[14]Donnelly J L, Decker . A, McClements D J. Iron-catalyzed oxidation of Menhaden oil as affected by emulsifiers [J]. Journal of Food Science, 1998, 63: 997-1000
[15]Lee S, Choi S J, Decker E A, et al. Protein-stabilized nanoemulsions and emulsions:compareson of physicochemical stability, lipid oxidation, and lipase digestibility [J]. Journal of Agricultural and Food Chemistry, 2011, 59:415-427.
Effect of Soybean Protein Isolates in Aqueous Phase on the Stability of Water-in-Oil Emulsions
Yi Jianhua1Sun Yifei1Zhu Zhenbao1Dong Wenbin1Li Jingjuan2
(School of Food and Biological Engineering, Shaanxi University of Science and Technology1, Xi′an 710021) (Jiaozuo Center for Disease Control and Prevent2, Jiaozuo 454003)
Walnut oil rich in PUEA was used as the oil phase and soybean protein isolates (SPI) were added into the water phase to prepare the water-in-oil (W/O) emulsions by using microfluidizer. The mean particle size and particle size distributions of emulsion were measured every other day, at the same time,the formation of primary oxidation products (lipid hydroperoxides) and secondary oxidation products (headspace hexanal) was determined to evaluate influence of aqueous phase SPI on the stability in W/O emulsions during storage at 45 ℃ in the dark. The results showed that the application of SPI in W/O emulsions could decrease the partical size of emulsion drops, and
improve the physical stability of W/O emulsions. With SPI at the levels of 0.1%~0.4%, the increasing of protein dose had non-significant effects on the physical stability of the emulsions; The increasing of SPI dose at the levels of 0.1%~0.2%could prolong the delay period between lipid hydroperoxides and headspace hexanal. However, the lipid oxidative stability of the emulsions was not remarkably improved with the addition of 0.4% SPI. Aqueous phase pH had a significant effect on the antioxidative stability of SPI. SPI had higher antioxidant activity at aqueous phase pH 7.0 than at pH 3.0. Meanwhile, the study indicated that calcium ion strength is 0~200 mmol/L CaCl, which increased the physical stability of W/O emulsions. When levels of calcium ionic strength was low (≤10 mmol/L CaCl), the increasing of ionic strength suppresses the antioxidant activity of SPI, whereas its higher levels (100~200 mmol/L CaCl) promoted lipid oxidation in the emulsions.
soybean protein isolates (SPI), water-in-oil (W/O) emulsions, lipid oxidation, calcium ion strength
TS201.2
A
1003-0174(2016)12-0039-07
陕西省科技厅农业攻关(2014K01-10-04)
2015-03-23

