钆塞酸二钠动态增强对肝功能评估的应用
钱吉芳
叶建军2YE Jianjun
朱晓华2ZHU Xiaohua
张雅滨2ZHANG Yabin
陈 纲2CHEN Gang
张文娟2ZHANG Wenjuan
罗雅萍2LUO Yaping
马强华2MA Qianghua
作者单位
1. 甘肃省妇幼保健医院放射科 甘肃兰州730000
2. 兰州军区总医院影像科 甘肃兰州 730050
钆塞酸二钠动态增强对肝功能评估的应用
钱吉芳1QIAN Jifang
叶建军2YE Jianjun
朱晓华2ZHU Xiaohua
张雅滨2ZHANG Yabin
陈 纲2CHEN Gang
张文娟2ZHANG Wenjuan
罗雅萍2LUO Yaping
马强华2MA Qianghua
作者单位
1. 甘肃省妇幼保健医院放射科 甘肃兰州730000
2. 兰州军区总医院影像科 甘肃兰州 730050
中国医学影像学杂志
2016年 第24卷 第11期:825-829
Chinese Journal of Medical Imaging 2016 Volume 24 (11): 825-829
目的研究不同肝功能分级的乙型肝炎肝硬化患者肝脏钆塞酸二钠(Gd-EOB-DTPA)动态增强时间-信号强度的变化特点,探讨肝脏特异性造影剂评估肝功能的可行性。资料与方法收集兰州军区兰州总医院2011年11月—2015年8月行Gd-EOB-DTPA肝脏MR动态增强扫描的乙型肝炎肝硬化患者159例(肝硬化组),其中男84例,女75例,平均年龄(47.8±9.8)岁;另收集36例无肝炎病史,肝功能检查均正常的患者(对照组)。获得平扫期、动脉期、门静脉期、平衡期及第3~15分钟(每分钟扫描1次共17次扫描)的轴位图像。对肝脏右后叶感兴趣区采样,获得动态增强时间-信号强度变化率曲线,并按Child-Pugh分级进行分组。比较对照组与Child-Pugh A、B、C级曲线的差异,并分析组间关系。结果4组时间-信号变化率曲线分别表现为N、A、B、C型。随着分级增加,门脉期增强率、波谷增强率、15 min增强率、重吸收斜率不断降低,波谷时间不断增加。其中,波谷时间、重吸收斜率在各组间差异有统计学意义(P<0.05)。结论肝硬化患者不同肝功能分级的时间-信号强度变化率曲线存在差异,波谷时间和重吸收斜率可作为判断肝硬化患者肝功能的重要指标。
肝硬化;肝炎,乙型;磁共振成像;图像增强;钆塞酸二钠
钆塞酸二钠(Gd-EOB-DTPA)是当前具有最高弛豫率的肝细胞特异性MR对比剂[1];同时具有非特异性细胞外对比剂和肝胆特异性对比剂的特性,并可在一个相对较短的时间窗内完成检查[2]。因此,该物质具有广阔的应用前景,在肝脏肿瘤的鉴别诊断中具有重要意义[3-6];并在肝功能分级的应用方面也有较多研究[7-10]。由于实际应用中认识和设备的差异,在成像参数和判断指标上有较多的不一致。本研究通过评价肝硬化患者使用Gd-EOB-DTPA作为对比剂进行动态增强扫描,获取时间信号强度变化率曲线,旨在分析曲线类型与肝硬化不同分级之间的相关性。
1 资料与方法
1.1 研究对象 收集兰州军区兰州总医院2011年11月—2015年8月行Gd-EOB-DTPA肝脏MR动态增强扫描的患者252例。其中159例乙型肝炎肝硬化患者纳入肝硬化组,36例非肝硬化、肝功能正常者作为对照组。所有患者签署知情同意书。肝硬化组:男84例,女75例;平均年龄(47.8±9.8)岁。纳入标准:①有明确的乙型肝炎病史及化验结果;②1个月内经临床确诊为乙型肝炎后肝硬化;③影像学方法提示肝硬化。排除标准:①非乙型病毒性肝炎肝硬化患者;②有胆系或者肝脏感染、肝后性胆道梗阻、既往肝脏或胆道手术史患者;③有MR检查禁忌及过敏反应患者;④有严重肝、肾功能异常患者。对照组:男15例,女21例;平均年龄(43.4±10.3)岁。其中脂肪肝2例,肝囊肿5例,肝脏检查正常7例,肝血管瘤22例。主要纳入近期肝功能及血清生化指标未发现阳性特征的患者。排除标准:①乙型肝炎及其他类型肝炎、肝硬化病史;②胆系或者肝脏感染、肝后性胆道梗阻、既往肝脏或胆道手术史患者;③有MR检查禁忌及过敏反应患者。
1.2 实验室检查 于MR检查前1周内行肝功能相关项目检查。指标主要包括血清总胆红素、白蛋白、血浆凝血酶原时间等[11-12]。由1名临床副主任医师根据Child-Pugh(C-P)分级标准[13]进行评分,评价患者肝脏储备功能。评分标准:5~6分为A级、7~9分为B级、10~15分为C级。
1.3 仪器与方法 采用Siemens Verio 3.0T超导型MR扫描仪,选用相控阵表面线圈,线圈中心置于剑突下,保证全肝覆盖在线圈内。检查前进行屏气训练,尽量保证每次屏气呼吸动度相似。所有患者使用Gd-EOBDTPA进行肝脏MR动态增强扫描,扫描期包括平扫期、动脉期、门静脉期、平衡期。平衡期扫描结束后第3~15分钟肝细胞特异期期间每分钟扫描1次,共17次。增强扫描采用高压注射器,经右侧肘静脉团注Gd-EOBDTPA,剂量为0.1 ml/kg,流速2 ml/s[14]。随后注入生理盐水20 ml,流速与对比剂一致。在对比剂注射后20~25 s时启动动脉期扫描,启动时根据年龄进行适当增加:<30岁患者20 s时启动,>30岁患者每增加10岁延后1 s,单次扫描时间13~15 s;动脉期和门静脉期间隔10 s,70 s内完成门静脉期扫描,在100~120 s时完成平衡期扫描。扫描序列采用三维容积式插入法屏气检查(three-dimensional volumetric interpolated breathhold examination,3D-VIBE),轴位,扫描参数:TR 3.96 ms、TE 1.41 ms、翻转角9°、激励次数1、视野350 mm×245 mm、矩阵320×224、层厚 4 mm。层数根据肝脏大小选择涵盖全肝脏的最小层数,范围为44~64层,间距 0 mm。第16分钟使用3D-VIBE采集一次冠状位图像。
1.4 图像分析和处理 应用Siemens Leonardo图像工作站mean curve软件对动态增强数据进行后处理,在肝右后叶肝实质区选一感兴趣区(ROI)测量信号强度,直径约10 mm。首选右后叶上下段之间,避开血管及明显异常信号改变区域,避开呼吸或心脏搏动所致的运动伪影区。根据动态增强17次扫描图像的测量值绘制患者的时间-信号强度变化率曲线(time signalintensity change rate curve,TIC),计算公式为Ei=(Sic-SI)/SI×100%(Ei表示在增强后每次采集相对应的强化率,Sic、SI分别为增强前后的信号强度值)。记录患者肝右后叶的动脉期增强率(contrast enhancement ratio of arterial phase,AP-CER)、门静脉期增强率(contrast enhancement ratio of portal venous phase,PVPCER)、波谷时间(time to valley,TTV)、波谷增强率(contrast enhancement ratio of valley,V-CER)、15 min增强率(contrast enhancement ratio of fifteen minutes,15'-CER)以及重吸收斜率(reabsorption slope,RS)。对因呼吸动度不一致导致的有明显解剖层面及信号差异的序列,依据解剖关系使用手动测量信号强度,并计算增强强度变化率。由2名副主任医师采用随机盲法分析,如各扫描时期未在标准时间内完成者给予剔除。1.5 统计学方法 采用SPSS 18.0软件,计量资料以x±s表示。组间曲线指标的比较采用单因素方差分析,两两比较采用LSD法,P<0.05表示差异有统计学意义。
2 结果
2.1 Gd-EOB-DTPA动态增强评估肝功能 肝硬化组C-P分级:A级75例,B级56例,C级28例。其动态增强率变化曲线如图1。各组肝右后叶信号强度变化率在动脉期均仅表现为轻微增强,组间差异均无统计学意义(P>0.05)。对照组在门静脉期达到首过灌注增强峰值,随后在平衡期较迅速下降后又较迅速开始增加,定义为N型曲线。C-P A级组表现为门静脉期后增强率即逐渐增加,定义为A型曲线。C-P B级组表现为门静脉期后增强率即逐渐下降,至5 min开始逐渐增加,定义为B型曲线。C-P C级组表现为到平衡期为止,增强率方逐渐下降,至13 min左右才开始逐渐增加,定义为C型曲线。
2.2 Gd-EOB-DTPA动态增强评估肝功能统计结果各组AP-CER、PVP-CER、TTV、V-CER、15'-CER以及RS组间比较,见表1。
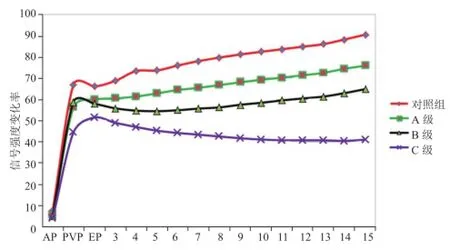
图1 不同分级肝功能患者Gd-EOB-DTPA动态增强信号强度变化率曲线。AP:动脉期;PVP:门静脉期;EP:平衡期

表1 不同肝功能组间TIC曲线参数比较
3 讨论
Gd-EOB-DTPA因具有亲脂性的基团乙氧基苯甲基,故可通过肝细胞膜上的有机阴离子转运多肽1(organic anion transporting polypeptide,OATP1)从细胞外间隙转运至肝细胞内,然后经胆小管多特异性有机阴离子转运体或多药抵抗相关蛋白2排泄至胆小管内[15]。此排泄过程中化学结构不发生改变,且一般通过胆系代谢的造影剂量为注射总量的50%,肝功能异常者对Gd-EOB-DTPA的摄取减低。由于Gd-EOB-DTPA具有缩短T1和T2*值的效应,故其增强前后肝实质的强化程度或测量肝实质增强前后的T1和T2*值可定量评价肝实质对Gd-EOB-DTPA的摄取,由此可以无创地评估患者肝功能[7-9]。这在反映肝脏排泌功能、术前肝功能储备等方面均有重要意义,并且可以更早地获得肝细胞特异期图像[16-19]。同类研究已开展较多,如Ryeom等[20]利用Gd-EOB-DTPA动态增强时间-信号曲线,发现新西兰白兔肝实质的肝脏摄取分数与靛氰绿15 min潴留率的改变有良好相关性。使用Gd-EOBDTPA增强对比原发性胆汁性肝硬化患者和健康志愿者肝段功能的肝脏摄取分数时也发现,原发性胆汁性肝硬化患者的肝脏摄取分数明显低于正常对照,且随C-P评分的升高,两者的差异增大[21]。
本研究发现,在注射Gd-EOB-DTPA后,肝脏MRI信号强度变化率在不同肝功能C-P分级的表现差异明显。对照组门静脉期表现为明显的信号强度增加,此为首过灌注导致。达到平衡期的过程出现短暂的信号下降,之后开始信号强度呈线性增加,表现为N型曲线。提示肝细胞在平衡期就开始大量摄取Gd-EOB-DTPA,肝细胞膜上的OATP1功能正常。肝硬化组C-P A级曲线与对照组存在差异,主要体现为平衡期信号强度高于门静脉期,未表现出如正常肝功能组相似的首过灌注后的信号强度下降。其原因可能是肝硬化肝组织纤维化,造成肝内供血血管减少或闭塞,肝窦不同程度狭窄,肝窦内皮细胞床孔减少等,进而导致血管阻力增高,门静脉期进入肝实质的对比剂量减少且速度减慢。门静脉灌注随肝纤维化程度的增加而减少,故肝硬化组的肝脏首过灌注峰值将随分级的增加而出现延缓,此现象在C级体现尤其明显,推测如果在门静脉期和平衡期增加图像采集次数可能获得更精确的数据支持[22]。另一方面,A级肝功能的肝细胞摄取Gd-EOB-DTPA分子功能可能受肝纤维化影响较小,在平衡期后即已经开始大量摄取Gd-EOB-DTPA,综合结果为平衡期以后信号强度持续增加,推测这可能是A级肝功能曲线表现为逐渐增强的原因;而B级肝功能的增强曲线表现为首过灌注后缓慢下降,肝细胞摄取造影剂的速度直至5 min左右才高于廓清速度,信号强度才呈现逐渐上升的态势,提示B级患者OATP1转运速度可能减慢,推测原因为肝硬化影响肝细胞通过转运蛋白谷胱甘肽-S-转移酶对Gd-EOB-DTPA分子的摄取和排泄,同时影响重吸收过程中OATP1等多个转运体的表达和活性[23-24];而C级肝功能患者,曲线需在12 min才表现为上升,提示肝细胞功能的损害要明显高于对照组、A级及B级肝功能患者。此外,RS的提示意义也进一步证实此观点。随着肝功能损害的加重,斜率将会减低。在C级患者中,有10例患者在15 min时信号增强率最低,并可能在15 min之后持续降低,这需要通过延长扫描时间来进一步验证。但同时也说明,对于肝硬化患者,C-P分级过于粗略,有进一步改进分级方法的必要。
本研究也发现,肝脏右后叶、右前叶、左叶,曲线类型相似,但增强率则表现出一定差异,右后叶、右前叶、左叶增强率依次要减少10%,这可能与后叶更接近脊柱线圈,信号强度更强有关系,也可能存在肝血坠积现象。因此,信号强度变化率指标的价值低于波谷时间和曲线类型,同时信号强度变化率的参考范围设立需要定位至每一个肝段为宜,故需要更大样本量的试验。
利用肝脏特异性造影剂增强方式研究肝脏功能可实现对每一肝段的准确评估,国内已经有相关研究,虽然具体的研究方法不一致,但具有其可行性[25-26]。动态增强MRI评价肝功能从试验方法上进行改进,较C-P分级和ICG清除试验可能具有更好的应用前景。
本研究通过观察时间信号强度变化率曲线变化情况了解不同患者肝脏功能储备差异。研究尚存一些不足:肝细胞对Gd-EOB-DTPA特异性摄取造成的强化与血流动力学引起的强化存在重叠,因此可考虑通过缩短单次扫描时间,并对血流动力学引起的强化做进一步的细分,借以提高研究质量;另外,与临床化验指标相结合,建立一组综合影响肝脏功能因素的回归方程可能更有利于准确评估肝脏功能。
[1] Rohrer M, Bauer H, Mintorovitch J, et al. Comparison of magnetic properties of MRI contrast media solutions at different magnetic field strengths. Invest Radiol, 2005, 40(11): 715-724.
[2] Palmucci S. Focal liver lesions detection and characterization: The advantages of gadoxetic acid-enhanced liver MRI. World J Hepatol, 2014, 6(7): 477-485.
[3] Ahn SS, Kim MJ, Lim JS, et al. Added value of gadoxetic acidenhanced hepatobiliary phase MR imaging in the diagnosis of hepatocellular carcinoma. Radiology, 2010, 255(2): 459-466.
[4] Chou CT, Chen YL, Su WW, et al. Characterization of cirrhotic nodules with gadoxetic acid-enhanced magnetic resonance imaging: the efficacy of hepatocyte-phase imaging. J Magn Reson Imaging, 2010, 32(4): 895-902.
[5] Golfieri R, Renzulli M, Lucidi V, et al. Contribution of the hepatobiliary phase of Gd-EOB-DTPA-enhanced MRI to Dynamic MRI in the detection of hypovascular small (≤ 2 cm) HCC in cirrhosis. Eur Radiol, 2011, 21(6): 1233-1242.
[6] Asayama Y, Tajima T, Nishie A, et al. Uptake of Gd-EOBDTPA by hepatocellular carcinoma: radiologic-pathologic correlation with special reference to bile production. Eur J Radiol, 2011, 80(3): e243-e248.
[7] Tajima T, Takao H, Akai H, et al. Relationship between liver function and liver signal intensity in hepatobiliary phase of gadolinium ethoxybenzyl diethylenetriamine pentaacetic acidenhanced magnetic resonance imaging. J Comput Assist Tomogr, 2010, 34(3): 362-366.
[8] Katsube T, Okada M, Kumano S, et al. Estimation of liver function using T1 mapping on Gd-EOB-DTPA-enhanced magnetic resonance imaging. Invest Radiol, 2011, 46(4): 277-283.
[9] Katsube T, Okada M, Kumano S, et al. Estimation of liver function using T2* mapping on Gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid enhanced magnetic resonance imaging. Eur J Radiol, 2012, 81(7): 1460-1464.
[10] Motosugi U, Ichikawa T, Sou H, et al. Liver parenchymal enhancement of hepatocyte-phase images in Gd-EOB-DTPA-enhanced MR imaging: which biological markers of the liver function affect the enhancement?. J Magn Reson Imaging, 2009, 30(5): 1042-1046.
[11] Tschirch FT, Struwe A, Petrowsky H, et al. Contrast-enhanced MR cholangiography with Gd-EOB-DTPA in patients with liver cirrhosis: visualization of the biliary ducts in comparison with patients with normal liver parenchyma. Eur Radiol, 2008, 18(8): 1577-1586.
[12] Vardar R, Vardar E, Demiri S, et al. Is there any non-invasive marker replace the needle liver biopsy predictive for liver fibrosis, in patients with chronic hepatitis?. Hepatogastroenterology, 2009, 56(94-95): 1459-1465.
[13] Rossi E, Adams LA, Bulsara M, et al. Assessing liver fibrosis with serum marker models. Clin Biochem Rev, 2007, 28(1): 3-10.
[14] Zech CJ, Vos B, Nordell A, et al. Vascular enhancement in early dynamic liver MR imaging in an animal model: comparison of two injection regimen and two different doses Gd-EOB-DTPA (gadoxetic acid) with standard Gd-DTPA. Invest Radiol, 2009, 44(6): 305-310.
[15] Kudo M. Will Gd-EOB-MRI change the diagnostic algorithm in hepatocellular carcinoma?. Oncology, 2010, 78(1): 87-93.
[16] Ratcliffe GE, Kirkpatrick ID, Anik Sahni V, et al. Detection and localization of bile duct leaks after cholecystectomy usingGd-EOB-DTPA-enhanced MR cholangiography: retrospective study of 16 patients. J Comput Assist Tomogr, 2014, 38(4): 518-525.
[17] Alegre Castellanos A, Molina Granados JF, Escribano Fernandez J, et al. Early phase detection of bile leak after hepatobiliary surgery: value of Gd-EOB-DTPA-enhanced MR cholangiography. Abdom Imaging, 2012, 37(5): 795-802.
[18]Pilleul F, Billaud Y, Gautier G, et al. Mangafodipir-enhanced magnetic resonance cholangiography for the diagnosis of bile duct leaks. Gastrointest Endosc, 2004, 59(7): 818-822.
[19] Lee MS, Lee JY, Kim SH, et al. Gadoxetic acid disodiumenhanced magnetic resonance imaging for biliary and vascular evaluations in preoperative living liver donors: comparison with gadobenate dimeglumine-enhanced MRI. J Magn Reson Imaging, 2011, 33(1): 149-159.
[20] Ryeom HK, Kim SH, Kim JY, et al. Quantitative evaluation of liver function with MRI using Gd-EOB-DTPA. Korean J Radiol, 2004, 5(4): 231-239.
[21] Nilsson H, Blomqvist L, Douglas L, et al. Assessment of liver function in primary biliary cirrhosis using Gd-EOB-DTPA-enhanced liver MRI. HPB (Oxford), 2010, 12(8): 567-576.
[22] Hagiwara M, Rusinek H, Lee VS, et al. Advanced liver fibrosis: diagnosis with 3D whole-liver perfusion MR imaging--initial experience. Radiology, 2008, 246(3): 926-934.
[23] Lee NK, Kim S, Lee JW, et al. Biliary MR imaging with Gd-EOB-DTPA and its clinical applications. Radiographics, 2009, 29(6): 1707-1724.
[24] Goodwin MD, Dobson JE, Sirlin CB, et al. Diagnostic challenges and pitfalls in MR imaging with hepatocyte-specific contrast agents. Radiographics, 2011, 31(6): 1547-1568.
[25] 兰莲君, 邱琳, 舒健. 肝细胞特异性MRI对比剂钆塞酸二钠评估肝脏储备功能的研究进展. 中国医学影像学杂志, 2015, 23(8): 632-634.
[26] 罗宴吉, 蔡华崧, 汤地, 等. 肝细胞特异性MR对比剂在肝脏功能评价中的初步研究. 中华消化病与影像杂志(电子版), 2013, 3(5): 23-26.
(本文编辑 闻 浩)
Application of Gd-EOB-DTPA Dynamic Contrast Enhanced MRI in Assessing Liver Function
Department of Radiology, Lanzhou Military General Hospital, Lanzhou 730050, China
Address Correspondence to:YE Jianjun
E-mail: 397850147@qq.com
PurposeTo investigate the time signal-intensity cure (TIC) using Gd-EOBDTPA dynamic enhancement in hepatitis B patients with different liver function and to explore thefeasibilityof evaluating liver function with hepatocyte-specific contrast agents.Materials and Methods159 hepatitis B patients with complete clinical data including 84 malesand 75 femalesaged (47.8±9.8) years and 36 cases with normal liver function as control group underwent Gd-EOB-DTPA dynamic contrast enhanced MRI of the liver. 17 phases of axial images at 1 minute/phase were obtained including no-contrast scan, arterial phase, venous phase and equilibrium phase. Area of interest was sampled in the right posterior lobe to create TIC and its main features were analyzed according to the different liver function classification of Child-Pugh score, and compared to normal control. The difference and relationship among four groups (normal control and Child-Pugh A, B, C) were determined.ResultsThe TIC was divided into N, A, B and C types. The contrast enhancement ratio of portal venous phase (PVP-CER), contrast enhancement ratio of valley (V-CER), contrast enhancement ratio of fifteen minutes (15'-CER) and reabsorption slope (RS) decreased with the increase of Child-Pugh grades, and time to valley (TTV) increased. TTV and RS were statistical different in each group (P<0.05).ConclusionThe TICs are different among hepatitis B patients with different liver function grading. TTV and RS may be used as animportant indicator of liver function.
Liver cirrhosis; Hepatitis B; Magnetic resonance imaging; Image enhancement; Gd-EOB-DTPA
10.3969/j.issn.1005-5185.2016.11.006
叶建军
2016-04-05
2016-05-30
R575.2;R445.2

