我院17种中药注射剂说明书内容变更调查分析
唐樑+黄玉宇+唐秋月
[摘要] 目的 分析苏州市中医医院(以下简称“我院”)常用中药注射剂说明书变更信息,为医师和药师提供参考,促进中药注射剂的安全合理使用。 方法 收集我院常用17种中药注射剂新旧两个版本的说明书,对其主要内容进行分类对比,掌握其修订情况,分析其变更依据并对变更效果做出评价。 结果 17种中药注射剂中有15种说明书的主要内容发生变更,涉及多项重要信息,其中不良反应、禁忌、注意事项等与临床用药安全密切相关的内容项增订幅度较大。 结论 药学人员应关注中药注射剂说明书变更信息,掌握其最新说明书内容有利于开展临床药学服务。
[关键词] 中药注射剂;药品说明书;超说明书用法;药学服务
[中图分类号] R288;R954 [文献标识码] A [文章编号] 1673-7210(2016)10(c)-0071-04
[Abstract] Objective To analyze the content changes of package inserts for commonly used TCM injections in Suzhou Hospital of Traditional Chinese Medicine (“our hospital” for short), to provide reference for physicians and pharmacists, and to promote the rational use of TCM injections safely. Methods New and old versions of package inserts of 17 kinds of TCM injections in our hospital were collected, of which, the main contents were classified and compared, the revisions were grasped. Then the basis of revisions was analyzed and the effect of the content changes was evaluated. Results The main contents of 15 kinds of package inserts in 17 kinds of TCM injections were changed, involved multiple important information; several sections related closely with clinical drug safety such as adverse reactions, contraindications and precautions were revised obviously. Conclusion Pharmacists should concern the information changes of package inserts of TCM injections. It is beneficial to carry out clinical pharmacy practice to grasp the latest contents of package inserts.
[Key words] TCM injection; Package insert; Off-label drug use; Pharmaceutical care
药品说明书是具有法律地位的文件,不仅载明药品的重要信息,而且还与医疗质量密切相关[1]。近年来,中药注射剂说明书的修订周期有所缩短,新版说明书在诸多项目尤其是安全性方面增补了资料。临床医师和药师如对这些新资料缺乏了解,可能忽视有关安全性的重要信息,易造成用药不合理现象。本文通过对收集的中药注射剂说明书的新旧版本内容的对比分析,为医师开具医嘱、药师审核医嘱提供参考,同时为进一步完善中药注射剂说明书提出建议。
1 资料与方法
1.1 资料来源
收集苏州市中医医院(以下简称“我院”)临床常用的中药注射剂说明书17种,以2010年为界,每个品种收集前后2份(后者以最新版本为准),共34份。新旧版本平均时间跨度5.6年。
1.2 方法
参照原国家食品药品监督管理局2006年颁布的中药、天然药物处方药说明书内容书写要求[2]和中药、天然药物处方药说明书撰写指导原则[3](以下简称指导原则),对所收集中药注射剂说明书的主要内容如警示语、辅料、功能主治、滴速、溶媒、疗程、不良反应、禁忌、注意事项、药物相互作用、药理毒理等进行分类对比和分析。
2 结果
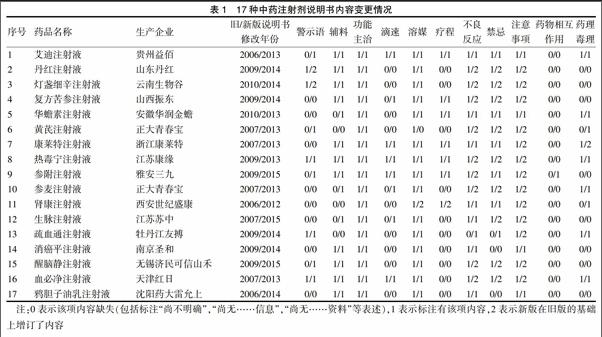
调查的17种中药注射剂,除消癌平、鸦胆子油乳外,其余15种说明书的主要内容都有所增订,见表1。
2.1 警示语
警示语增订6种,修订率为35.3%,其中4种为新增。目前标注率为52.9%。警示语的内容,以本品可能发生过敏性休克等严重不良反应的警示为主,提示应在有抢救条件的医疗机构使用(4种);另有关于本品含某种毒性中药饮片的警示(2种,分别为艾迪注射液含斑蝥、参附注射液含附片)。
中药注射剂说明书的警示信息应当充分、显著[4]。以上增订的警示语具有强制性。如醒脑静注射液增加的警示语,系2015年3月国家食药监总局发布《关于修订醒脑静注射液说明书的通知》,要求企业增加相关警示语。2013年11月,国家食药监总局发出《关于修订含毒性中药饮片中成药品种说明书的通知》,规定凡含有28种毒性中药(包括其炮制品)的中成药品种的说明书必须增加“本品含××”的警示语。警示语标注在说明书首页的醒目位置,黑体印刷,对使用者产生良好的警示效果。
2.2 辅料
辅料增订3种,修订率为17.6%,均为新增。目前标注率为82.4%。根据《指导原则》,中药注射剂应列出所用的全部辅料名称。据此,即使除主要药效成分外只含注射用水或氯化钠的,也应该列出注射用水或氯化钠的名称,但上述最新版本的说明书仍有3种未列出任何辅料。
2.3 功能主治
功能主治项均未见变更。目前标注率为100%。
2.4 滴速
滴速增订3种,修订率为17.6%,均为新增。目前标注率为47.1%(包括7种标明“××滴/分”的,以及1种标注“在××分钟内滴毕”的)。静脉输液速度控制不当,可能影响治疗效果,甚至产生不良反应[5-6]。考虑到中药注射剂成分复杂,滴速与不良反应存在相关性[7],说明书宜根据患者年龄、病情程度不同注明合适的滴速。
2.5 溶媒
溶媒修订2种,修订率为11.8%。目前标注率为94.1%。其中,黄芪注射液旧版说明书原标注“宜用5%~10%葡萄糖注射液稀释”,新版说明书删除了此段内容,未标注使用何种溶媒。肾康注射液新版说明书则在“注意事项”下增加了除按“用法用量”使用外的其他溶媒的配置方法,以便特殊患者(高血糖等)使用。不同溶媒对中药注射剂稳定性可能产生影响,建议严格按照说明书选择溶媒[8-9]。
2.6 疗程
疗程增订1种,修订率为5.9%。目前标注率为41.2%。增订内容的肾康注射液,旧版说明书已标注了疗程(4周),新版说明书在“注意事项”下增加了对长期使用患者的特别要求(在每疗程间应间隔15~30 d),进一步完善了内容。中药注射剂超说明书疗程使用现象较为常见,应引起重视[10]。
2.7 不良反应
不良反应增订10种,修订率为58.8%。目前标注率为100%。不良反应是药品说明书的重要内容,提示医师在用药前注意,在用药后如出现不良反应时也可根据说明书提示做出正确判断,及时处理[11]。不良反应项的内容缺失,长期以来是中药注射剂说明书质量缺陷的主要原因之一,也成为中药注射剂安全性“不可靠”的标志,常为学术论文及媒体舆论所诟病[12]。国家食品药品监督管理(总)局药品评价中心自2001年11月起发布《药品不良反应信息通报》70期(截至2016年4月),涉及中药注射剂不良反应的就有14期,涉及品种16个,某些品种先后2次被通报。食药监总局要求修订某中药注射剂品种的说明书,很大程度上也是基于其不良反应的监测数据,而不良反应项正是修订的重点内容。上述修订该项的10个品种中有9个是在旧版基础上增订的,增订力度普遍较大,其格式及内容描述均有显著变化。如丹参、黄芪、灯盏细辛、醒脑静、血必净注射液等的旧版说明书标注“偶有见不良反应”或“(极)个别患者出现……不良反应”的,在新版说明书中均撤销了此类表述,而换以数字排序的格式,详细列出各系统发生的(或各主要类型所包括的)各种不良反应症状。热毒宁、参附注射液等则在旧版说明书的基础上,增加了关于过敏性休克的标注。疏血通注射液旧版说明书不良反应标注“尚不明确”,新版说明书则增加了多种不良反应及症状的描述。参附注射液新版说明书还增加了不良反应/事件发生率的研究内容。
2.8 禁忌
禁忌增订10种,修订率为58.8%。目前标注率为88.2%。禁忌项列出该药品不能应用的各种情况,例如禁止应用该药品的人群、疾病等情况,是应当严格遵守的重要项。该项的修改呈现两个特征,一是内容具体化。以修改后的灯盏细辛注射液说明书为例,详细列出了10个禁忌项,包括对灯盏细辛相关制剂或药品(灯盏花素、野黄芩苷、咖啡酸酯)过敏或有严重不良反应病史者禁用,对脑出血等几种患者禁用,对特殊人群(月经期、新生儿、婴幼儿、孕妇)禁用等,较修改前有大幅度的增订。又如黄芪注射液,旧版说明书禁忌项仅标注“对本类药物有过敏史患者禁用”,修改后的禁忌项则具体标出了3类禁用对象,包括对本品或含有黄芪制剂有过敏或严重不良反应病史者,孕妇及婴儿,有“热象”者(详列中医诸证)等。二是规范化。如丹红注射液说明书将“孕妇及哺乳期妇女忌用”改为“孕妇及哺乳期妇女禁用”;热毒宁注射液说明书将“有药物过敏史者慎用”删去,改在注意事项上标注该信息。
2.9 注意事项
注意事项增订13种,修订率为76.5%。目前标注率为100%。该项列出使用时必须注意的问题,包括需要慎用的情况,影响药物疗效的因素,用药过程中需观察的情况等。在调查的所有项目中,该项的修订率最高,修改幅度也最大,如丹红注射液原注意事项6项调整为8项,灯盏细辛注射液4项调整为10项,热毒宁注射液6项调整为9项,生脉注射液2项调整为7项,血必净注射液4项调整为7项。从内容来看,新版说明书呈现以下几个特点:一是重点提示该药可能引发的严重不良反应及其必要的防治措施(4/13)。二是对功能主治和用法用量作补充说明,突出“两个严格”(7/13)。三是强调配伍和联合用药的问题,明确标明应单独使用,禁忌与其他药物混合配伍使用(13/13)。四是提示加强用药监护(13/13)。五是对药品出厂后至使用前可能发生的质量变化作了必要的说明(13/13),提示保存不当可能影响产品质量。六是对配制方法等作了具体说明(10/13),通常要求在洁净环境配制,所配药液即配即用。除以上几类之外,该项的增订内容还涉及对临床辨证、疗程、联用药品(如“十八反”“十九畏”禁忌)等方面的补充说明。
2.10 药物相互作用
药物相互作用增订1种,修订率为5.9%。目前标注率为5.9%,仅参附注射液的新版说明书标注了该项,其余品种说明书均表述为“尚无本品与其他药物相互作用的信息”。参附注射液该项列出了应避免与辅酶A、维生素K3、氨茶碱等6种化学药品及丹参注射液1种中药注射剂混合配伍使用,另外列出了与其所含成分(红参、附片)存在“十八反”配伍禁忌的半夏、藜芦等中药,提示如同时使用应咨询医师。这是我院首次发现某中药注射剂说明书在药物相互作用项下列出具体内容。
2.11 药理毒理
药理毒理增订3种,修订率为17.6%,其中黄芪注射液该项为新增。目前标注率为52.9%。已列出该项的9个品种说明书,均包含药理研究内容,其中5种也包含毒理研究内容。中药注射剂属于高风险药品,药理毒理试验是申请药品注册时必要的研究项[13],此项内容应尽快覆盖所有品种,特别是含有毒性中药成分的品种(参附注射液说明书暂缺该项)。
3 讨论
通过对以上品种中药注射剂新旧版本说明书的对比分析,可知近几年来多数产品的说明书内容作了不同程度的修订(15/17)。与临床用药安全密切相关的说明书内容项,如不良反应、禁忌、注意事项等,修订率超过了50%,其中许多内容增订幅度较大。提示中药注射剂的使用单位必须及时关注药品说明书的内容变更,以利于医师正确开具医嘱,药师准确审核医嘱。
“药品说明书之外的用法”也叫药品未注册用法、超说明书用法,是国内外临床用药中普遍存在的问题[14-15]。根据《赫尔辛基宣言》,“当无现存有效的预防、诊断和治疗方法治疗患者时,若医师觉得有挽救生命、重新恢复健康或减轻痛苦的希望,那么在取得患者知情的情况下,医师应当不受限制地使用尚未证实的或是新的预防、诊断和治疗措施”[16]。然而,超说明书用法应当是根据合理的科学理论、专家或临床对照试验获得的,是为了患者的利益而非其他。无依据的超说明书用药比说明书内用法存在更大的风险,应视为不合理用药。中药注射剂由于成分复杂,用法需按中医辨证等特殊性,加上临床资料不足,使用风险较大,因此在临床工作中更应规范其用法用量,严格限制超说明书用法[17-19]。
中药注射剂说明书的质量曾长期被指缺陷多,存在许多问题[20-21]。本文调查结果显示,近年来中药注射剂说明书的修订频度和力度均非常显著,故应以发展的眼光看待问题,应承认中药注射剂的研制水平在提高,随着安全性研究和再评价工作的开展,相关资料不断完善。然而药品说明书的修订是持续改进的过程。目前中药注射剂说明书总体质量与化学药品注射剂说明书相比仍有不小差距[22],特别是药物相互作用、药理毒理等方面资料不足,对临床用药的指导作用有限,相关专业人员仍应密切关注这些资料的变更发展。对于药师而言,做好药品不良反应监测,加深对中药注射剂的临床药学研究,也有利于企业改进药品质量,完善说明书内容。
[参考文献]
[1] 王静.37份中药注射剂说明书的合理性调查分析[J].光明中医,2015,30(1):186.
[2] 国家食品药品监督管理总局.关于关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知(国食药监注[2006]283号)[EB/OL]. [2006-06-22] http://www.sda.gov.cn/WS01/CL0172/10573_2.html
[3] 国家食品药品监督管理总局.关于关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知(国食药监注[2006]283号)[EB/OL]. [2006-06-22] http://www.sda.gov.cn/WS01/CL0172/10573_3.html
[4] 张建平.中药注射剂说明书中的警示缺陷[J].中国医院药学杂志,2014,34(8):665-666.
[5] 冯强,黄惠红,朱婷婷.中药注射剂溶媒类型、滴速与中药注射剂不良反应相关性分析[J].河南中医,2015,35(12):3200-3202.
[6] 葛艳.我院中药注射剂合理应用分析[J].中医药导报,2014,20(3):67-69.
[7] 刘平平.中药注射剂溶媒选择和滴速与不良反应的相关性[J].北方药学,2014,1(12):125.
[8] 郑雪.中药注射剂溶媒选择的统计分析[J].中国药事,2014,28(7):795-798.
[9] 杜娆,袁红,虞勋.热毒宁、痰热清、喜炎平注射剂临床使用稳定性[J].中国医院药学杂志,2016,36(13):1095-1099.
[10] 孙永旭,高翠华,唐启令,等.我院热毒宁注射液临床应用分析[J].中国药房,2015,26(20):2742-2744.
[11] 曾聪彦,梅全喜.中药注射剂安全应用案例分析[M].北京:人民卫生出版社,2015:45.
[12] 何远.14种中药注射剂说明书的结构完整性和用药安全性分析[J].临床合理用药,2012,5(3A):147-148.
[13] 吴晋.从药品注册核查看药理毒理试验管理存在的问题[J].海峡药学,2015,27(10):291.
[14] 洪蕾,朱小宾.药品未注册用法的现状、危害、原因及应对措施[J].基层医学论坛,2015,19(2):251.
[15] 张波,赵彬,张钰宣,等.我院“药品说明书之外的用法”现状调查和探讨[J].实用药物与临床,2014,17(5):661-665.
[16] 张波,郑志华,李大魁.超药品说明书用药参考[M].北京:人民卫生出版社,2013:5-6.
[17] 张弦,汪琳,徐文科.中药注射剂说明书存在的问题分析与建议[J].中国执业药师,2014,11(12):25.
[18] 沈闻文.我院29种常用中药注射剂说明书调查分析[J].中国现代药物应用,2014,8(17):253-254.
[19] 张盛敏,杨冬梅,黄娟,等.中医院中药注射剂超说明书用药调查与合理性分析[J].中国药业,2015,24(6):7-9.
[20] 陈新苗,杨妙清,林鹏锋,等.24种中药注射剂药品说明书调查与分析[J].中国药业,2014,23(20):14-15.
[21] 张妙英,林琴,陈宇.中成药注射剂说明书现状分析[J].海峡药学,2014,26(11):228.
[22] 蔡华,杜士明.从84份中药注射剂说明书看药品执行标准情况[J].医药导报,2014,33(1):125-127.
(收稿日期:2016-07-18 本文编辑:张瑜杰)

