‘丰水’梨二次开花过程中枝芽多胺含量的变化
张全军,钟必凤,李文贵,邓家林,张绍铃,唐秋萍
(1.四川省农业科学院园艺研究所/农业部西南地区园艺作物生物学及种质创制重点实验室,四川 成都 610066;2.南京农业大学梨工程技术研究中心,江苏 南京 210095;3金川县农业畜牧水务局,四川 金川 624100)
‘丰水’梨二次开花过程中枝芽多胺含量的变化
张全军1,钟必凤1,李文贵1,邓家林1,张绍铃2,唐秋萍3
(1.四川省农业科学院园艺研究所/农业部西南地区园艺作物生物学及种质创制重点实验室,四川 成都 610066;2.南京农业大学梨工程技术研究中心,江苏 南京 210095;3金川县农业畜牧水务局,四川 金川 624100)
分析了‘丰水’梨去叶后二次开花过程中3种内源多胺的动态变化,结果表明,无论是在枝皮还是花芽,3种内源多胺在去叶后第6天迅猛上升,而后呈下降趋势;但枝皮中内源多胺直线下降,而花芽中内源多胺含量平缓降低,说明去叶对枝皮内源多胺的含量影响较大。‘丰水’梨花芽萌芽率与亚精胺含量呈极显著的正相关关系,与腐胺和精胺含量呈显著的正相关关系。
二次开花;多胺;枝皮;花芽
影响南方砂梨秋季开花的因素很多[1-3],如秋季高温、早期落叶、干旱胁迫等。钟必凤等分析了秋季二次开花与内源激素的关系[4];研究表明,多胺与与RNA、DNA、蛋白质合成关系密切[5],多胺的浓度及其生物合成速度的升高一般总是先于或与DNA、蛋白质的增同时发生,多胺被认为是类似于“cAMP”那样的第二信使,调节植物的生长发育[6]。 周敏敏[7]对梨树叶芽和花芽的内源多胺进行了研究,结果显示:梨树的叶芽在生长期,多胺的含量较高,进入休眠期后,多胺含量急剧下降,处于旺盛分化期的幼胚,其内源多胺含量较高;当幼胚分化基本完成时,多胺含量迅速下降,说明内源多胺对梨叶芽的发育起着重要调节作用。 S.Y.Wang等[8]研究早花樱桃与晚花樱桃休眠及萌发过程中代谢产物变化规律时发现,早花樱桃游离态内源多胺腐胺、亚精胺、精胺从较低水平开始缓慢升高,晚花樱桃游离态内源多胺腐胺、亚精胺、精胺则一直保持在较高水平变化不大,临近萌芽两种材料游离态内源多胺均快速升高。本试验以二次花发生严重的代表品种‘丰水’梨为试验材料,拟揭示二次开花过程中内源多胺变化与花芽萌芽率之间的关系。
1 材料与方法
1.1 材料和试验地
本试验于2012年在南京农业大学江浦农场进行,试验品种为8年生‘丰水’梨,试验树生长结果正常,长势和立地条件基本一致。
1.2 方法
1.2.1 试验处理 在‘丰水’梨花芽分化完成后,即‘丰水’梨采果后8月20日,以全树人工脱叶100 %为处理,不脱叶为对照,5株小区,4次重复。每6 d取1次发育饱满的花芽,去除鳞片测试分析,各项指标重复4次。
1.2.2 测定项目及方法 枝条萌芽率,从开始处理后的42 d内每隔6 d统计萌芽率。
多胺的提取和测定方法 参照施木田[9]的方法。冷冻植物材料0.6 g,加入2 mL预冷的5 %的高氯酸(V/V)冰浴研磨,冰浴浸提1.5 h候离心。离心条件为:12 000 r/min,30 min,4 ℃。取500 μl上清液加入到10 mL带盖离心管中,加入7 μl苯甲酰氯,再加入1 mL 2 mol/L NaOH,涡旋20 s后在37 ℃水浴反应20 min。加入2 mL饱和NaCl溶液,混匀后加入2 mL乙醚萃取,1500 r/min离心5 min后,取1 mL醚相热风吹干,用500 μl甲醇涡旋溶解,过0.22 μm有机滤膜后,取10 μl进样。
Waters 600 controller,2487双波长紫外/可见光检测器,Empower software3.2色谱工作软件。腐胺、亚精胺、精胺标样均为Sigma公司产品,分析纯。甲醇为色谱纯,水为超纯水。色谱条件:色谱柱为Novapak C18柱(3.9*300 mm,4 μm);流动相为甲醇∶水=60∶40(V/V),检测波长为230 nm,流速为0.7 mL/min,柱温30 ℃。
1.3 数据处理
试验数据方差分析、相关性分析、显著性检验采用Excel 2003和SPSS16.0统计软件完成。
2 结果与分析
2.1 去叶后‘丰水’梨枝条萌芽率的变化
如图1所示,在试验点南京‘丰水’梨从去叶后第6天开始出现萌芽现象,并在随后2周内萌芽率迅猛增长,出现二次开花现象;从第24天起萌芽率增速减缓,到第42天萌芽率增至91 %,满树呈春天开花现象。相对来讲,未脱叶处理的‘丰水’梨在第12天出现零星萌芽,随着秋季气温的延续,到第42天萌芽率仅12.3 %,虽然其萌芽率动态变化与脱叶处理‘丰水’梨保持相似的趋势,但萌芽率一直保持在相对较低的水平。这可能与未脱叶‘丰水’梨保持正常的营养生长状态,抑制了生殖生长有关。
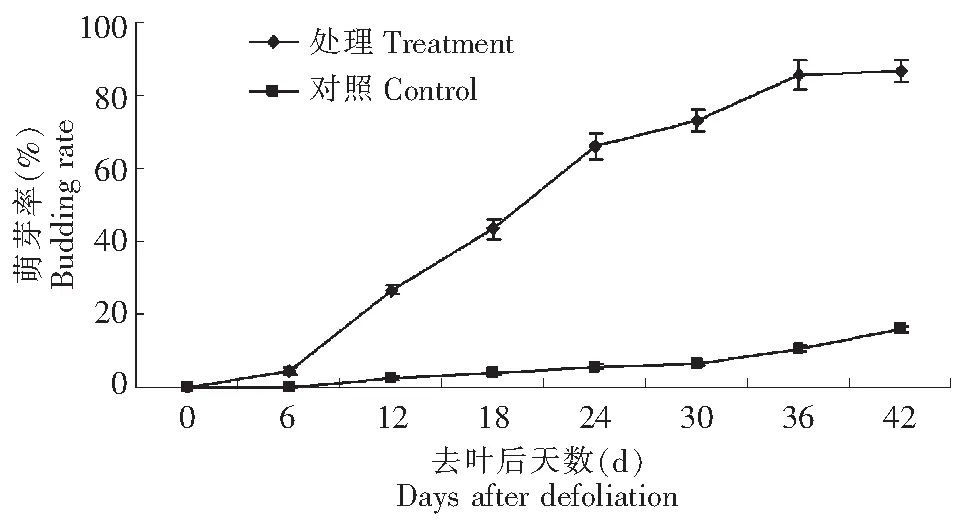
图1 去叶后‘丰水’梨萌芽率动态变化Fig.1 Effect of leaf defoliation treatment on budding rate of ‘Hosui’ compared to controls
2.2 去叶后‘丰水’梨二次开花过程中枝芽腐胺含量变化
由图2A可以看出,‘丰水’梨花芽腐胺含量由去叶处理当天的112 nmol/g·FW猛增至第6天的440 nmol/g·FW,在第12天降至370 nmol/g·FW,随后缓慢递减,但在去叶后的整个萌芽二次开花过程中(0~24 d),一直高于对照;而未处理花芽腐胺含量在第0~18天变化不明显,随着气温的降低,在第18~24天后缓慢递减,最后腐胺含量稳定在70 nmol/g·FW。与在花芽中一样,去叶处理的枝皮腐胺含量高于同期的对照处理;并且在处理枝皮中腐胺含量在第0~6天呈快速递增趋势(图2B),由60 nmol/g·FW增至320 nmol/g·FW;在对照的枝皮中,腐胺含量在0~6 d维持在70 nmol/g·FW,随着9月下旬气温的降低,枝皮腐胺在第12~42天呈递减状态,最后降至45 nmol/g·FW。
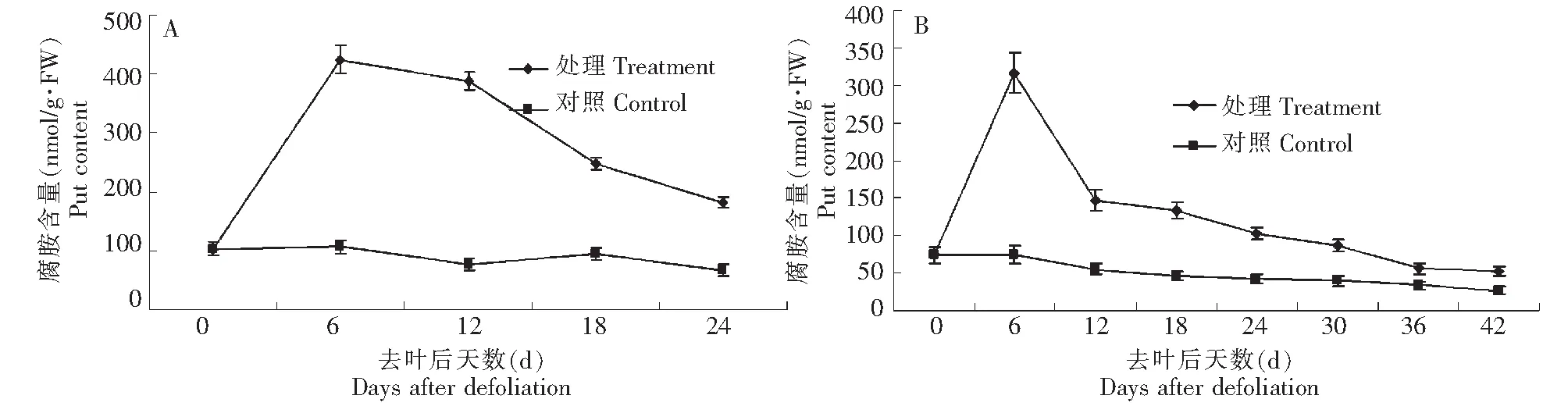
图2 去叶后‘丰水’梨枝芽内腐胺含量变化(A花芽,B枝皮)Fig.2 Changes of Put content in flower buds and shoots of ‘Hosui’ treated by defoliation(A flower bud,B shoot)

图3 去叶后‘丰水’梨枝芽内亚精胺含量变化(A花芽,B枝皮)Fig.3 Changes of Spd content in flower buds and shoots of ‘Hosui’ treated by defoliation(A flower bud,B shoot)
2.3 去叶后‘丰水’梨二次开花过程中枝芽亚精胺含量变化
由图3可见,‘丰水’梨去叶后花芽和枝皮中亚精胺发生了显著变化。图3A所示,‘丰水’梨花芽亚精胺含量由去叶处理当天的510 nmol/g·FW增至第6天的1420 nmol/g·FW,在第12天降至1280 nmol/g·FW,随后呈递减趋势,但在去叶后的整个萌芽二次开花过程中(0~24 d),花芽亚精胺含量一直高于对照;而未处理花芽亚精胺含量在第0~18 天变化不明显,随着气温的降低,亚精胺含量在第24天降至最低320 nmol/g·FW。就整体来讲,枝皮亚精胺含量低于花芽。去叶处理的枝皮亚精胺含量高于同期的对照(图3B);并且在处理亚精胺含量在第0~6天呈快速递增趋势,由420 nmol/g·FW增至1180 nmol/g·FW;在对照的枝皮中,亚精胺含量在0~18 d维持在410~430 nmol/g·FW,随着9月下旬气温的降低,枝皮亚精胺在第18~42天呈递减状态,最后减至310 nmol/g·FW。
2.4 去叶后‘丰水’梨二次开花过程中枝芽精胺含量变化
在去叶后整个二次开花过程中,‘丰水’梨花芽和枝皮中精胺含量发生了显著变化(图4)。图4A所示,‘丰水’梨花芽精胺含量由去叶处理当天的240 nmol/g·FW增至第6天的690 nmol/g·FW,在第18天降至480 nmol/g·FW,随后快速递减至24 d的210 nmol/g·FW;在去叶后的整个萌芽二次开花过程中(0~24 d),花芽中精胺含量一直高于对照;在整个花芽萌动二次开花过程中,未处理花芽精胺呈缓慢降低趋势,在第24天降至最低140 nmol/g·FW。总的来说,枝皮精胺含量低于花芽。去叶处理的枝皮精胺含量高于同期的对照(图4B);并且去叶处理枝皮精胺含量在第0~6天迅猛递增,由80 nmol/g·FW增至420 nmol/g·FW,随后随着萌芽率提高而逐渐降低,但精胺含量始终高于同期的对照;对照枝皮精胺含量在整个过程呈递减状态,由处理当天的85 nmol/g·FW降至第42天的45 nmol/g·FW。
2.5 二次开花过程中混合芽萌芽率和多胺含量的关系
对‘丰水’梨花芽萌芽率与花芽多胺含量进行相关性分析结果(表1)表明,‘丰水’梨花芽萌芽率与亚精胺含量呈极显著的正相关关系(r为0.902**),同时萌芽率与腐胺和精胺含量呈显著的正相关关系(r分别为0.834和0.874**);说明梨花芽中多胺代谢状况是影响砂梨花芽萌动的重要原因。
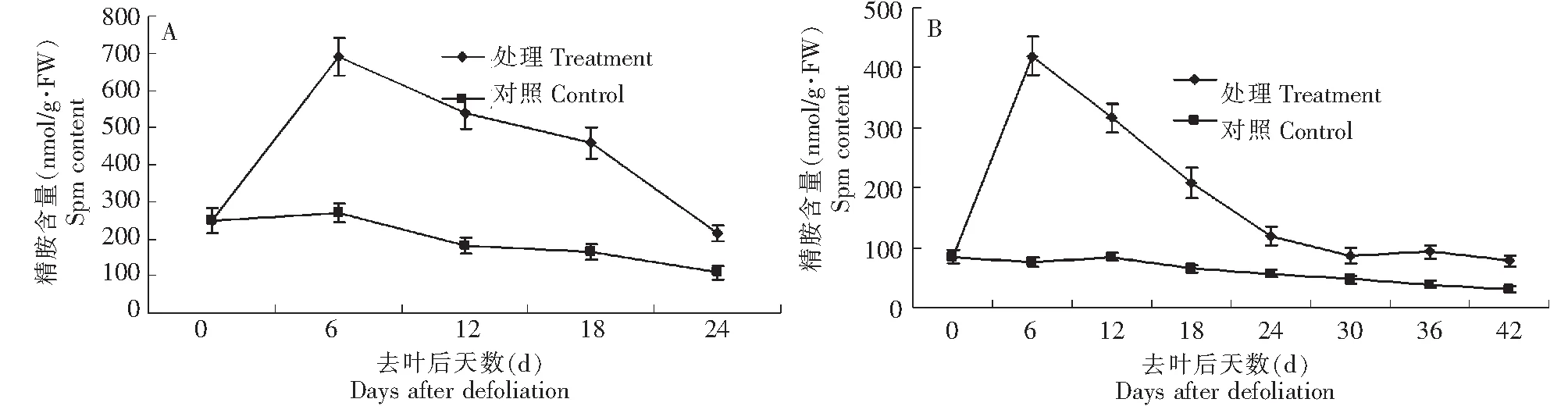
图4 去叶后‘丰水’梨枝芽内精胺含量变化(A花芽,B枝皮)Fig.4 Changes of Spm content in flower buds and shoots of ‘Hosui’ treated by defoliation(A flower bud,B shoot)
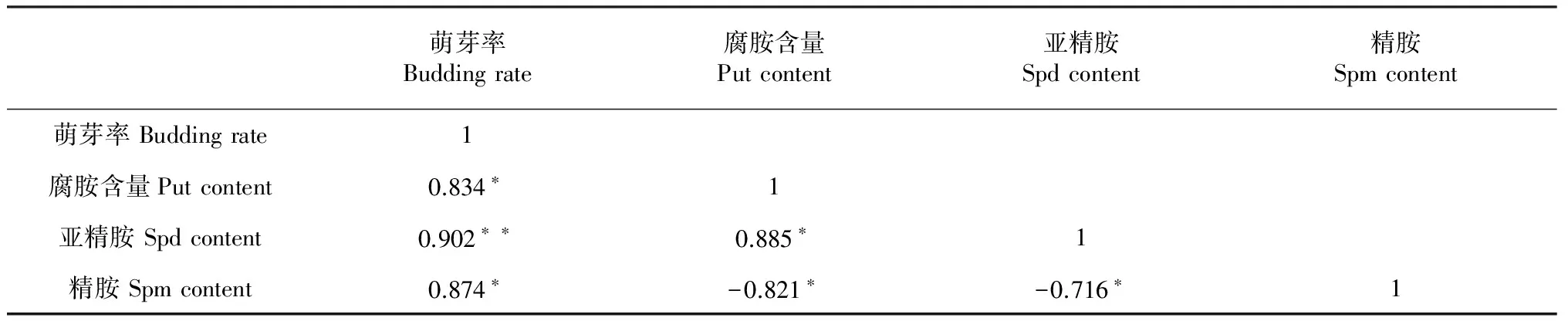
萌芽率Buddingrate腐胺含量Putcontent亚精胺Spdcontent精胺Spmcontent萌芽率Buddingrate1腐胺含量Putcontent0.834∗1亚精胺Spdcontent0.902∗∗0.885∗1精胺Spmcontent0.874∗-0.821∗-0.716∗1
注:*和**分别表示相关性在0.05和0.01水平达到显著水平。
Note: *and ** indicate that the correlation is significant at 0.05 and 0.01 level,respectively.
3 讨 论
对多胺与砂梨花芽萌发的关系,前人研究的较少,本试验测定了去叶后‘丰水’梨二次开花过程中花芽和枝皮梨多胺含量变化,显示3种内源多胺在去叶后第6天迅猛成倍增长。周敏敏[7]认为梨花芽休眠期多胺含量较低,生长旺季含量较高,根系中束缚态和游离态多胺含量均显著低于芽中的束缚态和游离态多胺含量,而且根系中3种内源多胺含量的相对比值与芽中内源多胺含量的相对比值有较大差异,导致根系上述内源多胺含量变化的原因可能是根系一般仅有被迫休眠,而无自然休眠特性,这也进一步说明植物内源多胺变化与生长状态有密切关系。在‘丰水’梨去叶后萌芽二次开花过程中,枝皮和花芽内源多胺均呈现出了显著的变化;还发现,在去叶后‘丰水’梨二次开花过程中,枝皮中内源多胺在去叶第6天后直线下降,而花芽中内源多胺含量平缓降低,说明去叶对枝皮内源多胺的影响较大;虽然还没有确切实验证据表明内源多胺变化是导致植物芽萌动萌发的直接诱因,但本试验反映出在梨萌芽、二次开花过程中内源多胺变化与花芽萌芽率之间存在着密切关系。
[1]付传明,黄宁珍,赵志国,等.南方早熟梨二次开花的成因及防治研究进展[J]. 南方农业学报,2011,42(4):422-425.
[2]黄新忠,陈义挺,雷 龑,等.福建梨早期大量落叶诱因与防控策[J].中国农学通报, 2010,26(2):91-95.
[3]张全军,李文贵,钟必凤,等.南方砂梨二次开花返青发生特性及其与早期落叶的关系[J].西南农业学报,2013,26(3):1160-1164.
[4 ]钟必凤,张全军,李文贵,等.南方砂梨返花过程中内源激素的含量变化及其与返花的关系[J]. 西北植物学报,2014,34(12):2453-2458.
[5]Ravindar KS, Liu MS, Arthur WG. Relation of Polyamine Biosynthesis to the Initiation of Sprouting in Potato Tubers [J]. Plant Physiol, 1982, 69: 411-415.
[6 ]Bagni N, Torrigiani P, Polyamines: a new class of growth substances. Plant Sci Biotechnol Agric Dordrencht: Kluwer Academic Publishers, 1992, 13:264-275.
[7]周敏敏. 梨砧木休眠过程中多胺代谢及相关生理生化指标的研究[D]. 扬州大学,2008.
[8 ]S.Y.Wang,M.Faust, G.L.Steffens.Metabolic changes in cherry flower buds associated with breaking of dormancy in early and late blooming cultivars[J].Physiol Plant,1985,65:89-94.
[9]施木田. HPLC分析植株多胺含量[J].福建分析测试, 1995 (1): 10-13.
(责任编辑 陈 虹)
Variation of Polyamines on Shoot and Flower Bud of ‘Hosui’Pear(PyruspyrifoliaNakai) during Reflorescence Period
ZHANG Quan-jun1,ZHONG Bi-feng1,LI Wen-gui1,DENG Jia-lin1,ZHANG Shao-ling2,TANG Qiu-ping3
(1.Horticultural Research Institute of Sichuan Academy of Agricultural Sciences/Key Laboratory of Horticultural Crops, Biology and Germplasm Enhancement in Southwest Regions, Ministry of Agriculture, Sichuan Chengdu 610066, China; 2.Center of Engineering and Technology Research, Nanjing Agricultural University, Jiangsu Nanjing 210095, China;3. Jinchuan Agricultural and Animal Husbandry Bureau,Sichuan Jinchuan 624100,China )
The Put, Spd and Spm contents in branches and buds of ‘Hosui’ were identified by HPLC analysis during reflorescence. The Put, Spd and Spm contents rose sharply and the content of Spm was the highest at 6 d and then decreased constantly. Three hormones were greatly infected by the defoliation in branches and floral bud. The result of correlation analysis was as follows: the reflorescence and polyamines appeared almost at the same time. The analysis of coefficients showed that the related coefficients for budding rate and three polyamines were 0.834-0.902, reached at the 1 % significant level, and polyamines play a central role in dormancy controlling.
Reflorescence;Polyamines; Shoot; Flower bud
1001-4829(2016)09-2221-04
10.16213/j.cnki.scjas.2016.09.036
2015-10-12
国家梨产业技术体系建设项目(NYCYTX29-37);四川省应用基础研究项目(15JC0096)
张全军(1975-),男,博士,副研究员,山东单县人,从事果树栽培生理与育种工作,E-mail:124317090@qq.com。
S661.2
A

