Prohibitin1基因沉默对人黑色素瘤细胞铺展、迁移及侵袭的影响
毕佳佳
(新乡医学院生命科学技术学院,河南新乡453003)
Prohibitin1基因沉默对人黑色素瘤细胞铺展、迁移及侵袭的影响
毕佳佳
(新乡医学院生命科学技术学院,河南新乡453003)
目的 探讨RNA干扰(RNAi)沉默抗增殖蛋白Prohibitin1(PHB)基因对人恶性黑色素瘤A375细胞铺展、迁移和侵袭的影响。方法 利用RNAi技术,将A375细胞分为对照组和观察组,对照组给予含10%FBS的DMEM培养,观察组加入脂质体Lipofectamine2000和PHB siRNA,均孵育24 h。采用RT-PCR法检测两组细胞中PHB mRNA的表达,Western blot法检测两组细胞中PHB蛋白的表达,铺展实验检测两组细胞在30、60、120 min铺展进程中的铺展情况,划痕实验检测两组细胞的迁移能力,Transwell侵袭实验检测两组细胞的侵袭能力。结果 观察组细胞中PHB mRNA及蛋白相对表达量均低于对照组(P均<0.01)。铺展30、60及120 min时,观察组发生铺展的相对细胞数均均少于对照组(P均<0.01)。划痕后12、24 h,观察组细胞迁移面积均少于对照组(P均<0.01)。观察组细胞的侵袭能力小于对照组细胞(P<0.01)。结论 PHB基因沉默可有效抑制黑色素瘤细胞的铺展、迁移和侵袭进程。
抗增殖蛋白;黑色素瘤;细胞铺展;细胞迁移;侵袭;RNA干扰
恶性黑色素瘤是一种来源于黑色素细胞、具有高致死率的皮肤癌。虽然黑色素瘤的发生率只占所有皮肤癌的5%,但由于转移性强,其造成的病死率却高达80%[1]。目前,对于转移的黑色素瘤还没有有效的治疗手段。抗增殖蛋白Prohibitin 1(PHB)是一类存在于生物细胞多种细胞器上的保守蛋白,具有稳定线粒体结构和功能、调控细胞能量代谢、抗细胞增殖等作用[2]。早期研究认为,PHB基因是一种抑癌基因,在乳腺癌、前列腺癌、肝癌、胃癌等恶性肿瘤的发生发展中发挥抑癌作用[3~6]。但近年研究发现,PHB在宫颈癌、食管癌、卵巢癌、膀胱癌、肺癌等多种肿瘤组织中呈高表达,且与肿瘤进展及转移呈正相关,被认为是一种潜在的肿瘤标志物[7,8]。目前对PHB是抑癌还是促癌基因尚存在争议。肿瘤细胞的铺展、迁移和侵袭能力在一定程度上反映了肿瘤的转移性。2014年5月~2015年5月,我们通过siRNA干扰技术抑制人恶性黑色素瘤A375细胞中PHB基因的表达,观察A375细胞铺展、迁移和侵袭能力的变化,探讨PHB在恶性黑色素瘤转移机制中的作用,为进一步明确PHB在肿瘤发生发展中的作用提供参考。
1 材料与方法
1.1 材料及试剂 人恶性黑色素瘤A375细胞购自中科院上海细胞库。DMEM培养基、Lipofectamine2000及TIRzol试剂均购自Invitrogen公司;Excell胎牛血清购自上海吉泰生物科技有限公司;荧光染料CFSE购自日本株式会社同仁化学研究所;Transwell小室购自美国Corning公司;Matrigel购自美国BD公司;兔抗PHB抗体(sc-28259)购自美国Santa Cruz公司;鼠抗Actin抗体(A5441)购自美团Sigma Aldrich公司;RT-PCR试剂盒购自美国Promega公司;ECL Plus免疫杂交化学反应试剂购自美团Amersham Biosciences公司。
1.2 细胞培养及分组 A375细胞用含有10%FBS的DMEM在37 ℃、5%CO2的培养箱中培养。将A375细胞分为对照组和观察组两组,待细胞融合至50%后,对照组给予含10%FBS的DMEM继续培养,观察组加入脂质体Lipofectamine2000和PHB siRNA,均孵育24 h。
1.3 PHB siRNA转染 根据文献报道[9],设计针对人PHB mRNA的小干扰序列,正义链:5′-CCCAGAAAUCACUGUGAAADTDT-3′,反义链:5′-UUUCACAGUGAUUUCUGGGDTDT-3′,由上海吉玛公司合成。转染前一天,以5×105/孔将A375细胞接种到6孔培养板中,过夜培养后,待细胞密度达到50%左右,按照Lipofectamine2000说明书将PHB siRNA转染进A375细胞中。转染24 h后收集细胞进行后续实验。
1.4 PHB siRNA转染效果评价方法
1.4.1 PHB mRNA表达检测 采用RT-PCR法。用TRIzol试剂分别提取两组细胞的总RNA,反转录酶将RNA反转录为cDNA,然后进行PCR反应。PHB引物序列为:正义链5′-GCTCTCACGCTCTCGGAACA-3′,反义链5′-ATTTTTGGTAGGGAGGTGGA-3′;反应条件为94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,72 ℃终延伸5 min,共扩增32个循环。β-actin引物序列为:正义链5′-ATGCCAGGGTACATGGTGGT-3′,反义链5′-TCGTGCGTGACATTAAGGAG-3′;反应条件为94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,72 ℃终延伸5 min,共扩增25个循环。PCR产物经1%琼脂糖凝胶电泳后,用Image J软件进行定量分析,以β-actin表达为内参,计算两组细胞PHB mRNA的表达量。
1.4.2 PHB蛋白表达检测 采用Western blot法。用预冷的PBS洗涤两组细胞各3次,将细胞置于冰上,用细胞裂解液裂解30 min,然后4 ℃、12 000 r/min离心30 min,收集上清行SDS-PAGE电泳。电泳结束后,将蛋白转移至硝酸纤维膜,3%BSA封闭1 h,之后分别用抗PHB和Actin的抗体室温孵育1 h,辣根过氧化物酶标记的二抗作用1 h,ECL避光显色曝光。Image J软件定量分析细胞中PHB蛋白表达量。
1.5 PHB siRNA转染后A375细胞铺展能力检测 收集两组细胞各5×105个,重悬于1 mL PBS中,加入适量CFSE工作液使其浓度达到10 μmol/L,37 ℃培养箱中培养30 min。然后1 000 r/min离心5 min去除上清,PBS洗两遍。将两组细胞重悬于DMEM中,以500 μL/孔的体积加入到24孔板中,细胞于37 ℃铺展30、60及120 min后,PBS洗两遍,10%甲醛固定10 min。荧光显微镜拍摄铺展不同时间点的对照组和观察组细胞并计数。发生铺展的相对细胞数目=视野中铺展细胞数/细胞总数×100%。
1.6 PHB siRNA转染后A375细胞迁移能力检测 采用细胞划痕实验。将两组细胞分别铺在24孔培养板中,37 ℃培养。待细胞长满时,用10 μL枪头在培养板中轻轻划直线。PBS洗掉划下的细胞,在培养板中加新鲜培养基并置于培养箱中。待培养0、12及24 h时分别将对照组和观察组细胞置于相差显微镜下拍照。Image J软件分析划痕后不同时间点细胞迁移面积,计算公式为:各时点迁移面积=0 min时空白面积-各时点空白面积。
1.7 PHB siRNA转染后A375细胞侵袭能力检测 采用Transwell侵袭实验。在Transwell小室底部膜的上室面加入Matrigel 50 μL,待Matrigel凝固后,分别取100 μL不含血清的对照组和观察组细胞悬液加入两个不同上室中,下室加入含10%胎牛血清的DMEM培养液500 μL,37 ℃培养箱孵育,48 h后取出Transwell小室,用棉签擦去小室内部聚碳酸酯膜上的细胞,PBS洗3遍。将聚碳酸酯膜下表面的细胞用甲醛固定10 min,结晶紫染色10 min,然后用清水洗3遍。倒置显微镜拍摄聚碳酸酯膜下表面细胞,然后用乙酸溶解结晶紫,酶标仪检测吸光率,表示A375细胞的侵袭能力。每个实验重复 3 次。
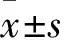
2 结果
2.1PHBsiRNA转染效果 对照组和观察组细胞中PHBmRNA的相对表达量分别为1.19 ±0.16、0.35±0.09,PHB蛋白的相对表达量分别为0.99±0.02、0.6±0.04,观察组细胞中PHBmRNA及蛋白相对表达量均低于对照组(P均<0.01)。见图1。

注:A为PHBmRNA表达;B为PHB蛋白表达。
图1 两组PHB mRNA及蛋白表达情况
2.2 两组细胞不同时点铺展能力比较 形态学观察发现,随着细胞铺展时间的变化,对照组细胞呈圆形-煎蛋样-铺展的形态改变,而观察组的大多数细胞仍呈圆形(图2)。铺展30 min时,对照组和观察组发生铺展的相对细胞数分别为36.8%±1.45%、13.33%±2.08%,观察组发生铺展的相对细胞数少于对照组(P<0.01)。铺展60 min时,对照组和观察组发生铺展的相对细胞数分别为47.34%±0.99%、20.25%±3.31%,观察组发生铺展的相对细胞数少于对照组(P<0.01)。铺展120 min时,对照组和观察组发生铺展的相对细胞数分别为78.3%±1.55%、25.42%±2.22%,观察组发生铺展的相对细胞数少于对照组(P<0.01)。
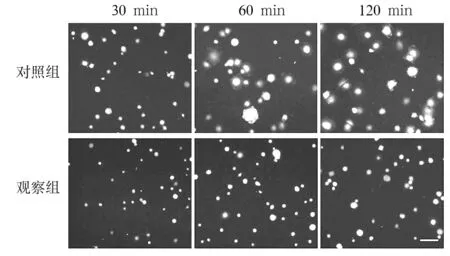
图2 两组细胞不同时点的铺展情况(细胞铺展实验)
2.3 两组细胞不同时点迁移能力比较 划痕后12 h,对照组和观察组细胞的迁移面积分别为(0.067±0.006)、(0.011±0.001)mm2,观察组细胞迁移面积小于对照组(P<0.01);划痕后24 h,对照组和观察组细胞的迁移面积分别为(0.084±0.01)、(0.035±0.005)mm2,观察组细胞迁移面积小于对照组(P<0.01)。见图3。

图3 两组细胞不同时点的迁移情况(细胞划痕实验)
2.4 两组细胞不同时点侵袭能力比较 对照组和观察组的吸光率分别为1.24±0.14、0.38±0.14,观察组吸光率低于对照组(P<0.01),观察组细胞的侵袭能力小于对照组细胞。见图4。

图4 两组细胞不同时点的侵袭情况(Transwell侵袭实验)
3 讨论
恶性黑色素瘤具有高侵袭性、高转移性、预后极差等特性,被称为“癌中之王”。在我国,恶性黑色素瘤的发病率呈逐年增长的趋势,同时病死率极高,5年生存率不到5%。深入研究恶性黑色素瘤的发生发展机制,寻找预防以及治疗黑色素瘤转移的有效靶点成为目前亟待解决的问题。
PHB属于Prohibitin蛋白家族成员,广泛表达于细菌、酵母、植物及哺乳动物等多种生物细胞中。人类Prohibitin家族由PHB和Prohibitin2组成,PHB基因定位于染色体17q21,分子量约为32 kD,Prohibitin 2基因定位于染色体12p13,分子量约为37 kD[10]。PHB因具有抑制细胞DNA合成和调控细胞周期等功能,曾被认为是一种肿瘤抑制基因。但是越来越多的研究发现,PHB在多种肿瘤中高表达,并可能具有致癌作用,是治疗肿瘤的新靶点。研究发现,PHB基因启动子上含有癌蛋白Myc的结合位点,Myc的过表达可促进PHB表达增强,这可能是PHB在多种肿瘤中高表达的原因之一[11]。研究显示,PHB参与原癌基因Ras活化C-Raf的过程[12],磷酸化PHB的高表达参与了Ras激活下游PI3K/AKT和Raf-1/ERK的级联反应,从而增强了肿瘤细胞的侵袭能力[13]。此外,有研究发现PHB的致癌和抑癌功能与其在细胞中的定位有关,细胞膜表面的PHB具有致癌作用,而核内表达的PHB通过调节转录发挥抑癌作用[14]。但是,目前关于PHB对肿瘤细胞的调控作用及机制仍不清楚。
黑色素瘤细胞向远端组织的转移是造成恶性黑色素瘤患者死亡的主要原因,而肿瘤细胞由圆形向铺展形态的转变、肿瘤细胞的迁移及侵袭是肿瘤成功转移的重要前提。本课题组前期研究发现,A375细胞的起始铺展依赖β1整联蛋白,而β1整联蛋白和PHB均定位于脂筏上[15],因此推测PHB可能与β1整联蛋白存在某种相互作用,进而影响肿瘤细胞的铺展和迁移。本研究发现,观察组各时点发生铺展的相对细胞数、细胞迁移面积及侵袭能力均少于对照组,提示PHB基因沉默后,A375细胞的铺展、迁移和侵袭能力均明显降低,表明PHB的表达可促进A375细胞的铺展、迁移和侵袭,进而对黑色素瘤的转移起促进作用,PHB在肿瘤发展中可能具有促瘤作用,为深入研究PHB在黑色素瘤转移中的作用机制奠定了基础。
综上所述,PHB基因沉默可明显抑制A375细胞的铺展、迁移和侵袭能力,表明PHB可能参与了黑色素瘤的迁移和侵袭进程,是具有致癌作用的基因,有望成为诊断和治疗黑色素瘤的新靶标。
[1] 张铁寒,高全立.恶性黑色素瘤的免疫治疗进展[J].国际免疫学杂志,2014,37(2):110-121.
[2] 祁晓晨,冒韵东,崔毓桂.抗增殖蛋白Prohibitin与肿瘤[J].生理科学进展,2013,44(1):52-55.
[3] Sato T, Saito H, Swensen J, et al. The human prohibitin gene located on chromosome 17q21 is mutated in sporadic breast cancer [J]. Cancer Res, 1992,52(6):1643-1646.
[4] Dart DA, Spencer-Dene B, Gamble SC, et al. Manipulating prohibitin levels provides evidence for an in vivo role in androgen regulation of prostate tumours[J]. Endocr Relat Cancer, 2009,16(4):1157-1169.
[5] Liu T, Tang H, Lang Y, et al. MicroRNA-27a functions as an oncogene in gastric adenocarcinoma by targeting prohibitin[J]. Cancer Lett, 2009, 273(2):233-242.
[6] Ko KS, Tomasi ML, Iglesias-Ara A, et al. Liver-specific deletion of prohibitin 1 results in spontaneous liver injury, fibrosis, and hepatocellular carcinoma in mice[J]. Hepatology, 2010,52(6):2096-2108.
[7] Ren HZ, Wang JS, Wang P, et al. Increased expression of prohibitin and its relationship with poor prognosis in esophageal squamous cell carcinoma [J]. Pathol Oncol Res, 2010,16(4):515-522.
[8] 许志宾,吴金鸿,查锡良.Prohibitin1的上调参与肝癌细胞的增殖和迁移[J].中国科学:生命科学,2011,41(6):449-455.
[9] Peng XJ, Mehta R, Wang S, et al. Prohibitin is a novel target gene of vitamin D involved in its antiproliferative action in breast cancer cells [J]. Cancer Res, 2006,66(14):7361-7369.
[10] Mishra S, Murphy LC, Nyomba BL, et al. Prohibitin: a potential target for new therapeutics [J]. Trends Mol Med, 2005,11(4):192-197.
[11] Coates PJ, Nenutil R, McGregor A, et al. Mammalian prohibitin proteins respond to mitochondrial stress and decrease during cellular senescence [J]. Exp Cell Res, 2001,265(2):262-273.
[12] Rajalingam K, Wunder C, Brinkmann V, et al. Prohibitin is required for Ras-induced Raf-MEK-ERK activation and epithelial cell migration [J]. Nat Cell Biol, 2005,7(8):837-843.
[13] Chiu CF, Ho MY, Peng JM, et al. Raf activation by Ras and promotion of cellular metastasis require phosphorylation of prohibitin in the raft domain of the plasma membrane [J]. Oncogene, 2013,32(6):777-787.
[14] Rastogi S, Joshi B, Fusaro G, et al. Camptothecin induces nuclear export of prohibitin preferentially in transformed cells through a CRM-1-dependent mechanism [J]. J Biol Chem, 2006,281(5):2951-2959.
[15] Wang RF, Bi JJ, Ampah KK, et al. Lipid raft regulates the initial spreading of melanoma A375 cells by modulating β1 integrin clustering [J]. Int J Biochem Cell Biol, 2013,45(8):1679-1689.
Effects of Prohibitin 1 gene silencing on spreading, migration and invasion of melanoma cells
BIJiajia
(DepartmentofLifeSciencesandTechnology,XinxiangMedicalUniversity,Xinxiang453003,China)
Objective To investigate the effects of prohibitin 1 (PHB) silencing on spreading, migration and invasion of melanoma A375 cells by RNA interference (RNAi). Methods The A375 cells were divided into the control group and experimental group. The cells in the control group were cultured in DMEM containing 10% FBS, while the cells in the experimental group were treated with Lipofectamine2000 and PHB siRNA. After incubation for 24 hours, RT-PCR and Western blotting were used to detect the mRNA and protein expression of PHB in transfected A375 cells. Spreading experiment was performed for assessing the cell spreading at 30, 60 and 120 min. The migration and invasion abilities of A375 cells were detected by Scratch and Transwell invasion assay, respectively. Results The mRNA and protein expression levels of PHB in the experimental group were lower than those in the control group (allP<0.01). Compared with the control group, the spreading cells in the experimental group were less at 30, 60 and 120 min (allP<0.01). The migration area in the experimental group was significantly less than that in the control group at 12 and 24 h after wounding healing (P<0.01). Meanwhile, the invasive ability of the experimental group was less than that of the control group (P<0.01).Conclusion PHB gene silencing can effectively inhibit the spreading, migration and invasion of melanoma cells.
prohibitin; melanoma; spreading; migration; invasion; RNA interference
国家自然科学基金资助项目(81402416);新乡医学院博士科研启动经费资助项目(505057)。
毕佳佳(1985-),女,博士,讲师,主要研究方向为肿瘤基础研究。E-mail: bijiajia2006@126.com
10.3969/j.issn.1002-266X.2016.46.007
R739.5
A
1002-266X(2016)46-0027-04
2016-05-17)

