TGF-β在香烟烟雾提取物诱导的中性粒细胞内质网应激中的作用
黄 宏, 王如娟, 朱慧芬, 杨道锋
1华中科技大学同济医学院附属同济医院呼吸与危重症学科,武汉 4300302华中科技大学同济医学院基础医学院免疫学系,武汉 4300303华中科技大学同济医学院附属同济医院感染科,武汉 430030
TGF-β在香烟烟雾提取物诱导的中性粒细胞内质网应激中的作用
黄 宏1, 王如娟1, 朱慧芬2, 杨道锋3△
1华中科技大学同济医学院附属同济医院呼吸与危重症学科,武汉 430030
2华中科技大学同济医学院基础医学院免疫学系,武汉 4300303华中科技大学同济医学院附属同济医院感染科,武汉 430030
目的 探讨TGF-β在香烟烟雾提取物(cigarette smoke extract,CSE)诱导的正常人外周血中性粒细胞内质网应激(endoplasmic reticulum stress,ER stress)中的作用。方法 实验分3组:正常对照组、CSE刺激组、CSE刺激+内质网应激抑制剂4-苯基丁酸(4-phenylbutyrate,4-PBA)组。培养正常人外周血中性粒细胞,给予不同浓度的CSE刺激16 h,流式细胞术检测中性粒细胞GRP78、TGF-β、NF-κB、ERK、p38-MAPK的表达,ELISA法检测CXCL-8蛋白表达水平。结果 CSE增强中性粒细胞GRP78及TGF-β的表达,并在一定范围内呈浓度依赖性;内质网应激抑制剂4-PBA减少CXCL-8的分泌(P<0.05)和TGF-β的表达(P<0.05)。CSE对中性粒细胞表面NF-κB、ERK、p38-MAPK的表达无明显作用。结论 CSE诱导中性粒细胞内质网应激,并上调CXCL-8和TGF-β水平;4-PBA减少中性粒细胞分泌CXCL-8,可能与下调TGF-β表达有关。
内质网应激; 香烟烟雾提取物; 中性粒细胞; 转化生长因子-β
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以持续气流受限为特征的气道、肺实质和肺血管的慢性炎症,而气道中性粒细胞的募集和激活是重要的环节之一[1]。中性粒细胞在多种刺激因子例如脂多糖(lipopolysaccharide,LPS)和嗜酸性粒细胞主要碱基蛋白等的作用下进一步分泌白细胞介素-8(IL-8/CXCL-8)。CXCL-8是重要的中性粒细胞趋化因子,内皮细胞、单核细胞、中性粒细胞均能合成和分泌CXCL-8。吸烟是COPD最主要的致病因素[2],研究已经发现吸烟导致COPD肺组织内质网应激(endoplasmic reticulum stress,ER stress)标志物糖调节蛋白78(glucose regulated protein 78,GRP78)表达上调[3-4]。最近,有研究发现内质网应激可通过非折叠蛋白反应(unfold protein response,UPR)偶联NF-κB、JNK/AP1等炎症通路调节炎症介质的表达[5],而NF-κB是中性粒细胞趋化因子CXCL-8重要的转录因子,因此我们推测香烟烟雾提取物(cigarette smoke extract,CSE)可以通过UPR信号途径参与中性粒细胞的趋化作用。本实验采用CSE刺激正常人外周血中性粒细胞,并检测不同炎症通路蛋白的表达,同时观察内质网应激抑制剂4-苯基丁酸(4-phenylbutyrate,4-PBA)对中性粒细胞分泌CXCL-8的影响,初步探讨不同信号通路在CSE诱导的中性粒细胞内质网应激中的作用。
1 材料与方法
1.1 CSE制备
参照Nakamura等[6]的方法制备CSE。用2支去过滤嘴香烟(红金龙牌,武汉卷烟厂,含焦油15 mg、烟碱1.1 mg)由负压驱动装置连续抽吸而燃烧,10 min内燃烧完。吸入的烟雾经另一出口进入并溶于50 mL RPMI 1640培养液中,摇晃使其完全溶解。制成的悬液密闭摇匀后用NaOH调节pH值至7.4,经0.22 μm微孔滤器过滤除菌,即为CSE原液,制备后30 min内用于实验。
1.2 中性粒细胞分离
取健康供血者外周血5 mL,加至淋巴细胞分层液上,2 000 r/min×20 min离心,分离单个核细胞(peripheral blood mononuclear cell,PBMC),去除PBMC、分离液和血浆。红细胞和粒细胞用5 mL PBS重悬,加入等体积的6% Dextran T500混匀,静置20 min后,吸取上层白细胞至另一干净离心管中,离心1 200 r/min×5 min,去上清。再加入10 mL红细胞裂解液,室温裂解7 min,离心1 000 r/min×5 min,去上清后,加入10 mL PBS,混匀计数,用10% FCS RPMI 1640培养液调整细胞密度为3×106/mL,加入48孔板中,500 μL/孔。
1.3 流式细胞术检测信号蛋白的表达
实验分3组:①正常对照组,加入PBS;②CSE刺激组,CSE终浓度分别为5%、10%和20%;③CSE刺激组+内质网应激阻断剂4-PBA组,根据预实验结果选择20%CSE,并于CSE刺激前1 h加入4-PBA,4-PBA终浓度为5 mmol/L。37℃培养16 h。采用流式细胞仪(FACSCalibur流式细胞仪,美国BD公司)检测中性粒细胞表面TGF-β、胞内GRP78、核内NF-κB、ERK、p38-MAPK的平均荧光强度(mean fluorescence intensity,MFI)。TGF-β、ERK、p38-MAPK检测试剂盒为eBioscience公司产品,GRP78、NF-κB检测试剂盒为Biolegend公司产品。
1.4 ELISA法检测CXCL-8表达水平
实验具体分组同上。刺激24 h后收取培养上清。ELISA法测CXCL-8蛋白表达水平,操作步骤严格按照北京达科为生物技术公司人CXCL-8预包被试剂盒说明书进行。
1.5 统计学方法
本实验采用GraphPad Prism 6.0软件对实验数据进行处理,多组间差异比较采用单因素方差分析,两组间差异比较采用SNK-q检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 CSE刺激中性粒细胞表达GRP78、TGF-β及4-PBA对TGF-β表达的影响
CSE刺激下,正常人外周血中中性粒细胞内质网应激标志物GRP78的表达水平逐渐升高,且呈浓度依赖性;TGF-β表达也明显增强,亦呈浓度依赖性,而且4-PBA可明显减弱TGF-β的表达。见图1。
2.2 CSE刺激中性粒细胞NF-κB、p38-MAPK、ERK的表达
图2可见,随着CSE刺激浓度增加,NF-κB、p38-MAPK、ERK的表达水平亦有逐渐升高趋势,但与正常对照组比较,差异均无统计学意义(均P>0.05)。
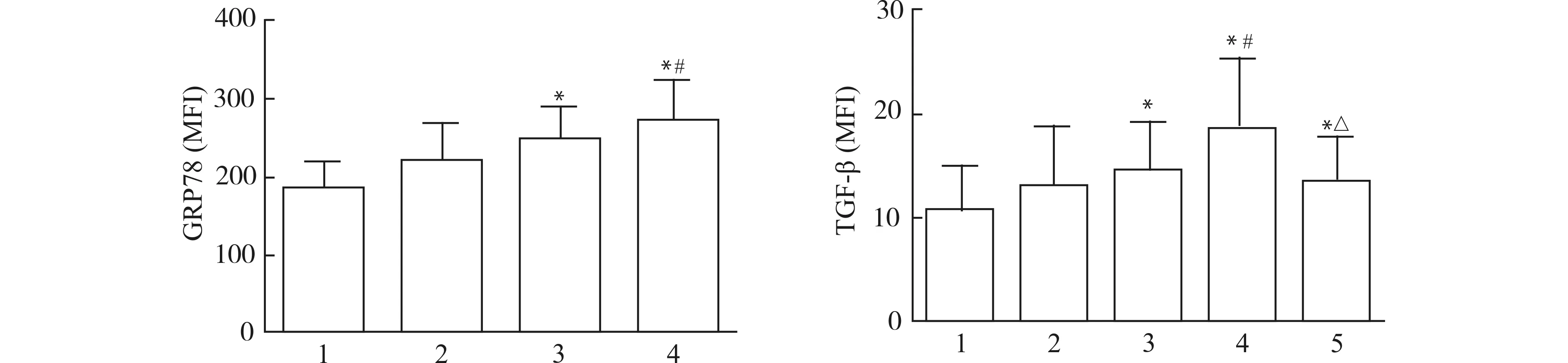
1:正常对照;2:5%CSE;3:10%CSE;4:20%CSE;5:20%CSE+5 mmol/L 4-PBA;与正常对照组比较,*P<0.05;与10%CSE组比较,#P<0.05;与20%CSE组比较,△P<0.05图1 CSE刺激中性粒细胞表达GRP78、TGF-β及4-PBA对TGF-β表达的影响(n=4)Fig.1 MFI of GRP-78 and TGF-β on neutrophils stimulated with CSE and effect of 4-PBA on expression of TGF-β (n=4)
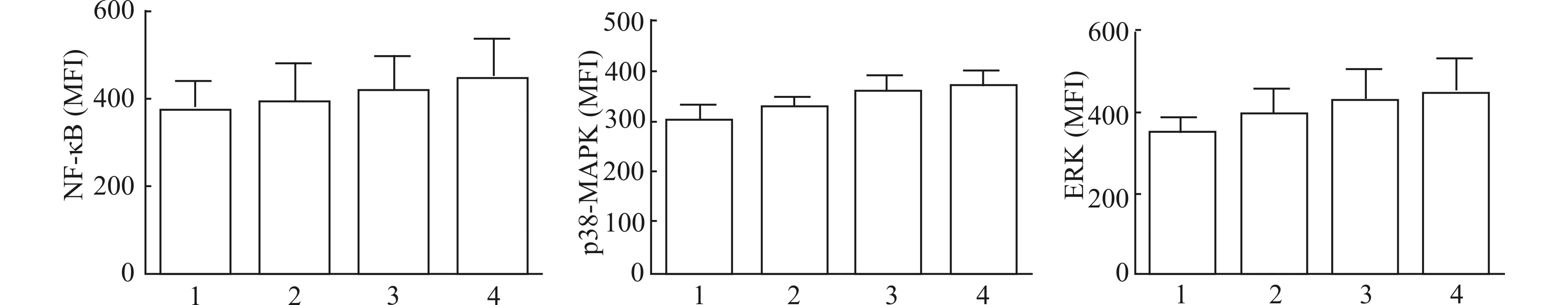
1:正常对照;2:5%CSE;3:10%CSE;4:20%CSE图2 CSE刺激中性粒细胞NF-κB、p38-MAPK、ERK的表达(n=3)Fig.2 MFI of NF-κB,p38-MAPK and ERK on neutrophils stimulated with CSE (n=3)
2.3 CSE刺激中性粒细胞分泌CXCL-8及4-PBA对CXCL-8分泌的影响
图3可见:与正常对照组比较,CSE刺激组CXCL-8表达水平均升高,且呈浓度依赖性,差异有统计学意义(均P<0.05)。内质网应激抑制剂4-PBA作用下CXCL-8表达水平较CSE刺激组降低,差异具有统计学意义(P<0.05)。
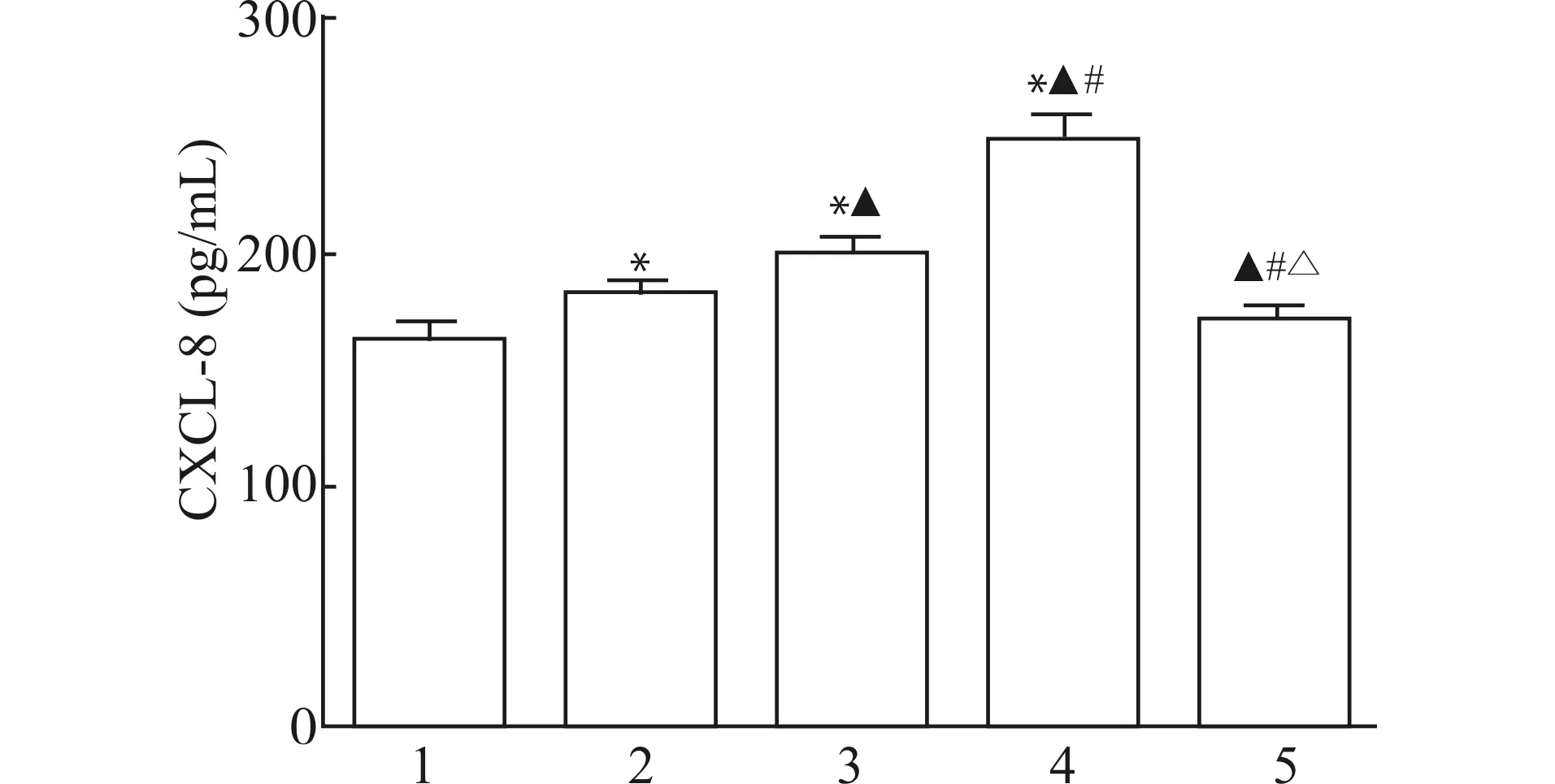
1:正常对照;2:5%CSE;3:10%CSE;4:20%CSE;5:20%CSE+5 mmol/L 4-PBA;与正常对照组比较,*P<0.05;与5%CSE组比较,▲P<0.05;与10%CSE组比较,#P<0.05;与20%CSE组比较,△P<0.05图3 ELISA法检测各组中性粒细胞CXCL-8分泌水平及4-PBA对其的影响(n=3)Fig.3 Detection of secretion of CXCL-8 from neutrophils by ELISA and effect of 4-PBA on CXCL-8(n=3)
3 讨论
COPD的慢性气道炎症以中性粒细胞浸润为主要特征之一。吸烟是COPD的重要致病因素。研究已证实吸烟者较非吸烟者外周血中性粒细胞计数明显增多,吸烟的COPD患者其肺泡灌洗液、支气管腺体和痰液中的中性粒细胞亦显著增加。香烟烟雾含有4 000多种化合物,其中包括自由基以及多种毒性成分[7],吸烟导致气道上皮、血管内皮、巨噬细胞释放前炎性因子和粘附分子,吸引中性粒细胞等炎性细胞的迁移并活化,参与气道炎症和重构。但是,吸烟对外周血中性粒细胞的直接作用以及相关的信号通路则少见报道。近来研究表明吸烟COPD动物模型以及吸烟COPD患者肺组织存在内质网应激,并参与炎症过程[4,8],然而,吸烟是否影响中性粒细胞内质网应激,以及相关的信号途径尚未见报道。
内质网(endoplasmic reticulum,ER)是细胞内蛋白合成、加工修饰及钙离子储存的主要场所,当细胞受到缺氧、感染、自由基、药物等刺激时,未折叠或错误折叠的蛋白质在ER内异常堆积,发生内质网应激。正常情况下,ER膜上的3个跨膜蛋白肌醇需要酶1(inositol requiring protein-1,IRE1)、PKR样内质网激酶(kinase RNA-like ER kinase,PERK)和活化转录因子6(activating transcriptionfactor 6,ATF6)与GRP78结合形成蛋白复合物,维持无活性状态;内质网应激发生时,GRP78与非折叠或错误折叠的蛋白结合,IRE1、PERK和ATF6与GRP78解离并活化,启动适应性非折叠蛋白反应,增强对蛋白的折叠能力,加速非折叠蛋白的降解,从而恢复和维持ER内环境的相对稳态。然而,过度的内质网应激可通过非折叠蛋白反应偶联NF-κB、JNK/AP-1等多种炎症通路,上调炎症因子的表达[5]。多项研究[9-11]发现,内质网应激参与多种因素诱导的肺部炎症,例如内质网应激通过NF-κB通路参与了哮喘小鼠肺部炎症及脂多糖诱导的小鼠肺部炎症,体外实验用CSE刺激A549细胞,发现JNK通路参与内质网应激调节CXCL-8表达过程。TGF-β是具有广泛生物学活性的多肽生长因子。TGF-β促进IL-1、IL-6和CXCL-8等因子的释放,参与COPD的气道炎症和重建。研究表明,TGF-β参与诱导内质网应激[12]。本实验初步探讨了TGF-β、NF-κB、ERK、p38-MAPK信号蛋白在CSE诱导的人外周血中性粒细胞内质网应激中的作用,结果显示CSE显著增强TGF-β的表达,4-PBA则能下调20%CSE刺激下TGF-β的表达水平,表明TGF-β信号可能参与CSE诱导的中性粒细胞内质网应激。我们的结果亦表明,尽管CSE能上调中性粒细胞NF-κB、ERK、p38-MAPK,但差异无统计学意义。
本研究用CSE刺激中性粒细胞,实验结果显示,在CSE刺激作用下,内质网应激标志物GRP78表达升高,且呈浓度依赖性。同时,我们发现内质网应激阻断剂4-PBA能显著抑制CSE刺激的中性粒细胞分泌CXCL-8。我们的结果表明内质网应激参与了吸烟诱导的中性粒细胞分泌CXCL-8。CXCL-8是重要的中性粒细胞趋化因子,CXCL-8不仅促进中性粒细胞细胞粘附,还能促进中性粒细胞跨内皮移动和活化[13]。有研究发现在LPS诱导的小鼠肺部炎症中,肺泡灌洗液、肺泡腔及支气管周围以中性粒细胞为主的炎症细胞明显增多,4-PBA能明显减弱上述作用[14],4-PBA还能减弱卵清白蛋白(OVA)诱导的哮喘小鼠模型肺组织中以嗜酸性粒细胞为主的炎症细胞浸润[15]。我们的结果表明CSE诱导中性粒细胞内质网应激,而内质网应激阻断剂能明显减少中性粒细胞分泌CXCL-8,结合上述信号通路的研究,提示4-PBA减少CXCL-8的分泌,可能与TGF-β有关。
综上所述,CSE可诱导中性粒细胞发生内质网应激,并上调CXCL-8和TGF-β水平。抑制CSE诱导的内质网应激,可能是通过下调TGF-β水平进而减少了CXCL-8的分泌所致。
[1] Vestbo J,Hurd S S,Agusti A G,et al.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease:GOLD executive summary[J].Am J Respir Crit Care Med,2013,187(4):347-365.
[2] Bartal M.COPD and tobacco smoke[J].Monaldi Arch Chest Dis,2005,63(4):213-225.
[3] Kelsen S G,Duan X,Ji R,et al.Cigarette smoke induces an unfolded protein response in the human lung:a proteomic approach[J].Am J Respir Cell Mol Biol,2008,38(5):541-550.
[4] 何白梅,罗百灵,彭振宇,等.慢性阻塞性肺疾病大鼠模型的肺组织内质网应激与细胞凋亡[J].中华结核和呼吸杂志,2011,34(5):375-379.
[5] Zhang K,Kaufman R J.From endoplasmic-reticulum stress to the inflammatory response[J].Nature,2008,454(7203):455-462.
[6] Nakamura Y,Romberger D J,Tate L,et al.Cigarette smoke inhibits lung fibroblast proliferation and chemotaxis[J].Am J Respir Crit Care Med,1995,151(5):1497-1503.
[7] Tuder R M,Petrache I.Pathogenesis of chronic obstructive pulmonary disease[J].J Clin Invest,2012,122(8):2749-2755.
[8] Csordas A,Kreutmayer S,Ploner C,et al.Cigarette smoke extract induces prolonged endoplasmic reticulum stress and autophagic cell death in human umbilical vein endothelial cells[J].Cardiovasc Res,2011,92(1):141-148.
[9] Kim H J,Jeong J S,Kim S R,et al.Inhibition of endoplasmic reticulum stress alleviates lipopolysaccharide-induced lung inflammation through modulation of NF-kappaB/HIF-1 alpha signaling pathway[J].Sci Rep,2013,3:1142.
[10] Kim S R,Kim D I,Kang M R,et al.Endoplasmic reticulum stress influences bronchial asthma pathogenesis by modulating nuclear factor kappaB activation[J].J Allergy Clin Immunol,2013,132(6):1397-1408.
[11] Maguire J A,Mulugeta S,Beers M F.Endoplasmic reticulum stress induced by surfactant protein C BRICHOS mutants promotes proinflammatory signaling by epithelial cells[J].Am J Respir Cell Mol Biol,2011,44(3):404-414.
[12] Huang Y,Liu J,Fan L,et al.miR-663 overexpression induced by endoplasmic reticulum stress modulates hepatocellular carcinoma cell apoptosis via transforming growth factor beta 1[J].Onco Targets Ther,2016,17(9):1623-1633.
[13] Huber A R,Kunkel,S L,Todd,R R,et al.Regulation of transendothelial neutrophil migration by endogenous interleukin-8[J].Science,1991,254(5028):99-102.
[14] Chen H W,Li C K,Ku H J,et al.Cigarette smoke extract induces expression of cell adhesion molecules in HUVEC via actin filament reorganization[J].Environ Mol Mutagen,2009,50(2):96-104.
[15] Sharma J,Young D M,Marentette J O,et al.Lung endothelial cell platelet-activating factor production and inflammatory cell adherence are increased in response to cigarette smoke component exposure[J].Am J Physiol Lung Cell Mol Physiol,2012,302(1):L47-L55.
(2016-06-16 收稿)
Effect of TGF-β in Endoplasmic Reticulum Stress of Neutrophils Induced with Cigarette Smoke Extract
Huang Hong1,Wang Rujuan1,Zhu Huifen2etal
1DepartmentofRespiratoryandCriticalCareMedicine,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China2DepartmentofImmunology,SchoolofBasicMedicine,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
Objective To investigate the effect of TGF-β in endoplasmic reticulum stress (ER stress)of neutrophils induced by cigarette smoke extract (CSE).Methods Neutrophils were cultured and divided into 3 groups:normal control group,CSE-stimulation group,and CSE+4-phenylbutyrate(4-PBA)group.Neutrophils were cultured and stimulated with CSE for 16 h at concentrations of 5%,10% and 20%,respectively.GRP78,TGF-β,NF-κB,ERK and p38-MAPK were detected by flow cytometry.ELISA was performed to test the secretion of CXCL-8.Results The expression of GRP78 and TGF-β was increased in CSE-stimulated neutrophils(P<0.05),furthermore,it was concentration-dependent in a certain range.4-PBA significantly reduced the expression of CXCL-8 and TGF-β(P<0.05),in addition,CSE did not significantly affect the expression of NF-κB,ERK and p38-MAPK on neutrophils.Conclusion Cigarette smoke extract induces ER stress in neutrophils and up-regulates CXCL-8 and TGF-β;4-PBA decreases secretion of CXCL-8 in 4-PBA probably through down-regulating the expression of TGF-β.
endoplasmic reticulum stress; cigarette smoke extract; neutrophils; transforming growth factor-β
R329.28
10.3870/j.issn.1672-0741.2016.06.008
黄 宏,女,1967年生,副教授,副主任医师,E-mail:huanghong@tjh.tjmu.edu.cn
△通讯作者,Corresponding author,E-mail:yandaofeng@aliyun.com
——记华中科技大学哲学系教授欧阳康

