健脾解毒方对大肠癌细胞mTOR信号通路相关蛋白表达的影响
施利,毛丹,张绍钒,黄建华,刘新义,张英进,雷三林,马进安,向大雄,胡春宏,张四方*
(1.中南大学湘雅二医院,湖南长沙410008,2.湖南中医药大学药学院,湖南长沙410028)
健脾解毒方对大肠癌细胞mTOR信号通路相关蛋白表达的影响
施利1,毛丹1,张绍钒1,黄建华2,刘新义1,张英进1,雷三林1,马进安1,向大雄1,胡春宏1,张四方1*
(1.中南大学湘雅二医院,湖南长沙410008,2.湖南中医药大学药学院,湖南长沙410028)
目的探讨健脾解毒方对大肠癌细胞增殖的影响及可能作用机制。方法采用水提法制作健脾解毒方提取物,利用超高效液相-高分辨飞行时间质谱法分析健脾解毒方的主要成分,MTT法检测健脾解毒方对大肠癌细胞增殖的影响,Graphpad Prism5软件计算IC50值,流式细胞术检测细胞周期,Western Blot技术检测Phospho-mTOR、Phospho-P53和P21的蛋白表达。结果健脾解毒方能够抑制大肠癌细胞增殖,处理24、48、72 h后四种大肠癌细胞系的IC50值分别为HCT116(6.894、5.668、3.648 mg/mL)、LoVo(14.65、8.737、7.849 mg/mL)、SW48(8.029、7.026、5.740 mg/mL)及HT29(13.06、9.646、8.448 mg/mL);健脾解毒方使大肠癌细胞周期阻滞在G1期;并能够下调Phospho-mTOR蛋白表达(P<0.05),上调Phospho-P53和P21蛋白的表达(P<0.05),使大肠癌细胞周期阻滞在G1期。结论健脾解毒方可能通过mTOR-P53-P21途径抑制大肠癌细胞的增殖,这可能是健脾解毒方治疗大肠癌的作用机制之一。
健脾解毒方;大肠癌;细胞增殖;半抑制浓度;mTOR
健脾解毒方为湖南省首届老中医师承导师朱伟光教授治疗大肠癌的有效经验方,全方由黄芪、白术、西洋参、半枝莲、甘草等11味药物组成,具有健脾益气、清热解毒之功,随症加减在临床上取得了很好疗效[1-2]。本研究采用水提法制作健脾解毒方,利用超高效液相-高分辨飞行时间质谱(UPLC-QTOF/MS)法分析健脾解毒方的主要成分,应用MTT法、流式细胞术、Western Blot等技术,探讨健脾解毒方对大肠癌HCT116、LoVo、SW48及HT29细胞增殖的影响,并进一步探讨其可能的作用机制,为健脾解毒方治疗大肠癌的临床推广应用提供实验依据。
1 材料与方法
1.1 主要试剂和仪器
RPMI-1640培养液,美国Corning公司产品;胎牛血清澳大利亚Ausbian公司产品;噻唑兰美国Genview公司产品;BCA Protein Assay Kit试剂盒上海碧云天生物技术公司产品,NP-40裂解液上海鼎国生物技术有限公司;P-mTOR(phospho s2448)、PP53(phospho s15)及P21抗体美国abcam公司产品;标准品毛蕊异黄酮葡萄糖苷、人参皂苷Re、芹菜素、人参皂苷Rb1、黄芪甲苷、甘草酸、白术内酯Ⅱ均购自南京森贝伽生物科技有限公司,供定量测定用,HPLC测定质量分数均≥98%;乙腈(色谱纯)德国Merck公司产品;甲酸(色谱纯)美国sigma公司。色谱柱为ACQUITYUPLCBEHC18柱(50 mm×2.1 mm,1.7 μm)美国Waters公司产品;CO2培养箱及生物安全柜为中国Heal Force公司产品;SDS-PAGE蛋白电泳仪为上海天能公司产品;倒置相差显微镜为中国Motic公司产品;酶标仪为美国Thermo公司产品;美国Bechman-Coulter流式细胞仪,美国UVP-2000图像分析系统,美国PHANTOM 4300图像扫描仪,ACQUITY UPLC超高效液相色谱仪、Xevo G2 QTof四级杆飞行时间质谱仪美国Waters公司产品。
1.2 细胞培养
人大肠癌HCT116、LoVo、SW48及HT29细胞和人正常结直肠粘膜FHC细胞(均购自长沙艾佳生物技术有限公司),于含10%胎牛血清的RPMI-1640培养液中生长,37℃、5%CO2培养箱中培养,隔天换液,待细胞贴壁生长铺满瓶底达80%以上时常规消化、传代、冻存。
1.3 健脾解毒方的制备
健脾解毒方药材由湖南省中医药研究院中药研究所提供,并经湖南省中医药研究院中药研究所中药鉴定研究室谢昭明研究员鉴定。健脾解毒方由中南大学湘雅二医院药剂科刘新义博士制备,具体步骤如下:按比例称取健脾解毒复方中各组分,浸泡1 h,分别加8倍水和6倍水加热回流提取,每次2 h,混合后滤过,真空负压旋转浓缩后分瓶密封,折算成生药为1 g/mL。
1.4 UPLC-Q-TOF/MS法测定健脾解毒方粗提物中多种有效成分
液相色谱条件色谱柱:ACQUITY UPLC BEH C18柱(50 mm×2.1 mm,1.7 μm),0.1%甲酸水(A)-乙腈(B),使用前超声脱气,用0.22 μm微孔滤膜滤过;梯度洗脱程序:流动相0~2 min,95%A;2~40 min,50%A;40~50 min,0A;50~52 min,0A;0~2 min,5%B;2~40 min,50%B;40~50 min,100% B;50~52 min,100%B;流速:0.4 mL/min,柱温20℃,进样量1 μL。质谱条件:离子源为点喷雾电离源正离子模式(ESI+),毛细管电压为1.1 kV,锥孔电压为40 V,离子源温度为100℃,脱溶剂气温度为350℃,脱溶剂气流量为800 L/h,碰撞能量低能量为6 V,梯度高能量为20 V,碰撞气体为氩气,扫描时间为0.2 s,质谱扫描范围100~1 200 m/z。
1.5 细胞生存率检测
采用MTT法检测健脾解毒方对大肠癌HCT116、LoVo、SW620及HT29细胞和人正常结直肠粘膜FHC细胞增殖的影响。分别收集对数期细胞,接种于96孔培养板中,每组设置6个复孔,分别培养24、48、72 h后取出,加入MTT溶液10 μL,继续培养4 h,用酶标仪检测各孔在570 nm处波长的吸光值(OD值),计算平均OD值和细胞生存率。细胞生存率(Cell Viability)=健脾解毒方各浓度组平均OD值/空白对照组平均OD值×100%。实验重复3次。
1.6 流式细胞仪检测细胞周期
用含10%胎牛血清RPMI-1640培养液培养大肠癌HCT116、LoVo、SW620及HT29细胞,收集对数期细胞,加入无血清培养液,接种于50 mL培养瓶中,孵育24 h使细胞同步化(各组细胞生长至60%融合)。更换细胞培养液,实验分2组,分别为空白对照组(Con)、健脾解毒方组(JPJD)。继续于恒温培养箱中培养干预24 h后,胰酶消化细胞,制成单细胞悬液,配制细胞浓度为1×106/mL,用流式细胞仪测定细胞周期分布百分比,计算细胞增殖指数(proliferation index,PI)。PI=(S+G2/M)/(G0/G1+S+G2/ M)×100%。实验重复3次。
1.7 Western Blot检测蛋白的表达
10%胎牛血清RPMI-1640培养液培养大肠癌HCT116、LoVo、SW620及HT29细胞,收集对数期细胞,加入无血清培养液,接种于50 mL培养瓶中,孵育24 h使细胞同步化(各组细胞生长至60%融合)。更换细胞培养液,实验分2组,分别为空白对照组和健脾解毒方组,继续于恒温培养箱中培养干预48 h后,收集各组细胞,加入100 μL裂解缓冲液,冰浴放置120 min,期间轻摇振荡。然后4℃、12 000 r/min离心10 min,取上清液。应用Bradford法检测蛋白浓度。每孔上样50 μg,保持各孔蛋白量平衡,加入SDS缓冲液,煮沸5 min,10%SDS-聚丙烯酰胺凝胶电泳分离蛋白质,然后将蛋白转印至NC膜上,用Tris缓冲盐溶液稀释脱脂奶粉为5%浓度封闭液,室温封闭2 h,再加入P-mTOR、PP53及P21抗体(1∶700)4℃孵育过夜,经Tris缓冲盐溶液洗膜3次后,加入相应过氧化物酶标记的羊抗兔IgG二抗(1∶4 000)室温孵育1 h,Tris缓冲盐溶液洗膜10 min×3次,ECL发光显色,凝胶成像仪进行拍照记录并进行灰度分析。以目的蛋白与β-actin的光密度比值表示目的基因在蛋白水平的表达。实验重复3次。
1.8 数据处理
运用Graphpad Prism5软件计算IC50值。采用SPSS 20.0统计软件进行统计分析,实验数据以“±s”表示,方差齐性时两组间比较采用独立样本t检验,方差不齐时采用秩和检验,P<0.05表示差异有统计学意义。
2 结果
2.1 UPLC-Q-TOF/MS法检测到健脾解毒方提取物中7种主要成分
以2015版《中华人民共和国药典》中对复方中各单味草药的质量控制标准为依据,我们选取了17个标准样品并配成混标。分别取混合对照品溶液、供试品溶液各2 μL,按色谱和质谱条件进样,分别得到供试品图谱和对照品图谱(见图1)。依照相应的保留时间和相应的质谱信息进行比对,最终鉴定出毛蕊异黄酮葡萄糖苷、人参皂苷Re、芹菜素、人参皂苷Rb1、黄芪甲苷、甘草酸、白术内酯Ⅱ共7个成分,其详细质谱信息见表1。

图1 对照品混合物(A)和健脾解毒方(B)的总离子流图
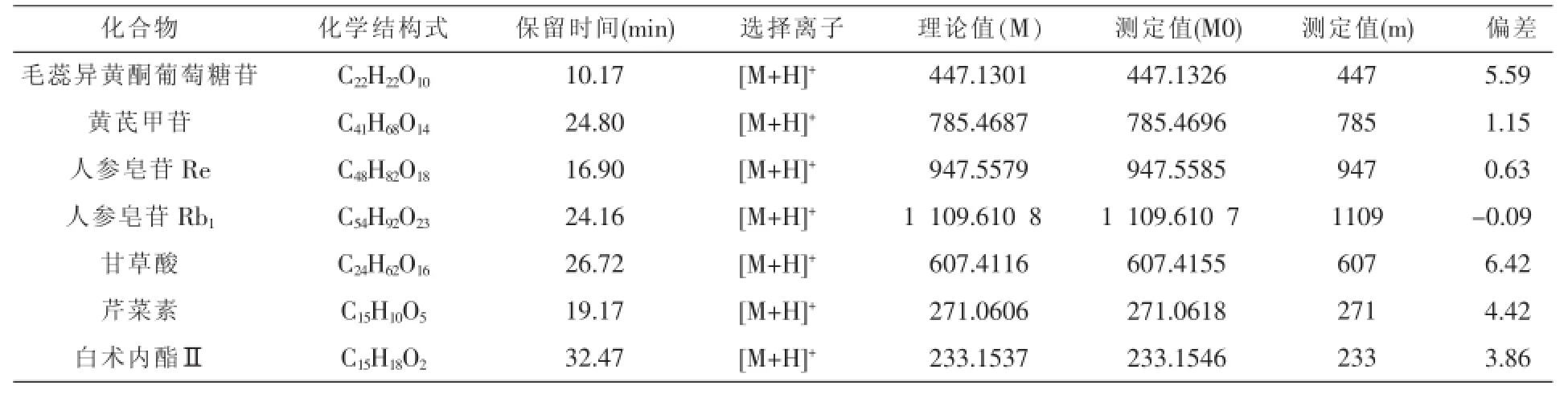
表1 健脾解毒方提取物7种成分质谱信息
2.2 健脾解毒方对大肠癌HCT116、LoVo、SW48及HT29细胞增殖的影响
将健脾解毒方分别设置0、0.05、0.5、5、50、500 mg/mL共6个浓度梯度干预24、48、72h后,采用MTT法计算出健脾解毒方各浓度组细胞生存率值,结果表明4种大肠癌细胞系在5~50 mg/mL浓度区间细胞生存率值均能达到50%,见图2(A)。通过Graphpad Prism5软件计算IC50值,结果显示,健脾解毒方干预24、48、72 h后,四种大肠癌细胞系的IC50值分别为HCT116(6.894、5.668、3.648 mg/mL)、LoVo(14.65、 8.737、7.849 mg/mL)、SW48(8.029、7.026、5.740 mg/mL)及HT29(13.06、9.646、8.448 mg/mL),提示健脾解毒方对大肠癌HCT116、LoVo、SW620及HT29细胞的增殖抑制作用与时间有一定相关性,见表2。采用2倍稀释法重新设置0、2.5、5、10、20、40 mg/mL共6个浓度梯度分别干预24、48、72 h后,计算出健脾解毒方各浓度组细胞生存率值并绘制出各组细胞生存率的曲线图,见图2(B,C和D),提示健脾解毒方对大肠癌细胞系HCT116、LoVo、SW48及HT29的增殖抑制作用与浓度相关。
表2 健脾解毒方对大肠癌细胞不同时间点IC50值的影响(±s,mg/mL)

表2 健脾解毒方对大肠癌细胞不同时间点IC50值的影响(±s,mg/mL)
注:与24 h组比较,*P<0.05;与48 h组比较,#P<0.05。
24 h 48 h 72 h 24 h VS 48 h 24 h VS 72 h 48 h VS 72 h HCT116 6.894±0.542 5.668±0.467* 3.648±0.279*#t=6.476 P=0.032 t=28.313 P=0.001 t=8.542 P=0.014 LoVo 14.65±1.142 8.737±0.68* 7.849±0.61* t=21.375 P=0.002 t=21.972 P=0.002 t=2.377 P=0.142 SW48 8.029±0.709 7.026±0.593 5.740±0.435*#t=4.672 P=0.061 t=15.377 P=0.006 t=7.689 P=0.026 HT29 13.06±0.107 9.646±0.765* 8.448±0.671*#t=13.344 P=0.005 t=20.876 P=0.003 t=6.547 P=0.031
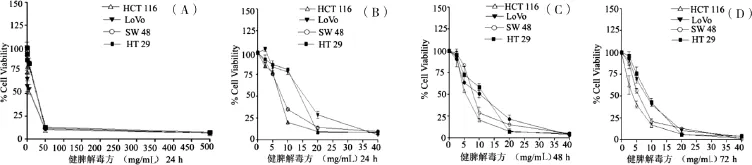
图2 MTT法检测健脾解毒方对大肠癌细胞增殖的影响
2.3 健脾解毒方对大肠癌HCT116、LoVo、SW48及HT29细胞周期的影响
依据计算得到的大肠癌HCT116、LoVo、SW48及HT29细胞的IC50值结果,设定健脾解毒方的干预浓度分别为HCT116(7 mg/mL)、LoVo(14 mg/mL)、SW48(8 mg/mL)及HT29(13 mg/mL),干预24 h后采用流式细胞仪检测健脾解毒方对各组细胞周期的影响,结果显示,与对照组比较健脾解毒方组G1期细胞所占比例明显上升,S期+G2期细胞比例显著下降,其增殖指数也显著性降低,具有统计学差异(P<0.05)。这些数据提示健脾解毒方能够抑制大肠癌HCT116、LoVo、SW48及HT29细胞DNA合成并使细胞周期阻滞于G1期,见表3。
表3 健脾解毒方对大肠癌细胞周期的影响(±s,%,n=3)

表3 健脾解毒方对大肠癌细胞周期的影响(±s,%,n=3)
注:与对照组比较,*P<0.05。
t值P值HCT116 LoVo SW48 HT29 G1 S G2 G1 S G2 G1 S G2 G1 S G2 Con 50.81±4.61 27.91±2.1 14.01±1.2 48.15±4.17 28.03±2.34 15.01±1.23 49.12±4.16 28.01±2.52 14.21±1.71 50.08±4.31 26.91±2.1 14.81±1.31 JPJD 71.12±6.21* 16.21±1.35* 8.31±0.81* 68.17±5.76* 18.01±1.54* 9.54±0.78* 69.12±5.38* 17.61±1.17* 9.23±0.81* 67.21±5.52* 19.02±1.65* 9.72±0.79* -21.986 27.020 25.315 -21.809 21.694 21.054 -28.394 13.343 10.210 -16.818 30.369 16.954 0.002 0.001 0.002 0.002 0.002 0.002 0.001 0.006 0.009 0.004 0.001 0.003
2.4 健脾解毒方对大肠癌HCT116、LoVo、SW48及HT29细胞Phospho-mTOR(P-mTOR)、Phospho-P53 (PP53)和P21蛋白表达的影响
如前所述,同样设定健脾解毒方的干预浓度分别为HCT116(6 mg/mL)、LoVo(9 mg/mL)、SW48(8 mg/mL)及HT29(10 mg/mL),干预48 h后采用Western Blot法检测健脾解毒方对mTOR信号通路相关蛋白表达的影响,结果显示,与对照组比较健脾解毒方组P-mTOR表达水平明显下调,PP53和P21表达水平明显上调,差异具有统计学意义(P<0.05),见表4及图3。
表4 健脾解毒方对大肠癌细胞P-mTOR、PP53和P21蛋白表达的影响(±s%,n=3)

表4 健脾解毒方对大肠癌细胞P-mTOR、PP53和P21蛋白表达的影响(±s%,n=3)
注:与对照组比较,*P<0.05。
t值P值HCT116 LoVo SW48 HT29 P-mTOR PP53 P21 P-mTOR PP53 P21 P-mTOR PP53 P21 P-mTOR PP53 P21 Con 1.32±0.16 0.33±0.03 0.26±0.03 1.51±0.17 0.12±0.01 0.21±0.02 1.55±0.16 0.22±0.02 0.21±0.02 1.53±0.16 0.16±0.02 0.12±0.01 JPJD 0.72±0.08* 0.82±0.07* 0.53±0.06* 0.68±0.07* 0.32±0.04* 0.65±0.07* 0.23±0.02* 0.61±0.05* 0.65±0.07* 0.75±0.08* 0.34±0.04* 0.25±0.03* 12.990 -21.218 -5.892 9.714 -11.547 -8.468 16.331 -9.650 -8.468 16.887 -9.000 -5.629 0.006 0.002 0.028 0.010 0.007 0.014 0.004 0.011 0.014 0.003 0.012 0.030

图3 HCT116、LoVo、SW48及HT29细胞两组P-mTOR、PP53及P21蛋白表达的电泳图
3 讨论
大肠癌是癌症死亡的主要原因之一,大肠癌的治疗方法包括手术、化疗、放疗及靶向治疗等,但是其临床疗效并没有得到大的改善,手术后5年生存率约60%[2],出现转移灶后5年生存率约10%[3],因此找到新的能提高临床疗效的综合治疗方法一直是大肠癌治疗的研究热点。在我国,中医药在大肠癌的临床治疗中有着重要地位[4]。大量临床研究表明,中医药具有改善临床症状、提高免疫力、结合放化疗增敏减毒、减少复发转移等独特优势[5]。脾虚气弱、瘀毒结聚是大肠癌的主要病因病机,治以健脾益气、清热解毒为法,已成医家共识[6-7]。虽然近年来关于中医药治疗大肠癌的疗效机制的实验研究取得较大进展[8],但是基于健脾解毒立法的中医有效方剂的具体作用机制仍不十分清楚。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是PI3K/Akt通路的下游分子。mTOR包括mTORC1和mTORC2两个复合物,其中mTORC1对雷帕霉素敏感,对各种细胞内(能量及应激)和细胞外(营养、生长因子及激素)信号起反应,通过其下游的S6K1和4E-BP1促进蛋白质合成,是细胞生长增殖的中心环节[9]。mTOR通路可调控与肿瘤发生密切相关的细胞恶性转化、生长增殖、周期调控、侵袭与转移、肿瘤干细胞的形成等多项细胞功能[10]。mTOR信号通路异常与大肠癌的发生、发展密切相关[11]。mTOR已成为抗肿瘤治疗的靶点,mTOR抑制剂临床试验结果表现出抗肿瘤活性,新的m-TOR抑制剂的临床试验仍在进行中[12-13]。
P53基因为抑癌基因,通过调控细胞周期停滞、凋亡及衰老等途径起抑制肿瘤的作用[14]。P53基因功能异常与大肠癌的发生发展密切相关,大约有40%~50%的大肠癌患者P53基因突变[15]。P21是细胞周期依赖性激酶抑制蛋白(CDKs)家族中重要的调节因子,促进细胞周期阻滞的主要蛋白[16]。P53在肿瘤细胞周期进程中通过活化转录P21基因,P21蛋白能抑制CDK磷酸化或Cyclin-CDK的活性使肿瘤细胞停滞在G1期,从而阻滞细胞周期从G1期向S期的进展[17]。mTOR的活化能够磷酸化P53蛋白的丝氨酸-15位点的磷酸酶(由α-4亚基和PP2A催化亚基组成)从而抑制P53的活性[18]。肿瘤细胞中异常活化的mTOR能够抑制P53的表达与活性,促进肿瘤异常增殖及肿瘤血管生成,从而使肿瘤细胞获得永生性[19]。
健脾解毒方由黄芪、白术、西洋参、半枝莲、甘草等11味药物组成。元代著名医学家刘元素指出黄芪的作用有五:“补诸虚不足,一也;益元气,二也;壮脾胃,三也;去肌热,四也;排脓止痛,活血生血,内托阴疽,为疮家圣药,五也”。健脾解毒方以黄芪益气健脾解毒,白术健脾益气利水共为君药,全方共奏健脾益气、解毒清热、利湿消肿之功。我们采用水提法制作健脾解毒方,并利用UPLC-Q-TOF/MS法检测到了健脾解毒方中7种有效成分:毛蕊异黄酮葡萄糖苷、人参皂苷Re、芹菜素、人参皂苷Rb1、黄芪甲苷、甘草酸、白术内酯Ⅱ。现代药理研究表明,黄芪提取物毛蕊异黄酮葡萄糖苷能够通过ERβ/miR-17信号通路促进大肠癌细胞凋亡[20],黄芪甲苷具有增强免疫、抑制肺癌侵袭、转移的作用[21]。西洋参提取物人参皂苷可通过多种途径促进大肠癌细胞凋亡、抑制肿瘤侵袭、转移及进展[22-23],白术内酯Ⅱ能够诱导黑素瘤细胞周期G1期停滞及细胞凋亡[24],半枝莲提取物芹菜素具有诱导大肠癌HCT116细胞凋亡及促进自噬的作用[25],甘草提取物甘草酸可通过下调HSP90基因表达诱导人结肠癌HT-29细胞凋亡而发挥抗肿瘤作用[26]。
本文通过MTT法检测健脾解毒方对大肠癌HCT116、LoVo、SW48及HT29细胞增殖的影响,结果表明,健脾解毒方对4种大肠癌细胞系均有抑制增殖的作用,其抑制效率与浓度呈正相关。我们同时运用Graphpad Prism5软件计算健脾解毒方干预24、48 h及72 h后的IC50值,结果提示,随着作用时间延长IC50值下降,其抑制作用增强。说明健脾解毒方的抑制作用与浓度相关并有时间依赖性。健脾解毒方粗提取物对人正常结直肠粘膜FHC细胞增殖没有影响(数据没有显示),说明其抑制增殖的作用具有针对大肠癌细胞的特点而对正常结直肠粘膜细胞没有毒性。
为了进一步明确健脾解毒方抑制大肠癌细胞增殖的具体机制,采用流式细胞仪检测发现健脾解毒方能使大肠癌HCT116、LoVo、SW48及HT29细胞周期停滞于G1期。基于mTOR-P53-P21通路在大肠癌发生发展中的重要作用,通过检测P-mTOR、PP53和P21蛋白表达的变化,结果发现,健脾解毒方能够下调P-mTOR蛋白表达,上调PP53和P21蛋白表达,提示健脾解毒方可能通过在转录后水平抑制mTOR的活化,进而促进P53的活化,进一步活化转录P21基因,促使大肠癌细胞G1期停滞。
综上所述,健脾解毒方具有抑制大肠癌细胞增殖的作用,其抑制作用与浓度及时间相关,健脾解毒方可能通过mTOR-P53-P21信号途径抑制大肠癌细胞增殖,这可能是健脾解毒方治疗大肠癌的作用机制之一。
[1]张四方,朱伟光,何明大,等.中药干预对结肠癌化疗患者生活质量和负性情绪影响的动态观察[J].中国临床心理学杂志,2007,4(4):125-130.
[2]Lin FX,Tian LF,Lei CY,et al.Chinese medicine for outcomes in colorectal cancer patients:A retrospective clinical study[J]. Chinese Journal of Integrative Medicine,2016,7:1-6.
[3]Storli KE,Sondenaa K,Bukholm IR,et al.Overall survival after resection for colon cancer in a national cohort study was adversely affected by TNM stage,lymph node ratio,gender,and old age[J].Int J Colorectal Dis,2011,26(10):1299-1307.
[4]Davies JM,Goldberg RM.Treatment of metastatic colorectal cancer[J].Semin Oncol,2011,38(4):552-560.
[5]白建平,张海波,李勇,等.中西医结合治疗大肠癌思路与方法探讨[J].陕西中医,2011,32(3):303-304.
[6]Deng S,Hu B,An HM.Traditional Chinese Medicinal Syndromes and Treatment in Colorectal Cancer[J].J Cancer Ther, 2012,3(6):888-897.
[7]张艺梁,叶丽红.大肠癌中医研究近况[J].辽宁中医药大学学报,2015,17(4):216-219.
[8]刘宣,范忠泽,李琦.中医药治疗大肠癌的实验研究进展[J].中华中医药杂志,2013,28(6):1808-1811.
[9]Fingar DC,Salama S,Tsou C,et al.Mammalian cell size is controlledbymTORanditsdownstreamtargetsS6K1and 4EBP1/eIF4E[J].Genes Dev,2002,16(12):1472-1487.
[10]Asati V,Mahapatra DK,Bharti SK.PI3K/Akt/mTOR and Ras/ Raf/MEK/ERK signaling pathways inhibitors as anticancer agents:Structural and pharmacological perspectives[J].Eur J Med Chem,2016,109:314-341.
[11]Slattery ML,Herrick JS,Lundgreen A,et al.Genetic variation in a metabolic signaling pathway and colon and rectal cancer risk:mTOR,PTEN,STK11,RPKAA1,PRKAG2,TSC1,TSC2, PI3K and Akt1[J].Carcinogenesis,2010,31(9):1604-1611.
[12]Battelli C,Cho D C.mTOR inhibitors in renal cell carcinoma [J].Therapy,2011,8(4):359-367.
[13]LiuL,ZhangW,LiW,etal.AphaseIstudyof ridaforolimus in adult Chinese patients with advanced solid tumors[J].J Hematol Oncol,2013,6:48.
[14]Levine A J,Finlay C A,Hinds P W.P53 is a tumor suppressor gene[J].Cell,2004,116(2 Suppl):453-456.
[15]Takayama T,Miyanishi K,Hayashi T,et al.Colorectal cancer:genetics of development and metastasis[J].J Gastroenterol, 2006,41(3):185-192.
[16]Abbas T,Dutta A.p21 in cancer:intricate networks and multiple activities[J].Nature Reviews Cancer,2009,9(6):400-414.
[17]Liu SX,Bishop WR,Liu M.Differential effects of cell cycle regulatory protein p21WAF1/Cip1 on apoptosis and sensitivity to cancer chemotherapy[J].Drug Resistance Updates,2003,6(4):183-195.
[18]Longerich T.EEF1A2 inhibits the p53 function inhepatocellular carcinomaviaPI3K/AKT/mTOR-dependentstabilizationof MDM4[J].Pathologe,2014,35(Suppl 2):177-184.
[19]Kong M,Fox C J,Mu J,et al.The PP2A-associated protein alpha4 is an essential inhibitor of apoptosis[J].Science,2004, 306(5696):695-698.
[20]Chen J,Zhao X,Li X,et al.Calycosin induces apoptosis by the regulation of ERβ/miR-17 signaling pathway in human colorectal cancer cells[J].Food Funct,2015,6(9):3091-3097.
[21]ChengX,GuJ,ZhangM,etal.AstragalosideIVinhibits migration and invasion in human lungcancer A549 cells via regulating PKC-α-ERK1/2-NF-κB pathway[J].Int Immunopharmacol,2014,23(1):304-313.
[22]Gum SI,Rahman MK,Won JS,et al.Ginsenoside?Products Triggers Mitochondria/FasL-mediated Apoptosis in Colon Cancer Cells[J].Phytother Res,2016,30(1):136-43.
[23]Junmin S,Hongxiang L,Zhen L,et al.Ginsenoside Rg3 inhibits colon cancer cell migration by suppressing nuclear factor kappa B activity[J].J Tradit Chin Med,2015,35(4):440-444.
[24]Ye Y,Wang H,Chu JH,et al.Atractylenolide?II induces G1 cell-cycle arrest and apoptosis in B16 melanoma cells[J].J Ethnopharmacol,2011,136(1):279-282.
[25]Lee Y,Sung B,Kang YJ,et al.Apigenin-induced apoptosis is enhanced by inhibition of autophagy formation in HCT116 human colon cancercells[J].Int J Oncol,2014,44(5):1599-1606.
[26]Nourazarian SM1,Nourazarian A,Majidinia M,et al.Effect of Root Extracts of Medicinal Herb Glycyrrhiza glabra on HSP90 Gene Expression and Apoptosis in the HT-29 Colon Cancer Cell Line[J].Asian Pac J Cancer Prev,2015,16(18):8563-8566.
(本文编辑 杨 瑛)
Effect of Jianpi Jiedu Formula on the Expressions of Proteins Related to mTOR Signal Pathway in Colon Cancer Cell Line
SHI Li1,MAO Dan1,ZHANG Shaofan1,HUANG Jianhua2,LIU Xinyi1,ZHANG Yinjin1,LEI Sanlin1, MA Jin'an1,XIANG Daxiong1,HU Chunhong1,ZHANG Sifang1*
(1.The Second Hospital of Xiangya,Central South University,Changsha,Hunan 410011,China;
2.School of Pharmacy,Hunan University of Chinese Medicine,Changsha,Hunan 410028,China)
ObjectiveTo investigate the effects of Jianpi Jiedu Formula(JPJD)on inhibiting colon cancer cell proliferation capacity and its possible mechanism.MethodsThe main components of water extract of JPJD were analyzed by UPLC-Q-TOF/MS.The effect of JPJD on colon cancer cell proliferation capacity was determined by MTT assays.The IC50value concentration were calculated by Graphpad Prism5 software.The cell cycle was detected by Flow cytometric method.The protein levels of Phospho-mTOR(P-mTOR),Phospho-P53(PP53)and P21 were examined by Western Blot.ResultsMTT assays demonstrated that JPJD can inhibite the colon cancer cell proliferation capacity.The IC50value concentration of JPJDat24h,48hand72haftertreatmentwere6.894,5.668,3.648mg/mLinHCT116cell,14.650,8.737, 7.849 mg/mL in LoVo cell,8.029,7.029,5.740 mg/mL in SW48 cell and 13.06,9.646,8.448 mg/mL in HT29 cell,respectively.JPJD could down-regulate the expression of Phospho-mTOR protein,up-regulate the expression of Phospho-P53 and P21 protein,and keep the cycle of the large intestine cancer cells at G1 phase.ConclusionThe JPJD could inhibit HCT116,LoVo,SW48 and HT29 cells proliferation capacity by mTOR-P53-P21 signaling pathways,and it may be the probable mechanism of JPJD on colorectal cancer.
Jianpi Jiedu Formula;colon cancer;cell proliferation;IC50;mTOR
R285.5;R735.3+4
A
10.3969/j.issn.1674-070X.2016.12.003
2016-09-01
国家自然科学基金面上项目(81273722)。
施利,女,在读硕士研究生,研究方向:中西医结合恶性肿瘤基础与临床研究。
*张四方,男,副教授,硕士研究生导师,E-mail:m13308439612@163.com。

