低温胁迫对不同品种山茶生理生化指标的影响
章锦涛, 王 华, 王 松, 江文渊, 谢宏斌,王冬良*
(1.安徽农业大学园艺学院,安徽合肥 230036; 2.安徽省无为县鼎兴园艺责任有限公司,安徽芜湖 238300)
低温胁迫对不同品种山茶生理生化指标的影响
章锦涛1, 王 华1, 王 松1, 江文渊1, 谢宏斌2,王冬良1*
(1.安徽农业大学园艺学院,安徽合肥 230036; 2.安徽省无为县鼎兴园艺责任有限公司,安徽芜湖 238300)
[目的]探究不同山茶品种的抗寒性。[方法]采用人工模拟低温处理的方法对3个山茶品种(逸香、克里木、六角大红)的耐寒性进行了测定,分析各生理指标与抗寒性的关系。[结果]不同低温胁迫下(0、-5、-10、-15 ℃),逸香的抗寒性明显高于克里木和六角大红。相关性分析表明,山茶的耐寒性与相对电导率和丙二醛(MDA)含量成反比,与超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、可溶性蛋白含量成正比。[结论]该研究可为低温地区山茶生产、引种以及园林应用提供参考。
山茶;抗寒性;生理生化指标
山茶属(Camellia)为山茶科中最大的属,约280种,我国有山茶属植物238种[1]。山茶属植物主要分布在亚洲,植物树形美观,花朵艳丽,具有较高的观赏价值,但大多数山茶不耐寒,因此山茶的耐寒性成为引种的主要限制性因素[2]。植物对于低温胁迫表现出的是主动的应激过程,随着环境温度的逐渐降低,植物通过调节自身生理环境或者诱导相关基因的表达,从而达到适应低温的过程[3]。在抗寒指标中,一般不采用单一指标,而是采用多个指标综合分析,从而鉴定植物的抗寒能力大小。低温胁迫下所有植物的抗氧化酶活性都会发生变化[4]。丙二醛(MDA)含量反映了细胞膜对外界逆境条件的适应能力[5]。相对电导率反映电解质渗透率,国内外专家对于其反应原理进行了深入研究,并将其应用在实际研究工作中。笔者在低温条件下测定山茶叶片的生理生化指标,并推测其变化规律,以期为低温地区山茶的生产、引种以及园林应用提供参考。
1 材料与方法
1.1 试验材料 试材来源于安徽农业大学园艺学院试验基地安徽无为县鼎兴园艺责任有限公司苗圃地,选取树龄3~4 a、株高50~60 cm、在当地能够室外越冬且长势良好的茶花。选用耐寒性不同的3个山茶品种:逸香、克里木、六角大红。
1.2 植物低温处理与样品采集 将山茶植株放入人工培养箱中低温处理6 h,从0 ℃依次降至-5、-10、-15 ℃,降温速度设为5 ℃/h。然后进行取样,取茎尖向下第3~6片长势良好的叶片待测。
1.3 测定方法 相对电导率的测定采用电导法;MDA含量的测定采用硫代巴比妥酸法;超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑法;过氧化物酶(POD)活性的测定采用愈创木酚比色法;可溶性蛋白含量的测定采用考马斯亮蓝G-250法[6]。
1.4 数据处理 使用Excel 2010软件进行绘图,使用SPSS 17.0统计软件进行方差分析。
2 结果与分析
2.1 低温对山茶叶片相对电导率的影响 低温可以使叶片细胞内的电解质和非电解质外渗,从而可以改变叶片细胞膜透性。在相同温度下,植株细胞的外渗物质越多,则耐寒性越差,相对电导率越高;反之,则耐寒性越差,相对电导率越低。因此,同一温度下植物的相对电导率越低,其抗性就越强。
从图1可以看出,随着温度的降低,山茶属3个品种的叶片相对电导率呈现上升的趋势,说明低温胁迫对山茶叶片的细胞膜已经产生了破坏。对不同温度的山茶叶片相对电导率的方差分析表明,山茶叶片的相对电导率与温度具有显著相关性(P<0.05);对相同温度下不同品种相对电导率的方差分析表明,山茶的相对电导率与其品种具有显著相关性(P<0.05),山茶逸香与克里木以及逸香与六角大红的相对电导率存在显著差异(P<0.05),但克里木和六角大红的相对电导率不存在显著差异(P>0.05)。

注:相同温度下不同品种间标有不同小写字母表示差异显著(P<0.05)。Note:Different small letters among different cultivars at the same temperature indicate significant difference (P<0.05).图1 低温胁迫下山茶叶片相对电导率的变化Fig. 1 The changes of relative electrical conductivity of camellia leaves under cold stress
2.2 低温对山茶叶片中MDA含量的影响 植物细胞内自由基在逆境胁迫的过程中产生,过剩的自由基会对膜系统造成伤害。MDA作为植物逆境条件下膜脂过氧化作用的产物,其含量可以反映植物抵御逆境的能力,一般MDA 含量越高,表明植株的受损害程度越大[5]。
从图2可以看出,随着环境温度的降低,不同品种山茶的MDA含量整体上呈现升高的趋势,当温度从0 ℃降至-15 ℃后山茶叶片中MDA含量的增加幅度不大,基本在5.00 μmol/g左右,说明这些物种在受到低温胁迫时细胞膜受损程度较小。方差分析表明,逸香与克里木以及逸香与六角大红的MDA含量差异显著(P<0.05),但克里木与逸香的MDA含量差异未达到显著水平(P>0.05)。
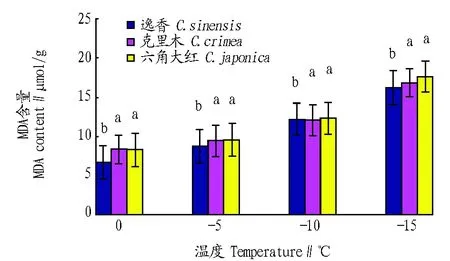
注:相同温度下不同品种间标有不同小写字母表示差异显著(P<0.05)。Note:Different small letters among different cultivars at the same temperature indicate significant difference (P<0.05).图2 低温胁迫下山茶叶片中MDA含量的变化Fig. 2 Changes of MDA content in camellia leaves under cold stress
2.3 低温对山茶叶片中SOD活性的影响 SOD可以清除植物体内的超氧自由基,植物耐寒性越强,则 SOD活性越高,抗性强的物种在低温下SOD活性始终高于抗性弱的物种[7]。从图3可以看出,随着温度的下降,山茶叶片中 SOD活性逐渐升高,而随着温度的继续降低,SOD活性略有下降,整体上呈现出先升高、后降低的趋势。试验过程中,不同山茶品种SOD活性变化不大,平均活性维持在80 U/(g·min),说明山茶叶片细胞的酶保护系统在受到低温胁迫时发挥了较好作用,增加了植株的耐寒性。试验结果表明,不同低温处理下山茶叶片的SOD活性也不同。方差分析表明,不同山茶品种之间SOD活性存在显著差异(P<0.05),同时随着温度的降低,植株内 SOD 活性差异显著(P<0.05)。
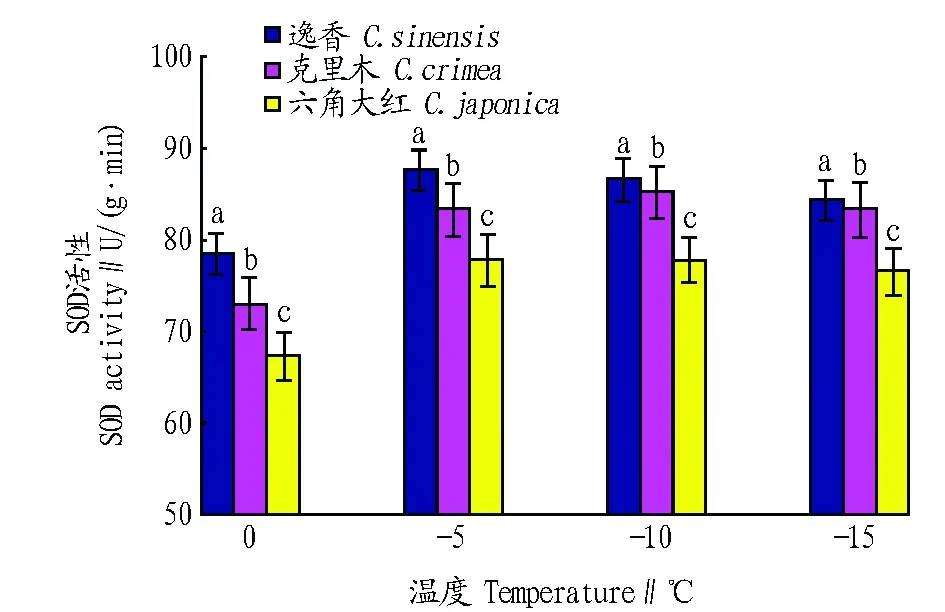
注:相同温度下不同品种间标有不同小写字母表示差异显著(P<0.05)。Note:Different small letters among different cultivars at the same temperature indicate significant difference (P<0.05).图3 低温胁迫下山茶叶片中SOD活性的变化Fig. 3 Changes of SOD activity in camellia leaves under cold stress
2.4 低温对山茶叶片中POD活性的影响 POD是清除活性氧的一种重要的酶。在逆境条件下,它能氧化植物体内的乙酸,有效降低膜脂过氧化的伤害,清除超氧自由基,避免植物在低温胁迫时遭遇伤害。从图4可以看出,山茶叶片POD活性随温度的下降呈现出先升高后下降的规律,其变化趋势与 SOD活性的变化趋势基本一致。随着环境温度的降低,植物体内会产生越来越多的自由基,POD可以清理自由基,保护植物细胞;随着环境温度的继续下降,POD活性随之降低,这可能是由于低温导致山茶花叶片的细胞失活。山茶
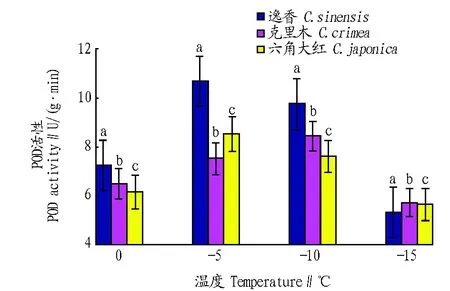
注:相同温度下不同品种间标有不同小写字母表示差异显著(P<0.05)。Note:Different small letters among different cultivars at the same temperature indicate significant difference(P<0.05).图4 低温胁迫下山茶叶片中POD活性的变化Fig. 4 Changes of POD activity in camellia leaves under cold stress
叶片中 POD 活性在-5 ℃左右时达到最高。方差分析表明,不同山茶品种之间POD活性存在显著差异(P<0.05),同时植株内 POD活性随温度的降低而显著下降(P<0.05)。2.5 低温对山茶叶片可溶性蛋白含量的影响 罗军武等[8]认为抗寒性强的茶树品种可溶性蛋白含量高于抗寒性弱的茶树品种,这表明叶片中可溶性蛋白含量可作为耐寒性检测的指标之一。从图5可以看出,山茶叶片中的可溶性蛋白含量的变化随温度的下降呈下降趋势。不同品种山茶叶片中可溶性蛋白含量差异显著(P<0.05),同一品种不同山茶叶片中可溶性蛋白含量差异显著(P<0.05)。可溶性蛋白含量下降的原因可能是植物叶片在抗寒的过程中消耗了蛋白。逸香的可溶性蛋白含量明显高于六角大红和克里木,克里木山茶的可溶性蛋白含量略高于六角大红。总体来看,3个山茶品种的可溶性蛋白含量均维持较高的水平。
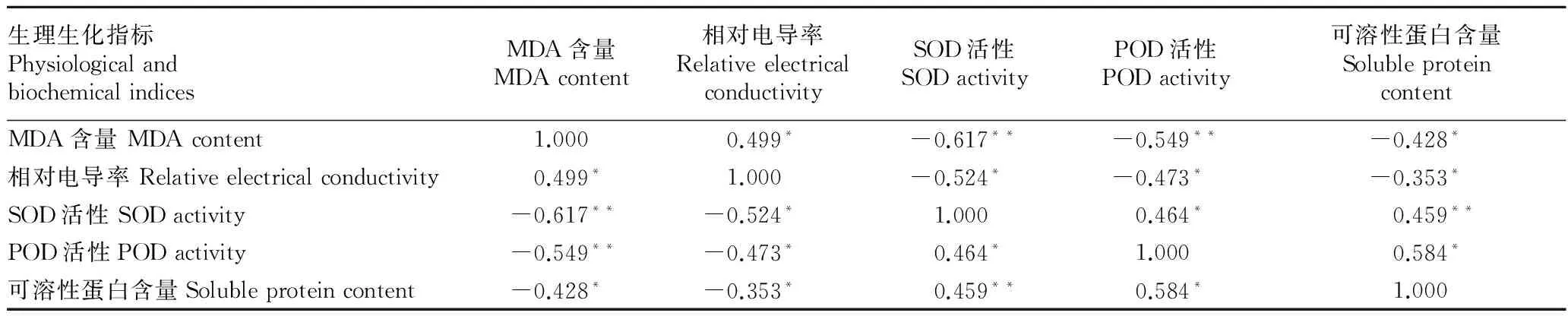
2.6 耐寒性相关性分析 由表1、2可知,无论是Person 相关系数还是 Spearman 相关系数,山茶叶片的相对电导率与可溶性蛋白含量、SOD活性和POD活性均呈极显著负相关(P<0.01),与MDA含量呈显著正相关(P<0.05);叶片的SOD活性、POD活性与可溶性蛋白含量呈显著正相关(P<0.05),而与相对电导率呈显著负相关。
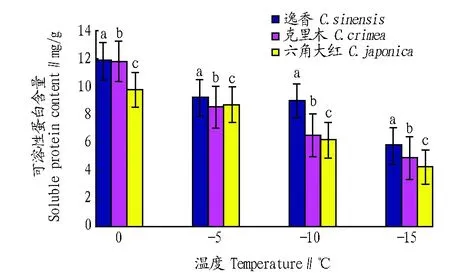
注:相同温度下不同品种间标有不同小写字母表示差异显著(P<0.05)。Note:Different small letters among different cultivars at the same temperature indicate significant difference (P<0.05).图5 低温胁迫下山茶叶片中可溶性蛋白含量的变化Fig. 5 Changes of soluble protein content in camellia leaves under cold stress
生理生化指标PhysiologicalandbiochemicalindicesMDA含量MDAcontent相对电导率RelativeelectricalconductivitySOD活性SODactivityPOD活性PODactivity可溶性蛋白含量SolubleproteincontentMDA含量MDAcontent1.0000.499*-0.617**-0.549**-0.428*相对电导率Relativeelectricalconductivity0.499*1.000-0.524*-0.473*-0.353*SOD活性SODactivity-0.617**-0.524*1.0000.464*0.459**POD活性PODactivity-0.549**-0.473*0.464*1.0000.584*可溶性蛋白含量Solubleproteincontent-0.428*-0.353*0.459**0.584*1.000
注:*表示相关性达到显著水平(P<0.05);**表示相关性达到极显著水平(P<0.01)。
Note:*indicates significant correlation(P<0.05);**indicates extremely significant correlation(P<0.01).

表2 低温胁迫下山茶耐寒性的Spearman系数相关性分析
注:*表示相关性达到显著水平(P<0.05);**表示相关性达到极显著水平(P<0.01)。
Note:*indicates significant correlation(P<0.05);**indicates extremely significant correlation(P<0.01).
3 结论
温度作为影响植物生长发育过程中的重要因子,影响着植物的生理特性。笔者采用人工模拟低温处理的方法,对3个山茶品种逸香、克里木、六角大红的耐寒性进行了测定,分析各生理指标与抗寒性的关系,得出以下结论。
(1) 低温胁迫对不同山茶叶片膜系统的影响。植株的耐寒性与植物的相对电导率成反比。该试验中山茶叶片的相对电导率随着温度的逐渐降低而不断增大,说明低温胁迫对植株的伤害是不可逆的。逸香的电导率明显低于克里木和六角大红。MDA含量可以反映低温对山茶叶片细胞膜的影响程度。该试验中山茶叶片MDA 含量整体上呈现升高的趋势,同时山茶叶片中保护酶活力与MDA含量成反比。这是由于当植物体保持较高的保护酶活力时,能有效清除体内的MDA。
(2) 低温胁迫对不同山茶叶片中保护酶活性的影响。POD 参与的有关氧化还原反应可产生自由基和 H2O2,因此植株内SOD 活性上升, POD 活性下降。山茶叶片中SOD活性和POD活性在-5 ℃或-10 ℃时达到最高,此后SOD活性和POD活性开始降低,表明这2种酶有协同作用,共同保护植株细胞,相关酶活性下降可能由于低温胁迫下叶片的部分细胞失活所致。
(3) 低温胁迫对不同山茶叶片中可溶性蛋白含量的影响。随着温度的降低,山茶叶片中可溶性蛋白含量下降,这可能由于植物受低温胁迫后消耗了蛋白。
(4)相关性分析表明,山茶叶片相对电导率与MDA含量之间存在显著正相关;POD活性与MDA含量呈显著负相关;山茶叶片的可溶性蛋白含量与相对电导率、MDA含量等生理指标呈显著负相关。这表明山茶的耐寒性与相对电导率、MDA含量成反比,与 POD活性、SOD活性、可溶性蛋白含量成正比。
(5)通过山茶叶片各生理生化指标的综合比较发现,3个山茶品种的抗寒性具有明显差异。逸香的各生理指标均优于其他2个品种,因此逸香的抗寒性强于克里木和六角大红。
[1] 张宏达. 中国植物志:第49卷 第3册[M]. 北京:科学出版社, 1998.
[2] 闵天禄. 世界山茶属的研究[M]. 昆明:云南科技出版社, 2000.
[3] THOMASHOW M F. So what’s new in the field of plant cold acclimation?[J]. Plant Physiol, 2001, 125(1):89-93.
[4] ZHOU B Y, GUO Z F, LIU Z L. Effects of abscisic acid on antioxidant systems of(Aublet)sw. under chilling stress[J]. Crop Sci, 2005, 45(2):599-605.
[5] 严青, 马玉寿, 施建军, 等. 低温胁迫对3种牧草幼苗抗性生理指标的影响[J].青海大学学报(自然科学版), 2007, 25(1):54-57.
[6] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2002.
[7] 徐康. 低温胁迫下茶梅‘小玫瑰’Camelliahiemalis‘ShiShi Gashira’生理生化变化的研究[D]. 杭州:浙江大学, 2003.
[8] 罗军武, 唐和平, 黄意欢,等. 茶树不同抗寒性品种间保护酶类活性的差异[J]. 湖南农业大学学报(自然科学版), 2001, 27(2):94-96.
Effects of Low Temperature Stress on the Physiological and Bioochemical Indices of Different Camellia Cultivars
ZHANG Jin-tao, WANG Hua, WANG Song, WANG Dong-liang*et al
(School of Horticulture, Anhui Agricultural University, Hefei, Anhui 230036)
[Objective] To explore the cold resistance of different camellia cultivars. [Method] Using artificial low temperature method, the cold resistance of three cultivars of camellia (Camelliasinensis,Camelliacrimea,Camelliajaponica) was determined. The relationship between physiological and biochemical indices and cold resistance of camellia was analyzed. [Result] Under low temperature stress(0,-5,-10,-15 ℃), the cold resistance ofC.sinensiswas significantly higher than that ofC.crimeaandC.japonica. The correlation analysis showed that the cold hardiness of camellia was inversely proportional to MDA content and relative electrical conductivity, but it was directly proportional to SOD activity, POD activity and soluble protein content. [Conclusion] The research can provide references for the production, introduction and gardening application of camellia in low temperature region.
Camellia;Cold resistance;Physiological and biochemical indices
芜湖市科技计划项目(2014hm03)。
章锦涛(1990- ),男,安徽桐城人,硕士研究生,研究方向:园林植物应用。*通讯作者,副教授,在读博士,硕士生导师,从事观赏园艺研究。
2016-10-28
S 601;S 685.14
A
0517-6611(2016)36-0007-03

